CRISPR/Cas9系統介導小鼠MSTN基因定點修飾研究
任紅艷 畢延震 李莉 等

摘要:利用CRISPR/Cas9系統突變小鼠Myostatin基因,為制備MSTN基因修飾豬奠定了理論和實踐基礎。結果表明,成功構建了CRISPR/Cas9定點敲除技術平臺,并獲得MSTN基因發生缺失突變的小鼠模型。
關鍵詞:CRISPR/Cas9系統;Myostain基因;定點修飾
中圖分類號:Q78 文獻標識碼:A 文章編號:0439-8114(2015)20-5155-04
DOI:10.14088/j.cnki.issn0439-8114.2015.20.058
Production of MSTN Gene Mutant Mice Using CRISPR/Cas9 System
REN Hong-yan,BI Yan-zhen, LI Li, ZHENG Xin-min
(Institute of Animal Husbandry and Veterinary, Hubei Academy of Agricultural Sciences, Wuhan 430064, China)
Abstract: In this paper, Myostatin gene mutant mice were generated using CRISPR/Cas9 system, which can be further applied to preparation of transgenic pigs. The results showed that CRISPR/Cas9 platform was established and MSTN gene mutant mice were generated successfully.
Key words:CRISPR/Cas9 system; Myostatin gene; site-directed mutation
基因敲除動物模型是開展基因功能研究、尋找合適藥物作用靶點的重要工具。傳統的基因敲除方法需要通過復雜的打靶載體構建、ES細胞篩選、嵌合體選育等步驟,不僅流程繁瑣,對技術的要求很高,而且費用大、耗時較長、成功率也較低。即使對于技術比較成熟的實驗室,利用傳統技術構建基因敲除大、小鼠一般也需要一年以上時間,因此其應用受到限制。新一代人工核酸內切酶(Engineered endonuclease,EEN)的出現,使這一現狀徹底改觀,鋅指核酸內切酶(Zinc Finger Endonuclease,ZFN)是第一代人工核酸內切酶,其可以在各種復雜基因組的特定位置制造DNA的雙鏈切口[1]。截至目前,ZFN已經成功應用于黑長尾猴、大鼠、小鼠、中國倉鼠、斑馬魚、果蠅、海膽、家蠶、擬南芥、煙草、玉米、豬、牛、人類iPS細胞中[2]。第二代人工核酸酶是一類轉錄激活因子效應物核酸酶(Transcription activator-like effector nuclease,TALEN),可以和ZFN一樣對復雜的基因組進行精細的修飾,同時其構建較為簡單,特異性更高,因此受到了科研工作者的青睞,在植物、人類細胞、小鼠、斑馬魚、豬、牛中迅速得以應用[3-5]。
2013年,《Cell》雜志報道稱加州大學舊金山分校的研究人員發現了一種效率更高、修飾更為精確的敲除基因的方法,稱為CRISPR/Cas9系統[6],該系統因其操作簡單、成本低、效率高等特點受到國內外研究者的關注。CRISPR/Cas9是細菌和古細菌在長期演化過程中形成的一種適應性免疫防御,可用來對抗入侵的病毒及外源DNA[7]。CRISPR/Cas9系統通過將入侵噬菌體和質粒DNA的片段整合到CRISPR中,并利用相應的CRISPR RNAs(crRNAs)來指導同源序列的降解,從而提供免疫性[8]。該系統的工作原理是crRNA(CRISPR-derived RNA)通過堿基配對與tracrRNA(trans-activating RNA)結合形成 tracrRNA/crRNA 復合物,此復合物引導核酸酶Cas9蛋白質在與crRNA配對的序列靶位點剪切雙鏈DNA。而通過人工設計的這兩種RNA,可以改造形成具有引導作用的sgRNA(short guide RNA),從而引導Cas9對DNA的定點修飾。2013年,美國兩個實驗室報道了基于CRISPR/Cas9系統在細胞系中進行基因敲除的新方法,利用靶點特異性的RNA將Cas9核酸酶帶到基因組上的具體靶點,從而對特定基因位點進行切割導致突變,并迅速將該技術應用于基因敲除小鼠和大鼠的制備中[8,9]。Jaenisch等利用CRISPR/Cas9系統在3~4周時間內構建出攜帶5種突變的小鼠,而用傳統的方法則需要3~4年的時間[10]。CRISPR/Cas9技術成為繼鋅指核酸酶(ZFN)、ES 細胞打靶和 TALEN 等技術后可構建基因敲除動物的第四種方法,且有效率高、速度快、生殖系轉移能力強等特點,在動物模型的構建中應用前景非常廣闊。
肌肉生長抑制素(Myostatin,MSTN),又稱生長分化因子-8,屬于轉化生長因子-β超家族,是骨骼肌發育的主要負調控因子。MSTN基因通過抑制肌源性調控因子如MyoD等降低成肌細胞的增殖率,并抑制肌細胞分化,MSTN基因缺失的動物表現明顯的雙肌表型[11]。因此,敲除MSTN基因成為提高動物瘦肉率的重要手段。本研究建立了CRISPR/Cas9系統介導的基因定點修飾技術平臺,并應用該技術制備了MSTN基因突變的小鼠,為后期制備轉基因豬奠定了理論和實踐基礎。
1 材料與方法
1.1 細菌與質粒
限制性內切酶、dNTP Mix、高保真酶rTaq、pMD-18T載體和T4 DNA連接酶,購自寶生物工程(大連)有限公司;質粒DNA小量提取試劑盒,瓊脂糖凝膠DNA回收試劑盒購自天根生化科技(北京)有限公司;大腸桿菌DH5α為湖北省農業科學院畜牧獸醫研究所生物技術室存留;MLM3613和pDR274載體購自美國Addgene公司;體外轉錄試劑盒mMessagemMachine T7購自Ambion公司,SURVEYOR突變檢測試劑盒購自Transgenomic公司。
1.2 靶位點設計
從NCBI(http://archive-dtd.ncbi.nlm.nih.gov/)獲得小鼠MSTN基因組序列,利用ZiFit軟件預測靶位點,選取其中的3個位點。
1.3 Cas9 mRNA的體外轉錄和加尾
1.3.1 Cas9表達載體線性化 Cas9表達載體MLM3613提純后用PmeⅠ酶切線性化。利用PCR產物純化試劑盒回收線性化片段;向回收產物中加入2倍體積無水乙醇和1/10體積NaAc,-20 ℃放置過夜后高速離心回收產物,無RNA酶水溶解產物濃度至500~1 000 ng/μL,-20 ℃保存備用。
1.3.2 體外轉錄 利用Ambion公司mMessagemMachine T7 試劑盒進行Cas9 mRNA的體外轉錄和polyA加尾。20 μL體外轉錄體系為:2 μL線性化質粒DNA(1 μg),10 μL 2×NTP/CAP, 2 μL 10×Reaction Buffer,2 μL Enzyme mix,4 μL ddH2O,混勻后37 ℃反應2 h。80 μL polyA加尾體系為:20 μL 5×EPAP Buffer,10 μL MgCl2(25 mmol/L),10 μL ATP(10 mmol/L),4 μL E-PAP,36 μL ddH2O,混勻后37 ℃反應30 min。以1%瓊脂糖凝膠檢測RNA轉錄和加尾情況。
1.4 gRNA編碼載體構建及體外轉錄
根據軟件預測的3個靶序列分別合成序列互補的正、反向引物,在正向引物5端合成TAGG接頭,在反向引物5端合成CAAA接頭,設計模式如圖1所示,合成3個靶序列引物如表1所示。
gRNA體外轉錄載體pDR274載體購自Addgene公司(Addgene No. 42250),將該載體用Bsa Ⅰ酶切線性化后回收,與上面得到的雙鏈產物進行連接,連接產物轉化大腸桿菌DH5α后提取質粒進行鑒定。將陽性質粒大量提取后用Dra Ⅰ內切酶線性化并回收線性化產物,濃縮濃度至500~1 000 ng/μL,-20 ℃保存備用。
1.5 小鼠胚胎注射
選取4~5周齡母鼠作為受精卵供體,腹腔注射PMSG和hCG進行超數排卵,交配后取細胞期胚胎進行顯微注射。將Cas9 mRNA(100 ng/μL)和sgRNA(100 ng/μL)混合均勻,注射到細胞期胚胎的胞質內,注射后的胚胎移植到假孕母鼠的輸卵管內。
1.6 敲除小鼠檢測
待移植后的胚胎發育到13 d時,取出胚胎提取基因組DNA進行錯配內切酶鑒定。具體步驟為:提取基因組DNA,設計引物擴增出靶序列兩側共350 bp片段,純化PCR產物;將純化的PCR產物在95 ℃變性10 min,之后緩慢降溫至室溫使片段重新退火,降溫程序為95℃→85 ℃(每秒降溫2 ℃),85 ℃→25 ℃(每秒降溫0.5 ℃);重新退火的PCR產物用2 U的T7EI在37 ℃酶切3 h,然后1%瓊脂糖凝膠電泳檢測結果。
2 結果與分析
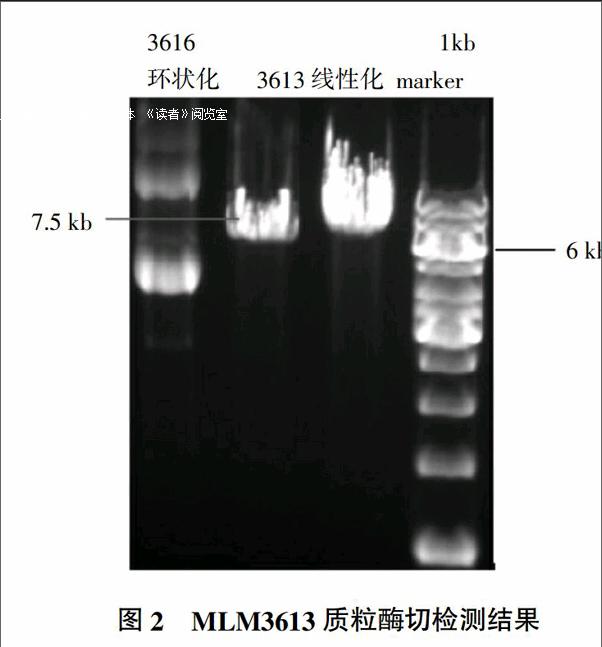
2.1 Cas9表達載體構建與線性化
Cas9表達載體MLM3613質粒經PmeⅠ酶切得到7.5 kb線性化片段(圖2),乙醇沉淀濃度達到1 000 ng/μL,純度高,可以用于下一步體外轉錄試驗。
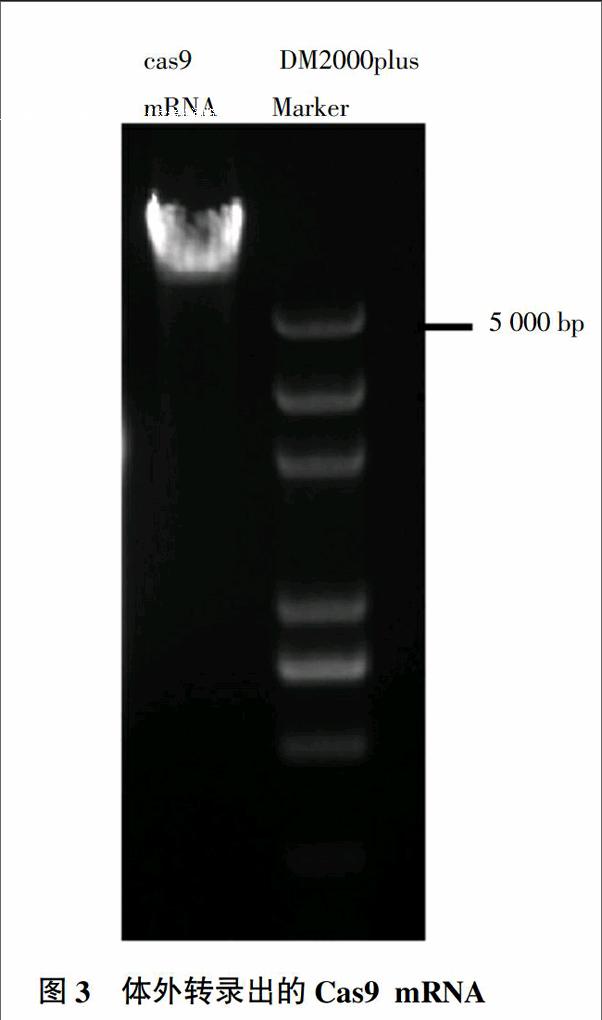
2.2 Cas9 mRNA體外轉錄結果
Cas9表達載體經酶切線性化后,通過ABI公司的體外轉錄試劑盒進行轉錄,得到了帶有帽子結構的Cas9 mRNA,并通過酚仿抽提得到純化的mRNA。結果(圖3)表明,轉錄的mRNA呈現明顯的兩條帶,為RNA的不同結構,純度較高,可用于下一步加尾試驗。
2.3 加polyA尾后得到全長mRNA序列
將體外轉錄出的mRNA通過polyA Tailing Kit試劑盒進行加尾,加上長度約150 bp的polyA尾巴,使之成為完整的有功能的mRNA。結果(圖4)表明,加尾后的mRNA在電泳時出現了適當的滯后,polyA加尾成功。
2.4 敲除小鼠檢測
待孕母鼠懷孕13 d時取出30只胚胎,提取其基因組DNA。用Transgenomic公司的SURVEYOR突變檢測試劑盒進行突變檢測。結果表明,PCR擴增出T1靶位點兩側473 bp序列,靶序列兩側序列分別為322 bp和151 bp。當序列內部存在堿基突變時,退火后形成的雜合雙鏈能夠被酶切開,形成3條帶(圖5樣品10);當不存在堿基突變時,退火形成的雙鏈不存在堿基錯配,不能被酶切開,30個樣品中共檢測出2只為突變陽性。
3 小結與討論
本研究獲得的Cas9和gRNA表達載體,為下一步進行相關研究提供了試驗材料;建立了CRISPR/Cas9基因定點修飾技術平臺,為轉基因小鼠和轉基因豬的制備奠定了技術基礎,通過CRISPR/Cas9系統獲得了MSTN基因敲除小鼠。
基因敲除動物模型一直是在活體動物上開展基因功能研究、尋找合適藥物作用靶標的重要工具。但是傳統的基因敲除方法需要通過復雜的打靶載體構建、ES細胞篩選、嵌合體小鼠選育等一系列步驟,不僅流程繁瑣、技術要求高,而且費用大、耗時較長,成功率受到多方面因素的限制。即使對于技術比較成熟的實驗室,利用傳統技術構建基因敲除大、小鼠一般也需要一年以上時間。本研究通過體外轉錄和顯微注射等方法在較短時間內獲得了MSTN基因敲除的小鼠,從時間、成本等方面節約了大量資源,也為下一步進行大動物轉基因研究奠定了基礎。但是從檢測的結果來看,效率并不高,30只小鼠中只檢測到2只陽性。分析原因可能是:①RNA顯微注射過程中RNA降解問題。RNA很不穩定,容易受到外界環境中RNA酶的降解而失效,在進行中RNA裸露在環境中的時間較長,且溫度無法控制到很低,導致RNA降解嚴重;②檢測方法靈敏度較低。本研究應用的是SURVEYOR檢測方法,該方法對試驗條件要求特別嚴格,酶添加量及酶切時間長短都會嚴重影響試驗結果,導致試驗結果不穩定,重復性差,只能通過大量克隆測序來解決。
參考文獻:
[1] KIM Y G, CHA J, CHANDRASEGARAN S. Hybrid restriction enzymes: Zinc finger fusions to Fok I cleavage domain[J]. Proceedings of the National Academy of Sciences of the United States of America,1996, 93(3):1156-1160.
[2] URNOV F D, REBAR E J, HOLMES M C,et al. Genome editing with engineered zinc finger nucleases[J]. Nature Reviews Genetics, 2010, 11(9):636-646.
[3] MOSCOU M J, BOGDANOVE A J. A simple cipher governs DNA recognition by TAL effectors[J]. Science, 2009, 326:1501-1508.
[4] BOCH J, SCHOLZE H, SCHORNACK S,et al. Breaking the code of DNA binding specificity of TAL-type III effectors[J]. Science, 2009, 326:1509-1512.
[5] BOCH J, BONAS U. Xanthomonas AvrBs3 family-type III effectors: Discovery and function[J]. Annual review of phytopathology, 2010, 48:419-436.
[6] LI T, HUANG S, ZHAO X, et al. Modularly assembled designer TAL effector nucleases for targeted gene knockout and gene replacement in eukaryotes[J]. Nucleic Acids Research, 2011, 39(14):6315-6325.
[7] WIEDENHEFT, STERNBERG B S H, DOUDNA J A, et al. RNA-guided genetic silencing systems in bacteria and archaea[J]. Nature,2012, 482: 331-338.
[8] MALI P, ESVELT K M, CHURCH G M, et al. Cas9 as a versatile tool for engineering biology[J]. Nat Methods,2013, 10(10): 957-963.
[9] MALI P, YANG L, ESVELT K M, et al. RNA-guided human genome engineering via Cas9[J]. Science,2013, 339:823-826.
[10] WANG H Y, YANG H, SHIVALILA C S,et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering[J]. Cell,2013, 153(4): 910-918.
[11] STINCKENS A, LUYTEN T,BIJTTEBIER J, et al.Characterization of the complete porcine MSTN gene and expression levels in pig breeds differing in muscularity[J]. Anim Genet, 2008,39(6):586-596.

