高考化學試題中的中和滴定分析及其教學
蘭建祥
摘要:分析了中和滴定分析教學的難點與教學策略。通過對高考化學試題中中和滴定的分析,歸納出滴定分析的反應類型、滴定計算原理、滴定方法和滴定分析的注意事項,以幫助學生初步認識多種常見的滴定分析,了解不同化學反應和不同滴定方法在滴定分析中的廣泛應用,達到對中和滴定知識遷移和拓展的目的。
關鍵詞:滴定分析;中和滴定;拓展教學;教學研討
文章編號:1005–6629(2015)9–0073–05 中圖分類號:G633.8 文獻標識碼:B
滴定分析是重要的化學分析方法。中學化學課程重點介紹和要求掌握的是酸堿中和滴定,但包括高考在內的各種考試,考查的重點卻是其他類型的滴定分析,借以考查學生知識的遷移能力。在全國各地的化學高考試題中,滴定分析業已成為重要的考點,高三復習教學中特別需要拓展滴定分析的教學內容,豐富學生對滴定分析的認識。
1 教學難點與教學策略分析
中學教材介紹的酸堿中和滴定在滴定方法上屬于直接滴定,也只涉及一步化學反應,滴定原理比較簡單。學生常常因為認識局限于酸堿中和滴定而難以理解其他類型的滴定分析,問題主要集中在以下四個方面?
(1)為什么酸堿中和反應之外的其他反應也可用于滴定分析?
(2)除酸堿中和反應外,還有哪些反應可用于滴定分析?
(3)間接滴定、返滴定、置換滴定、雙指示劑滴定的原理是什么?
(4)滴定分析有哪些注意事項?
針對以上問題,筆者在進行高三復習教學時,借助高考試題創設的問題情景,通過對滴定分析的“全”歸納(歸納滴定分析的反應類型、滴定計算原理、滴定方法和滴定分析的注意事項),幫助學生初步認識多種常見的滴定分析,了解不同化學反應和不同滴定方法在滴定分析中的廣泛應用,達到對中和滴定知識遷移和拓展的目的。
2 哪些反應可以用于滴定分析——歸納滴定分析的反應類型
通過列舉有關滴定分析的試題,讓學生從中感受并據此歸納出用于滴定分析的四大反應類型,教師進一步整理每一種反應類型用于滴定分析的要點,側重講解和點撥有關反應規律和指示劑的選擇。
2.1 酸堿中和反應
題1 (2014·北京理綜,節選)碳、硫的含量影響鋼鐵性能,碳、硫含量的一種測定方法是將鋼樣中碳、硫轉化為氣體,再用測碳、測硫裝置進行測定。
(1)采用裝置A,在高溫下將x克鋼樣中碳、硫轉化為CO2、SO2。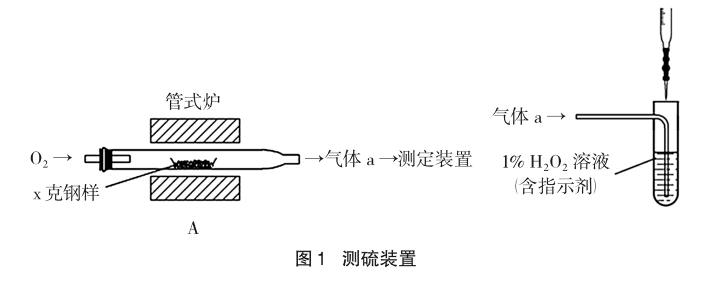
(2)將氣體a通入測硫裝置中(如圖1所示),采用滴定法測定硫的含量。



歸納與點撥:
(1)雙指示劑法是測定混合堿(Na2CO3與NaOH或Na2CO3與NaHCO3的混合物)的重要方法。先以酚酞為指示劑,NaOH完全被中和,Na2CO3被滴定成NaHCO3,NaHCO3不被滴定,此時為第一化學計量點,設滴定體積為V1mL;再加入甲基橙指示劑,繼續用HCl標準溶液滴定至溶液由橙黃色變為橙紅色即為終點,NaHCO3被中和成NaCl,此時為第二化學計量點,設滴定體積為V2mL。
(2)根據V1和V2可以判斷出混合堿的組成:當V1>V2時,試液為Na2CO3與NaOH的混合物;當V1 5 滴定分析的注意事項——歸納滴定分析的重要知識關聯點 在中學,滴定分析是要求學生重點掌握的一項基本實驗技能,特別是實驗的規范操作、指示劑的選擇、滴定終點的判斷、數據處理、誤差分析等。 5.1 實驗儀器 包括滴定管的選用、檢漏、讀數等。 5.1.1 滴定管的選用 (1)酸性、氧化性試劑一般用酸式滴定管,因為酸和氧化性物質易腐蝕橡膠管。 (2)堿性試劑一般用堿式滴定管,因為堿性物質易腐蝕玻璃,致使活塞無法打開。 5.1.2 酸式滴定管的檢漏 向滴定管中注入一定量的水,固定在滴定管夾上直立靜置兩分鐘,觀察有無水滴漏下。然后將活塞旋轉180°,再靜置兩分鐘,觀察有無水滴漏下,如均不漏水,滴定管即可使用。 5.1.3 滴定管的讀數 (1)視線應與凹液面最低點保持水平,視線與刻度的交點即為讀數(即凹液面定視線,視線定讀數,如圖2所示)。 (2)至于俯視和仰視的誤差:滴定管刻度從下到上逐漸減小,并且滴定管中液體的體積是兩次體積讀數之差,分析時還要看滴定前讀數是否正確,然后才能判斷實際量取的液體體積是偏大還是偏小。 (3)估讀一位,精確到0.01。 5.1.4 排除滴定管尖嘴部分氣泡的方法 對于酸式滴定管,可迅速轉動活塞,使溶液急速流下,將氣泡帶走;對于堿式滴定管,可將橡皮管向上彎曲并在稍高于玻璃珠處用兩手指擠壓玻璃珠,使溶液從尖嘴處噴出即可排除氣泡(如圖3所示)。 

5.2 操作步驟
5.2.1 滴定前的準備
(1)滴定管:查漏→洗滌→潤洗→裝液并固定→排氣泡并調整液面→記錄初始讀數。
(2)錐形瓶:注堿液→記體積→加指示劑(注意:錐形瓶不能潤洗,洗滌后也無需干燥)。
5.2.2 滴定操作
左手控制活塞或小球,右手振蕩錐形瓶,眼睛始終注視錐形瓶中溶液的顏色變化;速度先快后慢(如圖4所示)。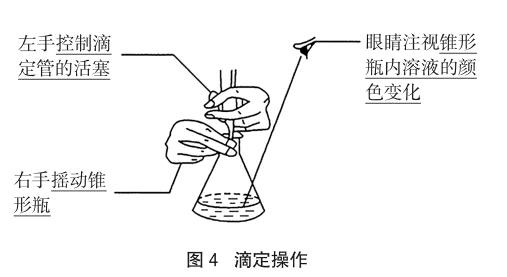
5.2.3 終點判斷
滴入最后一滴標準液,指示劑變色,且在半分鐘內不恢復原來的顏色,視為滴定終點并記錄末讀數。
5.2.4 數據處理
重復操作2~3次,取體積的平均值計算待測物的濃度。
5.3 指示劑的選擇
(參照上文中的“歸納滴定分析的反應類型”)
5.4 滴定終點的判斷
當滴入最后一滴標準溶液,溶液變成某色,且半分鐘內不恢復原來的顏色。
表述滴定終點的現象時,注意三個關鍵點:
(1)最后一滴:必須說明是滴入“最后一滴”溶液。
(2)顏色變化:必須說明滴入“最后一滴”溶液后溶液“顏色的變化”。
(3)半分鐘:必須說明溶液顏色變化后“半分鐘內不再恢復原來的顏色”。
5.5 數據處理
正確“取舍”數據(特別是要舍棄離群數據),計算“平均”體積,根據反應式確定標準液與待測液濃度和體積的關系,從而列出關系式進行計算。
5.6 誤差分析
根據反應方程式寫出計算式,分析操作對V(標)的影響,得出對最終測定結果的影響;對讀數時的視線問題要學會畫圖分析,切忌死記硬背結論。
在中學教學中,特別是在高三的復習教學中,可以借助習題或試題中的某些“題材”,在學生認知水平可以接受的前提下,通過借題發揮、總結歸納,對化學課程中的一些知識進行適當的延伸、拓展或補充,不僅可以豐富學生的知識結構,開拓學生的知識視野,而且可以實現舊知識的升華和能力的遷移應用,有益于提升學生的學習能力和創新能力,讓學生體驗學無止境的樂趣。
參考文獻:
[1]華中師范大學等編.分析化學(第二版)[M].北京:高等教育出版社,1986:431.
[2]王朝銀.步步高大二輪專題復習與增分策略[M].哈爾濱:黑龍江教育出版社,2014:50.
[3]王朝銀.步步高大一輪專題復習講義[M].哈爾濱:黑龍江教育出版社,2014:168.

