肌氨酸氧化酶的酶學性質及失活機理
仝艷軍,辛瑜,楊海麟,馮守帥,張玲,王武*
(1.江南大學教育部工業微生物技術重點實驗室,江蘇無錫214122;2.江南大學生物工程學院,江蘇無錫214122)
肌氨酸氧化酶的酶學性質及失活機理
仝艷軍1,2,辛瑜1,2,楊海麟1,2,馮守帥1,2,張玲1,2,王武*1,2
(1.江南大學教育部工業微生物技術重點實驗室,江蘇無錫214122;2.江南大學生物工程學院,江蘇無錫214122)
將來源于Bacillus sp.的肌氨酸氧化酶(SOX)基因在E.coli成功表達,并探索了肌氨酸氧化酶(sarcosine oxidase)酶學性質和失活機理。Bacillus sp.的肌氨酸氧化酶基因克隆入載體pET28a,并轉化至E.coli BL21(DE3)表達。經IPTG誘導8 h,對菌體破壁液進行SDS-PAGE電泳分析,發現在43 kDa處有明顯蛋白質條帶。采用親和介質分離純化獲得較高純度SOX。SOX酶學性質分析結果表明,其相對分子質量為43.8 kDa,最適反應溫度40℃,最適反應pH值為8.0;20 mmol/L的Mn2+對SOX具有明顯激活作用;其動力學參數分析表明,肌氨酸作為底物時的Km值為141.6 mmol/L,Vmax為0.115 mmol/(L·min)。結合SDS-PAGE凝膠電泳、熒光光譜和圓二色性光譜分析,探明了液態SOX的失活機理。在37℃恒溫條件下,隨儲存時間延長,SOX酶分子內部疏水基團逐漸暴露且二級結構被破壞,導致酶分子變性以及最終酶活力下降。為進一步提高SOX的酶活穩定性提供了理論依據。
肌氨酸氧化酶;酶學性質;失活機理
肌氨酸氧化酶(sarcosine oxidase;SOX;EC 1.5.3.1)屬于黃素蛋白質,可偶聯肌酐酶和肌酸酶將肌酐降解為甘氨酸、甲醛和過氧化氫[1]。作為一種重要的診斷酶制劑,SOX被廣泛應用于人體血清中肌酐水平的檢測,用來判斷腎功能的健康程度[2]。
肌酐檢測已成為醫療機構常規的檢測項目,SOX臨床需要量較大。目前,采用基因工程實現SOX的異源高效表達是滿足其臨床診斷應用的有效手段。E.coli作為常用的表達宿主菌,具有發酵成本低、產量高、易于操作、遺傳背景清楚、繁殖周期短和易于調控等諸多優點,被普遍認為是重組蛋白質生產的首選體系[3-5]。尤其,由于不同生物來源的SOX酶學性質差異較大,會直接影響其應用效果,如相對分子質量及亞基組成和蛋白質組成等[6-9]。因此,深入探索SOX酶學性質變得非常重要。此外,診斷酶試劑的穩定性普遍較差也是限制該類酶制劑實際應用的重要因素[10-12]。而翔實的酶分子失活機理研究是有效提高酶穩定性的基本前提。
研究中將Bacillus sp.BSD-8來源的SOX在E. coli中進行異源重組表達,采用親和層析獲得純度較高的目的蛋白質。在此基礎上,作者對SOX的酶學性質進行研究,并采用SDS-PAGE凝膠電泳、熒光光譜和圓二色性光譜等方法探討SOX的失活機理,為該SOX的穩定性研究奠定了理論基礎。
1 材料與方法
1.1菌株與質粒
克隆宿主菌E.coli JM109,表達宿主菌E.coli BL21(DE3)和重組菌E.coli JM109/pUC57-sox,由作者所在實驗室保藏;質粒pET28a,購自Novagen公司。
1.2主要材料
限制性內切酶EcoRⅠ,Hind III,T4 DNA連接酶,Taq DNA聚合酶,250 bp DNA分子量標準品,蛋白質分子量標準品,均購自TaKaRa公司(大連);膠回收試劑盒,質粒提取試劑盒,IPTG,卡那霉素,均購自上海生物工程有限公司;其他試劑均為國產或進口分析純試劑。
1.3主要儀器
電熱恒溫水浴鍋,上海醫療器械五廠制造;F-7000型熒光分光光度儀,日立公司制造;蛋白質電泳儀,美國BIO-RAD公司制造;MOS-450 AF圓二色性光譜儀,法國Bio-Logic公司制造;pHS-3TC型pH計,德國賽多利斯股份有限公司制造。
1.4肌氨酸氧化酶基因工程菌的構建
重組質粒的構建策略如圖1所示。將含有pET28a載體的重組菌和含有pUC57-sox的重組菌分別接種于含Kan的LB液體培養基中,37℃,200 r/min培養過夜,將得到的菌液用于質粒的提取。經PCR擴增純化后的目的基因和pET28a質粒分別經EcoRⅠ和Hind III雙酶切,產物經凝膠電泳后分別純化回收。在16℃,T4 DNA連接酶的作用下連接。連接產物轉化E.coli JM109感受態細胞,在含100 μg/mL Kan的LB平板上選取陽性轉化子,提取重組質粒,進行雙酶切電泳鑒定;并挑取陽性克隆送上海生物工程有限公司測序。將經過測序鑒定正確的重組質粒pET28a-sox轉化表達宿主菌E.coli BL21(DE3)感受態細胞,并將轉化產物涂布于含有Kan的LB固體培養基中,并挑取重組轉化子單菌落接種于LB液體培養基中,培養后提取質粒進行鑒定。
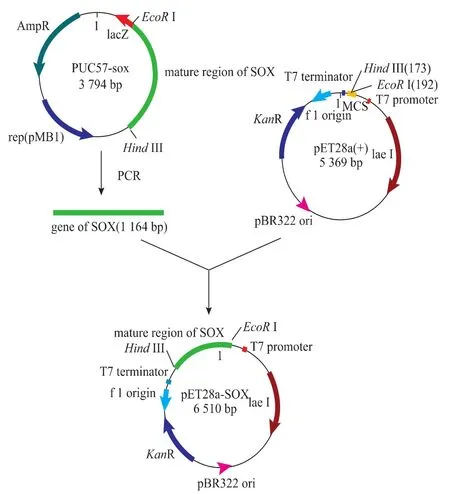
圖1 重組表達載體pET28a-sox的構建流程Fig.1Construction of recombinant plasmids pET28a-sox
1.5重組質粒在E.coli中的誘導表達
挑取陽性E.coli重組轉化子單菌落接種于50 mL含Kan的LB液體培養基,于37℃,200 r/min振蕩過夜。按體積分數5%的接種量轉接于50 mL含Kan的LB液體培養基中,于37℃200 r/min振蕩至菌體濃度OD600約為0.6~0.8,加入IPTG達到終濃度為1 mmol/L進行誘導,繼續培養8 h。8 000 r/min,4℃離心5 min收集菌體,用20 mmol/L pH 8.0的Tris-HCl緩沖液洗滌懸浮菌體,冰水浴超聲破碎菌體,獲得待測酶液。同時以不加IPTG誘導的重組菌和一個經IPTG誘導的非重組菌作為對照,進行SDS-PAGE凝膠電泳鑒定。
1.6肌氨酸氧化酶酶活測定
以肌氨酸為底物,參照文獻方法測定[13],取50 μL不同濃度的SOX酶液,分別加入3 mL顯色液于1 mmol/L的4-氨基安替比林、6 mmol/L的苯酚、7 000 U/L的辣根過氧化物酶、20 mmol/L的Tris-HCl緩沖液(pH 8.0)中,混勻后加入150 μL肌氨酸(0.2 mol/L),振蕩混勻,于37℃水浴反應5 min,結束后沸水浴煮沸3 min終止反應,冷卻,于500 nm下測定吸光度。酶活單位定義為:在37℃下,每分鐘轉化1 μmoL肌氨酸產生甲醛所需的酶量定義為1個酶活單位(U)。
1.7重組肌氨酸氧化酶的純化及酶學性質
1.7.1肌氨酸氧化酶的純化從固體平板挑取單菌落,接入種子培養基,37℃培養過夜。按照體積分數5%的接種量接入發酵培養基,37℃,200 r/min培養至OD6000.6~0.8后,采用1 mmol/L的IPTG誘導8 h。菌液破壁離心后,取酶上清液進行純化,參照文獻[14],純化后的酶液置于4℃保存備用。
1.7.2酶的最適反應溫度和最適pH值的測定在pH 8.0、20 mmol/L Tris-HCl緩沖液體系中,在20~80℃范圍內測定不同溫度下的酶活力,觀察溫度對酶活性的影響,以確定酶的最適反應溫度;在不同pH的反應體系(pH 4.0~11.0)中測定SOX的酶活力,以酶活力最高的記為100%,計算其他pH條件下的相對酶活力,確定酶促反應的最適pH。不同pH的緩沖液體系為檸檬酸-檸檬酸鈉緩沖液(pH 4.0~5.0),磷酸-磷酸鉀緩沖液(pH 6.0~7.0),Tris-HCl緩沖液(pH 8.0~9.0),碳酸氫鈉-NaOH緩沖液(pH 10.0~11.0)。
1.7.3酶的熱穩定性和pH穩定性分析在pH 8.0、20 mmol/L Tris-HCl緩沖液體系中,0~80℃系列梯度范圍內保溫10 min,測定其對應的剩余酶活力,以觀察酶的熱穩定性。另外,將一定量的酶液分別置于一系列不同pH的緩沖液中,37℃放置2.5 h后,測定其對應的剩余酶活力,以觀察酶的pH穩定性。不同pH的緩沖液體系同1.7.2。
1.7.4金屬離子對酶活力影響的測定在不同反應體系中分別加入不同的金屬離子Na+、K+、Ca2+、Mg2+、Mn2+、Fe3+、Co2+、Cu2+和Zn2+,設置3個終濃度梯度為2.0、20、100 mmol/L,分別混勻在37℃水浴中保溫2.5 h,測定各組酶活力。以未加入金屬離子的酶液的活性為100%,計算各組的相對酶活力,以觀察金屬離子對酶活性的影響。
1.7.5SOX酶動力學參數的測定用pH 8.0的Tris-HCl緩沖液配制濃度分別為1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 mmol/L的肌氨酸溶液,于37℃反應5 min的條件下測定SOX在不同肌氨酸濃度時的初始氧化活力。得到反應速度V和1/V。根據Lineweaver-Burk雙倒數作圖法,以1/[S]為橫坐標,1/V為縱坐標作圖,計算SOX對肌氨酸的Km和Vmax。
1.8肌氨酸氧化酶失活機理的分析方法
1.8.1SOX酶活力測定酶活力12 U/mL、pH 8.0的SOX酶液置于37℃恒溫水浴中,定時取樣測定其剩余酶活,設水浴前SOX酶液的酶活力為100%,計算37℃放置不同時間后的酶活保留率,重復3次取平均值。
1.8.2SDS-PAGE凝膠電泳分析酶活力12 U/ mL、pH 8.0的SOX酶液置于37℃恒溫水浴中,定時取樣進行SDS-PAGE凝膠電泳分析,水浴前SOX酶分子溶液樣品作為對照,檢測SOX酶分子在儲存過程中是否存在聚集或降解現象。
1.8.3熒光光譜鑒定利用F-7000型熒光分光光度計對37℃儲存不同時間的SOX酶溶液內源熒光及FAD熒光光譜進行分析。內源熒光實驗條件為:激發波長280 nm,掃描范圍280~400 nm,狹縫寬度5.0 nm,檢測步長1 nm。FAD輔基熒光實驗條件為:激發波長460 nm,掃描范圍460~620 nm,狹縫寬度5.0 nm,檢測步長1 nm。
1.8.4圓二色性光譜分析使用MOS-450AF圓二色性光譜儀對37℃儲存不同時間的SOX酶液進行分析,掃描范圍為200~250 nm,檢測步長1 nm,響應時間2 s,狹縫寬度4.0 nm,比色皿寬度1 mm,以不含有SOX的相同緩沖液體系為背景,測定橢圓率(θ),計算摩爾橢圓率[θ]。
2 結果與分析
2.1重組質粒鑒定及目的產物誘導表達
2.1.1重組質粒的鑒定將全合成的sox基因成功構建在pUC57載體,以pUC57-sox為模板進行PCR擴增。擴增的目的條帶和pET28a質粒經EcoR I和Hind III雙酶切純化后連接,構建重組質粒pET28a-sox。從轉化子中提取重組質粒pET28asox,采用限制性內切酶EcoRⅠ和Hind III進行雙酶切驗證,同時重組質粒進行PCR擴增,結果如圖2所示,泳道2為雙酶切后的重組質粒,在1 000 bp和5 000 bp處出現兩條特異性條帶,分別對應sox和pET28a片段。該結果初步驗證了重組質粒pET28a-sox已成功構建。
2.1.2目的產物的誘導表達及SDS-PAGE檢測誘導表達后的菌體經超聲破碎處理,獲得粗酶液并進行SOX酶活的測定和SDS-PAGE分析。如圖3所示。E.coli BL21(DE3)/pET28a-sox菌體經IPTG誘導后,其細胞破壁液中發現相對分子質量約43 kDa蛋白質特異條帶,表達量約占總細胞蛋白質的30%,SOX在E.coli中已成功表達。后續實驗采用乳糖優化誘導表達,其產酶水平和生產強度可達4.0 U/mL和91.2 U/(L·h)。
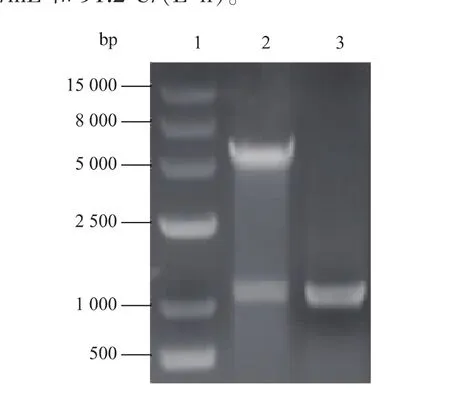
圖2 重組質粒pET28a-sox的雙酶切與PCR驗證Fig.2Identification of expression plasmid pET28a-sox by restriction digestion and PCR
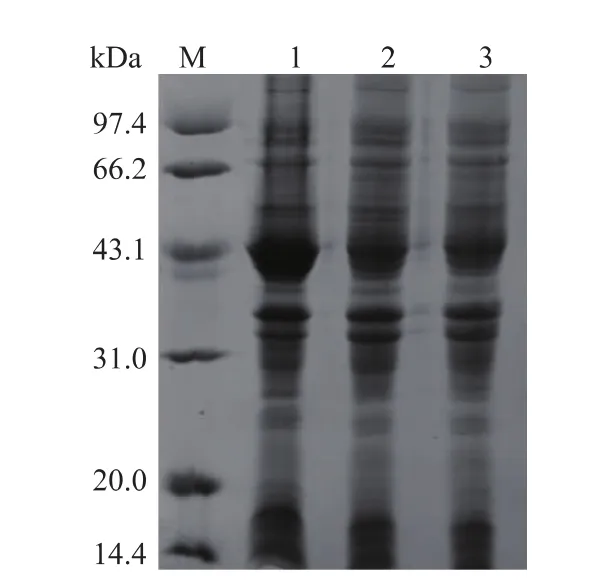
圖3 表達產物的SDS-PAGE分析Fig.3Analysis of SOX expression by SDS-PAGE
2.2重組肌氨酸氧化酶的酶學性質2.2.1重組肌氨酸氧化酶的純化收集濕菌體后,采用20 mmol/L的Tris-HCl緩沖液(pH 8.0)清洗后離心,去除上清液后重新將菌體懸浮于20 mmol/L的Tris-HCl緩沖液(pH 8.0)中超聲波破碎。破壁條件為4 min/1 min(超聲時間/間歇時間),破壁時間為20 min,至溶液變澄清,即獲得粗酶液。采用Sepharose-4-氨基吡咯-2-羧酸親和層析純化SOX;用20 mmol/L的Tris-HCl緩沖液(pH 8.0)平衡親和層析柱,再將粗酶液進樣層析柱,采用0.03 mol/L NaCl/20 mmol/L Tris-HCl緩沖液(pH 8.0)洗脫目的蛋白質,純化經SDS-PAGE分析,如圖4(a)所示,在相對分子質量43 kDa處有明顯單一蛋白質條帶。經Sephrose-4-氨基吡咯-2-羧酸親和純化,粗酶液中雜蛋白質基本除去,純化的SOX達到電泳純,比酶活為30.8U/mg,酶活回收率91.2%。采用MALDI-TOF對SOX相對分子質量進行鑒定,結果見圖4(b),該重組蛋白質相對分子質量43.8 kDa,與來源Bacillus sp.B-0618的SOX(43 839 Da)相近[15];純化后的樣品置于4℃保存備用。
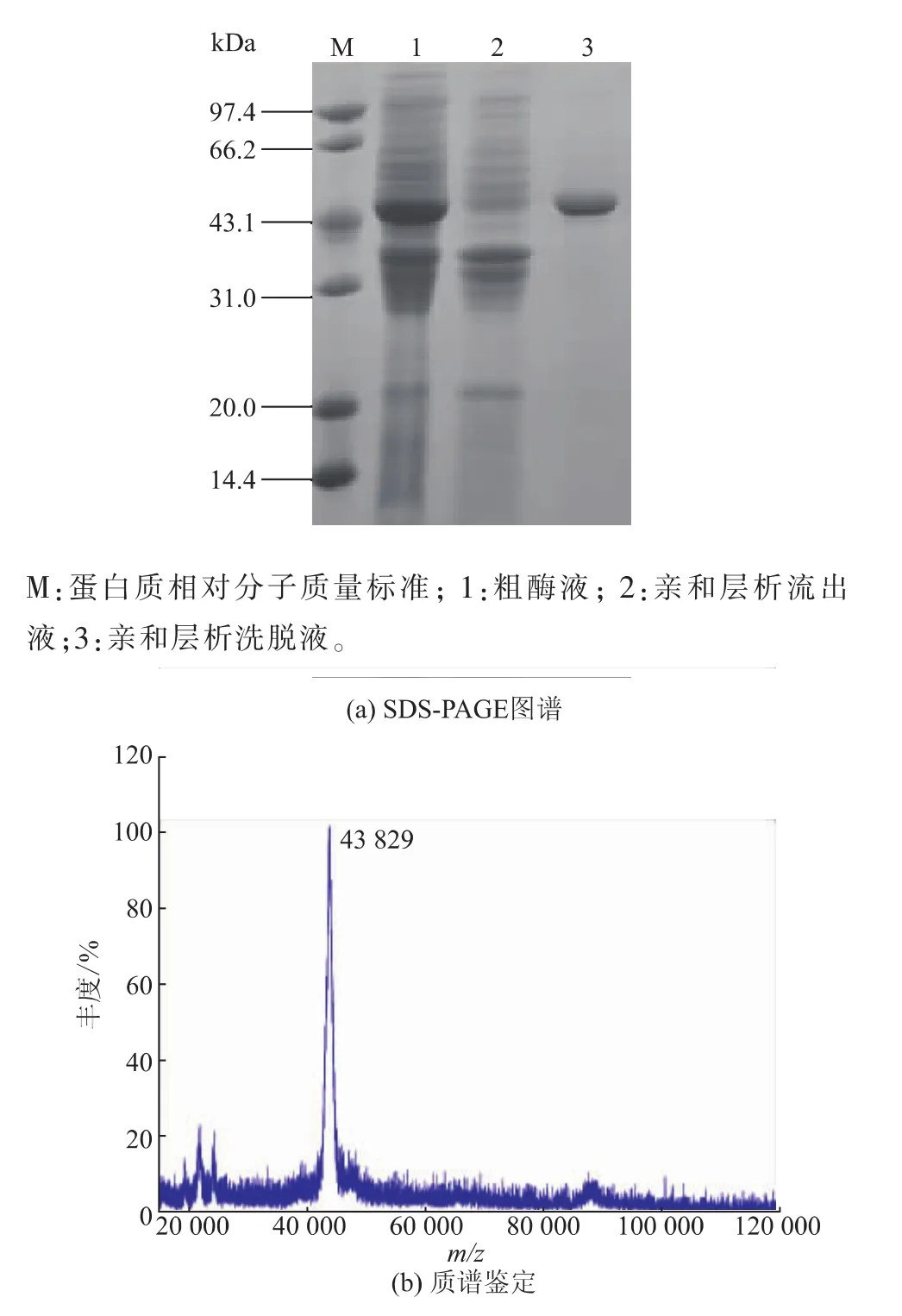
圖4 純化的肌氨酸氧化酶的SDS-PAGE圖譜及質譜鑒定圖譜Fig.4SDS-PAGE and mass spectrum analysis of purified SOX
2.2.2SOX最適反應溫度和pH值溫度和pH值是影響酶反應速率的重要因素,酶分子只在一定溫度和pH范圍內具有酶活性,對Bacillus sp.SOX的最適反應溫度和最適pH值進行分析。由圖5(a)可知,該SOX在20~80℃范圍內均具有一定的酶活性,其最適反應溫度為40℃。由圖5(b)可知,在pH 8.0~11.0范圍內,該重組酶具有較高的酶活力,在pH 8.0和pH 11.0的反應體系中可以獲得相同的酶活。據文獻報道[7,16],SOX在催化底物時,肌氨酸以兼性離子形式結合于SOX活性中心;而在脫甲基氧化過程中,肌氨酸則是以陰離子形式存在。底物的結合受到pKa 7.4和10.2兩個離子化參數的影響。對于肌氨酸其α-氨基的解離常數pKa為10.01,在pH 8.0的體系中,肌氨酸以適宜濃度的兼性離子存在,促進酶與底物的結合;在pH 11.0的體系中,肌氨酸其α-氨基已去質子化狀態,以較適濃度的陰離子形式存在,促進催化作用的進行。因此SOX在pH 8.0和pH 11.0的體系中呈現較高的酶活力。
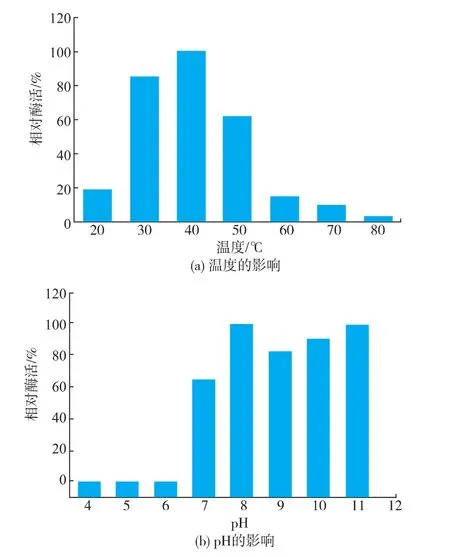
圖5 溫度及pH對SOX酶活力的影響Fig.5Effect of temperature and pH on SOX activity
2.2.3SOX的熱穩定性及pH穩定性酶液置于0~80℃不同水浴溫度保溫10 min,如圖6(a)所示,SOX在50℃以下具有較好的熱穩定性,剩余酶活可以保持在80%以上。將SOX在不同的pH體系下37℃放置2.5 h,如圖6(b)所示,SOX在pH 7.0~10.0體系中具有較好的pH穩定性,37℃下放置2.5 h,其剩余酶活仍保持在80%以上。在50℃以下或者pH 7.0~10.0體系中,SOX均可以保持其正確的空間構象。
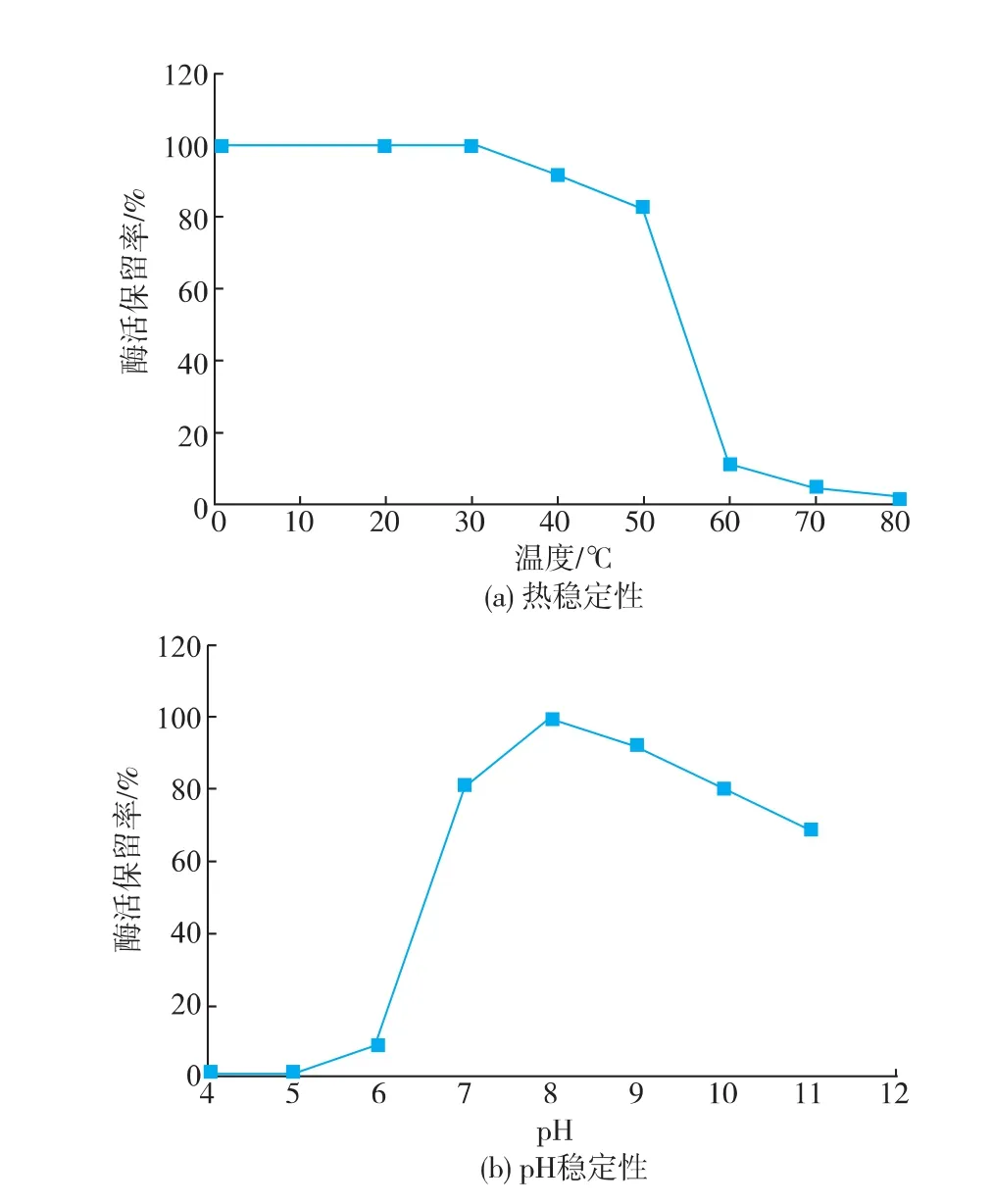
圖6 SOX的熱穩定性和pH穩定性分析Fig.6Analysis on thermal stability and pH stability of SOX
2.2.4金屬離子對肌氨酸氧化酶活性的影響SOX
對不同金屬離子的耐受性具有較大的差異,SOX在不同濃度(2.0、20、100 mmol/L)金屬離子體系中放置2.5 h(37℃)后,結果如圖7所示。不同濃度的Na+、K+及Ca2+對SOX酶活力基本沒有影響;Mn2+和Mg2+對SOX酶活力具有不同程度的激活作用,并呈現不同的變化趨勢;Mg2+對SOX酶活力的激活作用隨著Mg2+濃度的增加而減小;而Mn2+的激活作用隨著Mn2+濃度的增加先增加后減小,在20 mmol/L的體系下其相對酶活力達到最大為145.7%。Fe3+在低濃度下對酶活性基本沒有影響,Zn2+和Cu2+對SOX酶活力均有較強的抑制作用,在Zn2+和Cu2+體系中,SOX均出現了聚沉現象。Co2+在低濃度體系中對酶活性基本沒有影響,并在20 mmol/L的體系具有激活作用,其相對酶活力可以達到126.9%,然而在100 mmol/L的體系中則表現出較強的抑制作用并出現聚沉現象。某些金屬離子在合適的濃度范圍內,可能通過與酶表面的原子或基團發生相互作用而使SOX的構象發生一定的變化,使酶分子中的電子傳遞進行得更加流暢,因而表現為激活作用[17]。而某些金屬離子如Zn2+和Cu2+表現為強烈的抑制作用,則可能是由于Zn2+和Cu2+可導致酶分子疏水基團的暴露,導致聚集的發生和酶蛋白質的失活。其作用和其他Ca2+、Mg2+和Mn2+等二價金屬離子不同,可能與Zn2+和Cu2+特殊的化學性質有關[18]。
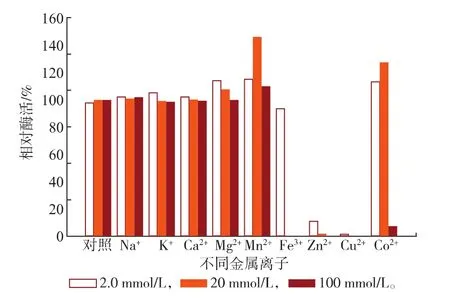
圖7 不同金屬離子對SOX酶活力的影響Fig.7Effect of various metal ions on the activity of SOX
2.2.5動力學參數的測定米式常數Km是酶的一個特征常數,可用于判斷酶的專一性,Km值越小,說明酶與底物的親和力越大,該底物越適宜作為該酶的天然底物。在pH 8.0條件下,SOX(10 U/mL)與1~10 mmol/L濃度梯度的肌氨酸于37℃反應5 min,測定SOX酶活力。根據Lineweaver-Burk雙倒數作圖法繪圖,結果如圖8所示,其米氏方程為
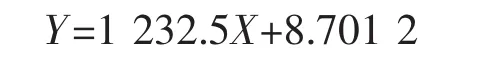
相關系數為0.994 7;計算得Bacillus sp SOX對肌氨酸的Km及Vmax值分別為141.6 mmol/L和0.115 mmol/(L·min)。來源不同的SOX對肌氨酸的Km值具有一定的差異性,如來源于Corynebacterium的SOX對肌氨酸的Km值為21 mmol/L[19]。
2.3肌氨酸氧化酶失活機理2.3.1SOX酶分子失活的表觀現象造成酶分子不穩定的因素有很多,如氨基酸消旋、脫酰胺、氧化,溫度和pH等。通過對SOX酶學性質研究發現,SOX在pH 8.0~10.0之間相對穩定,選擇酶活力12 U/mL,pH 8.0,37℃的條件下觀察酶失活現象。如圖9(a)所示,隨著儲存時間的延長,酶活保留率逐漸降低;在前3 d內,酶活保留率下降速度緩慢,約下降了18%,而后的4 d內酶活保留率下降較為明顯,到7 d時下降至7.9%。SOX在儲存過程中,隨著儲存時間的延長出現沉淀;經同步SDS-PAGE凝膠電泳分析(見圖9(b)),在SOX失活過程中,表現為目的條帶逐漸變細,并出現蛋白質聚集現象。
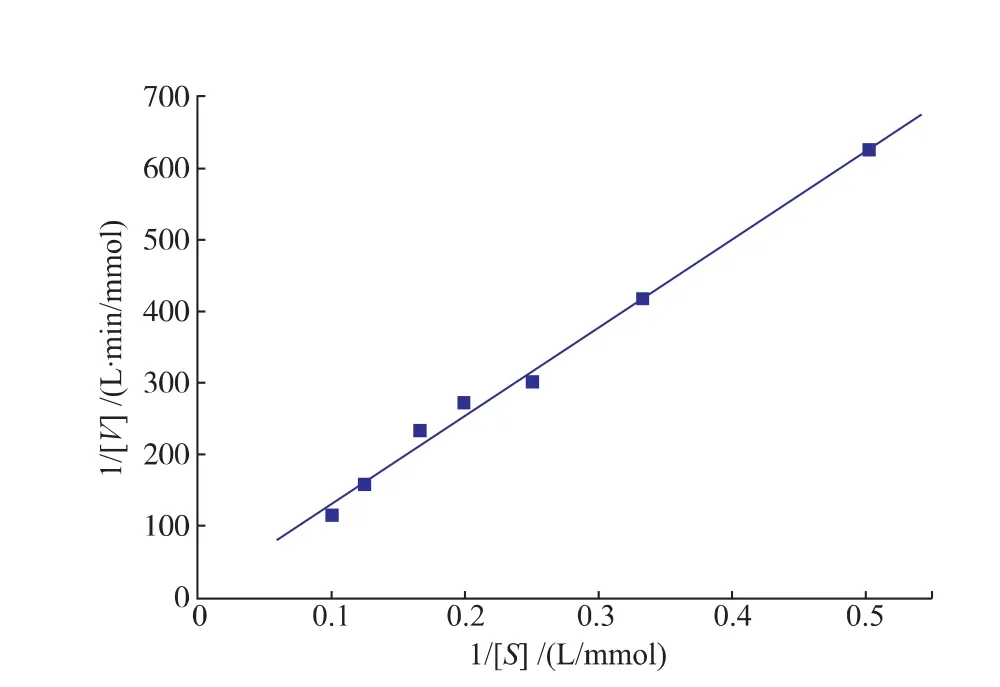
圖8 SOX的Lineweaver-Burk雙倒數圖Fig.8Lineweaver-Burk graph of recombinant SOX
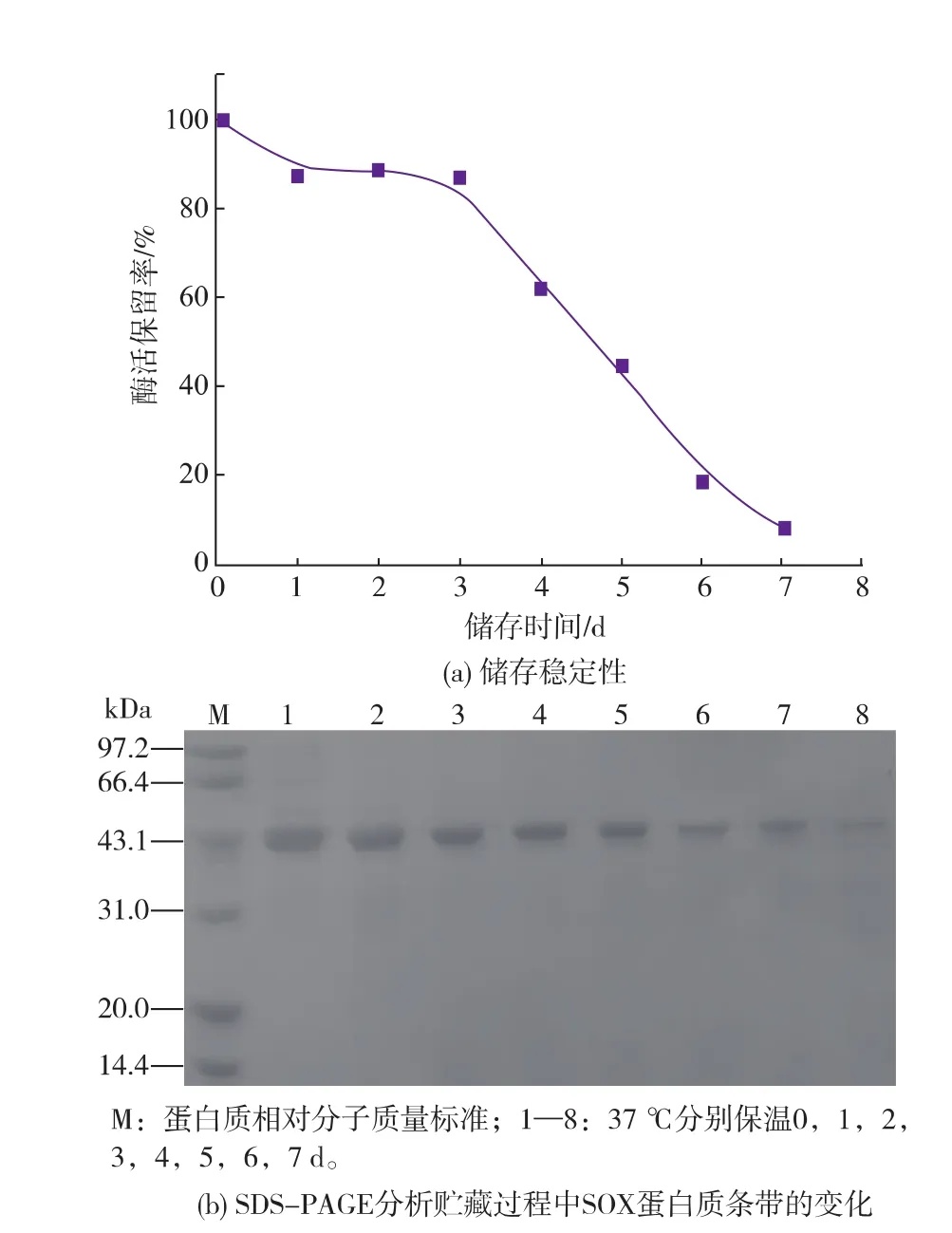
圖9 SOX的儲存穩定性曲線及SDS-PAGE凝膠電泳分析Fig.9The weakening of SOX enzymatic stability and protein banding at different storage period
2.3.2疏水基團暴露性分析通過內源熒光光譜法測定酶分子內部發色基團的變化,表征其結構的變化。酶分子中能發生熒光的氨基酸殘基有Trp、Tyr和Phe殘基,由于能量的轉移和傳遞,酶分子的熒光主要表現為Trp和Tyr殘基。SOX由387個氨基酸殘基組成,其中含有3個Trp和21個Tyr殘基;FAD作為SOX的輔基,含有異咯嗪環,有長共軛結構的π—π*躍遷,具有熒光性[20]。在酶分子結構解折疊時,內源性的疏水性殘基(Trp和Tyr)逐步暴露出來,導致Trp和Tyr殘基周圍的微環境的極性逐漸增強,酶分子的最大發射波長發生移動(熒光光譜紅移);另外,伴隨疏水基團的暴露,熒光強度逐漸上升。如圖10所示,隨著儲存時間的延長,SOX的最大發射波長由328 nm移向338 nm,熒光光譜發生紅移,最大熒光強度也逐漸增加,并在儲存3 d時趨于穩定。
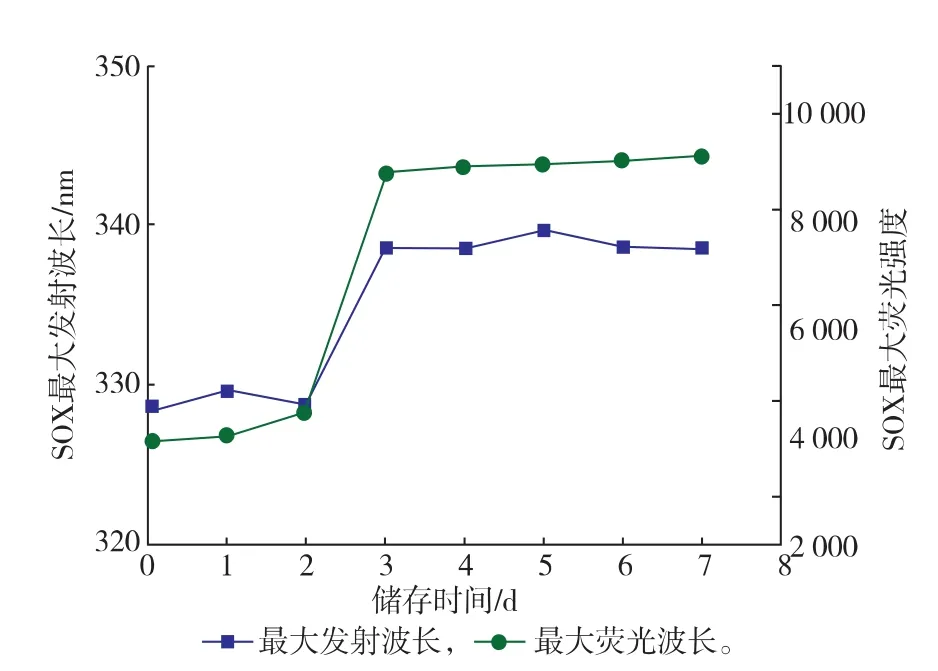
圖10 儲存不同時間的SOX的熒光光譜圖分析Fig.10Analysis of flurorescence on SOX under different storage period
SOX酶分子在儲存7 d之內,其內部結構基本暴露,二級結構基本喪失,FAD輔基基本暴露;如圖11所示,FAD的最大發射波長未發生偏移,最大熒光強度在儲存3 d后略有增加,表示FAD逐漸暴露于溶液中。通常SOX與FAD結合摩爾比為1∶1,大腸桿菌不能為SOX提供充足的FAD,而且FAD自身不能進入細胞,只能通過將核黃素運輸至胞內,并經濃縮和磷酸化作用轉化為FAD輔基[21-22],推斷SOX大量表達的過程中,由于FAD合成速度有限,SOX未能完全結合FAD輔基。綜上所述,推斷SOX在儲存過程中,SOX疏水基團逐漸暴露在溶液中,隨之酶活性逐漸降低,熒光強度增強;另外,大腸桿菌表達過程中未能提供足量的FAD,表達的SOX未能充分結合FAD輔基。
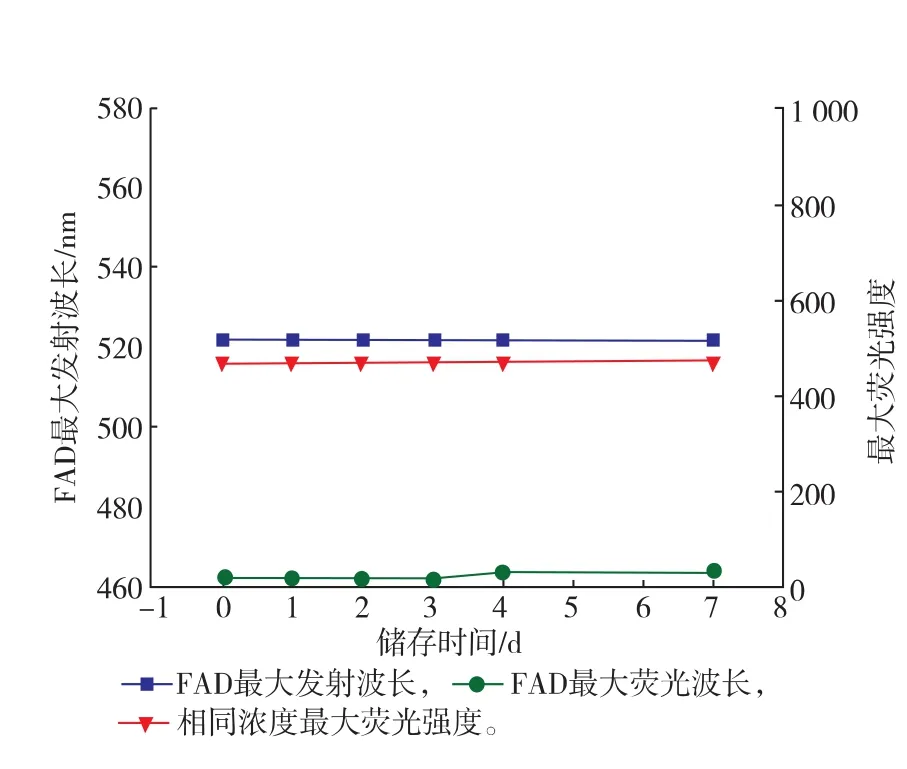
圖11 儲存不同時間的FAD的熒光光譜圖分析Fig.11Analysis of flurorescence on FAD under different storage period
2.3.3二級構象的變化酶分子中光活性發色基團的不對稱性及折疊結構的差異性會引起左右兩圓偏振光具有不同的光吸收,表現為圓二色性,常用于溶液中蛋白質二級結構變化的研究。在蛋白質二級結構中,α-螺旋在208 nm和222 nm處有兩個負的特征吸收峰,β-折疊在216 nm處有一負光譜帶,β-轉角在206 nm附近有一正吸收峰[23]。將置于37℃保溫不同時間的SOX酶液進行圓二色性光譜分析,結果如圖12所示,SOX初始時的二級結構特征吸收峰較為完整,但37℃恒溫水浴放置7 d后,SOX酶分子的二級結構特征吸收峰完整性降低,天然構象破壞,酶分子活性降低,其剩余的相對酶活不足10%。
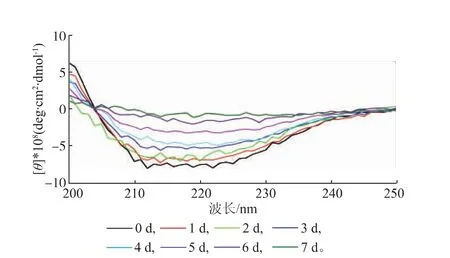
圖12 不同儲存時間下SOX酶分子的圓二色性光譜分析Fig.12Analysis of circular dichroism of SOX in far-UV region under different storage periods
3 結語
肌氨酸氧化酶在臨床診斷具有重要的應用價值。研究采用基因工程技術,實現了Bacillus sp.肌氨酸氧化酶的異源高效表達。SOX酶學性質分析表明,Bacillus sp.肌氨酸氧化酶為單亞基的蛋白質,肽鏈相對分子質量為43.8 kDa,最適反應溫度為40℃,最適反應pH為8.0;SOX的動力學參數分析表明,在以肌氨酸為底物時,Km值為141.6 mmol/L,Vmax為0.115 mmol/(L·min)。結合SDS-PAGE凝膠電泳、熒光光譜和圓二色性光譜等方法,研究了液態SOX的失活機理。來源于Bacillus sp.的SOX酶液于37℃恒溫放置過程中,SOX酶分子內部疏水基團逐漸暴露,同時二級結構逐漸破壞,SOX酶分子變性,導致酶活力下降。SOX失活機理的探明,為后續提高SOX的穩定性奠定了理論基礎。
[1]Suzuki M.Purification and some properties of sarcosine oxidase from Corynebacterium sp.U-96[J]. Journal of Biochemistry,1981,89(2):599-607.
[2]Nagata K,Sasaki H,Hua M,et al.Crystal structure of monomeric sarcosine oxidase from Bacillus sp.NS-129 reveals multiple conformations at the active-site loop[J].Proceeding of the Japan Academy series B,2005,81(6):220-224.
[3]Sorensen H,Mortensen K.Advanced genetic strategies for recombinant protein expression in Escherichia coli[J].Journal of Biotechnology,2005.115(2):113-128.
[4]Choi J,Lee S.Secretory and extracellular production of recombinant proteins using Escherichia coli[J].Applied Microbiology and Biotechnology,2004,64(5):625-635.
[5]Andersen D,Krummen L.Recombinant protein expression for therapeutic applications[J]. Current Opinion in Biotechnology,2002,13(2):117-123.
[6]Guo K,Ma X,Sun G,et al.Expression and characterization of a thermostable sarcosine oxidase(SOX)from Bacillus sp.in Escherichia coli[J].Applied Microbiology and Biotechnology,2006,73(3):559-566.
[7]Wagner M,Trickey P,Chen Z,et al.Monomeric sarcosine oxidase:Flavin reactivity and activity site binding determinants[J].Biochemistry,2000,39(30):8813-8824.
[8]Lee S,Jia B,Pham B,et al.Architecture and characterization of sarcosine oxidase from Thermococcus kodakarensis KOD1[J]. Extremophiles,2012,16(1):87-93.
[9]Hassan-Abdallah A,Zhao G.Cloning,expression and crystallization of heterotetrameric sarcosine oxidase from Pseudomonas maltophilia[J].Protein Expression and Purification,2005,43(1):33-43.
[10]張玉然,辛瑜,楊海麟,等.黃嘌呤氧化酶酶學性質及共價交聯固定化[J].食品與生物技術學報,2014,33(1):16-21.
ZHANG Yuran,XIN Yu,YANG Hailin,et al.Enzymatic properties of xanthine oxidase and its covalent immobilization on different supports[J]. Journal of Food Science and Biotechnolog,2014,33(1):16-21.(in Chinese)
[11]Tong Y,Xin Y,Yang H,et al.Efficient improvement on stability of sarcosine oxidase via poly-lysinemodification on enzyme surface[J].International Journal of Biological Macromolecules,2014,67:140-146.
[12]蘇二正,夏濤,宛曉春,等.單寧酶和β-葡萄糖苷酶的共固定化[J].食品與生物技術學報,2006,25(1):40-44.
SU Erzheng,XIA Tao,WAN Xiaochun,et al.Study on the co-immobilization of tannase and β-glucosidase[J].Journal of Food Science and Biotechnolog,2006,25(1):40-44.(in Chinese)
[13]Inouye Y,Nishimura M,Matsuda Y,et al.Purification and characterization of sarcosine oxidase of Streptomyces origin[J]Chemical&Pharmaceutical Bulletin,1987,35(10):4194-4202.
[14]Tong Y,Xin Y,Yang H,et al.Novel affinity purification of monomeric sarcosine oxidase expressed in Escherichia coli[J]. Journal of Separation Science,2013,36(18):3086-3092.
[15]Wager M,Khanna P,Jorns M.Structure of the flavocoenzyme of two homologous amine oxidase:monomeric sarcosine oxidase and N-methyltryptophan oxidase[J].Biochemistry,1999,38(17):5588-5595.
[16]Zhao G,Jorns M.Ionization of zwitterionic amine substrates bounds to monomeric sarcosine oxidase[J].Biochemistry,2005,44(51):16866-16874.
[17]方華,陳俊,陳瞾,等.緩沖體系和金屬離子對漆酶催化活性的影響[J].武漢理工大學學報,2009,31(5):27-30.
FANG Hua,CHEN Jun,CHEN Zhao,et al.Effect of buffer solutions and metal ions on the laccase activity[J].Journal of WuHan University of Technology,2009,31(5):27-30.(in Chinese)
[18]劉陶陶,王希成.銅離子對海參精氨酸激酶活力與結構的影響[J].海洋科學,2011,35(1):17-21.
LIU Taotao,WANG Xicheng.Effects of Cu2+on Arginine kinase:activity changes,conformational changes,and aggregation[J]. Marine Sciences,2011,35(1):17-21.(in Chinese)
[19]Hayashi S,Suzuki M Nakamura.Steady-state kinetics and spectral properties of Corynebacterium sarcosine oxidase[J].Biochimia et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1983,742(3):630-636.
[20]Brown M,Royer C.Fluorescence spectroscopy as a tool to investigate protein interactions[J].Current Opinion in Biotechnology,1997,8(1):45-49.
[21]陳亦,辛瑜,楊海麟,等.保護劑對膽固醇氧化酶穩定性機理的研究[J].食品與生物技術學報,2013,32(6):661-666.
CHEN Yi,XIN Yu,YANG Hailin,et al.Study on the effect of protective additives on stability mechanism of cholesterol oxidase[J].Journal of Food Science and Biotechnolog,2013,32(6):661-666.(in Chinese)
[22]郝淑美,王宣軍,張秀霞.用乳糖作為誘導劑進行重組蛋白的表達[J].中國生物制品學雜志,2005,18(5):409-411.
HAO Shumei,WANG Xuanjun,ZHANG Xiuxia.Expression of recombinant gene in E.coli using lactose as inducer[J]. Chinese Journal of Biologicals,2005,18(5):409-412.(in Chinese)
[23]沈瓊,黃濱,邵嘉亮,等.運用圓二色譜研究酶與化合物相互作用的機理[J].中山大學學報,2006,45(4):62-64.
SHEN Qiong,HUANG Bin,SHAO Jialiang,et al.Mechanism discussion of interaction between enzyme and several compounds with circular dichroism method[J].Journal of Zhongshan University,2006,45(4):62-64.(in Chinese)
On the Enzymatic Properties and Deactivation Mechanism of Sarcosine Oxidase
TONGYanjun,XINYu,YANGHailin,FENGShoushuai,ZHANGLing,WANGWu*
(1.Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
The sarcosine oxidase(SOX)gene from Bacillus sp.was expressed in E.coli,and the properties and deactivation mechanism were further analyzed.After transformation of the cloned DNA into host E.coli BL21(DE3),the SOX gene was induced by IPTG for 8 h,a protein band of 43 kDa appeared in SDS-PAGE electrophoresis.From the crude enzyme solution,SOX in high purity was obtained through affinitive separation and purification.The analytic results of enzymatic properties showed that its relative molecular mass was 43.8 kDa,and its optimum reactiontemperature and pH value were 40℃and 8.0,respectively.Moreover,20 mmol/L Mn2+exhibited an obvious activation effects on recombinant SOX.The kinetic parameters of Km and Vmax were determined as 141.6 mmol/L and 0.115 mmol/(L·min)when sarcosine used as a substrate.With the SDS-PAGE gel electrophoresis,fluorescence and circular dichroism spectroscopy,the deactivation mechanism of SOX was further studied.At constant temperature 37℃,the internal hydrophobic group of SOX molecule was gradually exposed and its secondary structure was destroyed along with the prolonged storage time,leading to the denaturation of SOX protein and the lowering down of its activity.The above results provide a theoretical basis for improving SOX stability in future.
sarcosine oxidase,enzymatic properties,deactivation mechanism
Q 783
A
1673—1689(2015)12—1239—09
2014-10-29
國家自然科學基金項目(21306064);江蘇省創新計劃項目(CXZZ12_0752);江南大學博士研究生科學研究基金項目(JUDCF12013)。
仝艷軍(1986—),女,山東荷澤人,工學博士,食品科學與工程博士后,主要從事耐熱肌氨酸氧化酶基因表達、純化及酶穩定性研究。E-mail:yanjun1986927@163.com
王武(1952—),女,福建福州人,教授,博士研究生導師,主要從事酶分子改造,遺傳工程和發酵工程研究。
E-mail:bioprocessor@aliyun.com;wangwu@jiangnan.edu.cn

