雞neurexophilin 1基因在畢赤酵母中的表達
陳美玲 聶彬 姜勛平 劉桂瓊
(華中農業大學動物科技學院,武漢 430070)
雞neurexophilin 1基因在畢赤酵母中的表達
陳美玲 聶彬 姜勛平 劉桂瓊
(華中農業大學動物科技學院,武漢 430070)
Neurexophilin 1是母雞子宮陰道結合部位的差異表達基因。根據雞nxph1的序列,結合畢赤酵母密碼子的偏好性,合成nxph1基因,設計引物以合成基因為模板,擴增其去除信號肽的DNA序列△nxph1,將合成的nxph1基因及去除信號肽的nxph1基因片段△nxph1分別插入pPICZαA真核表達載體,構建重組表達質粒pPICZαA/nxph1和去除信號肽的重組表達質粒pPICZαA/△nxph1,電轉入畢赤酵母GS115,陽性菌用終濃度為1%的甲醇誘導表達,SDS-PAGE電泳和Western blot檢測表達產物,結果表明重組菌成功分泌雞NXPH1蛋白和去除信號的△NXPH1蛋白,大小約29 kD,為探索NXPH1在母雞生殖道內的功能奠定基礎。
nxph 1;畢赤酵母;基因表達
Neurexophilin(NXPH)是一種從大鼠和牛的腦部分離純化的神經糖蛋白,其成熟肽29 kD,因其與神經元表面蛋白Iα(neurexin Iα)緊密結合而命名[1]。哺乳動物至少含4個與NXPH相關的基因,分別是nxph1、nxph2、nxph3和nxph4,這4種基因在不同動物不同組織中的表達不一致,如人類可表達4種基因,而鼠類則只表達nxph1、nxph3和nxph4基因,且只有NXPH1和NXPH3可以與neurexin Iα結合[2]。朱金金等[3]發現nxph1是雞子宮陰道結合部的差異表達基因,且該基因在高受精率組母雞子宮陰道交接部的表達高于低受精率組,推測其可能與精子貯存相關。劉桂瓊等[4]也發現在人工授精后,母雞貯精腺表達神經系統內特異表達的Neurexophilin1基因,而高受精力母雞貯精腺Neurexophilin1 表達量高于低受精力母雞,因此神經調控可能參與貯精腺內的精子貯存。本研究根據酵母基因表達的密碼子偏好改造雞nxph1基因,在畢赤酵母GS115中表達該基因,以期為后續研究NXPH 1蛋白的生物學功能奠定基礎。
1 材料與方法
1.1 材料
真核表達載體pPICZαA、畢赤酵母GS115菌株為華中農業大學國家微生物重點實驗室郭愛珍教授課題組惠贈;克隆載體PMD-18T購自大連寶生物公司(TaKaRa)公司;大腸桿菌DH5α菌株購自北京全式金生物技術有限公司;
ZeocinTM購自Invitrogen公司;質粒提取試劑盒購自Omega公司;T4 DNA連接酶、TEMED、限制性內切酶EcoRⅠ、NotⅠ、SacⅠ均購于TOYOBO公司;neurexophilin 1抗體購自美國R&D公司。
1.2 方法
1.2.1 Nxph1基因合成和引物設計 根據GenBank公布的雞nxph1基因(XM-418683)mRNA編碼序列,結合畢赤酵母密碼子的偏好性優化序列,在基因的兩端添加EcoRⅠ和NotⅠ限制性內切酶位點,序列長為833 bp,序列依次為保護性堿基、EcoRⅠ酶切位點、氨基酸的編碼序列813 bp、NotⅠ酶切位點和保護性堿基。依據優化后的堿基序列設計一對可擴增去除NXPH1蛋白信號肽的特異性引物P1和P2,并在引物序列的兩端分別添加EcoRⅠ和NotⅠ兩個限制性內切酶位點,其擴增產物為770 bp,其中氨基酸的編碼序列長750 bp,將該序列命名為△nxph1。優化基因序列和引物由北京金唯智公司合成。
1.2.2 Nxph1基因的序列鑒定 以合成的nxph1基因為模板,分別以P1/P2為上下游引物進行PCR擴增。PCR反應條件:94℃ 預變性4 min,94℃變性30 s,55℃退火1 min,72℃延伸 30 s,40個循環,72℃延伸10 min。2%的瓊脂糖凝膠檢測PCR產物。DNA凝膠回收試劑盒(北京莊萌生物公司)回收PCR產物,與pMD18-T載體連接,轉化DH5α,提取質粒后用EcoRⅠ和NotⅠ雙酶切鑒定,陽性克隆菌液送上海生工測序。
1.2.3 酵母表達載體的構建 將△nxph1質粒、合成的基因nxph1和酵母表達載體pPICZαA用 EcoRⅠ和NotⅠ在37℃條件下雙酶切3 h,2%的瓊脂糖凝膠電泳,回收酶切產物,T4 DNA連接酶16℃連接過夜,構建成重組表達質粒pPICZαA/ nxph1和pPICZαA/△nxph1。連接產物轉化DH5α感受態細胞,挑選菌落培養提質粒,用通用引物5' AOX和3' AOX進行PCR 鑒定,用 EcoRⅠ和NotⅠ進行雙酶切鑒定,陽性克隆菌液送上海生工測序。
1.2.4 構建重組nxph1的酵母菌株 用 SacⅠ線性化重組質粒pPICZαA/ nxph1 和pPICZαA/△nxph1,取制備好的GS115感受態50 μL與10 μL線性化的pPICZαA/nxph1、pPICZαA/△nxph1質粒充分混勻后轉移到預冷的0.2 cm電擊杯中,放入Bio-Rad電轉儀中1 500 V、50 μF和500 μs電擊,立即加入1 mL冰凍的山梨醇液,冰浴靜止10 min,菌液30℃孵育1.5 h,離心后棄上清液,取100 μL混合沉淀涂布在含有Zeocin(100 μg/mL)的YPD平板上,30℃培養至出現白色單菌落。挑選白色單菌落培養,采用“煮-凍-煮”的方法提取酵母基因組,用通用引物擴增,1 % 的瓊脂糖凝膠電泳檢測擴增產物。
1.2.5 NXPH1在酵母中的表達 陽性酵母重組質粒菌液接種BMGY培養基,30℃、220 r/min培養20-24 h。室溫6 000 r/min離心5 min,棄上清,沉淀用100 mL的BMMY培養基懸浮,30℃、220 r/min振蕩培養,甲醇誘導表達,每隔24 h添加100 %甲醇使終濃度為1.0 %,持續誘導96 h,每次添加甲醇時取2 mL的菌液,12 000 r/min離心5 min,取上清至新的離心管中 -20℃保存。按照BCA蛋白濃度定量試劑盒(北京索萊寶生物)測定表達蛋白的濃度,選擇誘導72 h的上清液進行真空冷凍干燥,凍干后的蛋白于-20℃長期保存備用。
1.2.6 表達產物的SDS-PAGE和Western blot檢測 將100 μL的三氯乙酸加入到1 mL的表達上清,4℃過夜。12 000 r/min離心10 min,棄上清液,加入1 mL預冷的丙酮,-20℃靜止30 min,離心棄上清,室溫晾干獲得濃縮蛋白。向離心管中加入100 μL的2×SDS-PAGE Loading Buffer,將離心管在沸水中煮10 min,取10 μL做Tricine-SDS-PAGE,考馬斯亮藍染色,同時轉印到硝酸纖維素膜上進行Western blot分析。
2 結果
2.1 △nxph1的PCR擴增
PCR擴增的產物經2 %的瓊脂糖凝膠進行電泳,可以看出在750 bp附近有一特異性的DNA條帶,與預期目的產物(770 bp)相符(圖1)。將PCR產物連接T載體,陽性克隆再用EcoRⅠ和NotⅠ雙酶切鑒定,在2 000 bp和750 bp有特異性條帶(圖2),分別是T載體片段和△nxph1目的基因片段,將此陽性克隆的菌液進行測序檢測,確定為目的基因片段。
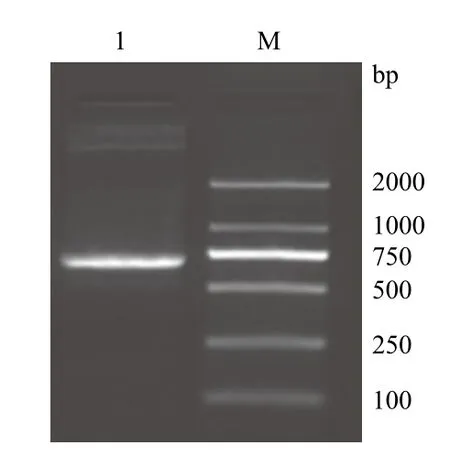
圖1 △nxph1 PCR產物
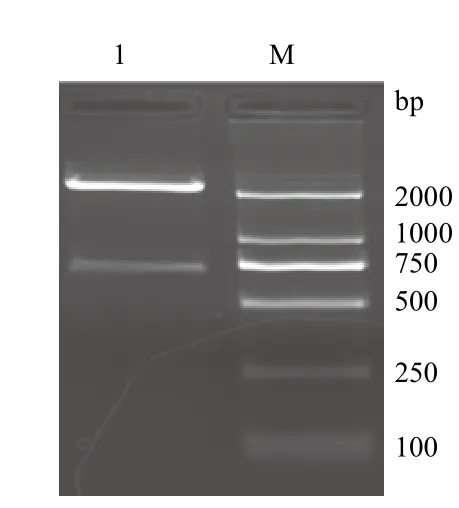
圖2 △nxph1陽性克隆的雙酶切
2.2 重組表達質粒的鑒定
用 EcoRⅠ和NotⅠ雙酶切重組質粒pPICZαA/ nxph1 和pPICZαA/△nxph1,酶切的重組質粒pPICZαA/ nxph1應在約3 500 bp處和813 bp處有特異性的條帶,酶切的重組質粒pPICZαA/△nxph1應在約3 500 bp處和750 bp處有特異性的條帶,圖3顯示在3 500 bp處和700-1 000 bp處分別有兩條帶,與預期結果相符。
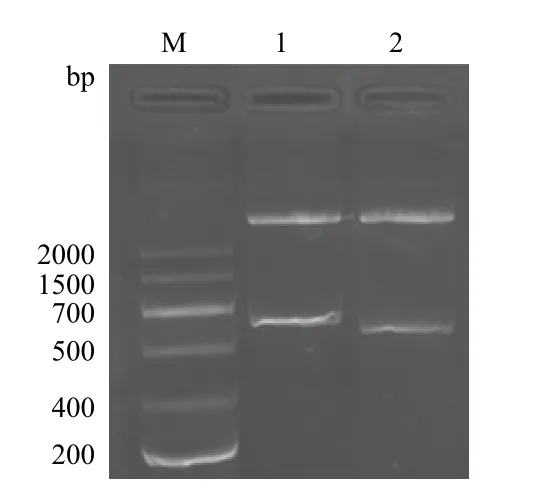
圖3 重組表達質粒pPICZαA/ nxph1 和pPICZαA/nxph1的酶切圖
以5'AOX和3'AOX為引物,以重組表達質粒pPICZαA/nxph1和pPICZαA/△nxph1為模板進行PCR反應,檢測到擴增出的目的片段大小在1 000-1 500 bp之間(圖4)。目的基因序列大小為分別為813 bp和750 bp,載體自身序列為588 bp,故擴增產物的片段大小約1 300 bp,擴增產物片段與預測片段一致,可以進一步進行測序檢測。
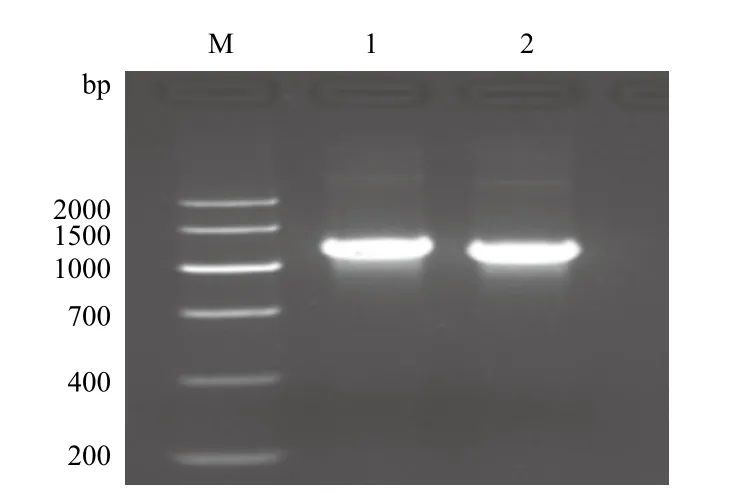
圖4 重組質粒pPICZαA/ nxph1 和pPICZαA/△nxph1的PCR檢測
將PCR鑒定和雙酶切鑒定正確的重組質粒pPICZαA/ nxph1和pPICZαA/△nxph1送上海生工進行序列測定,測序結果證明目的基因片段已正確插入到載體pPICZαA中。
2.3 重組酵母菌的鑒定
重組表達質粒pPICZαA/ nxph1和 pPICZαA/△nxph1轉入到畢赤酵母GS115后,以5'AOX和3'AOX為引物進行PCR檢測,在1 000-1 500 bp處有一條特異性條帶(圖5),擴增產物的片段大小約1 300 bp,擴增產物片段與預測片段一致,說明目的基因片段已整合入酵母基因組。
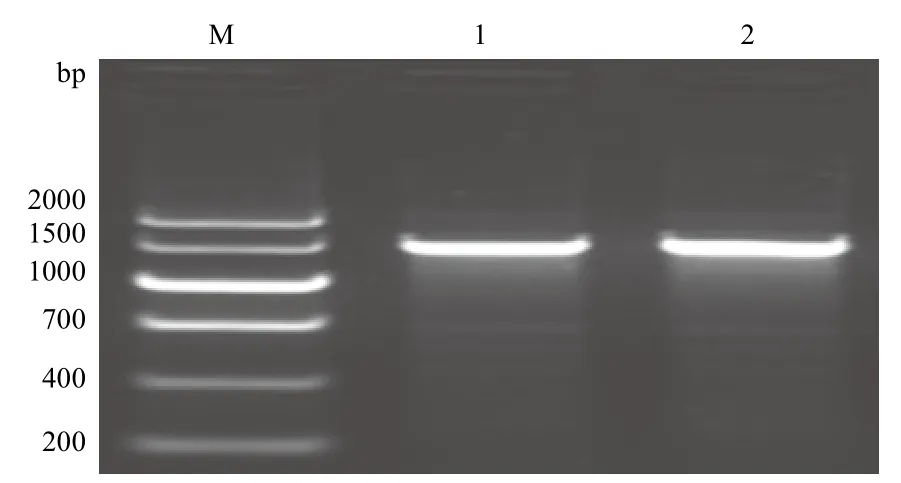
圖5 pPICZαA/ nxph1 和pPICZαA/△nxph1在GS115中的PCR鑒定
2.4 Tricine-SDS-PAGE和Western blot檢測結果
陽性重組菌用甲醇誘導表達,將表達產物濃縮變性后進行Tricine-SDS-PAGE電泳,用pPICZαA空酵母載體作對照,電泳完畢后考馬斯亮藍R-250進行染色,發現在約29 kD處有一條清晰的細條帶,對照組沒有條帶。選擇誘導72 h的蛋白做Western blot,結果(圖6)顯示在相應位置有特異的免疫性條帶。
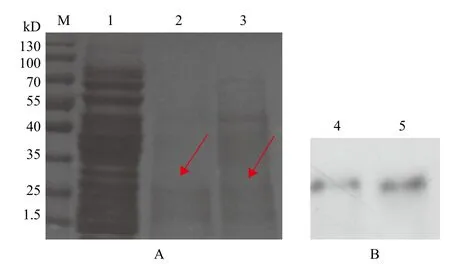
圖6 重組蛋白的Tricine-SDS-PAGE和Western blot檢測
2.5 蛋白濃度檢測結果
蛋白標準品繪制完成蛋白標準曲線,R2=0.992,說明標準曲線較為理想,可以用于測定蛋白樣品濃度。表1是分別對誘導48 h、72 h、96 h的重組蛋白pPICZαA/ nxph1和 pPICZαA/ △nxph1的濃度檢測結果,從表中可以看出去除信號肽的NXPH1表達量相對更高一些,且在72 h蛋白的濃度達到最高。
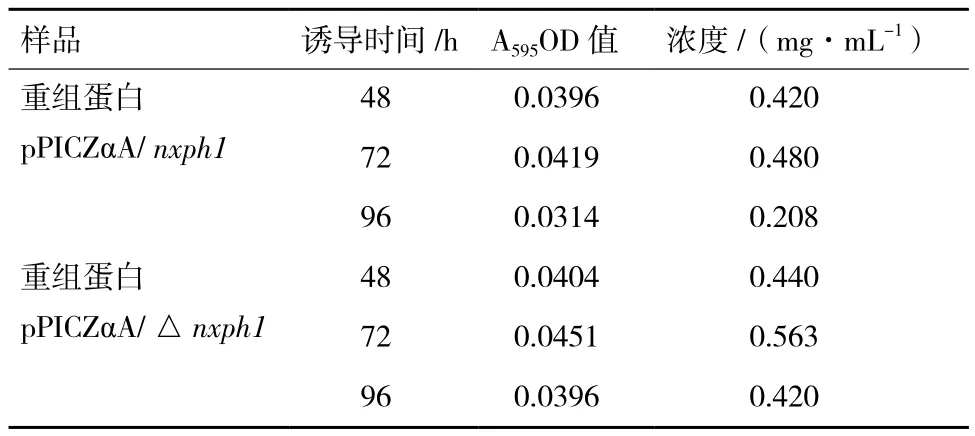
表1 蛋白濃度測定結果
3 討論
巴斯畢赤酵母作為真核機體對產生蛋白的翻譯可以進行修飾,另外有利于表達蛋白的分離純化[5]。pPICZαA載體是含有強啟動子AOX1和α-交配因子信號肽序列,能夠引導外源蛋白的分泌,可以用ZeocinTM抗性基因對重組子直接進行篩選,同時載體上His標簽可以進行親和純化[6-8]。本試驗選用pPICZαA作為表達載體,攜帶外源基因nxph 1進入酵母表達系統并整合入酵母GS115的染色體,利用pPICZαA表達載體上的信號肽序列引導NXPH1蛋白的分泌,使NXPH1高效表達,也證實外源基因在畢赤酵母中能得到高表達。
1987年,Hoekema等報道了酵母所偏愛的25個密碼子,所以在合成外源基因時可以根據畢赤酵母的密碼子偏愛性,在保持翻譯時氨基酸不變的情況下對密碼子進行突變以獲得高效表達的蛋白。2002年,Sinclair和Choy在畢赤酵母中表達人源葡糖腦苷酯酶時,通過對C+G含量的調整和密碼子的優化證明其蛋白產量比天然基因提高很多倍[9]。張朝春和梁偉鋒[10]根據人神經營養素(hNT-3)的基因序列,根據畢赤酵母密碼子的偏愛性把編碼氨基酸的密碼子進行了替換,發現蛋白表達量提高11倍。Delroisse等[11]研究發現沒有改造的赤擬盜羧酯酶基因在巴斯德畢赤酵母表達系統中并不表達,但是當按照酵母密碼子的偏好性改造之后,可以檢測到改基因的表達。Shumiao等[12]研究也發現通過優化密碼子之后,可以大幅度提高瑞氏木霉纖維素內切酶基因的表達量。本研究根據GenBank上公布的雞nxph1基因mRNA編碼序列,結合畢赤酵母密碼子的偏好性優化序列,將優化后的雞nxph1全長基因序列和去除信號肽的雞△nxph1基因序列分別定向插入酵母載體,電轉化入GS115,轉化后陽性菌用抗性進行篩選,甲醇誘導表達,表達的產物為NXPH1,表明我們已經通過畢赤酵母表達系統成功表達雞NXPH1蛋白。Thill等[13]研究發現,如果在外源基因的自身信號肽引導下表達蛋白,則酵母細胞自身信號肽的表達量不高,而且分泌效率也低,因此在構建質粒時通常將外源基因的信號肽去除。龔婷等[14]對雞白介素-2基因進行去除信號肽和全基因的誘導表達研究發現,在相同條件下去除信號肽的重組質粒的表達量高。馬亮等[15]也在弓形蟲表面抗原 SAG3基因的原核表達發現,不含信號肽的SAG3 基因,所構建的原核表達質粒在大腸桿菌中具有高效表達。另有研究表明,利用外源基因的信號肽引導表達的蛋白較易降解,利用酵母細胞對外源蛋白的信號肽識別后對蛋白進行傳送,則表達的外源蛋白更穩定[16]。所以本試驗中同時選取了去除信號肽的△nxph1基因和nxph1全基因,轉化到酵母中,蛋白的表達量分別為0.563 mg/mL和0.480 mg/mL,結果也證實去除信號肽的NXPH1表達量相對更高一些。
4 結論
本研究根據GenBank上公布的雞nxph1的序列,結合畢赤酵母碼子的偏好性,成功構建了重組表達質粒pPICZαA/ nxph1和去除信號肽的重組表達質粒pPICZαA/△nxph1,并成功獲得大小約29 kD雞NXPH1蛋白和去除信號的△NXPH1蛋白,且去除信號肽的NXPH1表達量相對更高。
[1]Petrenko AG, Kovalenko VA, Shamotienko OG, et al. Isolation and properties of the alpha-latrotoxin receptor[J]. EMBO J, 1990, 9(6):2023-2027.
[2]Yang P, Wang J, Gong G, et al. Cattle mammary bioreactor generated by a novel procedure of transgenic cloning for large-scale production of functional human lactoferrin[J]. PLoS One, 2008, 3(10):e3453.
[3] 朱金金, 劉桂瓊, 王志躍, 等. 雞貯精腺差異表達基因的研究[J]. 畜牧獸醫學報, 2007(11):1176-1179.
[4]Liu G, Jiang X, He C, et al. Neurexophilin 1 gene polymorphism in chickens and its variation among species[J]. Biochemical Genetics, 2013, 51(7-8):618-625.
[5]Ciarkowska A, Jakubowska A. Pichia pastoris as an expression system for recombinant protein production[J]. Postepy Biochem,2013, 59(3):315-321.
[6]董燕, 王捷, 楊連生, 等. 人骨唾液酸蛋白在巴斯德畢赤酵母中的高效分泌表達[J]. 華南理工大學學報:自然科學版, 2003(1):26-29.
[7]黃海, 謝蓓, 于瑞嵩, 等. 豬IFNα基因在畢赤酵母中的高效分泌表達[J]. 遺傳, 2005, 27(2):215-220.
[8] 朱騫, 張匯東, 等. 犬白細胞介素2在畢赤酵母中的誘導表達及生物活性的測定[J]. 農業生物技術學報, 2007(4):574-578.
[9]Sinclair G, Choy FY. Synonymous codon usage bias and the expression of human glucocerebrosidase in the methylotrophic yeast,Pichia pastoris[J]. Protein Expr Purif, 2002, 26(1):96-105.
[10]張朝春, 梁偉鋒, 楊希才. 神經營養素-3基因的人工合成及其在畢赤酵母中的分泌性表達[J]. 微生物學報, 2004(2):210-214.
[11] Delroisse JM, Dannau M, Gilsoul JJ, et al. Expression of a synthetic gene encoding a Tribolium castaneum carboxylesterase in Pichia pastoris[J]. Protein Expr Purif, 2005, 42(2):286-294.
[12]Shumiao Z, Huang J, Zhang C, et al. High-level expression of an Aspergillus niger endo-beta-1, 4-glucanase in Pichia pastoris through gene codon optimization and synthesis[J]. J Microbiol Biotechnol, 2010, 20(3):467-473.
[13]Thill GP, Davis GR, Stillman C, et al. Positive and negative effects of multi-copy integrated expression vectors on protein expression in Pichia pastoris[C]// In Proceedings of the 6th International Symposium on Genetics of Microorganisms. Paris:Societe Franscaise de Microbiologie, 1990, 2:477-490.
[14]龔婷, 楊孝樸, 李銀聚, 等. 雞IL-2全基因和去信號肽基因的原核表達[J]. 甘肅農業大學學報, 2009(01):11-14.
[15]馬亮, 刁玉梅, 任保彥, 等. 弓形蟲RH株表面抗原SAG3去信號肽基因的蛋白原核表達及鑒定[J]. 吉林農業大學學報,2012, 34(1):104-108.
[16]Ferrarese L, Trainotti L, Gattolin S, et al. Secretion, purification and activity of two recombinant pepper endo-beta-1, 4-glucanases expressed in the yeast Pichia pastoris[J]. FEBS Lett, 1998, 422(1):23-26.
(責任編輯 李楠)
Expression of Chicken Neurexophilin 1 Gene in Pichia pastoris
Chen Meiling Nie Bin Jiang Xunping Liu Guiqiong
(College of Animal Science and Technology, Huazhong Agricultural University, Wuhan 430070)
Neurexophilin 1 is the differentially expressed gene at the chicken utero-vaginal junction. According to the mRNA sequence of chicken nxph1 and codon bias of Pichia pastoris, the modified DNA sequence for chicken nxph1 which encodes the same amino acid sequence as that of chicken nxph1were synthesized. Specific primers were designed to amplify part of the synthesized DNA sequence whose expression product has no signal peptide. The two sequences were inserted into pPICZαA vector to construct the recombinant pPICZαA/ nxph1 and pPICZαA/△ nxph1(without signal peptide), and then the recombinant plasmids were transfected into Pichia pastoris GS115 by electroporation. The positive recombinant strains were inducted to express protein by addition of 1 % methanol. The expression protein was displayed on the Tricine-SDS- PAGE electrophoresis and Western blot. The result showed that chicken NXPH1 protein and △NXPH1 protein were successfully expressed, and the molecular weight of the protein was approximately 29 kD, which provided foundations for analyzing functions of NXPH1 in chicken reproductive tract.
nxph 1;Pichia pastoris;gene expression
10.13560/j.cnki.biotech.bull.1985.2015.04.030
2014-07-07
國家自然科學基金項目(31071088)
陳美玲,女,碩士研究生,研究方向:動物遺傳育種與繁殖;E-mail:chenmeiling064@126.com
劉桂瓊,副教授,E-mail:liuguiqiong@mail.hzau.edu.cn

