富硒乳酸菌的篩選及鑒定
曾議霆,郭溪浪,周 康*,劉書亮,韓新鋒
(四川農(nóng)業(yè)大學(xué)食品學(xué)院,四川 雅安 625014)
富硒乳酸菌的篩選及鑒定
曾議霆,郭溪浪,周 康*,劉書亮,韓新鋒
(四川農(nóng)業(yè)大學(xué)食品學(xué)院,四川 雅安 625014)
對(duì)5 種15 株乳酸菌的生長(zhǎng)曲線進(jìn)行了測(cè)定,并對(duì)亞硒酸鈉添加質(zhì)量濃度、耐硒和富硒能力進(jìn)行比較,篩選出了富硒優(yōu)勢(shì)乳酸菌,并進(jìn)行了生理生化和分子鑒定。結(jié)果表明:適宜的加硒時(shí)間為培養(yǎng)后的第6小時(shí),培養(yǎng)時(shí)間為24 h。通過(guò)對(duì)9 株菌株比較,確定了較適宜的亞硒酸鈉添加質(zhì)量濃度為6 μg/mL。最終篩選出BC-25為富硒優(yōu)勢(shì)菌株,富硒量425.79 μg/g,硒轉(zhuǎn)化率達(dá)27.00%,經(jīng)16S rDNA分析鑒定其為植物乳桿菌(Lactobacillus plantaru)。
乳酸菌;富硒;篩選;鑒定
硒是人體14大微量元素之一,已被聯(lián)合國(guó)糧食與農(nóng)業(yè)組織(Food and Agriculture Organization,F(xiàn)AO)/國(guó)際原子能組織(International Atomic Energy Agency,IAEA)/世界衛(wèi)生組織(World Health Organization,WHO)共同確認(rèn)為人體必需的一種重要微量元素,與機(jī)體正常生理功能的維持以及多種疾病的發(fā)生發(fā)展密切相關(guān)[1-2],是哺乳動(dòng)物體內(nèi)許多酶活性中心的必需組分,如谷胱甘肽過(guò)氧化物酶(glutathione peroxidase,GPx)[3]、脫碘酶(iodothyronine deiodinases,ID)[4]等,具有保護(hù)細(xì)胞膜的結(jié)構(gòu)和功能免受過(guò)度氧化損傷,抗癌、解毒、保肝和提高人體免疫力的生理功能[5-6]。據(jù)統(tǒng)計(jì)我國(guó)有2/3的人口居住在低硒或缺硒的地區(qū),約有3億 人處于缺硒狀態(tài),日常食用的食物中硒含量普遍較低,一般不足0.01 ?g/g,很難滿足國(guó)際學(xué)術(shù)組織聯(lián)合會(huì)建議的成年男女膳食硒適宜需要量分別為40 ?g/d和30 ?g/d的要求[7]。因而人工補(bǔ)硒方法已受到國(guó)內(nèi)外有關(guān)專家的廣泛關(guān)注。時(shí)至今日,一般補(bǔ)硒的方法仍是用無(wú)機(jī)硒化合物制成口服制劑,無(wú)機(jī)硒即亞硒酸鈉,但亞硒酸鈉具有較強(qiáng)的毒副作用,研究顯示,無(wú)機(jī)硒經(jīng)生物轉(zhuǎn)化后的有機(jī)硒化合物毒性低且在激發(fā)免疫反應(yīng)上比無(wú)機(jī)硒顯著[8],且吸收率更高,這對(duì)于我國(guó)推廣并用以改善硒缺乏的狀態(tài)有極大的意義。
由于人工合成有機(jī)硒技術(shù)難度大,成本高,因而不少學(xué)者對(duì)利用動(dòng)植物的吸收、轉(zhuǎn)化作用獲取有機(jī)硒進(jìn)行了研究[9-11]。富硒常用的載體多為植物類食品[12],富硒肉類食品[13-14]也有相關(guān)研究,而在以微生物作為載體研究最多的就是酵母菌[15],隨著生物化學(xué)技術(shù)的不斷發(fā)展,目前,作為益生菌——乳酸菌,其保健功能、良好的風(fēng)味和可靠的安全性已經(jīng)被廣大消費(fèi)者所認(rèn)可[16],作為有機(jī)硒的一個(gè)新型來(lái)源,其生物學(xué)效應(yīng)和 潛在開(kāi)發(fā)應(yīng)用前景非常廣闊。本實(shí)驗(yàn)旨在篩選出一株具有富硒優(yōu)勢(shì)的乳酸菌,并對(duì)其進(jìn)行生理生化和分子鑒定,為今后關(guān)于乳酸菌富硒的進(jìn)一步研究和應(yīng)用奠定基礎(chǔ)。
1 材料與方法
1.1材料
1.1.1菌種
15 株乳酸菌,編號(hào)分別為:2.10、K、M、F、U、Dx、SJ-01、L- N3、LB-12、JT-03、BC-12、BC-13、BC-23、BC-25、BC-32,由四川農(nóng)業(yè)大學(xué)微生物實(shí)驗(yàn)室提供。
1.1.2培養(yǎng)基
改良MRS液體培養(yǎng)基:蛋白胨10.0 g、牛肉粉5.0 g、酵母粉4.0 g、葡萄糖20.0 g、吐溫-80 1.0 mL、K2HPO4·3H2O 1.52 g、醋酸鈉5.0 g、檸檬酸三銨2.0 g、MgSO4·7H2O 0.58 g、MnSO4·H2O 0.19 g,蒸餾水1 000 mL,pH 6.2,分裝后121 ℃高壓滅菌15 min。
1.1.3試劑與儀器
亞硒酸鈉(分析純)、硝酸、高氯酸、5 g/100 mL乙二胺四乙酸二鈉鹽(ethylenediamine teraacetic acid disodium salt,EDTA-2Na)、3,3’-二氨基聯(lián)苯胺(3,3’-diaminobenzidine,DAB)等均為優(yōu)級(jí)純。
SW-CJ-2D超凈工作臺(tái) 蘇州智凈凈化設(shè)備有限公司;SHP-250恒溫培養(yǎng)箱 上海鴻都電子科技有限公司;DL-5000B-II冷凍離心機(jī) 上海安亭科學(xué)儀器廠;DK-S28電熱恒溫水浴鍋、DZF-6050電熱真空干燥箱上海精宏實(shí)驗(yàn)設(shè)備有限公司;ESJ210-4A電子精密天平 沈陽(yáng)龍騰電子有限公司;Carry60紫外-可見(jiàn)分光光度計(jì) 安捷倫科技有限公司;T100型梯度PCR儀、580BR 3755熒光定量PCR儀、Dio-Gel-2000凝膠成像儀 美國(guó)Bio-Rad公司。
1.2方法
1.2.1菌種活化
為了提高菌種的活力,將各菌株接種于液體MRS培養(yǎng)基中,36 ℃適宜條件下培養(yǎng)18 h,并連續(xù)活化培養(yǎng)3 代,用生理鹽水稀釋,調(diào)整OD600nm為0.60,即得到種子液,備用。
1.2.2菌種的生化鑒定
挑取典型菌落進(jìn)行糖發(fā)酵試驗(yàn),參考GB 4789.35—2010《食品安全國(guó)家標(biāo)準(zhǔn) 食品微生物學(xué)檢驗(yàn) 乳酸菌檢驗(yàn)》、《伯杰細(xì)菌鑒定手冊(cè)》、《乳酸菌分類鑒定及實(shí)驗(yàn)方法》,初步鑒定乳酸菌的屬種[17-19]。
1.2.3乳酸菌生長(zhǎng)曲線測(cè)定
通過(guò)測(cè)定乳酸菌生長(zhǎng)曲線,確定適宜的加硒時(shí)間和培養(yǎng)時(shí)間。種子液以5%的接種量接入到改良MRS液體培養(yǎng)基中,裝液量150 mL/250 mL三角瓶(以下接種相同)[20],36 ℃靜止培養(yǎng)。每隔2 h取出,采用比濁法,測(cè)定乳酸菌菌液的OD600nm值,繪制生長(zhǎng)曲線。
1.2.4適宜硒質(zhì)量濃度的選擇
根據(jù)生化鑒定結(jié)果,每種菌屬選出一些菌株,接種于含不同亞硒酸鈉質(zhì)量濃度(0、2、4、6、8、10、12、14 μg/mL)的液體培養(yǎng)基中培養(yǎng)24 h,5 000 r/min離心10 min,觀察菌體顏色變化,確定最適加硒質(zhì)量濃度[21]。
1.2.5耐硒能力測(cè)定
測(cè)定所有株菌在適宜無(wú)機(jī)硒質(zhì)量濃度下的生物量,每株菌兩個(gè)平行,同時(shí)做空白對(duì)照實(shí)驗(yàn),選出耐硒能力較強(qiáng)的菌株,-20 ℃保藏備用。
1.2.6富硒能力實(shí)驗(yàn)
將選出的耐硒能力較強(qiáng)的菌株接種于含適宜硒濃度的改良MRS液體培養(yǎng)基中,每組做兩個(gè)平行,同時(shí)做空白對(duì)照實(shí)驗(yàn),36 ℃適宜條件下富硒培養(yǎng)。收集菌體培養(yǎng)物,測(cè)富硒量和硒轉(zhuǎn)化率,選出一株富硒能力強(qiáng)的乳酸菌,-20 ℃保藏備用。
1.2.7乳酸菌生物量的測(cè)定
將菌體培養(yǎng)物于65 ℃烘干至恒質(zhì)量,計(jì)算每100 mL培養(yǎng)基菌體干質(zhì)量。
1.2.8菌體培養(yǎng)物制備
菌體培養(yǎng)物以5 000 r/min離心10 min,傾去上清液,加入30 mL雙重蒸餾水,混合均勻后離心(5 000 r/min,10 min),傾去上清液。如此反復(fù)洗滌3 次,將附著于細(xì)胞表面的硒洗去。最后5 000 r/min離心20 min獲得最終菌體培養(yǎng)物,65 ℃烘干,密封保存。
1.2.9硒含量測(cè)定
采用DAB分光光度法檢測(cè)硒含量[22]。

1.2.9.1標(biāo)準(zhǔn)曲線繪制
準(zhǔn)確吸取10 μg/mL的硒標(biāo)準(zhǔn)溶液0、2、4、6、8、10 mL分別加到100 mL的燒杯中,加水至35 mL,再加入5 g/100 mL EDTA-2Na溶液1 mL,搖勻,并用1:1的鹽酸調(diào)節(jié)pH值至2~3,各加0.5% DAB溶液4 mL,搖勻,置于暗處30 min,再用5% NaOH調(diào)節(jié)pH值至中性,加入到分液漏斗中,加入10 mL甲苯振搖2 min,靜置分層,去水層,收集甲苯層于比色皿中,于420 nm波長(zhǎng)處測(cè)吸光度,繪制標(biāo)準(zhǔn)曲線[23]。
1.2.9.2菌體培養(yǎng)物中硒的測(cè)定
稱取約0.1 g干菌體樣品于帶刻度具玻璃塞10 mL 試管中,加入混合酸消化液(硝酸-高氯酸(5:1,V/V))0.6 mL,放置過(guò)夜。然后將試管置于100 ℃水浴鍋中加熱4 h。當(dāng)試管內(nèi)黃褐色氣體排盡后,取出試管放冷卻,加入30%過(guò)氧化氫溶液2 mL,繼續(xù)置于沸水浴中消化,至消化液呈現(xiàn)無(wú)色或淡黃色即達(dá)終點(diǎn)。取出試管放冷卻后,以超純水定容至10 mL,待上機(jī)測(cè)定。同時(shí)作空白對(duì)照[24]。
1.2.9.3培養(yǎng)上清液中殘留硒含量測(cè)定
取20 mL上清液,加水至35 mL,加入2 mL 5 g/100 mL EDTA-2Na溶液,以下同標(biāo)準(zhǔn)曲線制定步驟[25]。同時(shí)作空白對(duì)照。
1.2.10乳酸菌菌株16S rDNA分析
采用細(xì)菌基因組DNA提取試劑盒(離心柱型)試劑盒提取菌株的DNA;向各無(wú)菌EP管中依次加入9.5 μL超純水、12.5 μL 2×PCR Master Mix、上下游引物各1 μL、DNA模板1 μL,瞬離后置于熒光定量PCR儀中,于如下PCR擴(kuò)增條件中擴(kuò)增:94 ℃預(yù)變性5 min,一次循環(huán);94 ℃變性1 min,65 ℃復(fù)性1 min,72 ℃延伸20 s,經(jīng)30 個(gè)循環(huán)后,72 ℃繼續(xù)延伸10 min,一次循環(huán);擴(kuò)增后的DNA在1%瓊脂糖凝膠板上于80 V電泳50 min,再凝膠成像;將DNA送檢測(cè)序,通過(guò)BLAST方法比對(duì),鑒定出所得菌株。
2 結(jié)果與分析
2.1生化鑒定結(jié)果
通過(guò)19 種糖發(fā)酵管鑒定出15 種菌的種屬,結(jié)果見(jiàn)表1。

表1 生化鑒定結(jié)果Table1 Biochemical identification resultss
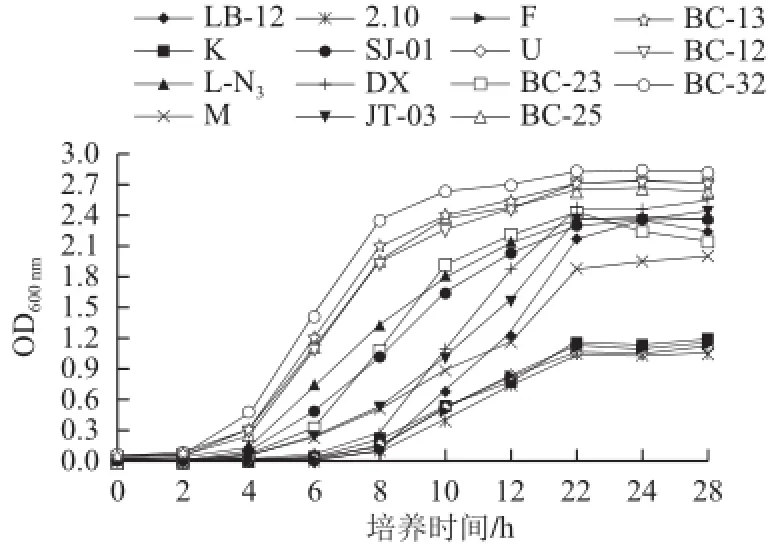
圖1 乳酸菌生長(zhǎng)曲線Fig.1 Growth curves of lactic acid bacteria (LAB)
2.2加硒時(shí)間和培養(yǎng)時(shí)間的確定
15 株乳酸菌的生長(zhǎng)曲線如圖1所示,在培養(yǎng)6 h后,菌的生長(zhǎng)開(kāi)始進(jìn)入對(duì)數(shù)期,24 h后,部分菌開(kāi)始降解。由于加硒時(shí)間越早,對(duì)菌生長(zhǎng)的抑制作用越強(qiáng),在對(duì)數(shù)期菌的生長(zhǎng)代謝旺盛,轉(zhuǎn)化率高。Suhajda等[26]研究發(fā)現(xiàn),在酵母細(xì)胞對(duì)數(shù)生長(zhǎng)期前期添加無(wú)機(jī)硒,所得酵母的含硒量最高,并隨著對(duì)數(shù)期細(xì)胞增殖,富硒能力增強(qiáng),以后隨穩(wěn)定期接近而逐漸減弱。靳志強(qiáng)等[27]研究也發(fā)現(xiàn),在對(duì)數(shù)生長(zhǎng)初期加入亞硒酸鈉可以得到菌體硒含量和細(xì)胞硒轉(zhuǎn)化率均最大的結(jié)果。因此從轉(zhuǎn)化率和生長(zhǎng)周期考慮,選擇乳酸菌進(jìn)入對(duì)數(shù)生長(zhǎng)初期時(shí)加入無(wú)機(jī)硒,即培養(yǎng)6 h后加入亞硒酸鈉溶液,培養(yǎng)24 h。
2.3適宜硒質(zhì)量濃度的確定
根據(jù)表1的生化鑒定結(jié)果,每個(gè)種屬乳酸菌選擇一些進(jìn)行不同硒質(zhì)量濃度的富硒實(shí)驗(yàn),植物乳桿菌:M、BC-23、L-N3、BC-25,干酪乳桿菌:U、BC-12,干酪乳桿菌假植物亞種:2.10,嗜酸乳桿菌:BC-13,木糖乳桿菌:BC-32,共9 株菌。不同菌株在不同亞硒酸鈉質(zhì)量濃度下的菌體顏色變化見(jiàn)表2。

表2 9 株菌在不同亞硒酸鈉質(zhì)量濃度下培養(yǎng)24 h后的菌體顏色變化情況Table2 Color changes of 9 strains cultured at different concentrations of sodium selenite for 24 h
由表2可知,在所設(shè)定的亞硒酸鈉質(zhì)量濃度范圍內(nèi),菌體顏色變紅的程度與亞硒酸鈉質(zhì)量濃度呈正相關(guān),說(shuō)明亞硒酸鈉質(zhì)量濃度越高,轉(zhuǎn)變成為單質(zhì)硒的量越多[28]。質(zhì)量濃度低于6 μg/mL時(shí)菌體顏色正常,6 μg/mL時(shí)菌體顏色變紅不明顯,為了使更多的無(wú)機(jī)硒進(jìn)入細(xì)胞轉(zhuǎn)化成有機(jī)硒,較少單質(zhì)硒的轉(zhuǎn)化。因此,以6 μg/mL作為加硒質(zhì)量濃度。
2.4耐硒篩選結(jié)果
同屬不同種細(xì)菌對(duì)無(wú)機(jī)硒的耐受能力不同[25],耐硒能力大小可以用多種指標(biāo)反映,如細(xì)菌光密度(OD600nm)值[29]、透明圈大小、紅硒現(xiàn)象出現(xiàn)所對(duì)應(yīng)的無(wú)機(jī)硒質(zhì)量濃度[30]、生物量[31]等。本實(shí)驗(yàn)通過(guò)比較相同無(wú)機(jī)硒質(zhì)量濃度下生物量變化大小,以篩選出耐硒能力較強(qiáng)的菌株。15 株菌在6 μg/mL亞硒酸鈉質(zhì)量濃度下富硒培養(yǎng)后,各株菌的生物量測(cè)定結(jié)果如表3所示。
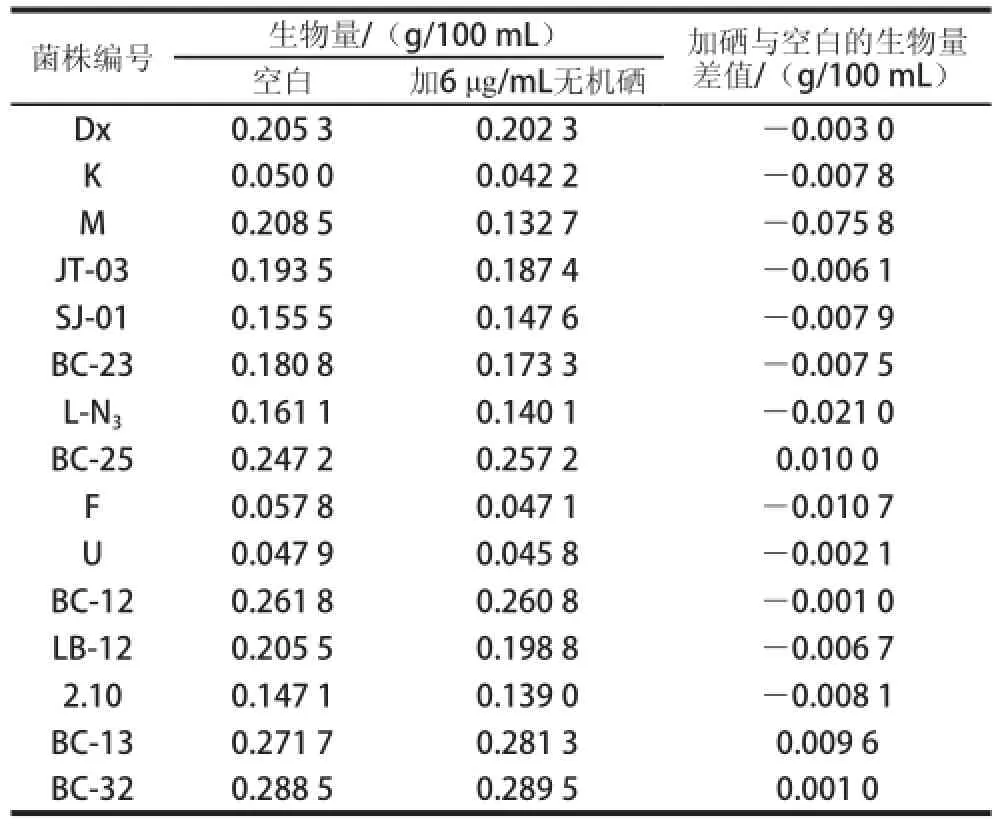
表3 15株菌在6μg/mL亞硒酸鈉質(zhì)量濃度下培養(yǎng)后的生物量測(cè)定結(jié)果Table3 Biomasses of 15 strains cultured with 6μg/mL sodium selenite
比較加硒與未加硒乳酸菌生物量的變化(表3)發(fā)現(xiàn),加了6 μg/mL亞硒酸鈉后,除BC-25、BC-13、BC-32生物量有增加外,其他12 株菌的生物量均有不同程度的降低,說(shuō)明6 μg/mL亞硒酸鈉的添加能抑制大多數(shù)菌的生長(zhǎng),而促進(jìn)BC-25、BC-13、BC-32的生長(zhǎng)。生物量增加順序?yàn)椋築C-25>BC-13>BC-32,BC-25和BC-13明顯高于BC-32,說(shuō)明BC-25和BC-13存活的總菌數(shù)大于BC-32,因此,確定BC-25、BC-13兩株菌株均具有相對(duì)較強(qiáng)的耐硒能力。
2.5富硒能力測(cè)定結(jié)果
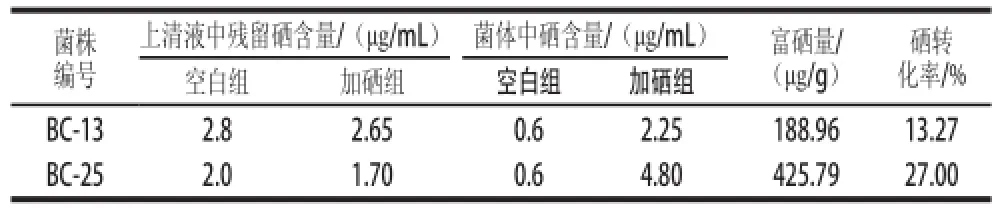
表4 分光光度法測(cè)硒含量結(jié)果Table4 Sodium selenite concentration in cultured cells and supernatants as determined spectrometrically by spectrophotometer
由表4可知,未加硒的空白上清液中測(cè)出的硒含量也較高,可能是培養(yǎng)基的色素被有機(jī)溶劑提取出來(lái)了,干擾了測(cè)定結(jié)果,使對(duì)照組測(cè)定結(jié)果較高,因此以菌體培養(yǎng)物中硒含量測(cè)定來(lái)分析硒轉(zhuǎn)換率。
由菌體中硒含量測(cè)定結(jié)果可知,富硒量和硒轉(zhuǎn)化率都一樣BC-25>BC-13,因此確定BC-25具有相對(duì)較強(qiáng)富硒能力。關(guān)于富硒能力研究,Calomme等[32]通過(guò)對(duì)3 株乳酸菌進(jìn)行富硒培養(yǎng)時(shí)發(fā)現(xiàn),添加硒(Ⅳ)質(zhì)量濃度為1 mg/L時(shí),3 株菌的硒含量分別為(253±50)、(375±33)、(407±108) μg/g,本實(shí)驗(yàn)篩選出的BC-25富硒量425.79 μg/g,說(shuō)明BC-25具有較好富硒性能。
2.6BC-25的16S rDNA分析結(jié)果

圖2 BC-25的16S rDNA PCR擴(kuò)增產(chǎn)物電泳圖Fig.2 Electrophoretogram of PCR-amplified 16S rDNA of BC-25
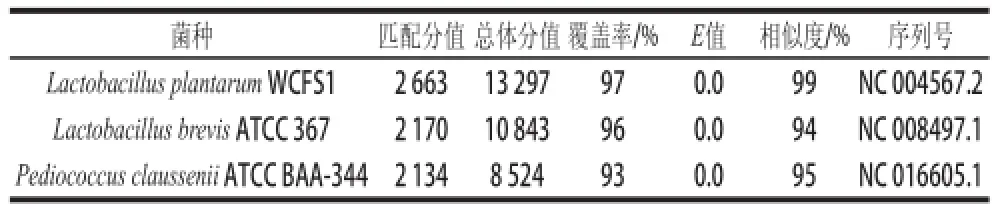
表5 菌株BC-25的BLAST同源性比較結(jié)果Table5 Homology between BC-25 and other strains by BLAST analysis
由系統(tǒng)發(fā)育樹(shù)和對(duì)比結(jié)果(表5)可知,被測(cè)菌株BC-25與Lactobacillus plantarum WCFS1的匹配一致性達(dá)到99%,同時(shí)結(jié)合生化鑒定結(jié)果來(lái)看,可以確定被測(cè)菌株BC-25即為一株植物乳桿菌。
3 結(jié) 論
本實(shí)驗(yàn)通過(guò)對(duì)15 株菌生長(zhǎng)曲線測(cè)定,確定適宜的加硒時(shí)間為培養(yǎng)后的第6小時(shí),培養(yǎng)時(shí)間為24 h;通過(guò)適宜硒質(zhì)量濃度選擇,確定適宜的亞硒酸鈉添加質(zhì)量濃度為6 μg/mL;根據(jù)耐硒能力、富硒能力及硒含量測(cè)定,選出BC-25為富硒優(yōu)勢(shì)菌株,富硒量為425.79 μg/g,硒轉(zhuǎn)化率為27.00%,具有相對(duì)較強(qiáng)的富硒能力。16S rDNA序列分析鑒定結(jié)果確定BC-25為L(zhǎng)actobacillus plantarum。本研究為在益生菌中尋找富硒載體提供了一定依據(jù),但是本實(shí)驗(yàn)篩選出的乳酸菌富硒能力還有待提高,為了進(jìn)一步提高它的耐硒富硒能力,可以考慮對(duì)其進(jìn)行更多富硒條件優(yōu)化,如耐硒馴化、紫外誘變等。
[1] 侯小東, 藺新英. 硒等微量元素的生物學(xué)相關(guān)效應(yīng)的研究進(jìn)展[J].環(huán)境與健康雜志, 2007(10): 840-841.
[2] 蔡?hào)|聯(lián), 耿珊珊. 硒的生理功用與疾病防治[J]. 微量元素與健康研究, 2006(2): 58-61.
[3] ROTRUCK J T, POPE A L, GANTHER H E, et al. Selenium: biochemical role as a component of glutathione peroxidase[J]. Science,1973, 179(73): 588-590.
[4] BERRY M J, BAN U L, LARSEN P R. Type Ⅰ iodothyronine deiodinase is a selenocysteine-containing enzyme[J]. Nature, 1991,349: 438-440.
[5] 熊華偉, 簡(jiǎn)少卿, 賈小芳, 等. 富硒酵母對(duì)斑點(diǎn)叉尾肝臟的毒性作用及蛋白質(zhì)組學(xué)的影響[J]. 水產(chǎn)學(xué)報(bào), 2011, 35(7): 1008-1014.
[6] 朱善良, 陳龍. 乳酸菌源有機(jī)硒對(duì)肝損傷小鼠組織脂質(zhì)過(guò)氧化的保護(hù)作用[J]. 江蘇教育學(xué)院學(xué)報(bào), 2012, 26(12): 38-40.
[7] 楊光圻, 顧履珍. 微量元素硒的人體需要量和安全攝入量范圍[J].生理科學(xué)進(jìn)展, 1992(2): 184-186.
[8] RAYMAN M P. The importance of selenium to human health[J]. The Lancet, 2000, 356: 233-241.
[9] 歐陽(yáng)培, 童斌. 富硒蚯蚓含硒蛋白研究[J]. 廈門大學(xué)學(xué)報(bào): 自然科學(xué)版, 1993, 32(6): 795-798.
[10] 蔣立科, 巴宇青, 詹萬(wàn)貴. 蜜蜂合成有機(jī)硒對(duì)釀蜜的影響[J]. 食品科學(xué), 1994, 15(7): 45-48.
[11] GENNITY J M, BOTTINO N R, ZINGARO R A, et al. A seleniumin duced peroxidation of glutathione in algae[J]. Phytochemistry, 1985,24(12): 2817-2821.
[12] PYRZYNSKA K. Selenium speciation in enriched vegetables[J]. Food Chemistry, 2009, 114: 1183-1191.
[13] 王燕燕, 吳森, 陳福財(cái), 等. 補(bǔ)硒對(duì)肉羊血硒水平、產(chǎn)肉性能和肉品質(zhì)的影響[J]. 家畜生態(tài)學(xué)報(bào), 2013, 34(6): 21-25.
[14] 王曉龍, 朱東澤, 魏營(yíng), 等. 富硒酵母和亞硒酸鈉對(duì)肉仔雞生長(zhǎng)后期日增重影響的Meta分析[J]. 生物數(shù)學(xué)學(xué)報(bào), 2009, 24(3): 551-555.
[15] P?REZ-CORONAA M T, S?NCHEZ-MART?NEZA M,VALDERRAMA M J, et al. Selenium biotransformation by Saccharomyces cerevisiae and Saccharomyces bayanus during white wine manufacture: laboratory-scale experiments[J]. Food Chemistry,2011, 124: 1050-1055.
[16] 駱承庠. 乳與乳制品工藝學(xué)[M]. 北京: 中國(guó)農(nóng)業(yè)出版社, 2003.
[17] GB 4789.35—2010 食品安全國(guó)家標(biāo)準(zhǔn) 食品微生物學(xué)檢驗(yàn) 乳酸菌檢驗(yàn)[S].
[18] 布坎南R E, 吉本斯N E. 伯杰細(xì)菌鑒定手冊(cè)[M]. 8版. 北京: 科學(xué)出版社, 1984: 814-815.
[19] 凌代文, 東秀珠. 乳酸細(xì)菌分類鑒定及實(shí)驗(yàn)方法[M]. 北京: 中國(guó)輕工業(yè)出版社, 1999: 85-86.
[20] 黃秀錦. 富硒乳酸菌發(fā)酵條件的研究[J]. 中國(guó)調(diào)味品, 2009, 34(12): 54-60.
[21] 宋照軍, 王樹(shù)林, 潘潤(rùn)淑, 等. 富硒乳酸菌的分離、篩選、馴化及富硒研究[J]. 中國(guó)釀造, 2004, 23(11): 4-6.
[22] XIA Shukai, CHEN Long, LIANG Junqing. Enriched seleniumand its effects on growth and biochemical composition in Lactobacillus bulgaricus[J]. Journal of Agricultural and Food Chemistry, 2007,55(6): 2413-2417.
[23] 賈姍姍, 朱連勤, 朱風(fēng)華, 等. 3,3’-二氨基聯(lián)苯胺分光光度法檢測(cè)硒[J].畜牧與獸醫(yī), 2012, 44(6): 74-76.
[24] 楊保收, 陳越, 金久善, 等. 水浴濕法消化Zeem an石墨爐原子吸收法測(cè)定肉雞肝組織中硒含量[J]. 中國(guó)獸醫(yī)學(xué)報(bào), 2000, 20(1): 55-57.
[25] 黃高明. 富硒乳酸菌種的篩選[J]. 廣州食品工業(yè)科技, 2004, 20(4): 33-35.
[26] SUHAJDA A, HEGO C J, JANZS O B, et al. Preparation of selenium yeasts Ⅰ. Preparation of selenium-enriched Saccharomy cescerevisiae[J]. Journal of Trace Elements in Medicine and Biology,2000, 14(1): 43-47.
[27] 靳志強(qiáng), 張博文, 李平蘭, 等. 動(dòng)物雙歧桿菌01耐硒性能及富硒條件的研究[J]. 食品科學(xué), 2009, 30(15): 184-187.
[28] 劉紅芳, 鄧澤元, 徐靚, 等. 乳酸菌LA4還原亞硒酸鈉形成紅色單質(zhì)硒[J]. 食品與發(fā)酵工業(yè), 2013, 39(7): 69-73.
[29] 余善鳴, 孫強(qiáng), 徐偉, 等. 乳酸菌耐硒能力的研究[J]. 現(xiàn)代食品科技,2005, 21(4): 17-18.
[30] 朱何東, 常峰, 羅俊成, 等. 富硒乳酸菌的篩選及其富硒能力的初步研究[J]. 釀酒科技, 2005(8): 29-31.
[31] 靳志強(qiáng). 富硒雙歧桿菌中硒的賦存形態(tài)及分布[J]. 食品與發(fā)酵工業(yè),2010, 36(1): 25-28.
[32] CALOMME M R, van den BRANDE N K, van den BERGHE D A. Selenium and Lactobacillius species[J]. Journal of Applied Bacteriology, 1995, 79: 331-340.
Screening and Identification of Se-Enriching Lactic Acid Bacteria
ZENG Yiting, GUO Xilang, ZHOU Kang*, LIU Shuliang, HAN Xinfeng
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
A total of 15 lactic acid bacteria derived from 5 species were studied by comparing their growth curves and abilities to tolerate and enrich Se. We also identified and characterized the selected strain by biochemical and molecular biological methods. The results showed that the optimum time to add Se was at the end of 6-hour culture period after which the culture was carried out for another 18 hours. The optimum sodium selenite concentration for Se enrichment was found to be 6 μg/mL by comparing 9 selected strains. The strain BC-25 was eventually selected as the best Se-enriching strain, which could enrich 425.79 μg/g of Se with a transformation rate of 27.00%. The 16S rDNA sequence results indicated that BC-25 is Lactobacillus plantarum.
lactic acid bacteria; Se enrichment; screening; identification
TS254
A
1002-6630(2015)03-0178-05
10.7506/spkx1002-6630-201503034
2014-10-09
曾議霆(1990—),女,碩士,研究方向?yàn)槭称焚|(zhì)量與安全。E-mail:1032401816@qq.com
周康(1983—),男,副教授,博士,研究方向?yàn)槭称焚|(zhì)量與安全。E-mail:kang_zhou@163.com

