嗜酸乳桿菌細菌素Lactobacillin XH2抑制大腸桿菌作用機理的探討
趙瑞香,段改麗,楊天佑,孫俊良,牛生洋,王 瑩
(1.河南科技學院食品學院,河南 新鄉 453003;2.河南科技學院生命科技學院,河南 新鄉 453003)
嗜酸乳桿菌細菌素Lactobacillin XH2抑制大腸桿菌作用機理的探討
趙瑞香1,段改麗1,楊天佑2,孫俊良1,牛生洋1,王 瑩1
(1.河南科技學院食品學院,河南 新鄉 453003;2.河南科技學院生命科技學院,河南 新鄉 453003)
將離子交換色譜純化獲得的抑菌效價為380.60 AU/mL的嗜酸乳桿菌細菌素Lactobacillin XH2作用于大腸桿菌(Escherichia coli),從死亡率、細胞膜損傷及引起胞內物質外泄方面,探討Lactobacillin XH2抑制大腸桿菌的機理。結果表明:Lactobacillin XH2作用于大腸桿菌后,在3 h內大腸桿菌死亡率達96%,菌體細胞變形并出現孔洞,菌體短小且不規整。進一步分析發現,細胞膜通透性增大,胞內K+快速大量泄露,膜電位紊亂失衡;胞內紫外吸收物質、乳酸脫氫酶等生命大分子物質大量流失;同時導致了大腸桿菌胞內三磷酸腺苷(adenosine triphosphate,ATP)外泄,細胞物質代謝、能量代謝失常,最終導致了菌體死亡。這些現象表明,孔道形成(pore formation)理論可能同樣適用于Lactobacillin XH2對革蘭氏陰性菌大腸桿菌的作用機理。
嗜酸乳桿菌;細菌素;革蘭氏陰性菌;抑菌機理
乳酸菌(lactic acid bacteria)細菌素具有熱穩定性,并耐酸、耐低溫,對食品的口感、口味等無不良影響。它的使用可以減弱殺菌強度,減少殺菌時間,有利于保持食品原有的營養價值和風味,在食品保鮮方面,可望成為替代化學抑菌劑的物質,目前乳酸菌細菌素已成為天然防腐劑研究與開發應用的熱點[1-3]。但是大多乳酸菌細菌素的抗菌譜較窄,只對革蘭氏陽性菌具有抑菌性,因此在使用中受到很大限制。近年來發現一些嗜酸乳桿菌(Lactobacillus acidophilus)細菌素具有廣譜性,不僅可抑制革蘭氏陽性菌,也可抑菌革蘭氏陰性菌和真菌,引起了人們越來越多的關注[4-7]。但是目前嗜酸乳桿菌細菌素的研究多集中在細菌素發現、分離純化、生物學特性等方面[4],而乳酸菌細菌素殺菌機制的研究對于細菌素開發應用、安全評價及柵欄技術的開發都十分重要。目前只有乳酸菌細菌素Nisin、Sakacin、Pedioncin PA-1等殺菌機制的研究較為深入,主要體現在細菌素通過在敏感菌的細胞膜上形成孔洞,使細胞內離子外泄,最終引起質子驅動勢的耗散[8]。但是對于嗜酸乳桿菌細菌素的抑菌機理,特別是對抑制革蘭氏陰性菌的作用機理的涉及較少,相關研究亟待開展。本課題前期從嗜酸乳桿菌La-XH2中分離出的細菌素,具有較高的熱和酸穩定性,對胰蛋白酶、胃蛋白酶及木瓜蛋白酶均有敏感性,分子質量為16 ku左右,其更為接近Ⅱ類細菌素[9-10],但有存在明顯不同,特別是該細菌素對革蘭氏陽性菌和革蘭氏陰性菌都有較強的抑制性,可能是一種新型的細菌素,具有較大的研究價值。
本實驗以離子交換色譜分離純化嗜酸乳桿菌細菌素Lactobacillin XH2作用于大腸桿菌(Escherichia coli),從死亡率、細胞膜的膜損傷、胞內物質外泄等方面探討該細菌素抑制大腸桿菌的機理,進而闡述嗜酸乳桿菌細菌素抑制革蘭氏陰性菌的機理,并為該細菌素的開發應用提供理論依據。
1 材料與方法
1.1菌株、培養基與試劑
細菌素產生菌:嗜酸乳桿菌(Lactobacillus acidophilus)La-XH2,來源于波蘭羅茲技術大學發酵工程與工業微生物系,經本實驗室馴化保藏;培養基為MRS培養基;指示菌:大腸桿菌(Escherichia coli)JM109,由河南科技學院食品學院微生物實驗室保藏提供,培養基為LB培養基。
Na2HPO4、NaH2PO4、Cellufine A-500 北京慧德易科技有限責任公司;考馬斯亮藍R-250(色譜純) 上海化學試劑公司分裝廠;N-(2-羥乙基)哌嗪-N’-2-乙烷磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonicaci,HEPES) 美國Sigma公司;細胞裂解液 北京Solarbio公司;乳酸脫氫酶試劑盒 南京建成生物工程研究所有限公司;三磷酸腺苷(adenosine triphosphate,ATP)檢測試劑盒 美國Promega公司。
1.2儀器與設備
Heraeus Multifuge低溫高速離心機、多功能酶標儀 德國賽默飛世爾公司;Quanta 200掃描電子顯微鏡美國FEI公司;Optima2100DV原子發射光譜儀 美國PE公司。
1.3方法
1.3.1蛋白質質量濃度及抑菌效價的測定[11-12]
將培養18 h的La-XH2菌液離心獲取的發酵上清液、由氯仿萃取的粗提物及粗提液經離子交換Cellufine A-500純化[13]獲取的細菌素Lactobacillin XH2,進行蛋白質質量濃度和抑菌效價測定。采用考馬斯亮藍(Bradford)法測定蛋白質質量濃度,以吸光度為縱坐標(y),蛋白質質量濃度為橫坐標(x,mg/mL),繪制標準曲線方程為:y=0.413 8x+0.005 2(R2=0.996 6)。抗菌蛋白的抑菌效價值(AU/mL)以100 ?L純化后樣品經系列稀釋后仍能形成明顯的抑菌圈的最大稀釋度的倒數再乘以10方法測定。
1.3.2大腸桿菌菌懸液的制備
將對數生長期的單核細胞增生大腸桿菌液,于4 ℃條件下8 000 r/min 離心10 min,沉淀用pH 7.0的2.5 mmol/L HEPES緩沖液洗滌一次,重懸浮在該緩沖液中,制備成107CFU/mL菌液備用。
1.3.3大腸桿菌的細菌素處理
取10 mL大腸桿菌菌懸液,加100 mmol/L葡萄糖活化,37 ℃溫育10 min,加2 mL的Lactobacillin XH2細菌素使其終效價為380.60 AU/mL,處理3 h,1~3 h每30 min取樣一次。采用平板計數法測定各個取樣點的大腸桿菌菌落數,重復3 次,每次3 個平行。取平均值計算細菌素對大腸桿菌的致死率(M),計算公式如下。

式中:a0、a1分別為未經細菌素處理的大腸桿菌菌落數和細菌素處理后大腸桿菌菌落數。
1.3.4大腸桿菌的光鏡及掃描電鏡觀察
取細菌素處理3 h后的大腸桿菌兩份,一份革蘭氏染色后在100×油鏡下觀察大腸桿菌細胞形態;另一份用體積分數1%戊二醛固定2 h,磷酸鹽緩沖液(phosphate buffer solution,PBS,pH 7.0,50 mmol/L,V(Na2HPO4):V(NaH2PO4)=1.56:1)漂洗3 次,每次5 min,先后用60%、70%的乙醇各脫水10 min,離心,沉淀真空冷凍干燥后,鍍金儀噴金90 s,在電鏡下進行掃描[14]。
1.3.5大腸桿菌細胞內外K+質量濃度的測定
取細菌素處理0~3 h內不同時間點(同1.3.3節)的大腸桿菌懸液各0.5 mL置于冰上,0 ℃條件下1 000 r/min離心10 min;上清液用于測細胞外K+質量濃度。菌體細胞用1 mL 5%的三氯乙酸懸浮,-20 ℃下冷凍過夜,解凍后95 ℃溫育10 min,每份樣品加 4 mL去離子水,10 000 r/min離心15 min,上清液用原子發射光譜測定測K+質量濃度。
1.3.6胞外紫外吸收物質及乳酸脫氫酶(lactate dehydrogenase,LDH)活力的測定
按1.3.5節中用于測定胞外K+質量濃度樣品的制備方法,制備上清液,分兩份,一份用于上清液中紫外吸收物質測定,通過酶標儀測定上清液260 nm波長處光密度值,以同樣處理且未加細菌素的樣品作對照;另一份用于胞外乳酸脫氫酶的測定,參考南京建成乳酸脫氫酶測定試劑盒說明書中的方法。
1.3.7大腸桿菌ATP含量的測定
取細菌素處理3 h內不同時間點(同1.3.3節)的大腸桿菌懸液各1 mL,4 ℃條件下12 000 r/min離心6 min,取上清液測胞外ATP含量。菌體加入100 ?L細胞裂解液,室溫放置10 min后,4 ℃條件下12 000 r/min離心6 min,取上清液測胞內ATP含量。取100 ?L熒光素-熒光素酶試劑和上清液樣品混合,用酶標儀熒光光度計測定10 s后的相對光單位(relative light units,RLU)為胞內外ATP值[15]。
2 結果與分析
2.1細菌素質量濃度及抑菌效價
對氯仿萃取粗提的細菌素及層析后的洗脫液進行抑菌效價、蛋白質質量濃度測定,其結果見表1。細菌素抑菌效價為380.60 AU/mL,而蛋白質質量濃度降低為68.52 μg/mL。以下實驗均采用離子交換純化后抑菌效價和蛋白質質量濃度分別為380.60 AU/mL、68.52 μg/mL的細菌素做抑菌機理研究。
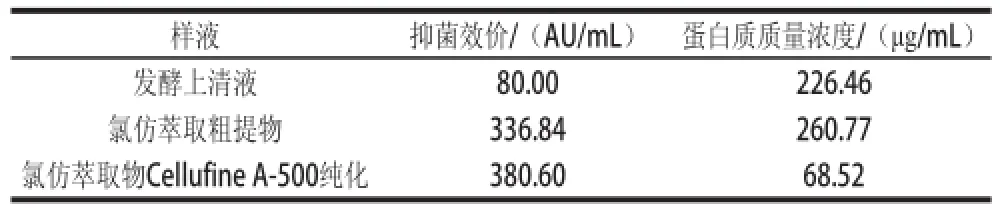
表1 嗜酸乳桿菌細菌素Lactobacillin XH2純化結果Table1 Purification of Lactobacillin XH2
2.2細菌素對大腸桿菌的致死率

表2 嗜酸乳桿菌細菌素Lactobacillin XH2作用下的大腸桿菌致死率Table2 Effects of Lactobacillin XH2 on the mortality rate of
細菌素Lactobacillin XH2處理大腸桿菌3 h內的變化如表2所示。嗜酸乳桿菌細菌素Lactobacillin XH2作用下的大腸桿菌在0~1.5 h內迅速減少,致死率達91.00%,之后基本趨于穩定。在3 h內大部分大腸桿菌由于細菌素的作用而死亡。
2.3光鏡及掃描電鏡下大腸桿菌細胞形態的變化
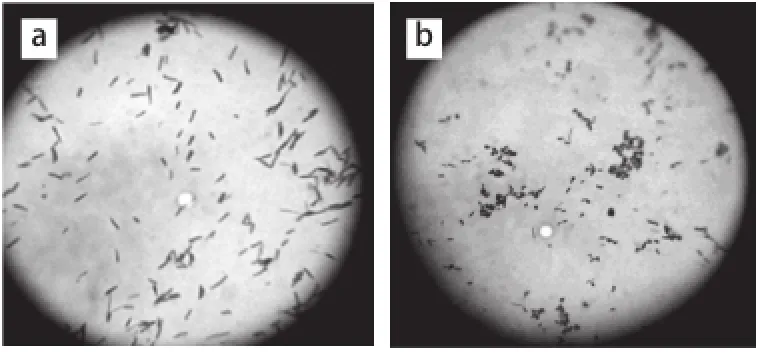

圖1 光鏡及掃描電鏡下嗜酸乳桿菌細菌素Lactobacillin XH2對大腸桿菌細胞形態的影響Fig.1 Effect of Lactobacillin XH2 on the structure of Escherichia coli under optical microscope and scanning electron microscope
細菌素Lactobacillin XH2作用大腸桿菌前后,細胞光鏡及電鏡下的形態結構如圖1所示。由圖1b、1d可知,細菌素作用后的大腸桿菌,菌體表面出現明顯的孔洞,菌體變得短粗。可見,細菌素Lactobacillin XH2作用大腸桿菌可在細胞表面形成明顯的孔洞,同時引起膜透性增大,致使細胞質外泄,胞內物質的損失及部分細胞壁缺失最終導致了菌體細胞的變形。這一結果與Altena等[16]對Nisin吸附與靶細胞膜上,致使靶細胞細胞膜形成孔洞的結論類似。
2.4大腸桿菌細胞內外K+質量濃度的變化
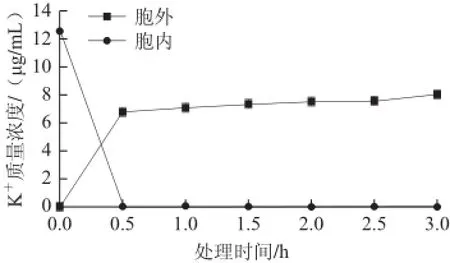
圖2 大腸桿菌細胞內外KK+質量濃度的變化Fig.2 K+leakage from Escherichia coli cells
由圖2可知,嗜酸乳桿菌細菌素Lactobacillin XH2作用于大腸桿菌,胞外K+質量濃度在0.5 h內迅速上升到6.78 ?g/mL后達到穩定狀態,胞內K+質量濃度在0.5 h內由12.57 ?g/mL迅速降到0.04 ?g/mL后達穩定狀態。由此可見該細菌素吸附在靶細胞膜上形成穿膜“孔道”,可允許分子質量為0.5 ku的親水離子通過[17],引起大腸桿菌K+迅速外泄,胞內K+大量泄露可導致細胞膜電位失衡。
2.5大腸桿菌胞外紫外吸收物質的變化
細菌素Lactobacillin XH2處理不同時間,大腸桿菌胞外紫外吸收物質變化,如圖3所示,未經Lactobacillin XH2處理的大腸桿菌,在0.5~3.0 h內,其胞外紫外吸收物質的OD260nm值處于0.05以下的較低范圍,而細菌素處理后其OD260nm介于0.3~0.4的較高水平,約為對照的10.0 倍。同時,隨著作用時間延長,大腸桿菌胞內紫外吸收物質外泄程度越來越嚴重。
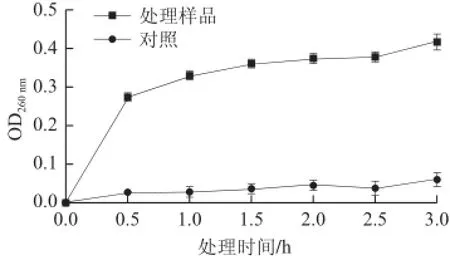
圖3 大腸桿菌胞外紫外吸收物質外泄情況Fig.3 Leakage of UV-absorbing substances from Escherichia coli cells
2.6大腸桿菌胞外乳酸脫氫酶活力的變化
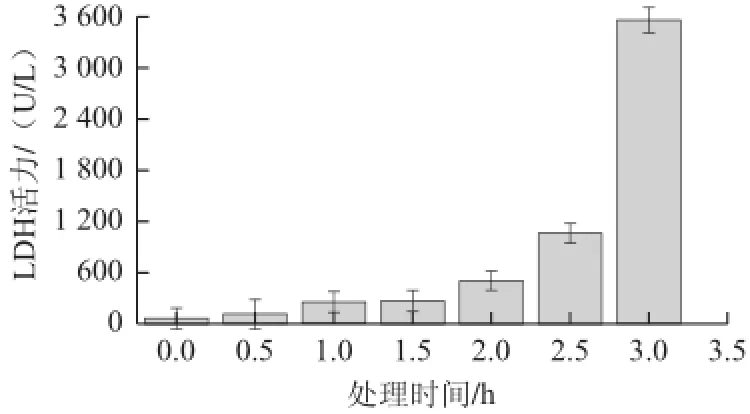
圖4 大腸桿菌胞內乳酸脫氫酶外泄情況Fig.4 LDH leakage from Escherichia coli cells
由圖4可知,隨著嗜酸乳桿菌細菌素Lactobacillin XH2處理時間的延長,大腸桿菌胞外LDH活力逐漸上升,在0~1.5 h內變化緩慢,之后迅速上升,在3.0 h時達3 554.32 U/L。乳酸脫氫酶是催化乳酸脫氫生成丙酮酸的糖酵解酶,會由破損的細胞內滲出,因此,可通過細胞培養液中LDH的活力大小評價細胞受損情況[18],這與周偉等[19]報道的植物乳桿菌素L-1對單核細胞增生李斯特氏菌作用下的LDH變化有類似的趨勢,但較該課題研究的LDH泄露量少,表明本實驗細胞受到較大的損傷。這些小分子生命物質的大量外泄,致使大腸桿菌細胞物質能量代謝失常。
2.7大腸桿菌胞內外ATP的含量變化
由圖5可知,細菌素Lactobacillin XH2作用后的大腸桿菌細胞內外ATP含量都發生了較大的變化,0~1 h內,大腸桿菌細胞內ATP的RLU值由112 861.000迅速下降至7.047較低的水平,胞外ATP呈逐漸增加趨勢,作用3 h后ATP的RLU值由0升高到235.805 。該結果與Naghmouchi等[20]研究的Divergicin M35細菌素對單核細胞增生李斯特菌(Listeria monocytogenes)細胞內ATP的影響有類似的趨勢。
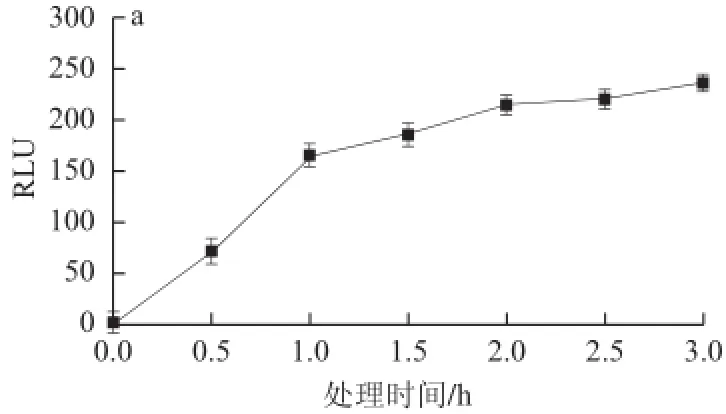

圖5 大腸桿菌胞內(b)外(a)ATP含量的變化趨勢Fig.5 Effects of Lactobacillin XH2 on intracellular (b) and extracellular (a) ATP levels in Escherichia coli cells
3 結 論
研究前期通過離子交換色譜法分離純化得到細菌素Lactobacillin XH2,發現其對大腸桿菌具有較高的抑制活性,在此基礎上對抑菌機理進行了探討。結果表明,嗜酸乳桿菌細菌素Lactobacillin XH2作用于大腸桿菌,3 h內大腸桿菌大部分死亡,菌體細胞變形并出現孔洞,細胞壁缺失;大腸桿菌胞內K+快速大量泄露,紫外吸收物質、乳酸脫氫酶等生命大分子物質大量流失;同時導致了ATP外泄,細胞物質能量代謝失常。由此推測Lactobacillin XH2作用大腸桿菌主要是通過膜透化作用而引起胞內物質泄漏,電鏡下觀察到的大腸桿菌細胞孔洞的形成,可能是由于細菌素分子嵌入細胞膜內而形成,使得膜通透性增加,形成穿膜“孔道”,導致紫外吸收物質、乳酸脫氫酶等生命物質大量流失,細胞物質代謝失常,并且K+的大量外泄導致膜電位的消散、細胞膜去極化,ATP維持膜電位而大量消耗,細胞外水分子流入,最終導致菌體死亡,可見,Engelke等[21]提出的“孔道形成(pore formation)”理論可能同樣適用于Lactobacillin XH2作用革蘭氏陰性菌大腸桿菌。該細菌素對大腸桿菌作用機理的探討可為進一步研究該細菌素的應用及其構效關系奠定基礎。
[1] G?LVEZ A, ABRIOUEL H, L?PEZ R L. Bacteriocin-based strategies for food biopreservation[J]. International Journal of Food Microbiology, 2007, 120(1/2): 51-70.
[2] GARC?A P, RODR?GUEZ L, RODR?GUEZ A, et al. Food biopreservation: promising strategies using bacteriocins,bacteriophages and endolysins[J]. Trends in Food Science & Technology, 2010, 21: 373-382.
[3] SHABANA M S, FARIHA H S, TARIQ M S, et al. Preliminary characterisation of bacteriocin produced by Lactobacillus acidophilus TS1 isolated from traditional dahi[J]. Annals of Microbiology, 2008,58(4): 617-622.
[4] ABO-AMER A E. Optimization of bacteriocin production byLactobacillus acidophilus AA11, a strain isolated from Egyptian cheese[J]. Annals of Microbiology, 2011, 61(3): 445-452.
[5] DRIDER D, FIMLAND G, H?CHARD Y, et al. The continuing story of class Ⅱa bacteriocins[J]. Microbiology and Molecular Biology Reviews, 2006, 70(2): 564-582.
[6] ENNAHAR S, SONOMOTO K, ISHIZAKI A. Class Ⅱa bacteriocins from lactic acid bacteria: antibacterial activity and food preservation[J]. Journal of Bioscience and Bioengineering, 1999, 87: 705-716.
[7] CUI Yanhua, ZHANG Chao, WANG Yunfeng, et al. Class Ⅱa bacteriocins: diversity and new developments[J]. International Journal of Molecular Sciences, 2012, 13(12): 1668-1670.
[8] TODOROV S D, FURTADO D N, SAAD S M, et al. Bacteriocin production and resistance to drugs are advantageous features for Lactobacillus acidophilus La-14, a potential probiotic strain[J]. New Microbiologica, 2011, 34(4): 357-370.
[9] COTTER P D, HILL C, ROSS R P. Bacteriocins: developing innate immunity for food[J]. Nature Reviews Microbiology, 2005, 3(10): 777-788.
[10] APPLEYARD A N, CHOI S, READ D M, et al. Dissecting structural and functional diversity of the Lantibiotic Mersacidin[J]. Chemistry & Biology, 2009, 16(5): 490-498.
[11] COLIGAN J E. 精編蛋白質科學實驗指南[M]. 李慎濤, 譯. 北京: 科學出版社, 2007: 297-298.
[12] 賈潔, 郭小華, 惠明, 等. 枯草芽孢桿菌R21-4的誘變育種及其抗菌蛋白性質的研究[J]. 食品工業科技, 2005, 26(11): 53-55.
[13] 陸泉, 施波, 李瑞勝, 等. 離子交換色譜在細菌素分離純化中的應用[J].中國微生態學雜志, 2010, 22(6): 570-572.
[14] 陳雪華, 江俊. 水中桿狀細菌的掃描電鏡觀察[J]. 熱帶農業科學,1998, 18(4): 24-25.
[15] 程建軍, 李想, 郭明若. 植物乳桿菌素抑菌機理的研究[J]. 中國乳品工業, 2011, 39(5): 31-33.
[16] ALTENA K, GUDER A, CRAMER C, et al. Biosynthesis of the lantibiotic mersacidin: origanization of a type B lantibiotic gene cluster[J]. Applied and Environmental Microbiology, 2000, 66(6): 2565-2571.
[17] 史沁紅, 李清. 天然食品防腐劑: 細菌素[J]. 肉類研究, 2008, 22(10): 44-47.
[18] 洪慶濤, 宋岳濤, 唐一鵬, 等. 細胞培養液乳酸脫氫酶漏出率的比色測定及其應用[J]. 細胞生物學雜志, 2004, 26(1): 89-92.
[19] 周偉, 劉國榮, 李平蘭, 等. 植物乳桿菌素L-1對單核細胞增生李斯特氏菌作用機理的研究[J]. 微生物學報, 2007, 47(2): 260-264.
[20] NAGHMOUCHI K, DRIDER D, FLISS I. Action of divergicin M35, a class Ⅱa bacteriocin, on liposomes and Listeria[J]. Journal of Applied Microbiology, 2007, 102(6): 1508-1517.
[21] ENGELKE G, GUTOWSKI E Z, HAMME I M, et al. Biosynthesis of the lantibiotic Nisin: genomic organization and membrane localization of the NisB protein[J]. Applied and Environmental Microbiology,1992, 58(11): 3730-3743.
Antibacterial Mechanism of Lactobacillin XH2 from Lactobacillus acidophilus on Escherichia coli
ZHAO Ruixiang1, DUAN Gaili1, YANG Tianyou2, SUN Junliang1, NIU Shengyang1, WANG Ying1
(1. College of Food Science, Henan Institute of Science and Technology, Xinxiang 453003, China; 2. College of Life Science and Technology, Henan Institute of Science and Technology, Xinxiang 453003, China)
Lactobacillin XH2 with antibacterial potency of 380.60 AU/mL was purified from the culture supernatant of Lactobacillus acidophilus by ion-exchange chromatography. Its antibacterial mechanism on Escherichia coli (E. coli) was investigated by examining its effects on mortality rate, cell membrane damage and leakage of intracellular contents from E. coli cells. Most E. coli cells died in 3 h and their cell walls were partially damaged. The concentration of intracellular K+in E. coli decreased rapidly, which resulted in imbalance of the membrane potential. The leakage of large amounts of macromolecules such as ultraviolet-absorbing substances, lactate dehydrogenase and intracellular ATP led to disruption of the cellular structure and abnormal energy metabolism, causing the cells to die eventually. These observations i ndicate that the pore formation theory could apply to Gram-negative bacteria E. coli.
Lactobacillus acidophilus; bacteriocin; Gram-negative bacteria; antibacterial mechanism
TS201.3
A
1002-6630(2015)03-0075-05
10.7506/spkx1002-6630-201503014
2014-04-09
河南省教育廳科學技術研究重點項目(12A550004);河南省科技攻關計劃項目(122102110117);新鄉市科技創新平臺建設項目(CP1310)
趙瑞香(1966—),女,教授,博士,研究方向為食品生物技術。E-mail:zrx338@163.com

