ACR在不同進水COD濃度下的產氫性能與菌群結構
昌盛,李建政,付青,趙興茹,鄭國臣
?
ACR在不同進水COD濃度下的產氫性能與菌群結構
昌盛1,2,李建政2,付青1,趙興茹1,鄭國臣2
(1中國環境科學研究院環境基準與風險評估國家重點實驗室,北京 100012;2哈爾濱工業大學市政環境工程學院,黑龍江哈爾濱 150090)
以稀釋糖蜜為底物,通過厭氧接觸式發酵制氫反應器(ACR) 的啟動和運行,考察了ACR在不同進水COD濃度下的運行特性。結果表明,當HRT= 6 h,進水COD濃度從 7000 mg·L-1提升至11000 mg·L-1時,反應器仍能穩定運行,并維持乙醇型發酵類型。隨著底物濃度的增加,系統的比產氫速率從COD 7000 mg·L-1時的2.43 m3·(m3·d)-1提高到COD11000 mg·L-1時的3.51 m3·(m3·d)-1,而活性污泥的比產氫速率在COD 為9000 mg·L-1時最高,為10.71 mol H2·(kg VSS·d)-1。聚合酶鏈式反應-變性梯度凝膠電泳(PCR-DGGE)分析結果表明,產氫發酵產乙醇菌群為ACR系統中的主要產氫功能菌群,且隨著進水COD濃度的增加,以YUAN-3為代表的產氫菌群的優勢度顯著增強,但丙酸發酵菌屬sp. F6也開始富集。
厭氧接觸式反應器;發酵制氫;進水COD濃度;菌群結構
引 言
發酵法生物制氫技術,能以可再生的生物質,甚至是富含有機物的廢水、垃圾或禽畜排泄物為原料[1-2],在清潔能源生產、廢物資源化和環境保護等方面均有重要意義[3-4]。以混合菌群(活性污泥)為基礎的發酵法生物制氫技術,因其原料的可再生性和廣泛性,以及易于實現工業化生產等特性,受到越來越多的關注[5-6]。為了提高發酵制氫反應系統的產氫效能,高效穩定的發酵制氫設備的開發一直是一個重要的研究方向[7-9]。在發酵生物制氫技術領域,目前采用最多的設備是連續流攪拌槽式反應系統(CSTR),由于機械攪拌的采用,傳質效率高,有效地提高了反應設備產氫效率。但是,在高有機負荷條件下,容易造成污泥流失,從而使系統的產氫效能受到了很大限制[10]。為解決這一技術問題,國內外學者進行了大量的研究,開發出了一系列基于細胞固定化技術的制氫工藝,如固定床(fixed bed)、流化床(fluidized bed)、膨脹床(expanded granular sludge bed, EGSB)、上流式厭氧污泥床(up-flow anaerobic sludge blanket, UASB)等[7-9,11-12]。但是,作為固定化載體的基質,會占據反應器內大量有效空間,反應器的產氫效能也會因傳質效率下降而受到限制。由CSTR發展而來的厭氧接觸反應器(anaerobic contact reactor,ACR),在保留了攪拌功能的同時,增設了污泥截留和回流裝置,通過水力停留時間和污泥停留時間的分離,使反應系統可以保持較高的生物量,在廢水生物處理中得到了較為廣泛的應用[13]。但利用ACR進行有機廢水發酵制氫的研究,還鮮有報道。因此,探討ACR發酵制氫系統的運行特性具有重要意義。
進水COD濃度作為重要的工程控制參數之一,COD對微生物群落結構與代謝活性影響顯著[14],通過COD的合理調控,可提高高效產氫菌群在厭氧發酵制氫系統中的數量和活性。目前,關于COD對厭氧發酵制氫系統運行特性的影響中,其研究點主要集中在探討COD對反應器的產氫速率的影響上,而關于乙醇型發酵制氫反應器內產氫菌群對COD變化的響應的研究還較為少見[15-16]。而揭示 COD對產酸發酵產氫菌群影響的規律,對于分析厭氧發酵制氫系統中揮發酸的積累機制,提高反應器的產氫效能均有重要意義。本文以前期成功啟動并將ACR反應器控制為乙醇型發酵的基礎上,考察了ACR反應器在不同進水COD濃度下的運行特性,并對反應器中的微生物群落結構進行解析,探索了發酵產氫菌群的演替規律,為ACR發酵制氫反應設備的運行控制提供技術參數。
1 材料與方法
1.1 試驗裝置
制氫系統采用專利技術設備[17],即厭氧接觸式發酵制氫反應器(ACR),其由反應單元和氣-液-固三相分離單元兩部分組成(圖1),均采用有機玻璃制成。ACR的反應單元呈圓筒形,有效容積為12 L。氣-液-固三相分離單元有效容積為14 L,下端為圓錐形污泥斗,收集的污泥由蠕動泵回流至反應單元。反應單元和氣-液-固三相分離單元的頂蓋上部設有集氣管并與水封相連,發酵氣產量采用濕式氣體流量計計量。反應器外表面纏有電熱絲,通過溫控裝置將反應器內部溫度控制在(35±1)℃。
1.2 試驗廢水
試驗廢水采用甜菜制糖廠的廢糖蜜加水稀釋而成。在配制廢水時,投加一定量的農用復合肥,使廢水中的 C、N、P 的質量比保持在(200~500):5:1左右,以保證污泥在生長過程中對 N、P 營養元素的需求,配水不進行人為的pH調節。糖蜜、復合肥的組分以及具體的投加比例均與Ren等[12,15]的研究完全相同。
1.3 污泥接種與反應器的運行控制
接種污泥取自當地某啤酒廢水處理廠二沉池排放的剩余污泥。使用前,污泥于室溫下密封堆置近3個月。污泥經反復淘洗、過濾后,置入ACR反應器中,接種量為9.3 g MLVSS·L-1。反應器在進水COD 7000 mg·L-1,HRT為6 h下啟動,經過55 d的運行并達穩定后,通過分階段提高進水COD濃度到9000、11000 mg·L-1,考察ACR反應器在不同進水COD濃度下的運行特性。在每次提高進水COD濃度前,系統均應穩定運行7 d左右,以利于高效產氫發酵優勢種群的形成與穩定。為便于分析,將反應器的運行控制分為3個階段:第1階段,即反應器在進水COD濃度為7000 mg·L-1時的運行階段(第55~65 d);第2階段,進水COD濃度為9000 mg·L-1時的運行階段(第66~80 d);第3階段,進水COD濃度為11000 mg·L-1時的運行階段(第81~93 d)。反應器的穩定運行是指反應器的產氣速率、氫氣含量、出水COD、pH和堿度、揮發酸各組分的含量基本在10%上下波動。
1.4 分析方法
1.4.1 物化指標分析 pH、堿度(alkalinity)、COD和生物量(MLSS和MLVSS)等常規監測項目采用標準方法測定[18]。包括乙酸、丙酸、丁酸在內的揮發性有機酸(VFAs)以及乙醇的檢測采用氣相色譜儀(SP-6890,山東魯南瑞虹化工儀器有限公司)測定[13],發酵氣組分采用另一臺氣相色譜儀(SP-6801T,山東魯南瑞虹化工儀器有限公司)分析[13]。
1.4.2 DNA提取、PCR及DGGE分析 采用DNA提取試劑盒提取厭氧活性污泥總DNA(MO Bio Laboratories, Inc., Carlsbad,CA, USA);PCR反應體系為:10×Ex Taq buffer 5 ml, dNTP 4ml(2.5 mmol·L-1),引物各0.5ml(20mmol·L-1),模板2ml,Ex Taq DNA聚合酶0.8ml,水37.2ml。PCR反應條件為:94℃預變性5 min;94℃1 min,55℃45 s,72℃45 s;32個循環;72℃10 min。所用引物為真細菌通用引物:BSF338, 5′-ACTCCTACGGGAGGCAGCAG-3′和BSR534, 5′-ATTACCGCGGCTGCTGGC-3′。
取15ml上述PCR產物進行梯度凝膠電泳分析(DGGE)。電泳條件:聚丙烯酰胺濃度40%~60%,電壓120 V,溫度60℃,時間10 h,然后進行銀染。將DGGE圖譜中的主要條帶切下來,碾碎并置于30ml 1×TE,40℃恒溫水浴3 h。然后于12000 r·min-1離心3 min。取3ml上清液作為模板,利用通用引物M13F(5′-TGTAAAACGACGGCCAGT-3′)和M13R(5′-CAGGAAACAGCTATGACC-3′)進行PCR擴增,然后用膠回收試劑盒(賽百盛)純化PCR產物;將純化的PCR產物連接到pMD19-T 載體上并轉化到大腸桿菌 DH5a中。隨機挑選3個白色克隆進行PCR檢測,將陽性克隆送至上海生工生物技術有限公司測序。測序結果與NCBI的BlastX進行序列比對。
2 結果與討論
2.1 反應器的產氫特性
2.1.1 產氫速率的變化 圖2表示反應器在進水COD濃度分別為7000、9000、11000 mg·L-1時反應器產氫速率隨運行時間的變化規律。反應器在第1階段的穩定運行期,反應器的產氣速率和產氫速率的平均值分別為68.1 L·d-1和28.2 L·d-1,氫氣含量基本穩定在42.2%。從第66 d開始,反應器進入到運行的第2階段,反應器的產氣速率迅速上升,并于第70 d達到峰值后趨于穩定,在運行穩定階段(第71~78 d),反應器產氣速率約為100.5 L·d-1。然而,氫氣的含量略有下降,保持在37.1%左右的水平。當反應器進入第79 d時,進水COD提高到11000 mg·L-1,反應器的產氣速率在第82 d達到117.8 L·d-1后,趨于穩定,此階段的氫氣含量的變化規律與第1次提高COD濃度的情形類似,經小幅波動后,也再次趨于穩定。如圖2所示,反應器在第1階段結束后的第3 d,反應器就達到了穩定運行狀態(圖2),在第71~78 d的穩定運行期,反應器的產氣速率和H2含量平均值分別為97.8 L·d-1和39.2%。在反應器運行的第3階段,反應器在提高COD濃度后的第8 d也即達到新的穩定運行,ACR發酵制氫反應系統在第3階段(第86~93 d)的穩定運行期,反應器的產氣速率和H2含量維持在107.1~125.5 L·d-1和34.5%~37.8%的水平。以上結果表明,ACR反應器的自我調節能力較強,反應器受到沖擊負荷后,在較短的時間內即能達到新的穩定運行狀態,其氫氣含量的變化表明反應器內的活性污泥微生物群落結構隨著進水COD的濃度發生了改變,進而變更了底物的代謝途徑,導致氣體組分也發生變動。
2.1.2 液相末端發酵產物的變化 在反應器的運行期間,液相末端發酵產物的變化規律如圖3所示。與系統的產氣速率和產氫速率變化規律相似,反應器出水中的液相末端發酵產物也呈現出隨進水COD濃度增加而逐漸增加的趨勢。在反應器第1階段的穩定運行期,液相末端發酵產物的各組分含量均比較恒定,乙醇、乙酸、丙酸和丁酸含量的平均值分別為1158.6、1149.3、158.9、和348.4 mg·L-1,發酵產物乙醇和乙酸含量之和占總揮發酸量(2850.2 mg·L-1)的80.9%,呈乙醇型發酵類型。當提高進水COD濃度后,即反應器進入到第2階段的運行,液相末端發酵產物各組分含量的變化規律呈現一定差異性。結果顯示,除丁酸濃度有所降低外,其他各組分均增加,其中乙醇和乙酸的含量增幅較大,在第2階段的穩定運行期,乙醇和乙酸濃度分別為2164.2和1220.1 mg·L-1。當反應器進入到第3階段的運行時,反應器出水液相末端發酵產物所呈現的規律則與第一次提高COD時呈現的規律有所不同。其中,乙酸含量基本上維持不變,平均水平約為1336.9 mg·L-1,而乙醇和丁酸卻呈下降趨勢,乙醇下降至2480.7 mg·L-1趨于穩定,丁酸下降至174.3 mg·L-1趨于穩定。在第3階段的運行穩定期,乙醇和乙酸的含量之和占液相發酵產物總和(4198.1 mg·L-1)的90.9%。從圖3可以看出,反應器在3個階段的運行中,盡管反應器均呈現出乙醇型發酵類型,但乙醇、乙酸質量分數卻有顯著差異。在反應器3個階段的穩定運行期,乙醇占揮發酸總量的質量分數分別為39.8%、40.9%、53.8%,乙酸占揮發酸總量的質量分數分別為35.3%、59.3%、31.6%。
2.1.3 pH和堿度的變化 反應器出水pH和堿度隨運行時間的變化情況如圖4所示。在反應器運行的第1階段,系統出水pH維持在5.0左右,而這一pH也正是乙醇型發酵類型的生態位[12]。在反應器運行的第2階段和第3階段,由于反應器出水揮發酸總量增加,出水pH呈現逐漸下降趨勢。在反應器第2階段和第3階段的穩定期,出水pH的平均值分別為4.9和4.7(圖4)。Hwang等[19]的研究結果表明,乙醇型發酵的最佳pH為5.0±0.2,但當pH低于4.5時,乙醇型發酵菌群活性很低,而Ren等[12,16,20]的研究發現,乙醇發酵的最佳pH為4.2~4.4。在本研究中,當pH為4.7~5.1時,系統均能呈現乙醇型發酵,這表明pH對發酵制氫反應器的影響還需要做進一步研究。
與pH的變化相比,系統出水堿度的波動較為明顯(圖4)。這主要是因反應器進水COD濃度的提高,揮發酸組分的變化引發了反應器堿度平衡體系的改變。在反應器運行的第1階段,系統出水堿度維持在850~900 mg CaCO3·L-1。當提高進水COD濃度后,出水堿度都出現了一個先上升后下降再趨于穩定的過程,這表明反應器啟動成功后,系統內形成的緩沖體系具有較好的調節能力,并未因進水COD濃度的增加和揮發酸濃度的提高,而引起反應器的“酸化”。在反應器第2階段和第3階段的穩定期,反應器出水堿度的平均值分別為960、870 mg CaCO3·L-1。
2.1.4 生物量的變化 進水COD濃度不僅對反應器內環境條件和微生物群落代謝特性有明顯影響,同時對反應器中的生物量和活性也有顯著影響。從圖5可以看出,隨著進水COD濃度的提高,即伴隨營養底物的增加,反應器中的發酵菌群大量繁殖,其生物量由第1階段的10.9 g·L-1增加到第2階段的13.6 g·L-1;當反應器進入第3階段的運行,生物量的變化規律與第1次提高COD的情形類似,生物量呈增加趨勢,最后在穩定器保持在16.4 g·L-1。
2.2 微生物群落結構的演變規律
在進水COD為9000 mg·L-1和11000 mg·L-1時的穩定運行期,即在第60 d和第90 d,從反應器內取污泥樣品,采用PCR-DGGE技術分析了反應器內污泥的微生物群落結構。DGGE譜圖如圖6所示,DGGE譜圖中1~14號條帶的測序結果見表1,通過系統進化分析優勢種群,主要分屬于3個門,分別是Actinobacteria、Bacteroidetes和Firmicute。Firmicute門占據絕對優勢,占微生物種類比例的61.5%。
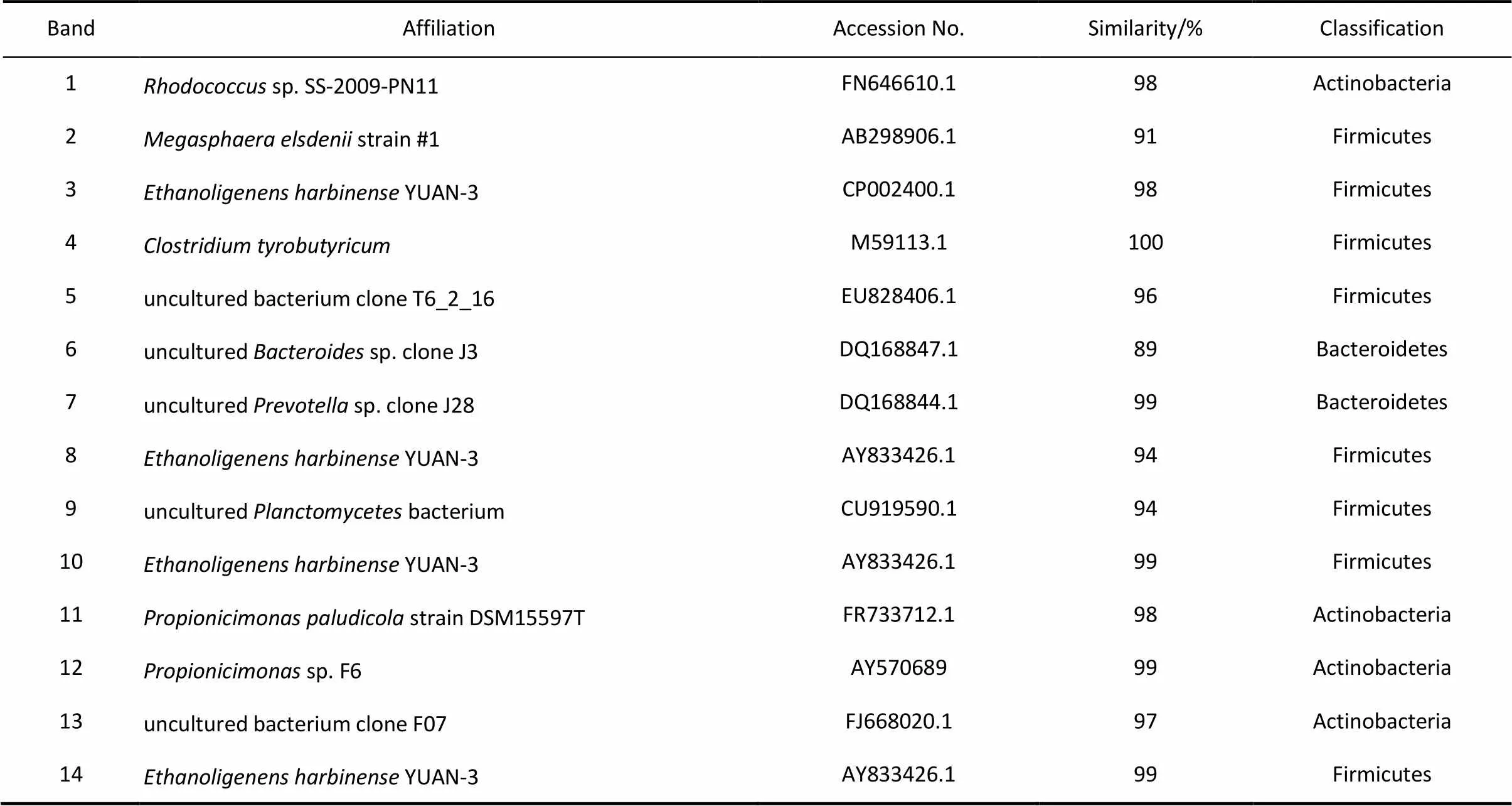
表1 DGGE條帶16S rDNA測序分析結果Table 1 Affiliation of denaturing gradient gel electrophoresis(DGGE)fragments by their 16S rDNA sequence
從圖6可見,在反應器運行的第90 d,條帶4、5、6消失,條帶7信號減弱,而根據基因序列比對結果,條帶4與(M59113.1)相似性為100%,為典型的丁酸型發酵菌屬,發酵產物以丁酸為主,所以提高進水COD濃度后(90 d),反應器出水中的丁酸含量下降(圖3)。然而,與第60 d的圖譜相比,條帶8、14為反應器在第3階段的特異條帶,其與YUAN-3(CP002400.1)高度相似,根據Ren等[16]的研究,YUAN-3是典型的產氫-產乙醇菌種,其代謝產物以乙醇和乙酸為主,這表明,進水COD濃度的增加,促進了YUAN-3的大量繁殖,其在微生物群落中的優勢度得到增強,反應器出水中乙醇和乙酸的含量明顯增加(圖3)。條帶10在反應器第60 d和第90 d的運行中均存在,測序結果說明其與YUAN-3相關度為99%,并且其信號強度明顯要大于條帶4,這說明在反應器運行的第1階段和第3階段,乙醇發酵產氫菌群均為反應器中的優勢菌群,這也是反應器呈現乙醇型發酵類型的根本原因。另外,從圖6可以看出,隨著進水COD濃度的增加,微生物種類增加,在反應器運行的90 d,strain DSM15597T(條帶11)和sp. F6 (條帶12)在系統內開始富集,這2種菌均屬于丙酸發酵菌,發酵產物以丙酸為主,而丙酸的產生能減弱基質的氫氣轉化率[15]。綜上所述,反應系統啟動成功后,YUAN-3為反應器內的優勢菌群,并隨著進水COD濃度的提高,反應器內的微生物群落結構發生了演替,系統中的YUAN-3優勢度得到增強。以上結果表明,隨著進水COD濃度的提高,反應器內的微生物群落結構發生了演替,且在第1階段和第3階段的穩定運行期,反應器內形成了不同的頂極群落,而導致了反應器在不同進水COD濃度下的產氫性能不同。
2.3 ACR反應器的產氫性能
表2列出了反應器在各穩定期的比產氫速率、氫氣轉化率和底物降解率。當COD從7000 mg·L-1增加到9000 mg·L-1時,底物降解率由85%降到80%,進水COD進一步增加到11000 mg·L-1時,底物降解率約為72%,但反應器的產氫速率和氫氣轉化率始終呈遞增的趨勢,這與Guo等[12]的研究結果相同。如表2所示,隨著進水COD濃度的提高,系統的比產氫速率不斷提高,當進水COD為11000 mg·L-1時,反應器的比產氫速率 (HPR) 最大,達到了(3.51±0.45)m3·(m3·d)-1。然而,活性污泥的比產氫速率并未隨COD的逐級提高而遞升,卻在COD為9000 mg·L-1時達到最高值,為(10.71±0.45)mol H2·(kg VSS·d)-1。分析認為,存在著以下兩點原因:一是系統在COD進水為11000 mg·L-1時,底物濃度過高引發了產物的反饋抑制作用[如底物降解率和氫氣含量明顯下降(表2和圖2)],此時微生物產氫代謝活性下降,所以,活性污泥的比產氫速率并未在COD為11000 mg·L-1時獲得最大值;二是因為隨著COD的提高,系統內的微生物群落結構發生改變,當進水COD為11000 mg·L-1時,丙酸發酵菌群開始富集(圖6),代謝產物中丙酸組分含量開始增加,而丙酸的代謝途徑不伴隨著氫氣的產生相反還會消耗氫氣,因此,系統在第3階段的運行中,活性污泥的比產氫速率較第2階段要小。
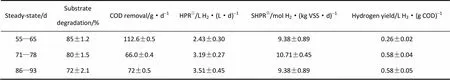
表2 反應器在各階段穩定運行期的產氫特性Table 2 Characteristic of hydrogen production in ACR during different steady-states
① Specific hydrogen production of reactor;②Specific hydrogen production rate of biomass.
3 結 論
(1)在HRT= 6 h,進水COD濃度逐級提高的過程中,ACR發酵制氫反應器的自我調節能力較強,能在較短時間內達到穩定運行。ACR發酵制氫反應器的比產氫速率從進水COD為7000 mg·L-1時的2.43 m3·(m3·d)-1提高到COD為11000 mg·L-1時的3.51 m3·(m3·d)-1,而活性污泥的比產氫速率在COD為9000 mg·L-1時最高,達到10.71 mol H2·(kg VSS·d)-1。
(2)進水COD濃度的提高使ACR發酵制氫反應器內的微生物群落結構發生了明顯的演替。隨著進水COD濃度的增加,系統中以YUAN-3為主的發酵產氫菌群優勢度得到增強,而丙酸型發酵菌spF6開始富集。
References
[1] Karapinar I, Kapdan K F. Bio-hydrogen production from waste materials [J]., 2006, 38(5): 569-582
[2] Das D, Veziroglu T N. Advances in biological hydrogen production processes [J]., 2008, 33(21): 6046-6057
[3] Hawkes F R, Dinsdale R, Hawkes D L, Hussy I. Sustainable fermentative hydrogen production: challenges for process optimization [J]., 2002, 27(11/12): 1339-1347
[4] David B L, Lawrence P, Murray L. Biohydrogen production: prospects and limitations to practical application [J]., 2004, 29(2): 173-185
[5] Pakarinen O, Kaparaju P, Rintala J. The effect of organic loading rate and retention time on hydrogen production from a methanogenic CSTR [J]., 2011, 102(19): 8952-8957
[6] Li Jianzheng(李建政),Yu Ze(于澤), Chang Sheng(昌盛), Su Xiaoyu(蘇曉煜). Operation characteristic comparison of CSTR and ACR systems for hydrogen production by butyric acid type fermentation [J].(化工學報), 2012, 63(5): 1551-1557
[7] Puyol D, Mohedano A F, Sanz J L, RodríguezJ J. Comparison of UASB and EGSB performance on the anaerobic biodegradation of 2, 4-dichlorophenol [J]., 2009, 76(9): 1192-1198
[8] Kotsopoulos T A, Zeng R J, Angelidaki I. Biohydrogen production in granular up-flow anaerobic sludge blanket (UASB) reactors with mixed cultures under hyper-thermophilic temperature (70℃) [J]., 2006, 94(2): 296-302
[9] Chang J S, Lee K S, Lin P J. Biohydrogen production with ?xed-bed bioreactors [J]., 2002, 27: 1167-1174
[10] Li Jianzheng(李建政), Zhang Ni(張妮), Li Nan(李楠), Wang Xingzu(王興祖). Influence of HRT on fermentative hydrogen production process by anaerobic activated sludge [J].(哈爾濱工業大學學報), 2006, 38(11): 1840-1846
[11] Zhang Z P, Tay J H, Show K Y, Yan R, Liang D T, Lee D J. Biohydrogen production in a granular activated carbon anaerobic ?uidized bed reactor [J]., 2007, 32: 185-191
[12] Guo Wanqian, Ren Nanqi, Wang Xiangjing. Biohydrogen production from ethanol-type fermentation of molasses in an expanded granular sludge bed (EGSB) reactor [J]., 2008, 33(19): 4981-4988
[13] Li Jianzheng(李建政), Li Weiguang(李偉光), Chang Sheng(昌盛), Liu Feng(劉楓), Wang Shujing(王淑靜),Zheng Guochen(鄭國臣). Start-up and performance of anaerobic contact reactor for hydrogen production [J].(科技導報), 2009, 27(14): 90-93
[14] Wang Bo, Wan Wei, Wang Jianlong. Inhibitory effect of ethanol, acetic acid, propionic acid and butyric acid on fermentative hydrogen production [J]., 2008, 33(23): 7013-7019
[15] Ren Nanqi, Li Jianzheng, Li Baikun, Wang Yong, Liu Shirui. Biohydrogen production from molasses by anaerobic fermentation with a pilot-scale bioreactor system [J]., 2006, 31(15): 2147-2157
[16] Ren Nanqi, Xing Defeng, Rittmann Bruce. Microbial community structure of ethanol type fermentation in bio-hydrogen production [J]., 2007, 9(5): 1112-1125
[17] Li Jianzheng(李建政), Chang Sheng(昌盛). Anaerobic contact digester reactor [P]: CN, 200710144460. 2008-05-14
[18] American Public Health Association. Standard Methods for the Examination of Water and Wastewater [S]. 19th ed. Washington DC, USA, 1998
[19] Hwang M H, Jang N J, Hyun S H.Anaerobic bio-hydrogen production from ethanol fermentation: the role of pH [J]., 2004, 111(3): 297-309
[20] Ren N Q, Wang B Z, Huang J C. Ethanol-type fermentation from carbohydrate in high rate acidogenic reactor [J]., 1997, 54(5): 428-433
Performance of fermentative hydrogen production and microbial community in ACR at different influent COD concentrations
CHANG Sheng1, 2,LI Jianzheng1,2,FU Qing1,ZHAO Xingru1,ZHENG Guochen2
(State Environmental Protection Key Laboratory of Drinking Water Source ProtectionChinese Research Academy of Environmental SciencesBeijingChinaSchool of Municipal and Environmental EngineeringHarbin Institute of TechnologyHarbinHeilongjiangChina
The operation performance of fermentative hydrogen production in anaerobic contact reactor (ACR) at different influent COD concentrations was investigated. The ACR could be kept at steady-state with ethanol-type fermentation, as influent chemical oxygen demand (COD) increased from 7000 mg·L-1to 11000 mg·L-1with constant HRT of 6 h. Specific hydrogen production of the ACR system increased from 2.43 m3·(m3·d)-1to 3.51 m3·(m3·d)-1as influent COD increased from 7000 mg·L-1to 11000 mg·L-1, while specific hydrogen production of activated sludge peaked at 10.71 mol H2·(kg VSS·d)-1at influent COD of 9000 mg·L-1. The results of polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE) profiles showed that hydrogen-producing ethanol fermentative bacteria were dominant in the ACR. As influent COD concentration increased,YUAN-3 became more abundant, and propionate fermentative bacteria,.spF6 also started to be enriched.
anaerobic contact reactor;fermentative hydrogen production; influent COD concentration; microbial community
2014-09-03.
CHANG Sheng, changsheng83@163.com
10.11949/j.issn.0438-1157.20141345
TK 6
A
0438—1157(2015)03—1156—07
國家自然科學基金項目(51178316);國家水體污染控制與治理重大專項 (2014ZX07405-001);國家環保公益項目(201409029)。
2014-09-03收到初稿,2014-11-03收到修改稿。
聯系人及第一作者:昌盛(1983—),男,博士,助理研究員。
supported by the National Natural Science Foundation of China(51178136), the National Major Projects of Water Pollution Control and Treatment (2014ZX07405-001) and the National Environmental Charity Project (201409029).

