醋酸乙酯加氫合成乙醇反應器的模型化
孫帆,程雙,于小芳,張新平,張春雷,周興貴
?
醋酸乙酯加氫合成乙醇反應器的模型化
孫帆1,2,程雙1,于小芳1,張新平1,張春雷1,周興貴2
(1上海華誼集團技術研究院,上海 200241;2華東理工大學化學工程聯合國家重點實驗室,上海 200237)
根據實驗室數據對醋酸乙酯加氫制乙醇宏觀動力學方程進行參數估計,得到宏觀動力學模型。根據動力學模型,同時考慮內擴散的影響以及物料、熱量和動量衡算方程建立了醋酸乙酯加氫制乙醇固定床反應器的一維擬均相模型,并分別得到不同氫酯比、不同控制溫度、不同壓力下的多種工況的模擬結果。模擬結果與實際生產數據吻合。該模型可用于指導工業反應器的設計和操作優化。
醋酸乙酯;固定床;反應器;乙醇;動力學;一維擬均相
引 言
乙醇是重要的化工原料和燃料。關于乙醇的制備技術,目前我國主要采用糧食發酵以及乙烯水合法[1],也有采用天然氣為原料制備的報道[2-4],國外近幾年有較多以天然氣為原料制備乙醇的專利報道[5-7]。近年來,醋酸酯加氫制備乙醇技術越來越受到人們的重視,一方面可以緩解目前國內醋酸行業處于產能嚴重過剩、市場持續低迷的困境,開發其下游產業鏈[8],另一方面由于石油的不可再生和石油產區的不穩定性,燃料能源安全問題在全球范圍內引起了越來越多的關注,因此,大力發展燃料乙醇、乙醇柴油等以乙醇為原料的能源產業已經成為國際燃料能源產業的一大亮點[9]。與其他技術相比,采用醋酸乙酯加氫合成乙醇,催化劑價格較低、單程轉化率高、擇性好且副產物少,可以大大降低后續分離的難度[10]。
加氫反應器是醋酸乙酯加氫制乙醇生產中的重要裝置,目前國內外文獻還沒有關于該反應器模型的相關報道,僅有關于催化劑的文獻[11-13]。本研究首先根據實驗室數據建立動力學模型,然后根據動力學模型,同時考慮內擴散的影響以及物料、熱量和動量衡算方程建立了反應器模型,模型結果與單管實際工況較吻合。
1 宏觀動力學模型
原料氫氣(H2)和汽化的醋酸乙酯(EA)在固定床反應器中與銅基催化劑接觸,進行加氫反應,生成乙醇(EtOH)。反應過程可以描述為
為便于工程設計應用,宏觀動力學方程模型一般用冪函數形式,反應速率常數采用修正的阿倫尼烏斯方程[14],反應動力學方程形式如下
采用非線性最小二乘法對實驗數據進行參數估值[15],實驗結果和參數擬合可見文獻[16],經計算得到動力學參數為
01.585 Pa-1·s-1,6.056×104J·mol-1,
2 反應器模型
2.1 內擴散的影響
內擴散效率因子計算式為
氣相反應物A在固相中的有效擴散系數由式(6)~式(9)計算[17]
所用催化劑的物理參數為:粒徑0.003 m,長度0.003 m,顆粒密度1.6×103kg·m-3,顆粒平均孔徑260×10-10m,顆粒孔隙率0.61,曲節因子1.35。
2.2 數學模型
建立醋酸乙酯加氫合成乙醇固定床反應器模型時,采用一維擬均相平推流模型[18],做如下假設:①流體在反應器中溫度、濃度徑向均一,僅沿軸向變化;②流體與催化劑在任一與流體流動方向垂直的橫截面處的溫度、反應物濃度相同;③流體在床層中以平推流流動。
在反應器床層高度上取微元d進行物料、熱量和動量衡算,得到模型數學表達式如下。
物料衡算方程為
H2和EA在反應過程中的摩爾分數均用生成乙醇的摩爾分數表示
熱量衡算方程為
動量衡算采用厄根(Ergun)方程[19]
氣體混合物的混合規則采用Kay規則[20],該規則提出的虛擬臨界參數為
混合氣體的密度、比熱容等參數也均采用此混合規則。
3 模型計算結果
在模擬計算時,采用Runge-Kutta積分算法對反應器模型沿軸向積分求解反應結果。在不同工況條件下運行模型,得到模型的模擬結果,與實際工況下的乙酯轉化率、反應器熱點溫度和熱點位置等主要指標進行對比。
3.1 不同氫酯比下的模擬結果
在壓力為5.5 MPa、控制溫度為204℃時,對不同氫酯比下的5組工況(氫酯比分別為7.5、10、13、20和30時)進行模擬,乙酯轉化率模擬值與實際值的對比如圖1所示。

圖1 不同氫酯比時的乙酯轉化率
氫酯比分別為7.5、13、20和30時的床層溫度分布模擬值與實際值的對比如圖2所示。其中,模擬轉化率與實際轉化率的平均相對誤差為0.32%,模擬熱點溫度與實際熱點溫度的平均相對誤差為0.20%。從模擬結果可以看出,隨著氫酯比的增大,反應器出口的乙酯轉化率逐漸增大,熱點溫度逐漸降低,熱點位置略微提前。
3.2 不同控制溫度下的模擬結果
在壓力為5.5 MPa、氫酯比為13~14時(模擬時氫酯比取為13.5),對不同控制溫度下的7組工況進行模擬,乙酯轉化率模擬值與實際值的對比如圖3所示,床層溫度分布實際值和模擬結果如圖4所示。其中,模擬轉化率與實際轉化率的平均相對誤差為0.18%。從模擬結果可以看出,隨著進口溫度的增大,反應器出口的乙酯轉化率逐漸增大,熱點溫度逐漸增大,熱點位置略微提前。
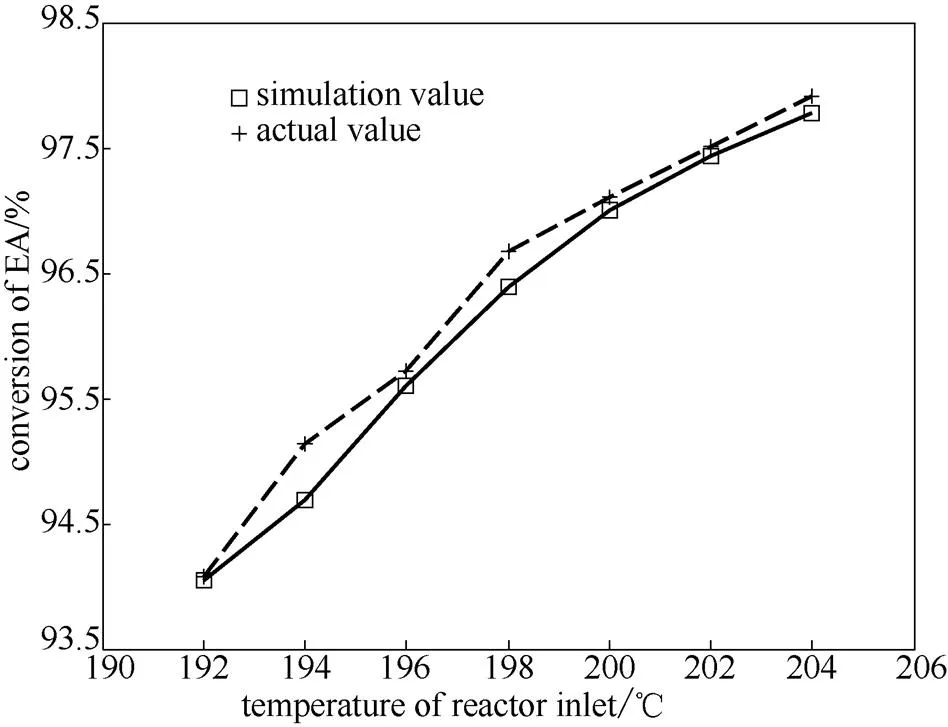
圖3 不同進口溫度時的乙酯轉化率

圖4 不同進口溫度時的床層溫度分布
3.3 不同壓力下的模擬結果
在控制溫度為204℃、氫酯比為13時,對不同壓力下的3組工況進行模擬,壓力分別為5.5、4.8、4 MPa時的乙酯轉化率模擬值與實際值的對比如圖5所示。
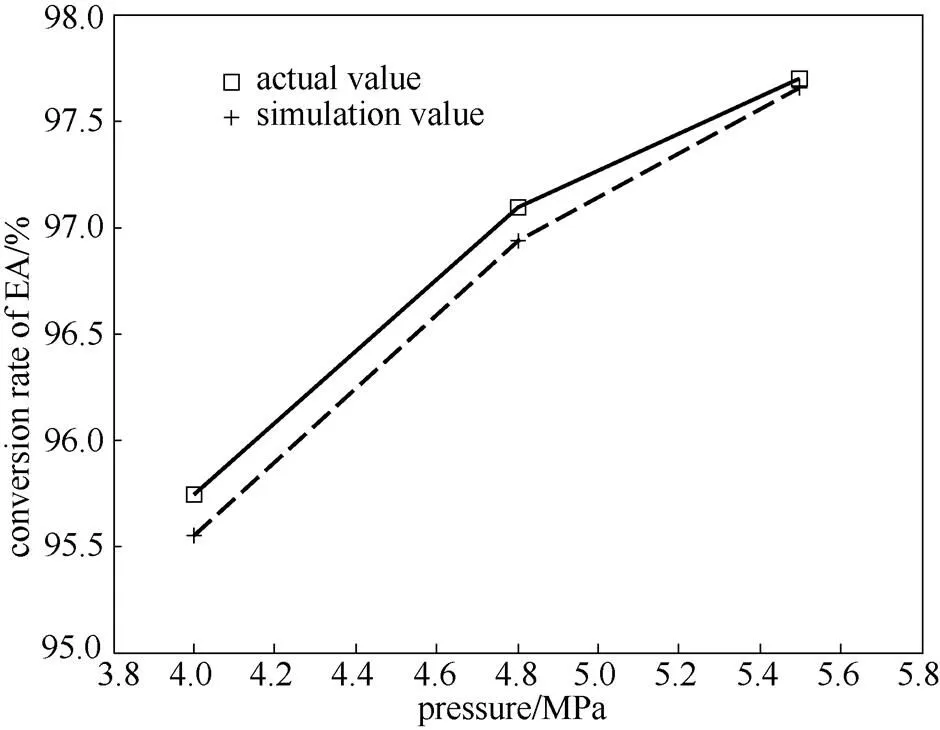
圖5 不同壓力下的乙酯轉化率
床層溫度分布模擬值與實際值的對比如圖6所示。其中,模擬轉化率與實際轉化率的平均相對誤差為0.34%,模擬熱點溫度與實際熱點溫度的平均相對誤差為0.47%。從模擬結果可以看出,隨著壓力的增大,反應器出口的乙酯轉化率逐漸增大,熱點溫度基本不變,熱點位置略微提前。
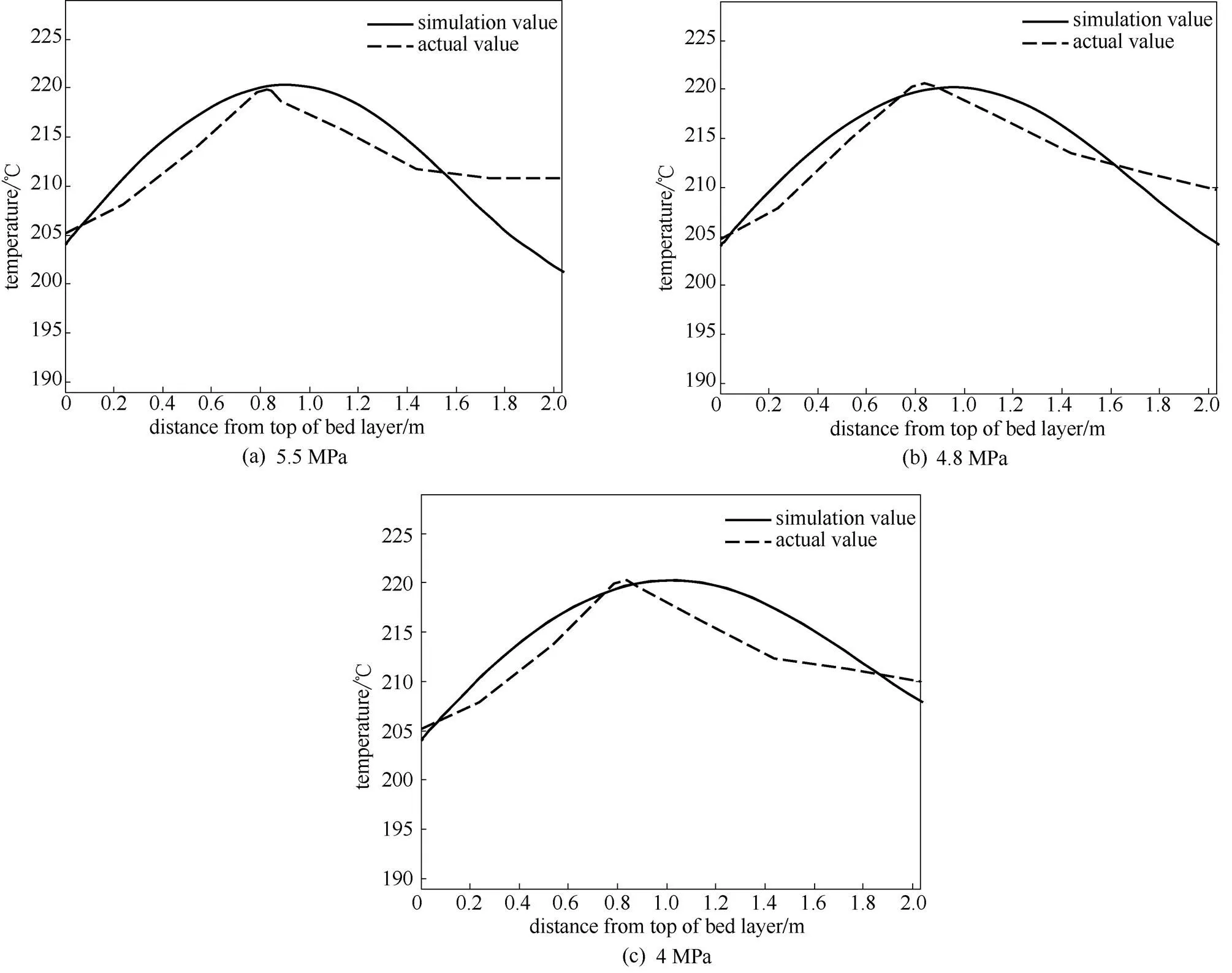
圖6 不同壓力時床層溫度分布
4 結 論
(1)針對醋酸乙酯加氫制乙醇反應體系建立了醋酸乙酯加氫合成乙醇固定床反應器的一維擬均相模型。模擬計算結果表明,增大氫酯比、增加反應器進口溫度以及增加反應器壓力均可以增大反應器出口的乙酯轉化率,氫酯比和反應器進口溫度對反應器熱點溫度影響較大,反應器壓力則對熱點溫度影響較小。
(2)模型計算結果與單管裝置實際生產數據吻合度較好,偏差較小,表明所建立的反應器模型及其他數據的計算和處理是合適的,所建模型可用于醋酸乙酯加氫合成乙醇固定床工業反應器的模擬、設計和操作優化。
符 號 說 明

Am——催化劑顆粒外表面面積,m2 cp——混合氣體比熱容,J·mol-1·K-1 cpc——導熱油比熱容,J·mol-1·K-1 DA,Knu——Knudsen擴散系數,m2·s-1 DA,mol——分子擴散系數,m2·s-1 DA,pore——孔擴散系數,m2·s-1 Deff,A——氣體反應物A在固相的有效擴散系數,m2·s-1 dpore——顆粒平均孔徑,m

ds——顆粒當量直徑,m E——活化能,J·mol-1 F——混合氣體流量,kg·m-2·s-1 Fc——導熱油流量,kg·m-2·s-1 H——反應熱,J·mol-1 K——管程傳熱系數,J·m-2·K-1·s-1 k——反應速率常數,Pa-1·s-1 k0——指前因子,Pa-1·s-1 l——床層位置,m M——組分相對分子質量 p——氣體總壓,Pa pci——組分i的臨界壓力,Pa pcm——虛擬臨界壓力,Pa pEA——EA的分壓,Pa R——氣體常數,J·mol-1·K-1 Rem——Reynolds數 S——反應管內截面積,m2

T——溫度,K Tc——導熱油溫度,K Tci——組分i的臨界溫度,K Tcm——虛擬臨界溫度,K t——反應時間,s um——混合氣體質量流速,kg·m-2·s-1 V——分子擴散體積 yi——組分i的摩爾分數 α——H2的反應級數 β——EA的反應級數 εB——床層孔隙率 εp——催化劑顆粒孔隙率 η——內擴散效率因子 ρB——催化劑床層密度,kg·m-3 ρg——混合氣體密度,kg·m-3 τp——曲節因子 ——Thiele模數
References
[1] Li Fang, Zhang Ke, Ma Hongfang, Zhang Haitao, Ying Weiyong, Fang Dingye. Thermodynamic analysis of different routes of ethanol synthesis [J]., 2013, 30 (3): 256-260
[2] Sun Lujing (孫陸晶). Alcohol fuel industry prospect [J].(化學工業), 2011, 29 (1): 8-12
[3] Wang Peng (王鵬),Wang Xiangui (王憲貴),Guo Zhanying (郭戰英). Research progress in producer gas to ethanol technology [J].(潔凈煤技術), 2010, 16 (1): 55-58
[4] Phillips J, Clausen E, Gaddy J. Biological production of ethanol from coal synthesis gas [J]., 1993, 40 (1): 559-571
[5] Johnston V, Chapman J, Chen L. Ethanol production from acetic acid utilizing a cobalt catalyst [P]: US, 7608744. 2009
[6] Wollrab R, Johnston V, Warner R. Process for producing ethanol by hydrogenation of acetic acid [P]: WO, 2011140468. 2011
[7] Johnston V, Kimmich B, Waal J. Ethanol production from acetic acid utilizing a molybdenum carbide catalyst [P]: US, 8350098. 2013
[8] Hu Yurong (胡玉容), Wang Ke (王科), Li Yang (李揚), Fan Xin (范鑫), Yuan Xiaojin (袁小金), Xu Hongyun (許紅云). Simulation of synthesizing ethanol by hydrogenation of ethyl acetate [J].(化學工程師), 2011 (9): 25-27
[9] Yang Jie (楊潔), Ding Mingzhu (丁明珠), Li Bingzhi (李炳志), Yuan Yingjin (元英進). Phospholipidome alterations ofin bioethanol fermentation process [J].(化工學報), 2012, 63 (6):1830-1835
[10] Wang Biao (王彪), Wang Xiting (王熙庭), Xu Guohui (徐國輝). Advances in technologies for hydrogenation of acetic acid and acetates to ethanol [J].(天然氣化工), 2013, 38 (3): 79-83
[11] Song Qingfeng (宋慶鋒),Zhang Yong (張勇),Zeng Qinghu (曾清湖). Techno-economic analysis of production process of syngas to ethanol [J].(工業催化), 2013, 21 (6): 17-21
[12] Yang Yong (楊勇), Wang Yangdong (王仰東), Liu Su (劉蘇). Mo-Co-K sulfide-based catalysts promoted by rare earth salts for selective synthesis of ethanol and mixed alcohols from syngas [J].(催化學報), 2007, 28 (12): 1028 -1030
[13] Pan Hui (潘慧), Bai Fenghua (白鳳華), Su Haiquan (蘇海泉). Research progress of Rh-based catalyst for conversion of syngas to ethanol [J].(化工進展), 2010, 29 (2): 157-161
[14] Xia Xinyu (夏新宇), Zhang Wenzheng (張文正). A kinetic study on closed-system petroleum generation simulations under constant temperature and its significance [J].(石油勘探與開發), 2000, 27 (5): 22-26
[15] Roger F, Sven L. Solving mathematical programs with complementarity constraints as nonlinear programs [J]., 2004, 19 (1): 15-40
[16] Yu Xiaofang (于小芳), Cheng Shuang (程雙), Sun Fan (孫帆), Zhang Xinping (張新平), Zhang Chunlei (張春雷), Tang Yi (唐頤). The macro-kinetics of ethyl acetate hydrogenation to ethanol [J].:(復旦學報:自然科學版), 2014, 53 (1):77-83
[17] Zhang Xinping (張新平), Sui Zhijun (隋志軍), Zhou Xinggui (周興貴). Modeling of coke burning off regeneration for coked propane dehydrogenation catalyst [J].(化工學報), 2009, 60 (1): 163-167
[18] Ling Zeji (凌澤濟). Mathematical simulation of synthetic reactor of ethylene oxide [J].(江蘇化工), 2005, 33 (5): 54-57
[19] Xiong Wei (熊瑋), Bi Xuegong (畢學工), Zhou Guofan (周國凡). Simulation study on gas pressure drop characteristics in the lower zone of blast furnace [J].(高校化學工程學報), 2007, 21 (2): 233-238
[20] An Chao (安超), Guo Xiao (郭肖), Zhang Yong (張勇), Li Gang (李剛), Ma Jun (馬軍). Calculation methods optimization of deviation factor for overpressure gas reservoir [J].:(重慶科技學院學報: 自然科學版), 2010, 12 (5): 92-94
Modeling of ethyl acetate hydrogenation reactor
SUN Fan1,2, CHENG Shuang1, YU Xiaofang1, ZHANG Xinping1, ZHANG Chunlei1, ZHOU Xinggui2
(Technology Research Institute of Shanghai Huayi GroupShanghaiChinaState Key Laboratory of Chemical EngineeringEast China University of Science and TechnologyShanghaiChina
A kinetic model of synthesizing ethanol by hydrogenation of ethyl acetate was developed based on laboratory data, and then corrected by taking into consideration the pore diffusion effect. With the correction, the results could conform with actual operation. Based on the principles of material balance, energy balance, momentum balance and kinetics of the reactions, an one-dimensional pseudo-homogeneous model of the ethanol synthesis reactor by hydrogenation of ethyl acetate using fixed bed was established. The simulation results of a variety of conditions were obtained by the model with different H2/EA molar ratios, different temperatures and different pressures. The model could reflect the performance of the hydrogenation reactor and provide guidance for the design and operation optimization of industrial reactor.
ethyl acetate; fixed bed; reactor; ethanol; kinetics; one-dimensional pseudo-homogeneous
2014-08-11.
10.11949/j.issn.0438-1157.20141217
TQ 021.8
A
0438—1157(2015)02—0561—06
2014-08-11收到初稿,2014-09-30收到修改稿。
聯系人:張春雷,周興貴。第一作者:孫帆(1985—),男,博士。
Prof.ZHANG Chunlei, clzhang@shhuayitec.com; Prof. ZHOU Xinggui, xgzhou@ecust.edu.cn

