鄧恩桉不同成熟度組織中rboh基因表達分析
彭麗君,溫小芳,黃真池
(1. 嶺南師范學院生命科學與技術學院,廣東湛江524048;2. 嶺南師范學院應用生物技術研究所,廣東 湛江524048;3. 嶺南師范學院資源植物工程中心,廣東 湛江524048)
鄧恩桉(Eucalyptus dunnii Maiden)是桉樹屬-雙蒴蓋亞屬(subgenus symphyomyrtus)-藍桉組(section Maidenaria)-多枝桉系(series Vim inales)中的速生樹種之一[1],其木材是良好的紙漿材來源。鄧恩桉幼樹相對其他樹種比較耐寒[2],因此是培養耐寒桉樹的優選品種。在我國較冷地區推廣鄧恩桉,不僅有巨大的經濟價值,還能為綠化、增施防護林、增加木材產量等作出貢獻。
rboh 基因的表達產物為NADPH 氧化酶,又稱呼吸爆發氧化酶同源蛋白(respiratory burst oxidase homolog,rboh),是一類以細胞質中的NADPH 為電子供體,將氧催化生成活性氧(reactive oxygen species,ROS)的氧化酶[3]。植物在正常生理代謝過程中會產生活性氧,這些活性氧一方面可能會對植物自身造成氧化傷害[4],另一方面也可能作為信號分子參與細胞周期調控、程序性死亡、激素信號、生物和非生物脅迫反應及生長發育等生命活動的調節[5-7]。已有試驗表明,rboh 基因在擬南芥[8]、煙草[9-10]、馬鈴薯[11]、水稻[12]及玉米[13]的抗病、抗水分等抗脅迫反應中發揮了重要功能。在桉樹中,rboh 基因的表達活性與冷脅迫及抗寒機制有著密切聯系[14]。研究檢測了鄧恩桉不同成熟度組織rboh 基因的表達量,探討了其與鄧恩桉生長分化的聯系,以期為培育耐寒桉樹提供參考。
1 材料與方法
1.1 供試材料
半年生鄧恩桉樹苗(Eucalyptus dunnii Maiden),由湖南森林植物園提供。
1.2 材料的培養與處理
剪取鄧恩桉嫩莖,先用清水沖洗表面灰塵,再用75%酒精表面消毒45 s,然后用20%次氯酸鈉消毒兩次,每次7 m in,最后用無菌水淋洗干凈。將嫩莖切成1 cm 左右的莖段,接種到添加了0.86 μmol/L N-苯基-N- 噻唑基脲(PBU) 和0.57 μmol/L 吲哚乙酸(IAA)的SPCa 培養基中。先暗處培養2 周,再轉移至16 h 光照/8 h 黑暗、50 μmol/m2·s 光強、25±2℃培養箱中繼續培養4 周。
1.3 PCR 分析
1.3.1 總RNA 的提取和反轉錄 用手術刀分別取20 mg 鄧恩桉的成熟葉、不定芽和嫩莖于研缽中研磨。先用1 m l RNAiso-mater for Plant Tissue 處理,再按RNAiso Plua 試劑的操作手冊提取總RNA,溶于30 μL RNAase-free H2O。在10 μL 反應體系中分別加入5×gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL 和總RNA 1 μg,用RNAase-free H2O 補齊至10 μL 后瞬間離心混勻,30℃反應5 min 以去除總RNA 中殘存的基因組DNA。再在上述反應體系中依次加入5×PrimeScript Buffer 4 μL、PrimeScript RT Enzyme M ix I 1 μL、RT Prime M ix 1 μL 和RNAase-free H2O 4 μL,瞬間離心混勻,37℃反應15 m in,85℃5 S 使酶失活,所得產物為cDNA。上述所用試劑均為寶生生物工程(大連)有限公司產品。
1.3.2 目的基因選擇及引物設計 根據ThePeroxiBase數據庫中巨桉過氧化物酶基因的序列,用primer3 plus軟件設計qPCR 引物。經qPCR 預試驗篩選出3個擴增效率高、特異性好的rboh 基因作為目的基因。根據黃真池等[15]的研究,選擇RTEF 基因作為內參基因。目的基因編號、引物序列及內參基因引物序列見表1。
表1 3種NADPH 氧化酶基因的編號和引物序列及內參基因的引物序列
1.3.3 qPCR 分析rboh 基因 qPCR 反應儀器為Chromo 4TMSystem(Bio-Rad)。以cDNA 溶液進行qPCR。25 μL 反應體系中,添加2 μL cDNA 溶液作模板,每個反應3 次重復。qPCR 程序為:變性94℃9 s,退火58℃9 s,延伸72℃15 s。40個循環后,分析PCR產物的特異性。用Opticon Monitor 3.1 軟件分析各基因的擴增效率、Ct 值。設嫩莖的基因表達量為1,用相對定量的Pfaff1 方法計算各基因的相對表達值。
2 結果與分析
2.1 不定芽的誘導
嫩莖切段接種在SPCa 培養基中,15 d 后不定芽直接從芽原基處長出,呈淺綠色(圖1)。50 d 后,不定芽變得較為粗壯,苗莖伸展,葉子大而舒展。

圖1 鄧恩桉萌發的不定芽
2.2 總RNA 的提取
桉樹組織中多糖、酚類等物質含量豐富,嚴重干擾了RNA 的提取。經RNAiso-mate for Plant Tissue 預處理,再用RNAiso Plus 抽提,均可從鄧恩桉不定芽、嫩莖和成熟葉中提取出高質量的RNA。經NanoDrop 2000c 紫外分光光度法檢測,樣品OD260/OD280為1.9~2.05。瓊脂糖凝膠電泳結果顯示,總RNA 條帶清楚、完整,無明顯降解,且無可見的DNA 污染(圖2)。
2.3 rboh 基因和內參基因的擴增特異性分析
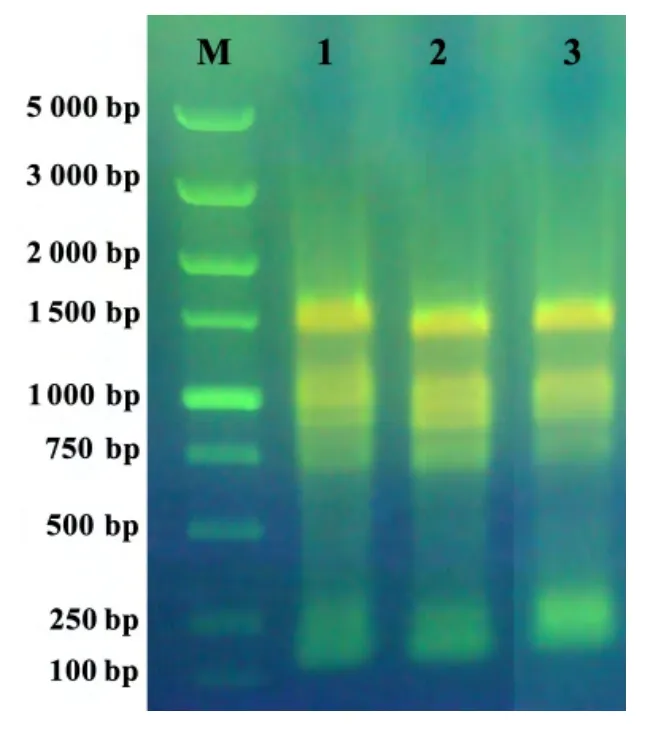
圖2 3種鄧恩桉組織總RNA 的瓊脂糖凝膠電泳結果
由圖3 可知,rboh 基因和內參基因的融鏈曲線均只有1個特征峰值,RTEF、rboh2、rboh3 和rboh4 基因的融鏈溫度分別為82、86、85、82℃,說明qPCR 擴增特異性好。
圖3 rboh 基因和RTEF 基因qPCR 融鏈溫度
2.4 rboh 基因表達
設嫩莖的基因表達量為1,qPCR 檢測得到了鄧恩桉3種不同成熟度組織中rboh2、rboh3 和rboh4 的相對定量表達結果(圖4)。這3個基因在成熟葉組織中的表達量最高,嫩莖次之,不定芽的表達量最低。其中成熟葉中的rboh2 基因的表達量約為不定芽中的5倍,成熟葉中rboh4 基因的表達量約為不定芽中的3倍。3個rboh 基因在不同成熟度組織中的轉錄水平由強到弱依次為成熟葉>嫩莖>不定芽。

圖4 鄧恩桉不定芽和成熟葉相對于嫩莖中的rboh 基因轉錄水平
3 結論與討論
活性氧作為植物的代謝中間產物,不僅影響植物各器官(根、莖、葉、花、果實、種子)的生長發育[16],并且與其他信號分子如水楊酸[17-20]、NO[17,21]等共同調節植物的各種生理活動。實驗證明,NADPH 氧化酶是植物細胞活性氧產生的主要酶類之一[22-27],即rboh 基因是調節植物各種生理活動的關鍵基因。影響rboh 基因表達的因素有很多,水分脅迫、重金屬脅迫、鹽脅迫、高低溫脅迫等都能影響和調節rboh 基因的表達和ROS 的積累[28]。試驗表明,在適宜的生長條件下,隨著植物生長發育程度的不同,rboh 基因的表達量也會有所差異,即鄧恩桉rboh 基因的表達受組織分化程度的影響。
桉樹的抗寒機制相當復雜,不僅受過氧化物的影響,還受原生質膜透性、膜脂成分、保護酶以及可溶性物質等的影響[29]。rboh 基因在鄧恩桉抗寒代謝中是如何起作用的,其是否對鄧恩桉抗寒代謝起關鍵作用,這些問題有待于進一步開展遺傳轉化方面的研究。
[1]林 彥.鄧恩桉組培快繁體系的建立及應用[D].北京:中國林業科學研究院,2004.
[2]林成立.鄧恩桉扦插繁殖試驗[J].福建林業科技,2005,32(2):80-84.
[3]林 凡.玉米(Zeamays L.)NADPH氧化酶基因克隆、表達特性及功能研究[D].南京:南京農業大學,2008.
[4]Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annual Review of Plant Biology,2004,55:373-399.
[5]Mittler R,Vanderauwera S,Gollery M,et al.Reactive oxygen gene network of plants[J].Trends in Plant Science,2004,9:490-498.
[6]Foyer C H,Noctor G.Redox sensing and signalling associated with reactive oxygen in chloroplasts,peroxisomes and mitochondria[J].PhysiolPlant,2003,119:355-364.
[7]Fujita M,Fujita Y,Noutoshi Y,et al.Crosstalk between abiotic and biotic stress responses:a current view from the points of convergence in the stress signaling networks[J].CurrentOpinion in Plant Biology,2006,9:436-442.
[8]Kwak JM,Mori I C,Pei Z M,et al.NADPH oxidase AtrbohD and AtrbohF genes function in ROS-dependent ABA signaling in Arabidopsis[J].The EMBO Journal,2003,22(11):2623-2633.
[9]Simon-Plas F,Elmayan T,Blein JP.The plasma membrane oxidase NtrbohD is responsible for AOS production in elicited tobacco cells[J].Plant Journal,2002,31(2):137-147.
[10]Yoshioka H,Numata N,Nakajima K,et al.Nicotiana benthamiana gp91phox homologs NbrbohA and NbrbohB participate in H2O2accumulation and resistance toPhytophthora infestans[J].Plant Cell,2003,15(3):706-718.
[11]KobayashiM,KawakitaK,MaeshimaM,etal.Subcellular localization of Strboh proteinsand NADPH-dependentO2-generatingactivity in potato tuber tissues[J].Journal of Experimental Botany,2006,57(6):1373-1379.
[12]Yoshie Y,Goto K,Takai R,et al.Function of the rice gp91phox hom-ologs OsrbohA and OsrbohE genes in ROS-dependent plant immune responses[J].PlantBiotechnol,2005,22(2):127-135.
[13]趙 宇,蔣明義,張阿英,等.水分脅迫誘導玉米Zmrboh基因表達及ABA在其中的作用[J].南京農業大學學報,2008,3(13):26-30.
[14]劉 建,項東云,周 堅.桉樹抗寒生理及分子機理研究進展[J].西南林學院學報,2006,26(5):81-85.
[15]黃真池,歐陽樂軍,張 龍,等.桉屬植物內參基因的篩選及評估[J].西北農林科技大學學報,2013,41(10):67-72.
[16]林植芳,劉 楠.活性氧調控植物生長發育的研究進展[J].植物學報,2012,47(1):74-86.
[17]田 敏,饒龍兵,李紀元.植物細胞中的活性氧及其生理作用[J].植物生理學通訊,2005,41(2):235-240.
[18]Dat JF,Foyer CH,Scott IM.Changes in salilylic acid and antioxidants during Induced thermo to lerance inmustard seedlings[J].PlantPhysiol,1998,118:1455-1461.
[19]Dat JF,Lopez-Delgado H,Foyer C H,et al.Parallel changes in H2O2and catalase during thermo to lerance induced by salicylic acid or heat acclimationmustard seedlings[J].PlantPhysiol,1998,116:1351-1357.
[20]Van Camp W,Van Montagu M,Inze D.H2O2 and NO:redox signals in disease resistance[J].Trends in PlantScience,1998,3:330-334.
[21]BeligniM V,Lamattina L.Nitric oxidestimulatesseed ger-mination and de-etiolation,and inhibits hypocotyl elongation,three light-inducible responses in plants[J].Planta,2000,210:215-221.
[22]蔡以瀅,陳 珈.植物防御反應中活性氧的產生和作用[J].生物學通報,1991,16(2):107-112.
[23]LAMBC,DixonRA.Theoxidativeburstin theplantdiseaseresistance[J].Annual Review of Plant physiology and Plant Molecular Biology,1997,48(1):251-275.
[24]Sagi M,Fluhr R.Superoxide production by plant homologue of the gp91phox NADPH oxidase.Modulation of activity by calcium and by tobaccomosaicvirusinfection[J].PlantPhysiol,2001,126(3):1281-1290.
[25]Zhao ZG,Chen G C,Zhang C L.Interaction between reactivee oxygen species and nitric oxide in drought-induced absciisic acid synthesis in root tips ofWheat seedings[J].Australian Journal or Plant Physiology,2001,28(10):1055-1061.
[26]Song C J,Steinebrunner I,Wang X Z,et al.Extracellular ATP induces the accumulation of superoxide via NADPH oxidases in Arabidop sis thaliana[J].PlantPhysiol,2006:105.
[27]宮海軍,陳坤明,陳國倉,等.春小麥葉片質膜氧化還原系統及其對緩慢干旱脅迫的響應[J].西北植物學報,2003,23(2):229-234.
[28]Fry S C.Oxidation scission of plant cell wall polysaccharides by ascorbateinduced hydroxyl radicals[J].Biochem Journal,1998,332:507-515.
[29]趙娟娟,洪 偉.我國桉樹抗寒性研究進展[J].福建林學院學報,2005,25(3):284-288.

