濕式催化過氧化氫氧化技術(shù)綜述
羅磊,代成義,張安峰,宋春山,郭新聞
(1 大連理工大學(xué)化工學(xué)院,遼寧 大連 116024;2 賓夕法尼亞州立大學(xué),美國(guó) 賓夕法尼亞州 16802)
引 言
水是人類及一切生物賴以生存的基礎(chǔ),是生產(chǎn)、生活不可替代的寶貴資源。近年來,隨著經(jīng)濟(jì)的發(fā)展和人口的膨脹,工業(yè)用水和生活用水快速增長(zhǎng),廢水的大量排放給水體安全帶來了重大影響。減少污水排放、治理污染廢水迫在眉睫。
目前,對(duì)廢水中有機(jī)物進(jìn)行氧化降解的方法眾多,包括物理法、生化法、化學(xué)法等。采用傳統(tǒng)的物理法不能有效去除污染物,而生化法對(duì)污染物種類的依耐性強(qiáng),使用范圍較窄。高級(jí)氧化技術(shù)(AOPs)作為新型廢水處理技術(shù),可直接礦化或提高有機(jī)污染物的可生化性,具有很好的應(yīng)用前景。
高級(jí)氧化技術(shù)是利用化學(xué)反應(yīng)過程中產(chǎn)生的氧化能力極強(qiáng)的羥基自由基(·OH)使大分子難降解有機(jī)物氧化為低毒或無毒的小分子,甚至直接礦化為水和二氧化碳。根據(jù)產(chǎn)生自由基的方式不同,可將其分為臭氧氧化技術(shù)、濕式氧化技術(shù)、催化過氧化氫氧化技術(shù)、超臨界水氧化技術(shù)、光催化氧化技術(shù)及多種技術(shù)的聯(lián)用等。濕式催化過氧化氫氧化技術(shù)(CWPO)是高級(jí)氧化技術(shù)中的一種,以過氧化氫為氧化劑,在不加外能輔助設(shè)備的條件下,通過加入催化劑促進(jìn)過氧化氫分解生成具有更強(qiáng)氧化性的羥基自由基從而氧化降解有機(jī)物。1894年,英國(guó)科學(xué)家Fenton[1]發(fā)現(xiàn)采用Fe2+/H2O2體系能氧化多種有機(jī)物,后人為紀(jì)念他將Fe2+/H2O2稱為Fenton試劑。1964年,Eisenhauer[2]首次將Fenton 試劑應(yīng)用于處理苯酚和烷基苯廢水,并取得了良好的效果。但是傳統(tǒng)均相Fenton 催化體系需要在pH=2~4 才能保證活性,因此進(jìn)出口水需要調(diào)節(jié)pH,導(dǎo)致大量污泥的產(chǎn)生,造成二次污染。Fajerwerg[3]于1996年首次將FeZSM-5 用于多相Fenton 體系,拓展了Fenton試劑pH 適用范圍。因此,如何保證多相Fenton 體系近中性條件下的催化活性逐漸成為研究的熱點(diǎn)。
1 濕式催化過氧化氫氧化技術(shù)原理
關(guān)于Fenton 試劑具有強(qiáng)氧化性有兩種解釋:一種是1934年Haber 等[4]首次提出的自由基機(jī)理,另一種是Bray 等[5]首先提出的高價(jià)鐵氧中間體機(jī)理。兩種解釋的區(qū)別在于具有強(qiáng)氧化性的活性物種,前者認(rèn)為活性物種是羥基自由基(·OH),而后者則認(rèn)為具有強(qiáng)氧化性的是 FeO2+和 FeO3+,而不是·OH[6]。到目前為止,還沒有明確的實(shí)驗(yàn)?zāi)軌騾^(qū)分這兩種機(jī)理,關(guān)于這兩種機(jī)理的爭(zhēng)論仍在繼續(xù)。
1.1 Fenton 反應(yīng)機(jī)理
羥基自由基機(jī)理是目前文獻(xiàn)中報(bào)道較多的Fenton 反應(yīng)機(jī)理。均相體系中,由Fe2+引發(fā)的鏈反應(yīng)產(chǎn)生·OH,見表1。氧化還原電對(duì)Fe3+/Fe2+的氧化還原電勢(shì)為0.77 eV,因此Fe2+→Fe3+的轉(zhuǎn)化在熱力學(xué)上是自發(fā)進(jìn)行的,而Fe3+→Fe2+的轉(zhuǎn)化需要耗費(fèi)能量,這一過程是Fenton 反應(yīng)的速率控制步驟。要提高 Fenton 試劑的活性,關(guān)鍵在于降低Fe3+→Fe2+轉(zhuǎn)化過程的能壘,促進(jìn)Fe2+的生成。
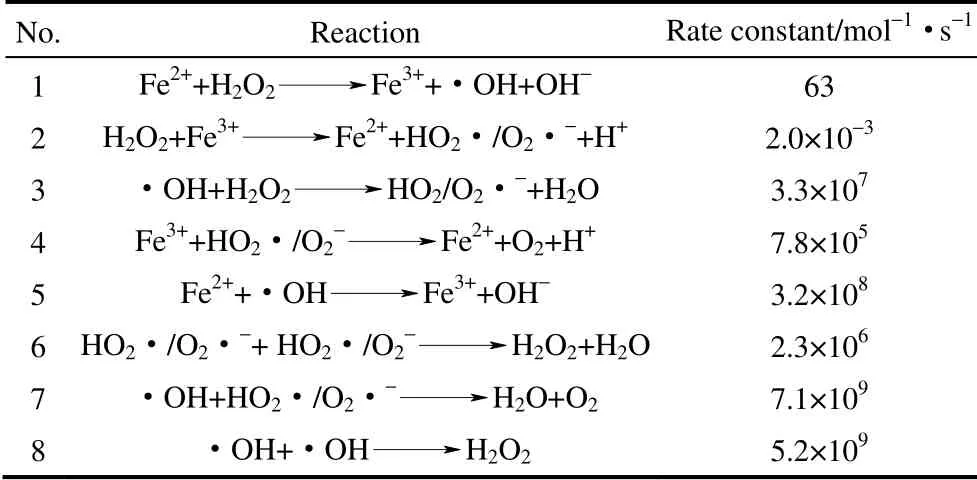
表1 Fe2+引發(fā)的鏈反應(yīng)[7]Table 1 Chain reaction initiated by Fe2+[7]
對(duì)多相Fenton 反應(yīng)而言,多相界面的存在,使得多相Fenton 催化氧化機(jī)理比均相Fenton 反應(yīng)機(jī)理更加復(fù)雜。多相Fenton 催化劑組成、晶型、粒徑大小、固液微界面的性質(zhì)、表面形態(tài),以及反應(yīng)溶液的pH、溶劑性質(zhì)等諸多因素都會(huì)影響到Fenton催化劑的催化性能。在均相溶液中,H2O2主要與溶液中的金屬離子發(fā)生鏈反應(yīng),而在多相Fenton 催化體系中,除了H2O2與溶出金屬離子的反應(yīng)外,還存在界面反應(yīng)。一個(gè)性能優(yōu)異的多相Fenton 催化劑,應(yīng)該盡可能地發(fā)揮多相催化的作用,應(yīng)該保持高活性、高穩(wěn)定性,即不僅催化去除污染物的效率高,而且具有盡可能低的金屬離子溶出率和較好的重復(fù)使用性能。因此,高效穩(wěn)定的多相Fenton 催化劑催化體系中,H2O2與催化劑之間的界面催化反應(yīng)機(jī)制占據(jù)主要地位。諸多研究表明[8-12],H2O2在多相催化劑界面的分解主要有兩種機(jī)制:氧空位機(jī)制和自由基機(jī)制。Lee[13]通過研究H2O2在Ln1-xAxMnO3(Ln=La 或Nd,A=K 或Sr)上的分解機(jī)制,提出了氧空位機(jī)制,即表面氧空位與H2O2作用形成吸附氧,吸附氧脫附形成氧氣(O2),反應(yīng)式為
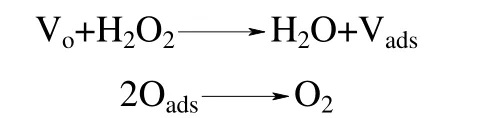
H2O2通過氧空位機(jī)制分解的產(chǎn)物是氧氣,是無效分解步驟。要提高H2O2的有效利用率,需要經(jīng)過自由基機(jī)制產(chǎn)生具有強(qiáng)氧化性的·OH。因此,高效的多相Fenton 催化劑要獲得對(duì)H2O2的有效分解必定遵循自由基機(jī)制,其催化機(jī)制主要是通過催化劑表面的氧化還原反應(yīng)驅(qū)動(dòng)界面電子遷移,誘發(fā)H2O2分解形成羥基自由基(·OH)、超氧自由基(O2·-)等多種活性氧物種,這些活性氧物種的協(xié)同作用會(huì)產(chǎn)生強(qiáng)大無選擇性的氧化能力,對(duì)水體中難降解有機(jī)污染物實(shí)現(xiàn)高效無機(jī)礦化。H2O2在含過渡金屬或金屬氧化物的催化劑表面分解的自由基機(jī)制可以簡(jiǎn)單地表示如下
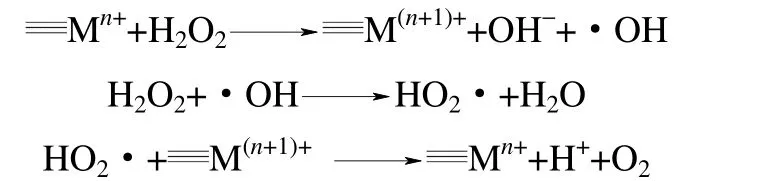
依據(jù)多相Fenton 催化體系H2O2分解的自由基反應(yīng)機(jī)制,界面電子遷移循環(huán)的速率是反應(yīng)的關(guān)鍵。諸多研究[14-19]通過不同氧化還原電對(duì)之間的電子轉(zhuǎn)移來活化H2O2產(chǎn)生。因此,通過構(gòu)筑不同的氧化還原電對(duì),對(duì)催化劑表面結(jié)構(gòu)特性進(jìn)行調(diào)控,強(qiáng)化界面電子轉(zhuǎn)移速率,可以提高Fenton 催化系統(tǒng)的催化效率。
1.2 羥基自由基的性質(zhì)
Fenton 反應(yīng)通過·OH 對(duì)有機(jī)污染物進(jìn)行降解,因此研究·OH 的性質(zhì)對(duì)研究Fenton 試劑具有重要意義。羥基自由基具有如下重要特性:①具有極強(qiáng)的氧化性,其氧化性僅次于F2(表2)[20],能從富含電子的有機(jī)物或其他介質(zhì)中奪取一個(gè)電子而形成OH-。·OH 的氧化能力隨pH 的變化而變化,在pH=3和pH=14 時(shí),其氧化能力分別為2.8 V 和1.9 V[21]。同時(shí),由于氫氧鍵(O—H)鍵能通常大于碳?xì)滏I(C—H),因此·OH 能夠破壞碳?xì)浠衔锏奶細(xì)滏I并從中奪取一個(gè)氫原子。·OH 的高氧化性及氫氧鍵的強(qiáng)鍵能保證了·OH 能夠輕易地攻擊任何有機(jī)物[20]。②H2O2作為氧化劑不產(chǎn)生二次污染。過氧化氫本身是一種環(huán)境友好型試劑,其分解產(chǎn)物為水和氧氣,不會(huì)造成二次污染。
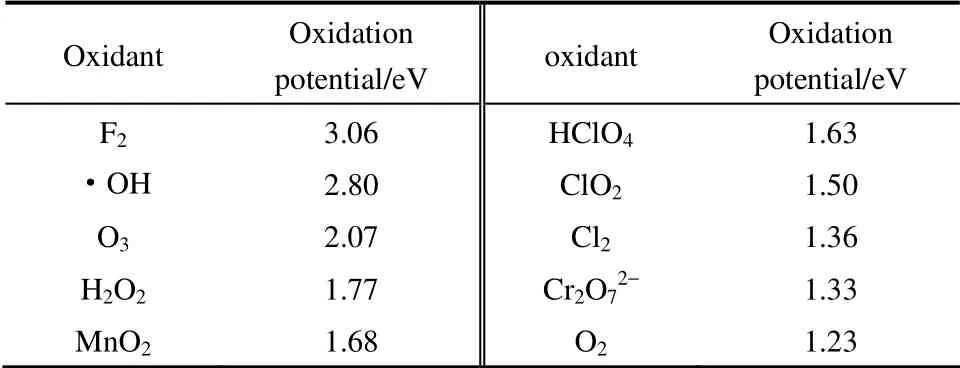
表2 常見氧化劑的標(biāo)準(zhǔn)電極電位[20]Table 2 Standard electrode potential for common oxidants[20]
2 濕式催化過氧化氫氧化催化劑的研究現(xiàn)狀
影響Fenton 催化劑活性的因素包括溫度、pH、H2O2加入量、催化劑、反應(yīng)時(shí)間、廢水性質(zhì)。而催化劑的研發(fā)是催化過氧化氫氧化技術(shù)的關(guān)鍵。在Fenton 反應(yīng)中應(yīng)用最多的是Fe[22]、Cu[23]、Ni[24]、Co[25]、Mn[26]和Cr[27]6 種元素,它們既可以作為活性組分單獨(dú)使用,也可以與多種金屬共同起催化作用;同時(shí),金屬存在形式多樣,既可以使用金屬氧化物直接催化,也可以擔(dān)載在不同的載體上起催化作用。目前,多相Fenton 催化劑存在的問題主要是催化劑的活性和穩(wěn)定性問題。
2.1 Fenton 催化劑活性的提升
影響Fenton 催化劑活性的主要原因在于鐵物種循環(huán)過程中Fe2+的生成。
2.1.1 過渡金屬 過渡金屬如零價(jià)鐵(Fe0)在酸性條件下與H2O2反應(yīng)生成Fe2+并促進(jìn)Fe2+再生。Segura 等[28]研究了Fe0/H2O2體系對(duì)苯酚的降解活性,認(rèn)為Fe0/H2O2體系優(yōu)于經(jīng)典的Fenton 體系。Chu 等[29]利用Fe0/H2O2體系處理焦化廢水,在pH<6.5,H2O2濃度0.3 mol·L-1的條件下,反應(yīng)1 h,COD 去除率可達(dá)到44%~50%。Bokare 等[30]在研究Al0/O2體系降解有機(jī)污染物如4-氯酚、苯酚、硝基苯和二氯乙酸等時(shí)發(fā)現(xiàn)Al0轉(zhuǎn)移電子到O2導(dǎo)致H2O2的形成,H2O2從Al0得到電子形成·OH,也能夠降解有機(jī)物。此外,Au0[12]在濕式催化過氧化氫氧化降解有機(jī)污染物如苯酚也顯示出較高的催化活性。
2.1.2 鐵氧化物及其他金屬?gòu)?fù)合氧化物 過渡金屬氧化物也可以作為多相Fenton 催化劑催化H2O2分解產(chǎn)生·OH。單純的金屬氧化物作為催化劑時(shí),由于反應(yīng)僅在固液界面發(fā)生,所以提高催化劑活性除了考慮Fe 物種的循環(huán)外,還需要考慮Fe 物種的分散狀態(tài),增大其比表面積以促進(jìn)活性位的暴露。Zhu等[31]、Hou 等[32]使用多孔磁鐵礦降解二甲酚橙、苯酚,發(fā)現(xiàn)多孔結(jié)構(gòu)能夠有效提高催化活性。Luo 等[33]通過PEI修飾的介孔ZSM-5 作為載體成功制備了負(fù)載型高分散Fe3O4,并用于氧化降解苯酚,結(jié)果表明,將金屬活性組分納米化對(duì)提高Fenton 反應(yīng)活性具有積極影響。Zboril 等[34]對(duì)不同結(jié)晶度和比表面積的α-Fe2O3的多相Fenton 體系進(jìn)行了研究,發(fā)現(xiàn)結(jié)晶度對(duì)Fenton 反應(yīng)催化活性影響較大。
為了提高金屬氧化物的Fenton 反應(yīng)活性,除了調(diào)控金屬氧化物比表面積和相對(duì)結(jié)晶度外,許多研究通過摻雜其他過渡金屬陽離子或通過H2熱還原等方式對(duì)鐵氧化物進(jìn)行修飾。Costa 等[8,35]通過H2程序升溫還原制備了對(duì)亞甲基藍(lán)具有高催化活性的Fe0/Fe3O4復(fù)合物(圖1),并且在2 h 內(nèi)COD 去除率即能達(dá)到75%。與單純Fe0或鐵氧化物相比,不同價(jià)態(tài)金屬或金屬氧化物的復(fù)合物能夠明顯提高Fenton 反應(yīng)活性。但是在還原氣氛中制備的復(fù)合氧化物性能活潑,在空氣中不能穩(wěn)定存在,容易被氧化失活。而通過向鐵氧化物中摻雜其他過渡金屬元素得到的復(fù)合物往往具有更好的穩(wěn)定性。同時(shí),利用不同金屬對(duì)(Cu2+/Cu+, Co3+/Co2+, Mn3+/Mn2+, Cr3+/Cr2+等)氧化還原電勢(shì)的差異,調(diào)控Fe3+→Fe2+的催化循環(huán),能夠提高Fenton 反應(yīng)活性。Wang等[18]、Luo 等[15]通過使用FeCu 雙金屬作為活性組分催化Fenton 反應(yīng),結(jié)果表明,雙金屬催化劑的活性明顯優(yōu)于單組分Fe 或Cu 催化劑。其主要原因是氧化還原電對(duì)Cu2+/Cu+的引入,使Fe3+→Fe2+的轉(zhuǎn)化途徑轉(zhuǎn)化為Fe3++Cu+→Fe2++Cu2+,氧化還原電勢(shì)由0.77 eV 降低為0.60 eV,從而提高了催化活性。Liu 等[17]通過浸漬法制備了Fe-Ce/Al2O3,并用于氧化降解間苯酚,結(jié)果表明,Ce 負(fù)載量為2.0%時(shí)催化活性最好,Ce 的加入能夠增加催化劑表面非晶格氧的含量,進(jìn)而提高催化劑的催化活性。
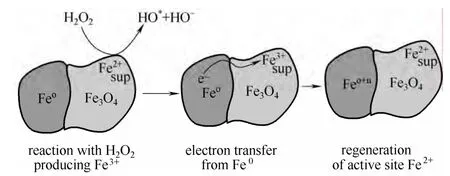
圖1 Fe0 將電子傳輸給Fe3+再生Fe2+的示意圖Fig.1 Schematic representation of electron transfer from Fe0 to Fe3+ magnetite to regenerate Fe2+
2.1.3 其他金屬氧化物 除了含鐵氧化物對(duì)多相Fenton 反應(yīng)具有催化活性外,國(guó)內(nèi)外研究者還成功研制了不含鐵的氧化物,并將其用于多相Fenton 反應(yīng)體系。Yang 等[36]、Rhadfi 等[37]通過比較不同錳氧化物在亞甲基藍(lán)催化降解中的活性,發(fā)現(xiàn)β-MnO2和納米化的Mn3O4均具有較高的催化活性。Zhan等[38-39]、Chen 等[19]使用含銅催化劑對(duì)偶氮染料和亞甲基藍(lán)進(jìn)行脫色處理,發(fā)現(xiàn)含銅催化劑是具有Fenton 反應(yīng)活性的,但催化劑的流失是含銅催化劑的重要缺陷。除此之外,Ce[17,40]、Ni[41]、Co[41]、Cr[16]等也具有Fenton 反應(yīng)活性。
2.2 多相Fenton 試劑的穩(wěn)定性
催化劑表面吸附、沉積和催化劑活性組分流失是造成CWPO 催化劑失活的主要原因。一般情況下,過渡金屬催化劑失活是由活性組分流失引起的。過渡金屬擔(dān)載在載體上時(shí)容易造成催化劑的流失,而添加少量的催化劑助劑有助于改善催化劑的晶體結(jié)構(gòu)及表面性質(zhì),可以抑制過渡金屬的流失,提高催化劑的活性和穩(wěn)定性[42]。
對(duì)于金屬的流失問題,主要來源于有機(jī)物降解過程中產(chǎn)生的無機(jī)酸中間物種,使得反應(yīng)體系的pH降低,從而刻蝕金屬顆粒,導(dǎo)致金屬離子的流失。因此,要減少Fenton 試劑金屬流失,既可以提高催化劑的耐酸性,也可以促進(jìn)產(chǎn)物擴(kuò)散,減少酸性中間物種與催化劑的直接接觸。利用有序介孔材料SBA-15 孔道的限域作用,控制生長(zhǎng)高分散雙金屬Fe-Cu[18,43]、Pd-Fe[14]等催化劑顆粒,并嵌在SBA-15壁上,不僅能夠提高金屬分散度,同時(shí)金屬流失得到抑制。對(duì)金屬進(jìn)行包覆,隔離金屬組分與反應(yīng)液,能夠明顯提高催化劑耐酸性[44]。Yan 等[45]使用浸漬法制備的FeZSM-5 在固定床上催化苯酚降解反應(yīng),結(jié)果表明,催化劑具有較好的重復(fù)使用性能和抗流失性能。除此之外,使用非金屬催化劑是解決金屬流失的重要手段之一。Fortuny 等[46]、Chang 等[47]使用活性炭和g-C3N4作催化劑降解苯酚和亞甲基藍(lán),發(fā)現(xiàn)非金屬催化劑也可以用于催化降解有機(jī)污染物。
3 結(jié) 論
濕式催化過氧化氫氧化技術(shù)作為有別于光、電、微波等輔助的Fenton 體系,具有無須外能輔助、反應(yīng)條件溫和、經(jīng)濟(jì)環(huán)保等優(yōu)點(diǎn),在印染、農(nóng)藥、醫(yī)藥等領(lǐng)域具有很好的應(yīng)用前景和極大的推廣價(jià)值。但目前,濕式催化過氧化氫氧化技術(shù)尚存在一些問題需要解決。首先,對(duì)多相Fenton 反應(yīng)的機(jī)理認(rèn)識(shí)不夠明確,尤其是高價(jià)鐵氧中間體機(jī)理,需要深入研究。其次,如何提高催化劑氧化降解能力,如何有效防止活性組分流失,提高催化劑的穩(wěn)定性和重復(fù)性,都是亟待解決的問題。
[1]Fenton.Oxidation of tartaric acid in presence of iron [J].J.Chem.Soc., 1894, 65: 899-910.
[2]Eisenhauer H R.Oxidation of phenolic wastes [J].Water Pollution Control Federation, 1964, 9(36): 1116-1128.
[3]Fajerwerg K D H.Wet oxidation of phenol by hydrogen peroxide using heterogeneous catalysis Fe-ZSM-5: a promising catalyst [J].Appl.Catal.B, 1996, 10(4): L229-L235.
[4]Haber F, Weiss J.über die katalyse des hydroperoxydes [J].Naturwissenschaften, 1932, 20(51): 948-950.
[5]Bray W C, Gorin M H.Ferrylion a compound of tetravalent iron [J].J.Am.Chem.Soc., 1932, 54(5): 2124-2125.
[6]Ensing B, Buda F, Baerends E J.Fenton-like chemistry in water oxidation catalysis by Fe(Ⅲ) and H2O2[J].J.Phys.Chem.A, 2003, 107(30): 5722-5731.
[7]Hartmann M, Kullmann S, Keller H.Wastewater treatment with heterogeneous Fenton-type catalysts based on porous materials [J].J.Mater.Chem., 2010, 20(41): 9002-9017.
[8]Costa R C C, Moura F C C, Ardisson J D, et al.Highly active heterogeneous Fenton-like systems based on Fe0/Fe3O4composites prepared by controlled reduction of iron oxides [J].Appl.Catal.B, 2008, 83(1/2): 131-139.
[9]Munoz M, de Pedro Z M, Casas J A, et al.Preparation of magnetite-based catalysts and their application in heterogeneous Fenton oxidation∶ a review [J].Appl.Catal.B, 2015, 176/177: 249-265.
[10]Satishkumar G, Landau M V, Buzaglo T, et al.Fe/SiO2heterogeneous Fenton catalyst for continuous catalytic wet peroxide oxidation prepared in-situ by grafting of iron released from LaFeO3[J].Appl.Catal.B, 2013, 138/139: 276-284.
[11]Yang X, Tian P, Zhang X, et al.The generation of hydroxyl radicals by hydrogen peroxide decomposition on FeOCl/SBA-15 catalysts for phenol degradation [J].AIChE J., 2015, 61(1): 166-176.
[12]Quintanilla A, García-Rodríguez S, Domínguez C M, et al.Supported gold nanoparticle catalysts for wet peroxide oxidation [J].Appl.Catal.B, 2012, 111/112: 81-89.
[13]Lee Y.Hydrogen peroxide decomposition over Ln1-xAxMnO3(Ln=Laor Nd and A=K or Sr) perovskites [J].Appl.Catal.A, 2001, 215(1/2): 245-256.
[14]Li X, Liu X, Xu L, et al.Highly dispersed Pd/PdO/Fe2O3nanoparticles in SBA-15 for Fenton-like processes: confinement and synergistic effects [J].Appl.Catal.B, 2015, 165: 79-86.
[15]Luo L, Dai C, Zhang A, et al.A facile strategy for enhancing FeCu bimetallic promotion for catalytic phenol oxidation [J].Catal.Sci.Technol., 2015, 5: 3159-3165.
[16]Wei G, Liang X, He Z, et al.Heterogeneous activation of oxone by substituted magnetites Fe3-xMxO4(Cr, Mn, Co, Ni) for degradation of acid orange II at neutral pH [J].J.Mol.Catal.A, 2015, 398: 86-94.
[17]Liu P, He S, Wei H, et al.Catalytic wet peroxide oxidation of m-cresol over Fe-Ce/Al2O3catalyst [J].Chem.Pap., 2015, 69(6): 827-838.
[18]Wang Y, Zhao H, Zhao G.Iron-copper bimetallic nanoparticles embedded within ordered mesoporous carbon as effective and stable heterogeneous Fenton catalyst for the degradation of organic contaminants [J].Appl.Catal.B, 2015, 164: 396-406.
[19]Chen X, Ma C, Li X, et al.Hierarchical Bi2CuO4microspheres: hydrothermal synthesis and catalytic performance in wet oxidation of methylene blue [J].Catal.Commun., 2009, 10(6): 1020-1024.
[20]Navalon S, Alvaro M, Garcia H.Heterogeneous Fenton catalysts based on clays, silicas and zeolites [J].Appl.Catal.B, 2010, 99(1/2): 1-26.
[21]Chen A, Ma X, Sun H.Decolorization of KN-R catalyzed by Fe-containing Y and ZSM-5 zeolites [J].J.Hazard.Mater., 2008, 156(1/2/3): 568-575.
[22]Wang Y, Sun H, Duan X, et al.A new magnetic nano zero-valent iron encapsulated in carbon spheres for oxidative degradation of phenol [J].Appl.Catal.B, 2015, 172/173: 73-81.
[23]Kim S, Ginsbach J W, Lee J Y, et al.Amine oxidative n-dealkylation via cupric hydroperoxide Cu-OOH homolytic cleavage followed by site-specific Fenton chemistry [J].J.Am.Chem.Soc., 2015, 137(8): 2867-2874.
[24]Civan F, ?zaltun DH, Klp?ak E, et al.The treatment of landfill leachate over Ni/Al2O3by supercritical water oxidation [J].J.Supercrit.Fluids, 2015, 100: 7-14.
[25]Costa D A S, Oliveira A A S, de Souza P P, et al.The combined effect between Co and carbon nanostructures grown on cordierite monoliths for the removal of organic contaminants from the liquid phase [J].New.J.Chem., 2015, (39): 1438-1444.
[26]Qu J, Shi L, He C, et al.Highly efficient synthesis of graphene/MnO2hybrids and their application for ultrafast oxidative decomposition of methylene blue[J].Carbon, 2014, 66: 485-492.
[27]Zhong Y, Liang X, He Z, et al.The constraints of transition metal substitutions (Ti, Cr, Mn, Co and Ni) in magnetite on its catalytic activity in heterogeneous Fenton and UV/Fenton reaction: from the perspective of hydroxyl radical generation [J].Appl.Catal.B, 2014, 150/151: 612-618.
[28]Segura Y, Martínez F, Melero J A, et al.Enhancement of the advanced Fenton process (Fe0/H2O2) by ultrasound for the mineralization of phenol [J].Appl.Catal.B, 2012, 113/114: 100-106.
[29]Chu L, Wang J, Dong J, et al.Treatment of coking wastewater by an advanced Fenton oxidation process using iron powder and hydrogen peroxide [J].Chemosphere, 2012, 86(4): 409-414.
[30]Bokare A D, Choi W.Zero-valent aluminum for oxidative degradation of aqueous organic pollutants [J].Environ.Sci.Technol., 2009, 43(18): 7130-7135.
[31]Zhu M, Diao G.Synthesis of porous Fe3O4nanospheres and its application for the catalytic degradation of xylenol orange [J].J.Phys.Chem.C, 2011, 115(39): 18923-18934.
[32]Hou L, Zhang Q, Jér?me F, et al.Shape-controlled nanostructured magnetite-type materials as highly efficient Fenton catalysts [J].Appl.Catal.B, 2014, 144: 739-749.
[33]Luo L, Dai C, Zhang A, et al.Facile synthesis of zeolite-encapsulated iron oxide nanoparticles as superior catalysts for phenol oxidation [J].RSC Adv., 2015, 5(37): 29509-29512.
[34]Hermanek M, Zboril R, Medrik I, et al.Catalytic efficiency of iron(Ⅲ) oxides in decomposition of hydrogen peroxide: competition between the surface area and crystallinity of nanoparticles [J].J.Am.Chem.Soc., 2007, 129(35): 10929-10936.
[35]Moura F, Oliveira G, Araujo M, et al.Highly reactive species formed by interface reaction between Fe0-iron oxides particles: an efficient electron transfer system for environmental applications [J].Appl.Catal.A, 2006, 307(2): 195-204.
[36]Yang Z, Zhang Y, Zhang W, et al.Nanorods of manganese oxides: synthesis, characterization and catalytic application [J].J.Solid.State.Chem., 2006, 179(3): 679-684.
[37]Rhadfi T, Piquemal J, Sicard L, et al.Polyol-made Mn3O4nanocrystals as efficient Fenton-like catalysts [J].Appl.Catal.A, 2010, 386(1/2): 132-139.
[38]Zhan Y, Li H, Chen Y.Copper hydroxyphosphate as catalyst for the wet hydrogen peroxide oxidation of azo dyes [J].J.Hazard.Mater., 2010, 180(1/2/3): 481-485.
[39]Zhan Y, Zhou X, Fu B, et al.Catalytic wet peroxide oxidation of azo dye (direct blue 15) using solvothermally synthesized copper hydroxide nitrate as catalyst [J].J.Hazard.Mater., 2011, 187(1/2/3)∶ 348-354.
[40]Chen F, Shen X, Wang Y, et al.CeO2/H2O2system catalytic oxidation mechanism study via a kinetics investigation to the degradation of acid orange 7 [J].Appl.Catal.B, 2012, 121/122: 223-229.
[41]Jablonski J.High temperature reduction with hydrogen, phase composition, and activity of cobalt/silica catalysts [J].J.Catal., 2003, 220(1)∶ 146-160.
[42]Liu Y, Sun D.Effect of CeO2doping on catalytic activity of Fe2O3/γ-Al2O3catalyst for catalytic wet peroxide oxidation of azo dyes [J].J.Hazard.Mater., 2007, 143(1/2): 448-454.
[43]Wang Y, Zhao H, Li M, et al.Magnetic ordered mesoporous copper ferrite as a heterogeneous Fenton catalyst for the degradation of imidacloprid [J].Appl.Catal.B, 2014, 147: 534-545.
[44]Lu A, Salabas E L, Schüth F.Magnetic nanoparticles: synthesis, protection, functionalization, and application [J].Angew.Chem.Int.Ed., 2007, 46(8): 1222-1244.
[45]Yan Y, Jiang S, Zhang H.Efficient catalytic wet peroxide oxidation of phenol over Fe-ZSM-5 catalyst in a fixed bed reactor [J].Sep.Purif.Technol., 2014, 133: 365-374.
[46]Fortuny A, Font J, Fabregat A.Wet air oxidation of phenol using active carbon as catalyst [J].Appl.Catal.B, 1998, 19: 166-173.
[47]Chang F, Xie Y, Li C, et al.A facile modification of g-C3N4with enhanced photocatalytic activity for degradation of methylene blue [J].Appl.Surf.Sci., 2013, 280: 967-974.

