茼蒿葉中總黃酮的提取純化及抗氧化活性分析
張祿捷,李 榮,姜子濤*(天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津 300134)
茼蒿葉中總黃酮的提取純化及抗氧化活性分析
張祿捷,李 榮,姜子濤*
(天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津300134)
采用二次回歸 正交旋轉組合設計法優化茼蒿葉總黃酮的提取條件,并利用制備色譜對粗黃酮進行純 化,最后通過不同的方法從4 個方面評價總黃酮的抗氧化活性。結果表明,茼蒿葉總黃酮的最佳提取工藝條件為:微波溫度73 ℃、乙醇體積分數68%、液料比30∶1(mL/g)、微波功率400 W和微波時間8 min。在此條件下實際總黃酮提取率為0.554%。優化后的總黃酮提取物在總抗氧化活性、羥自由基和DPPH自由基的清除作用,以及對卵黃脂蛋白脂質過氧化的抑制作用方面表現出較高的活性。
茼蒿葉總黃酮;二次回歸正交旋轉;制備色譜;抗氧化性
茼蒿(Chrysanthemum coronarium L.)為我國常見的蔬菜,又名蓬蒿,菊科茼蒿屬,一年生或二年生草本植物。原產于我國,也有說其原產于地中海地區[1]。莖葉可食用,亦可入藥,具有調胃健脾、降壓補腦等效用。茼蒿中含有多種氨基酸、膽堿、精油和維生素等多種物質,能夠調節機體代謝、消除水腫及抑制腫瘤轉移[2-3]。此外,茼蒿還具有改善記憶力和調理脾胃等功能[4]。
黃酮類化合物是植物中主要的藥理活性成分,具有降血脂、降血糖、抗腫瘤、增強機體免疫力等功能。有關茼蒿中黃酮類成分的分離鑒定已有少量報道,Anyos等[5]從茼蒿花序中檢測出槲皮素-7-O-葡萄糖苷、六羥基黃酮、木犀草素和少量的山奈酚糖苷,Ibrahim等[6]發現茼蒿還含有芹黃素。林丹英等[7]發現茼蒿黃酮提取液對羥自由基的清除作用比較明顯,其清除能力隨黃酮質量濃度的增加而增大。另外,酚及多酚類也是廣泛存在于茼蒿中的另一類生物活性成分。人們已從茼蒿中檢測出異阿魏酸[8]、阿魏酸甲酯[9]和對羥基苯甲酸甲酯[8]等3種酚類化合物,以及綠原酸、異綠原酸和3,5-二咖啡酰基奎寧酸等3 種多酚類化合物的存在[10-11]。
近年來,微波輔助提取技術在提取多糖、生物堿以及其他活性物質等領域已經顯露出常規的提取技術無法比擬的優點,并具有廣闊的應用前景[12-13]。鑒于不同國家的地理條件、降雨量、光照時間等有較大的差異,導致植物成分會有較大的不同。因此,開展中國產茼蒿黃酮的研究,具有一定理論和實際意義。本實驗采用二次回歸正交旋轉組合設計優化了茼蒿葉黃酮的提取條件,然后利用制備色譜對粗黃酮提取物進行了快速純化,并分別從總體抗氧化活性、羥自由基和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除以及對卵黃脂蛋白脂質過氧化的抑制作用幾方面對茼蒿葉黃酮的抗氧化活性進行了評價,為該植物黃酮在食品及相關領域的應用提供了理論依據。
1 材料與方法
1.1材料與試劑
茼蒿葉2014年6月購自于天津當地市場(天津本地產,食用期),剔除腐爛葉,洗滌并瀝干水分,70 ℃烘干48 h,恒質量,粉碎,過40 目篩。
蘆丁標準品(分析純)北京化學試劑公司;甲醇(色譜純)天津市科密歐化學試劑有限公司;超純水本實驗室自制;石油醚(分析純)天津市風船化學試劑科技有限公司;其他試劑均為分析純。
1.2儀器與設備
Multisynth微波合成儀意大利Milestone公司;U-3900型紫外-可見分光光度計日本Hitachi High-Technologie公司;Lambda25紫外-可見分光光度計珀金埃爾默儀器有限公司;Grace RevelerisTM全息快速純化色譜系統美國Alltech公司;1100 Series高效液相色譜儀美國Agilent公司;FA1104N型電子天平上海精密儀器有限公司;RE52-86A型旋轉蒸發儀上海亞榮生化儀器廠;純水器成都超純科技有限公司。
1.3方法
1.3.1茼蒿葉總黃酮的微波輔助工藝
稱取1.0 g茼蒿葉粉末置于微波反應器的圓底燒瓶中,以乙醇溶液為溶劑,按照一定的溫度、微波功率、液料比和時間進行提取,待提取液冷卻后采用布氏漏斗進行抽濾以除去葉渣,濾液經石油醚萃取3 次,棄去石油醚層,濾液即總黃酮提取液用相應的乙醇溶液定 容到30 mL。
1.3.2茼蒿葉總黃酮提取率測定
參照文獻[14],適當修改如下,蘆丁標準品,精確稱量20.0 mg,用30%的乙醇溶液溶解,移入100 mL容量瓶中,定容,即為質量濃度為0.2 mg/mL的蘆丁標準溶液。精密量取上述蘆丁標準溶液0.00、0.50、1.00、1.50、2.00、2.50 mL分別置于10 mL比色管中,依次加入0.40 mL 5%的NaNO2溶液,搖勻后靜置5 min,分別加入0.40 mL 10% Al(NO3)3溶液,靜置6 min,加入4.0 mL 4% 的NaOH溶液,搖勻后定容。靜置10 min,以試劑空白作為參比,于508 nm波長處測定吸光度。所得數據經回歸處理,得到各反應體系中蘆丁含量與吸光度的回歸方程為A=10.902 8C-0.000 7(R2=0.999 0),式中:A為508 nm波長處的吸光度;C為蘆丁質量濃度。
取1.0 mL黃酮提取液,稀釋4 倍以確保顯色后吸光度在標準曲線范圍內,取1 mL稀釋液按上述方法,測定其在508 nm波長處的吸光度,根據回歸方程,得到茼蒿葉提取液中黃酮質量濃度C,每組做3 次平行實驗,總黃酮提取率見式(1):
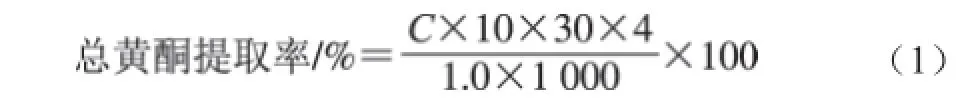
式中:C為由回歸方程計算的茼蒿提取液中總黃酮的質量濃度/(mg/mL)。
1.3.3單因素試驗
通過單因素試驗和正交試驗,確定了各因素對茼蒿葉總黃酮提取率的影響大小依次為:乙醇體積分數>液料比>微波溫度>微波功率>提取時間,其中液料比、乙醇體積分數和微波溫度3 個因素對總黃酮提取率影響較顯著,其余2 個因素的影響不顯著。鑒于實驗中所用的Multisynth微波合成儀具有自動溫控功能,當溫度達到設定溫度時,儀器會自動調整微波功率使提取液維持在設定溫度。微波功率越大,達到設定溫度的時間就越短。因此,微波功率和溫度對總黃酮提取的影響要綜合起來進行考察。
以乙醇溶液作為提取劑,分別考察乙醇體積分數(50%、60%、70%、80%和90%)、微波溫度(60、65、70、75、80 ℃)、液料比(20∶1、25∶1、30∶1、35∶1和40∶1),以及微波功率(300、400、500 W)與微波時間(7、8、9、10 min)對茼蒿葉總黃酮提取率的影響。根據公式(1)計算總黃酮的提取率。
1.3.4二次回歸正交旋轉組合試驗設計
參照文獻[15]的方法,根據單因素試驗結果分析,確定以乙醇體積分數(X1,變化范圍為50%~80%)、液料比(X2,變化范圍為20∶1~40∶1)、微波溫度(X3,變化范圍為60~80 ℃)為影響因素,按照1.3.2節方法測定黃酮含量,進行二次回歸正交組合試驗。由于因素數m=3,故選用正交表L8(27)進行變換,二水平試驗次數mc為8,星號試驗次數mγ為2,m為6,零水平試驗次數m0為4,依照星號臂長γ的計算公式得γ=1.414。水平編碼表見表1[16-18]。
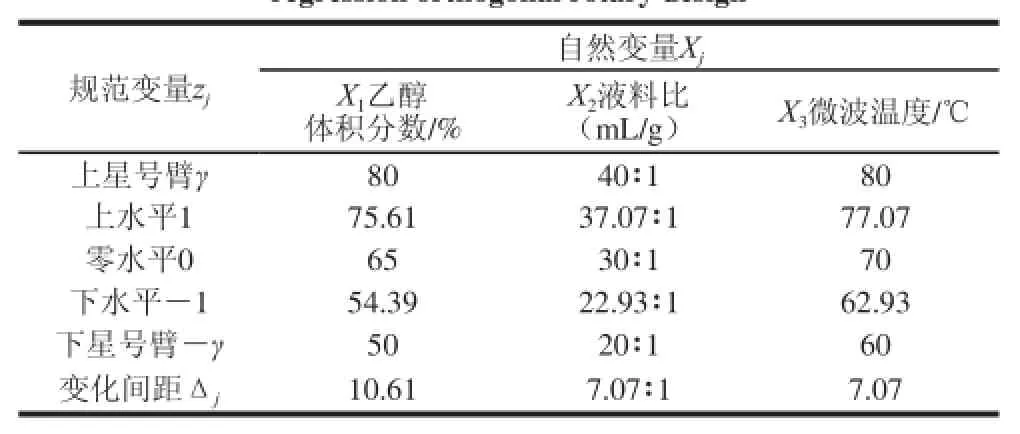
表1 水平取值及編碼表Taabbllee 11 CCooddeedd lleevveellss ooff iinnddeeppeennddeenntt vvaarriiaabblleess cchhoosseenn ffoorr qquuaaddrraattiicc regression orthogonal rotary desiggnn
1.3.5制備色譜純化茼蒿葉總黃酮及純化效果檢測
按照1.3.4節在最佳工藝條件下得到的總黃酮提取液,經減壓旋蒸至無乙醇后,冷凍干燥。稱取冷凍干燥后的茼蒿葉粗黃酮粉末5 g,溶于200 mL甲醇后轉移到500 mL容量瓶,蒸餾水定容,得到質量濃度為10 mg/mL的總黃酮溶液,為制備樣品液。
制備色譜純化條件:柱填料為12g RevelerisTMRP C18Cartridge,流動相為1%乙酸溶液(A)和甲醇(B),流速為10 mL/min,進樣量為15 mL,檢測波長為UV 272 nm,梯度洗脫條件為:0~15 min:0~70% B,15~20 min:70%~80% B,流動相A始終保持10%不變,設置儀器收集峰所對應洗脫液得制備色譜純化總黃酮溶液。將上述制得純化后茼蒿葉總黃酮溶液,減壓旋蒸至無乙醇后,冷凍干燥,得到純化后茼蒿葉總黃酮粉末。
高效液相色譜條件:Zorbax SB-C18(250 mm× 4.6 mm,5 μm),流動相為甲醇(A)、水(B)和1%乙酸溶液(C),流速為0.9 mL/min,進樣量為10 μL,洗脫條件為0~30 min,10%~80% A,1%乙酸溶液一直保持10%,檢測波長為272 nm。
總黃酮得率計算見式(2):
1.3.6茼蒿葉總黃酮的抗氧化活性的測定
參照文獻[19-20]方法采用磷鉬絡合物法并稍加改進。配制質量濃度分別為0.1、0.2、0.3、0.4、0.5 mg/mL經制備色譜純化并凍干成粉末的茼蒿葉總黃酮溶液和VC溶液。在一系列10 mL比色管中分別加入4.0 mL磷鉬試劑(終濃度0.6 mol/L硫酸、4.0 mmol/L鉬酸銨和28.0 mmol/L磷酸鈉)和0.4 mL總黃酮樣品液,迅速搖勻后置于95 ℃水浴中恒溫90 min,在695 nm波長處分別測量不同樣品液的吸光度A,對照組為4.0 mL磷鉬試劑和0.4 mL 70%乙醇溶液。
1.3.7茼蒿葉總黃酮清除DPPH能力的測定
參照文獻[21]方法改進,分別配制質量濃度為0.01、0.02、0.03、0.04、0.05 mg/mL純化后的茼蒿葉總黃酮及VC溶液,在一系列10 mL比色管中分別加入3.5 mL 1.0×10-4mol/L的DPPH溶液,后加入0.5 mL無水乙醇,搖勻閉光反應30 min,以無水乙醇為參比,測定其在517 nm波長處吸光度A1;同時用同樣方法測定3.5 mL 1.0×10-4mol/L的DPPH溶液和0.5 mL樣品液的吸光度A;測定3.5 mL無水乙醇與0.5 mL樣品液在517 nm波長處的吸光度A0,則樣品液對DPPH自由基的清除率計算見式(3):
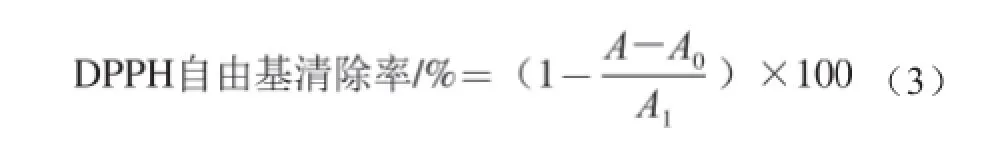
根據吸光度分別計算樣品液對DPPH自由基的清除率。
1.3.8茼蒿葉總黃酮對羥自由基的清除率 測定
參照文獻[22]方法改進。采用結晶紫法,配制0.05 mg/mL的 VC和純化后茼蒿葉總黃酮溶液。在10 mL比色管中加入0.2 mL結晶紫(0.4 mmol/L),后加入3 mL磷酸氫二鉀-檸檬酸緩 沖溶液(pH 4.0),繼續添加2 mL FeSO4溶液(15 mmol/L)和2 mL H2O2(15 mmol/L)溶液,緩沖溶液定容至10 mL,搖勻放置30 min,在58 0 nm波長處測吸光度A0,同時測定不加H2O2時,其吸光度為Ab。實驗組中,加入H2O2之前,加入不同體積純化后茼蒿黃酮樣品液,測定其吸光度為Ax。則樣品液對羥自由基的清除率計算見式(4):
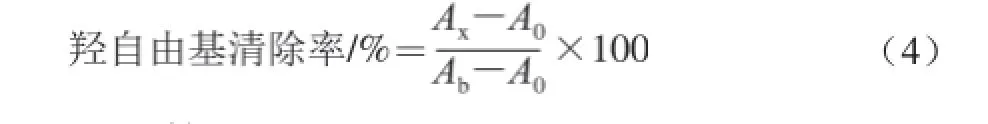
1.3.9Fe2+誘發卵黃脂蛋白過不飽和脂肪酸過氧化體系中抗氧化活性的測定
分別配制質量濃度為0.1、0.2、0.3 mg/mL純化后茼蒿葉總黃酮溶液和VC溶液。將卵黃懸浮液(pH 7.45)與0.1 mol/L的磷酸鹽緩沖液按1∶1的比例混合,磁力攪拌10 min后,進一步用磷酸鹽緩沖液稀釋至1∶25,適當攪拌后得到的懸浮液。吸取配好的卵黃懸浮液0.2 mL、茼蒿葉總黃酮溶液0.6 mL、25 mmol/L的 FeSO40.2 mL于離心管中,用磷酸鹽緩沖液補充至 2.0 mL,于37 ℃培養箱中培養12 h,取出后加入0.5 mL質量濃度為 20%三氯乙酸溶液,搖勻,靜置10 min,放入離心機中,以 3 500 r/min的速率離心10 min。離心后取2.0 mL 上清液,在其中加入1.0 mL 0.8%硫代巴比妥酸溶液,沸水浴15 min。冷卻后于532 nm波長處測定吸光度Ax。空白管為磷酸鹽緩沖液。對照管Ao操作步驟同上,只是不加樣品液。按照式(5)計算樣品液對卵黃脂蛋白脂質過氧化的抑制率:
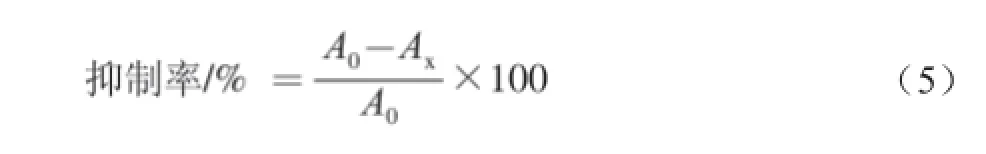
2 結果與分析
2.1單因素試驗結果
分別測定乙醇體積分數為50%、60%、70%、80%和90%時茼蒿葉總黃酮的提取率。由圖1A可知,茼蒿葉總黃酮的提取率隨乙醇體積分數的升高而逐漸增大,乙醇體積分數達到一定值時,提取率反而降低,原因可能是在一定乙醇體積分數范圍內黃酮類化合物的溶解度會升高,但過高時會促使細胞內的蛋白質凝固,導致黃酮類物質不易溶出[23]。所以選擇進一步優化茼蒿總黃酮的乙醇體積分數在50%~80%之間。
選擇乙醇的體積分數70%、微波溫度75 ℃,固定其他條件,選擇不同液料比20∶1、25∶1、30∶1、35∶1及40∶1(mL/g)時,分別測定茼蒿葉黃酮提取率。由圖1B可知,隨著乙醇溶液體積的增加,黃酮類化合物溶出增多,30∶1時提取率最大,隨后減小。選擇進一步優化提取茼蒿葉總黃酮的液料比為20∶1~40∶1。
選擇乙醇體積分數為70%,固定其他條件,測定微波溫度在60、65、70、75、80 ℃時,測定茼蒿葉總黃酮的提取率。由圖1C可知,在 60~80 ℃范圍內,隨著微波溫度的升高,茼蒿葉總黃酮提取率逐漸升高,但隨著溫度的升高提取率會下降。由于5 個溫度條件下黃酮提取率相差不大,故選擇優化時的溫度范圍為60~80 ℃。
當乙醇體積分數為70%、微波溫度為70 ℃、液料比為30∶1時,選擇不同的微波功率及時間,根據方法1.3.1節提取茼蒿葉總黃酮。由圖1D可知,微波功率300 W時的提取率較400 W和500 W稍低,400 W和500 W的提取率相當,根據試驗經驗,當微波溫度達到設定溫度時,功率就不再升高,只需數十瓦即可維持設定溫度,所以選取微波功率400 W條件下提取8 min為最佳提取條件。
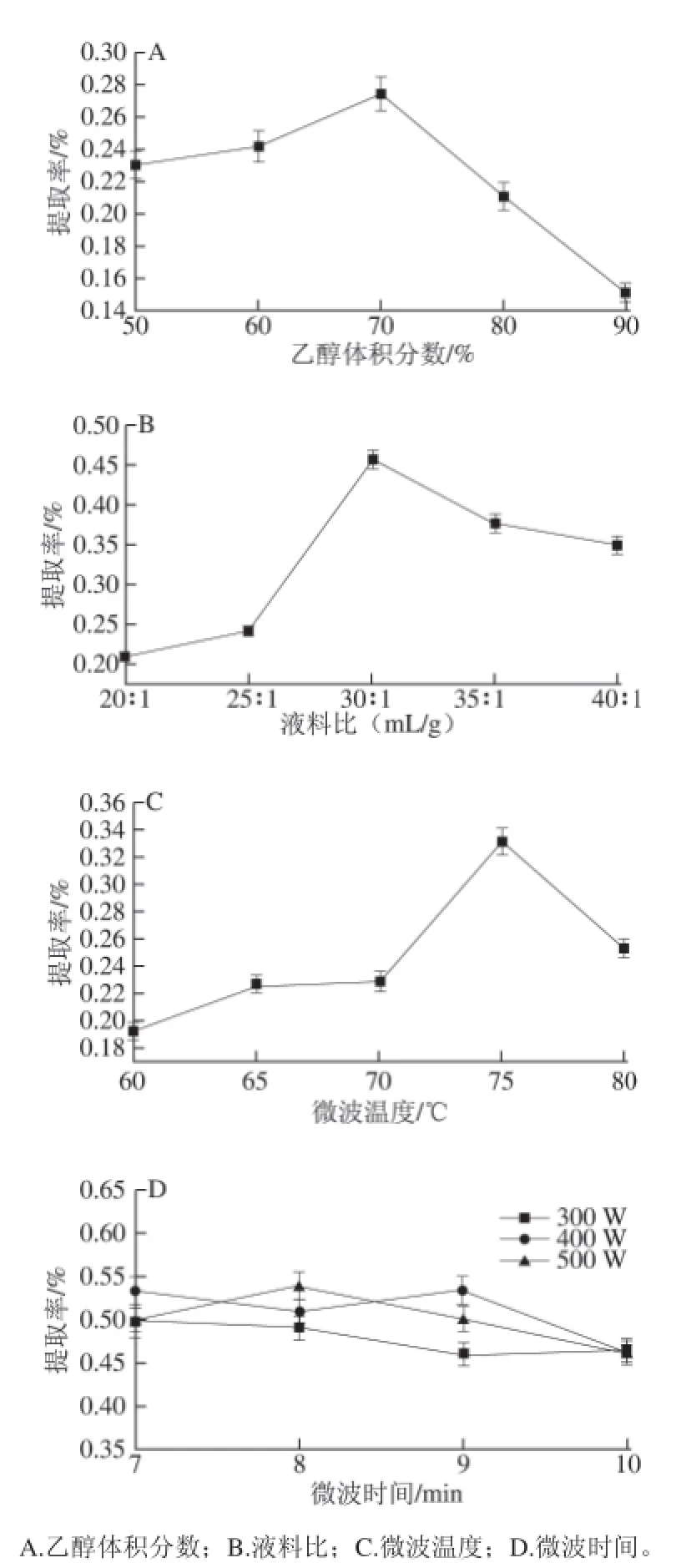
圖 1 單因素對茼蒿葉總黃酮提取率的影響Fig.1 Effect of process conditions on the extraction effi ciency of total fl avonoids
2.2二次回歸正交旋轉試驗設計與處理
2.2.1二次回歸正交旋轉試驗設計
根據方法1.3.4節,二次回歸正交旋轉組合試驗設計及結果見表2。
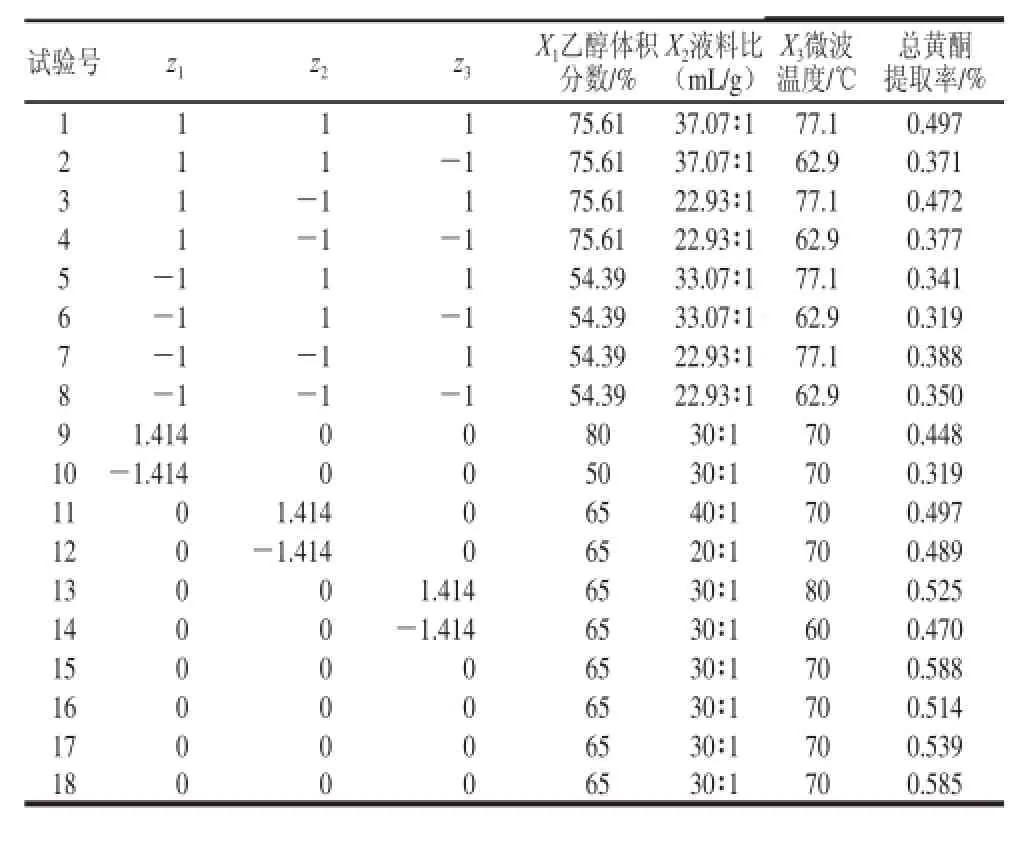
表2 二次回歸正交組合設計表及結果TTaabbllee 22 OOrrtthhooggoonnaall rreeggrreessssiioonn ddeessiiggnn wwiitthh eexxppeerriimmeennttaall rreessuullttss
2.2.2二次回歸正交試驗數據的分析與處理
運用SAS 9.2軟件對試驗數據進行統計計算,各項方差分析和參數估計及顯著性分析的主要結果歸納分別見表3、4。由表3二次回歸模型F=13.38,P=0.000 6<0.001;失擬性檢驗的F=0.67,P=0.674 9>0.05,說明該模型擬合得很好。一次項、二次項和交互項的P值分別P<0.05、P<0.001和P=0.224 6,說明3 個因素均對提取率有顯著影響,而交互作用的影響則不顯著。
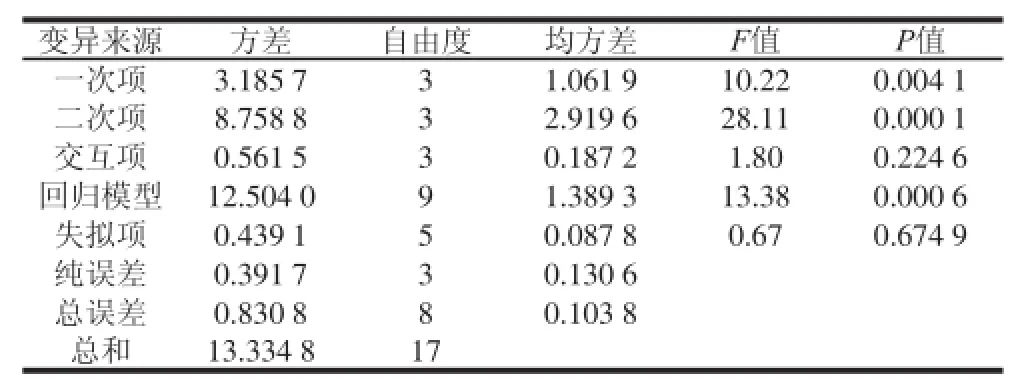
表3 總黃酮提取條件的回歸正交試驗方差分析表TTaabbllee 33 AAnnaallyyssiiss ooff vvaarriiaannccee ooff tthhee eexxttrraaccttiioonn eeffffi i cciieennccyy ooff ttoottaall fl avonoids with extraction conditionss
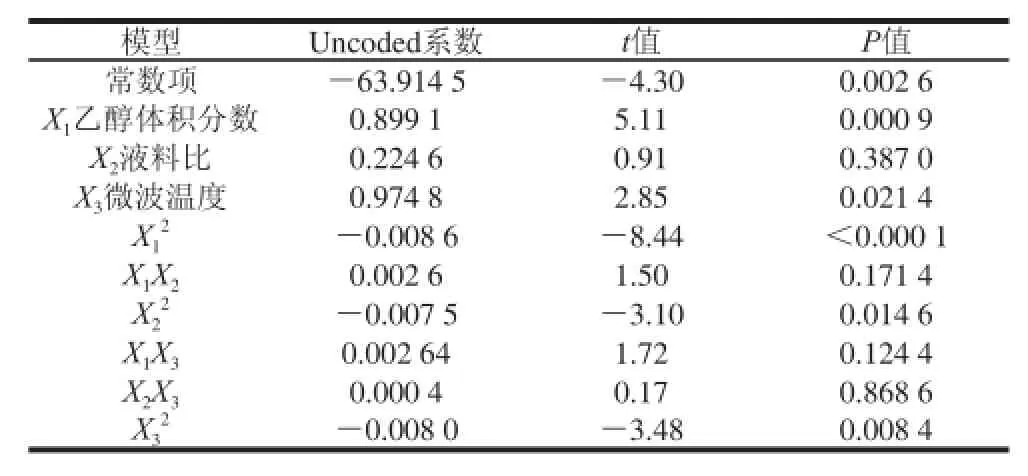
表 4 提取試驗二次回歸模型參數Taabbllee 44 PPaarraammeetteerrss ooff qquuaaddrraattiicc rreeggrreessssiioonn oorrtthhooggoonnaall mmooddeell
由表4可知,各因素的影響程度由大到小依次為X1>X3>X2,即乙醇體積分數>微波溫度>液料比。對數據進行多元二次回歸擬合,去除X1X2、X1X3、X2X3交互項以及X2項,得到優化后的茼蒿葉總黃酮提取率(y)的 二次多項回歸方程為:
y=-63.914 5+0.899 1X+0.974 8X-0.008 6X2-
1310.007 59X2-0.008 0X223
對回歸方程進行優化后整個模型(P=0.000 6<0.001)極為顯著;失擬項(F=0.67,P=0.674 9>0.05)不顯著,說明試驗無其他顯著因素的影響,試驗條件合適[24],該回歸方程與實際情況擬合的較好,其中R2=0.937 7。通過回歸模型預測的茼蒿葉總黃酮的最佳提取條件為:乙醇體積分數68.17%、液料比29.76∶1、溫度73.19 ℃,微波功率400 W和微波時間8 min。在此條件下總黃酮提取率的預測值為0.575%,考慮到實際可操作性,將工藝參數修正為乙醇體積分數68%、液料比30∶1、溫度73 ℃、微波功率400 W和微波時間8 min。在此條件下驗證后實際總黃酮提取率為0.554%,相對誤差為-3.65%,與預測值差異較小,證明此方法可以較好地對茼蒿葉總黃酮的提取條件進行優化,并且是真實可靠的。2.3茼蒿葉總黃酮純化效果
2.3.1純化得率和純度
根據公式(5)計算,純化前粗黃酮粉末為5 g, 純化后冷凍干燥粉末0.89 g,則純化得率為17.8%。分別稱取純化前的茼蒿葉粗黃酮粉末和純化后的茼蒿葉黃酮粉末各10 mg,分別溶于10 mL 70%乙醇溶液,得到質量濃度為1 mg/mL的溶液,取1 mL溶液與比色管中,按1.3.2節方法顯色,根據標準曲線計算茼蒿葉粗黃酮粉和純化后黃酮粉中茼蒿葉總黃酮的含量,結果如表5所示。
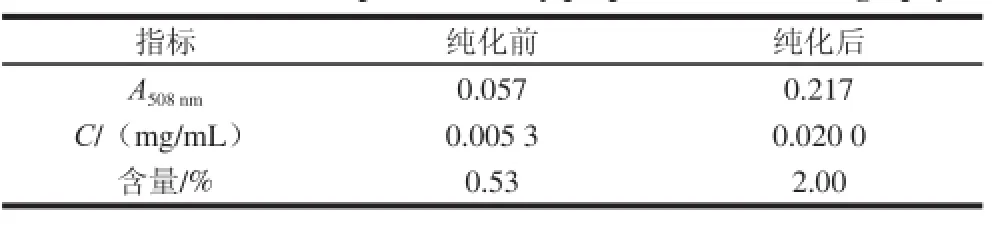
表5 茼蒿葉粗黃酮粉經制備色譜純化前后結果對比Table 5 Total fl avonoid contents of Chrysanthemum coronariiuumm L. leeaaff eexxttrraacctt bbeeffoorree aanndd aafftteerr ppuurriiffi i ccaattiioonn bbyy pprreeppaarraattiivvee cchhrroommaattooggrraapphhyy
由表5可知,茼蒿葉粗黃酮粉末經純化后總黃酮含量是純化前的3.8 倍,純化效果較好。
2.3.2純化前后茼蒿葉總黃酮成分的高效液相色譜圖
如圖2所示,茼蒿葉粗黃酮純化前圖譜中14~20 min時響應值偏離零線較高,這可能是由于提取液存在雜質引起的,而在純化后的圖譜中則未見此情況,說明利用制備色譜得到的成分比較純凈,雜質大大減少且純度明顯提高。制備色譜在較短的時間內完成了5 g茼蒿葉粗黃酮的純化,表明制備色譜高效快速,具有大孔樹脂不可比擬的優勢[25]。
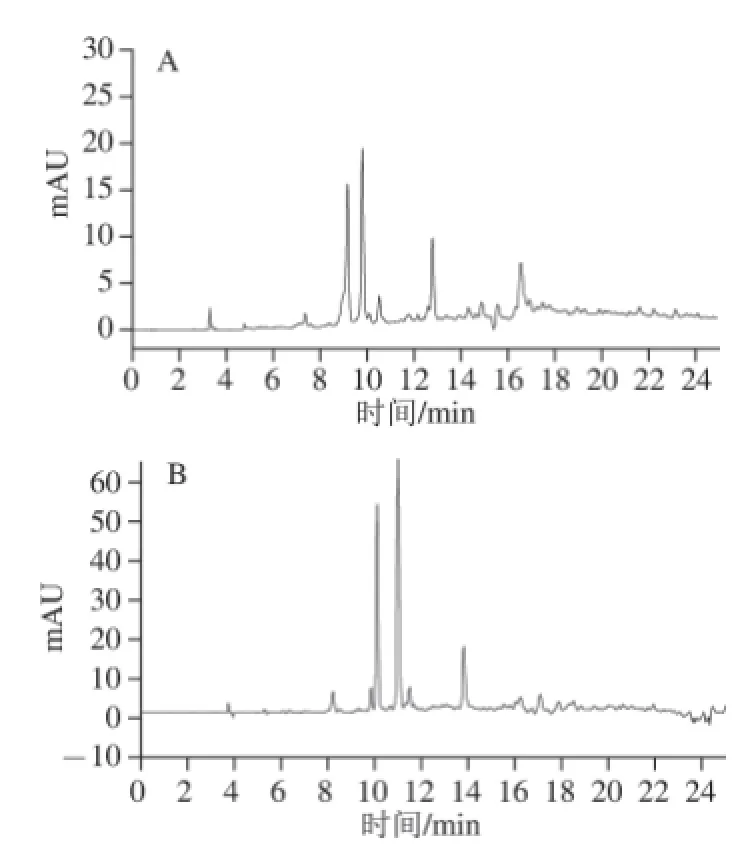
圖 2 茼蒿葉粗黃酮純化前(A)和純化后(B)的高效液相色譜圖Fig.2 HPLC profi les of fl avonoids from Chrysanthemum coronarium L. leaves before and after purifi cation by preparative chromatography
2.4茼蒿葉總黃酮的抗氧化活性
2.4.1總抗氧化能力
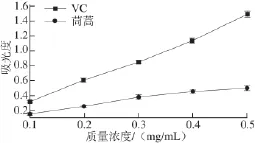
圖 3 吸光度與樣品液質量濃度的關系Fig.3 Relationship between absorbance and fl avonoid concentration
具有抗氧化能力的物質能將磷鉬絡合物中的Mo (+6價)還原為綠色的Mo(+5價),這種絡合物在695 nm波長處有最大吸收波長,并且其吸光度與它具有的抗氧化活性呈正相關。由圖3可知,隨著樣品液質量濃度的增加,吸光度越大,說明茼蒿葉總黃酮具有抗氧化活性,與VC溶液趨勢基本一致,但相比之下茼蒿葉總黃酮抗氧化能力較VC弱。
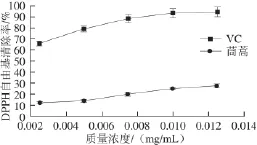
圖 4 DPPH自由基清除率與樣品液質量濃度的關系Fig.4 Relationship between DPPH radical scavenging activity and fl avonoid concentration
2.4.2清除DPPH自由基能力由圖4可知,茼蒿葉總黃酮成分具有清除DPPH自由基的作用,且隨質量濃度增加清除率增大。但與VC這種人工抗氧化劑相比,其清除效果仍然低于同質量濃度的VC。
2.4.3清除羥自由基能力
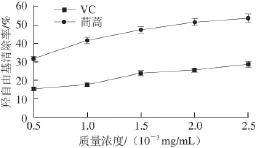
圖 5 羥自由基清除率與樣品液質量濃度的關系Fig.5 Relationship between hydroxyl radical scavenging and fl avonoid concentrations
如圖5所示,隨總黃酮溶液質量濃度增大羥自由基清除率也逐漸升高,說明茼蒿葉總黃酮成分具有清除羥自由基的能力,但較VC的清除能力低。
2.4.4卵黃脂蛋白體系中抗氧化活性
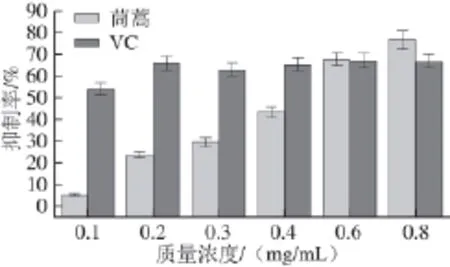
圖 6 樣品質量濃度對卵黃脂蛋白脂質的抑制率Fig.6 Inhibitory rate of fl avonoids from Chrysanthemum coronarium L. leaves at different concentrations on lipid peroxidation of yolk lipoprotein
由圖6可知,茼蒿葉總黃酮和VC對Fe2+引發的卵磷脂脂質體過氧化均有抑制作用。茼蒿葉總黃酮的抑制率隨著質量濃度的增加而逐漸增大,雖然低質量濃度時,VC較茼蒿葉總黃酮抑制率高,但其隨質量濃度增大抑制率沒有明顯變化,茼蒿葉總黃酮則在質量濃度為0.8 mg/mL時抑制率達到73.7%,VC在0.6 mg/mL時的抑制率最高為67.2%,表明茼蒿葉總黃酮具有良好的抗脂質氧化能力。
33 結 論
采用二次回歸正交旋轉試驗對茼蒿葉黃酮微波提取條件進行優化,得到最優提取條件為:乙醇體積分數68%、液料比30∶1、微波溫度73 ℃、微波功率400 W和微波時間8 min,在此條件下茼蒿葉總黃酮的提取率為0.554%。利用制備色譜實現了對茼蒿葉粗黃酮的快速純化。實驗結果表明,茼蒿葉黃酮類物質表現出較好的抗氧化活性,在自由基的清除以及卵黃脂蛋白脂質過氧化的抑制方面均有一定的作用。研究[26]表明,沒有一種單一的方法能夠充分地評價一種物質的抗氧化能力,需采用多種方法從不同角度對其進行,在本次實驗中茼蒿葉黃酮提取液在總抗氧化性、清除羥自由基和DPPH自由基方面略遜于VC,但在卵黃脂蛋白脂質過氧化的抑制方面比其稍強,因此也可以作為一種天然抗氧化劑在食品工業領域得到開發利用。但實驗對所提取的黃酮類物質的組分結構目前還不清楚,需要進一步研究確定。
[1]張金鳳, 孫永奎, 鄒學龍, 等. 基于微波提取法的茼蒿中黃酮類物質提取工藝優化[J]. 安徽農業科學, 2011, 39(32): 19765-19767.
[2]張金鳳, 袁會領, 劉希斌, 等. 響應面法優化茼蒿中黃酮類物質的提取工藝[J]. 農業機械, 2012(3): 128-131.
[3]陳蕙芳. 抑制腫瘤的茼蒿屬植物提取物[J]. 現代藥物與臨床, 2009,24(2): 121.
[4]余文慧. 醫食兼優的茼蒿[J]. 山東食品科技, 2000(6): 40.
[5]ANYOS T, STEELINK C. Fluorescent petal constituents of Chrysanthemum coronarium L.[J]. Archives of Biochemistry and Biophysics, 1960, 90(1): 63-67.
[6]IBRAHIM L F, El-SENOUSY W M, HAWAS U W. NMR spectral analysis of fl avonoids from Chrysanthemum coronarium[J]. Chemistry of Natural Compounds, 2007, 43(6): 659-662.
[7]林丹英, 尤婷婷, 黃鎖義. 茼蒿總黃酮提取及對羥自由基清除作用[J].中國野生植物資源, 2007, 26(5): 57-59.
[8]MAHAHIRO T, KAZUHIRO C. Novel plant growth inhibitors and an insect antifeedant from Chrysanthemum coronarium L.[J]. Agricultural and Biological Chemistry, 1984, 48: 1367-1369.
[9]SONG M C, YANG H J, JEONG T S, et al. Heterocyclic compounds from Chrysanthemum coronarium L. and their inhibitory activity on hACAT-1, hACAT-2, and LDL-oxidation[J]. Archives of Pharmacal Research, 2008, 31(5): 573-578.
[10] CHUDA Y, SUZUKI M, NAGATA T, et al. Contents and cooking loss of three quinic acid derivatives from garland (Chrysanthemum coronarium L.)[J]. Journal of Agricultural and Food Chemistry, 1998,46(4): 1437-1439.
[11] CHUDA Y, ONO H, OHNISHI-KAMEYAMA M, et al. Structural identifi cation of two antioxidant quinic acid derivatives from garland (Chrysanthemum coronarium L.)[J]. Journal of Agricultural and Food Chemistry, 1996, 44(8): 2037-2039.
[12] 張曉榮, 楊蓉. 黃酮類化合物的提取方法與功能應用研究[J]. 農業工程技術: 農產品加工業, 2013(3): 35-38.
[13] 呂鑒泉, 付勤. 微波萃取魚腥草中黃酮的研究[J]. 化學與生物工程,2008, 25(10): 49 -51.
[14] 王長春, 林向陽, 葉南慧, 等. Plackett-Burman設計和響應面分析法優化枇杷葉中總黃酮的超聲波提取工藝[J]. 中國食品學報, 2013,13(3): 84-91.
[15] 王文忠, 田躍, 吳旭, 等. 二次回歸正交設計法優化金蕎麥總黃酮的提取工藝[J]. 中藥材, 2012, 35(11): 1861-1862.
[16] 李運雁, 胡傳榮. 實驗設計獎與數據處理[M]. 北京: 化學工業出版社, 2008: 184-195.
[17] 巨敏, 楊鵬, 朱沛沛, 等. 二次回歸正交優化枸杞中總黃酮提取工藝的研究[J]. 中國釀造, 2011, 30(10): 92-96.
[18] MCQUARRIE A, TSAI C L. Model selection in orthogonal regression[J]. Statistics & Probability Letters, 1999, 45(4): 341-349.
[19] OZKAN G, SIMSEK B, KULEASAN H. Antioxidant activities of Satureja cilicica essential oil in butter and in vitro[J]. Journal of Food Engineering, 2007, 79: 1391-1396.
[20] KUMARAN A, KARUNAKARAN R. In vitro antioxidant activities of methanol extracts of fi ve Phyllanthus species from India[J]. LWTFood Science and Technology, 2007, 40: 344-352.
[21] VATTEM D A, LIN Y T, LABBE R G, et al. Phenolic antioxidant mobilization in cranberry pomace by solid-state bioprocessing usin g food grade fungus Lentinus edodes and effect on antimicrobial activity,against select food borne pathogens[J]. Innovative Food Science and Emerging Technologies, 2004, 5(1): 81-91.
[22] 劉駿. 結晶紫分光光度法測定Fenton反應產生的羥自由基[J]. 武漢工業學院學報, 2005, 24(2): 53-55.
[23] 陳偉, 劉青梅, 楊性民, 等. 微波技術在杜仲黃酮提取工藝中的應用研究[J]. 食品科學, 2006, 27(10): 285-288.
[24] 袁志發, 周靜芋. 試驗設計與分析[M]. 北京: 高等教育出版社, 2000: 381.
[25] 劉韜, 李榮, 張祿捷, 等. 八角茴香葉中黃酮的微波提取及純化[J]. 食品科學, 2015, 36(2): 30-35. doi: 10.7506/spkx1002-6630-201502006.
[26] KOLEVA I I, van BEEK T A, LINSSEN J P H, et al. Screening of plant extracts for antioxidant activity: a comparative study on three testing methods[J]. Phytochemical Analysis, 2002, 13: 8-17.
Extraction, Purifi cation and Antioxidant Activity of Total Flavonoids from Chrysanthemum coronarium L. Leaves
ZHANG Lujie, LI Rong, JIANG Zitao*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin300134, China)
The extraction conditions of total flavonoids from Chrysanthemum coronarium L. leaves were optimized using quadratic regression o rthogonal rotary method. The flavonoids extracted were purified by preparative chromatography. Their antioxidant activities were evaluated by four different methods. The optimal extraction conditions were determined as follows:extraction temperature, 73 ℃; ethanol concentration, 68%; ratio of solvent to sample, 30:1; microwave power, 400 W; and extraction time, 8 min. Under the optimal extraction conditions, the extraction rate of total flavonoids was 0.554%. The fl avonoids showed high total antioxidant activity, radical scavenging activity against hydroxyl and 1,1-diphenyl-2-picrylhydrazyl radical (DPPH) free radicals, and inhibitory effect on lipid peroxidation of yolk lipoprotein.
flavonoids from Chrysanthemum coronarium L. leaves; quadratic regression orthogonal rotary method;preparative chromatography; antioxidant activity
TS218
A
1002-6630(2015)24-0040-06
10.7506/spkx1002-6630-201524007
2015-04-25
天津市自然科學基金重點項目(12JCZDJC34100)
張祿捷( 1990—),女,碩士研究生,研究方向為食品添加劑。E-mail:362235435@qq.com
姜子濤(1956—),男,教授,博士,研究方向為食品添加劑及食品分析。E-mail:ztjiang@tjcu.edu.cn

