兩種α -葡萄糖苷酶的酶學性質及轉苷作用
(工業發酵微生物教育部重點實驗室,工業酶國家工程實驗室,天津市工業微生物重點實驗室,天津科技大學生物工程學院,天津300457)
(工業發酵微生物教育部重點實驗室,工業酶國家工程實驗室,天津市工業微生物重點實驗室,天津科技大學生物工程學院,天津300457)
來源于黑曲霉(Aspergillus niger)的不同α-葡萄糖苷酶,其對底物的水解和轉苷活性均存在一定差異,影響了它們在實際生產中的應用.以甲醇畢赤酵母重組菌株分別表達的兩種 α-葡萄糖苷酶 Glu-A和 Glu-B為研究對象,分析了兩種酶的酶學性質,結果表明Glu-A和Glu-B最適作用溫度均為50,℃,最適pH分別為5和6.對底物麥芽糖的轉苷作用研究表明,產物低聚異麥芽糖中各種糖的種類和比例差別較大,Glu-A作用麥芽糖后的總低聚糖、異麥芽糖、潘糖和異麥芽三糖的生成率分別為 51.04%、15.79%、31.41%和 4.18%,而 Glu-B作用麥芽糖后的總低聚糖、異麥芽糖、潘糖和異麥芽三糖的生成率分別為 35.85%、16.71%、4.15%與15.85%.
α-葡萄糖苷酶;低聚異麥芽糖;酶學性質;轉苷作用
低聚異麥芽糖包括異麥芽糖、潘糖、異麥芽三糖等,α-葡萄糖苷酶(α-transglucosidase,E.C.2.4.1.24)可轉移葡萄糖基到麥芽糖、葡萄糖等底物分子上進而獲得低聚異麥芽糖.研究[1]發現,產α-葡萄糖苷酶較高的微生物主要是黑曲霉(Aspergillus niger),目前的研究主要集中在酶基因的克隆及高效表達[2-4]方面,而針對不同基因編碼的酶的性質比較及轉苷應用分析報道較少.α-葡萄糖苷酶同時具有水解和轉苷兩種活性,不同的α-葡萄糖苷酶所表現出的這兩種活性具有較大的差異.在低聚異麥芽糖生產中,針對不同生產目的,如對低聚異麥芽糖產品不同成分、不同濃度、不同純度等的要求,需要選擇具有不同轉苷活性或水解活性的酶.GenBank中已報道的編碼α-葡萄糖苷酶基因有7個,這7個基因之間DNA相似性程度較低,不到 40%,氨基酸序列相似性也只有 25%左右,為了分析這些不同的α-葡萄糖苷酶的功能和應用特性,本文選取其中DNA和氨基酸序列相似度較高(均在50%左右)的兩個α-葡萄糖苷酶A(Glu-A)和α-葡萄糖苷酶 B(Glu-B)為研究對象,首先實現了這兩個酶在畢赤酵母中的高效表達,并主要對這兩個酶的酶學性質及轉苷作用進行比較分析,為研究其他幾種酶的酶學性質和酶的功能與結構之間的關系奠定基礎,也可為α-葡萄糖苷酶在低聚異麥芽糖生產中的應用提供參考.
1 材料與方法
1.1 菌株
畢赤酵母工程菌P. ,pastoris A、P., pastoris B,由本實驗室保存.
1.2 培養基
YPG固體培養基:酵母粉5,g、蛋白胨10,g、甘油10,g、瓊脂 5,g,溶解于 500,mL水中.121,℃滅菌20,min.
BMGY培養基:酵母粉5,g、蛋白胨12,g,溶解于420,mL水中.121,℃滅菌 20,min.冷卻至室溫加入60,mL 1,mol/L的磷酸鉀緩沖液、60,mL酵母氮源、1.2,mL生物素溶解液、60,mL甘油溶解液.
BMMY培養基:酵母粉 6,g、蛋白胨 12,g,溶解于420,mL水中.121,℃滅菌20,min.冷卻至室溫加入 60,mL 1,mol/L的磷酸二氫鉀-磷酸氫二鉀緩沖液、60,mL酵母氮源、1.2,mL生物素溶解液、60,mL甲醇溶解液.
1.3 酶活的測定方法
采用QB 2525—2001《食品添加劑·α-葡萄糖轉苷酶》的方法進行酶活的測定:用α-葡萄糖苷酶作用底物α-甲基-D-葡萄糖苷生成葡萄糖,所生成的葡萄糖與含有葡萄糖氧化酶、過氧化物酶的 4-氨基安替比林和酚試劑進行顯色反應來定量測定.在此實驗條件下,在 2.5,mL上述混合物的反應體系中,60,min產生l μg葡萄糖所需的酶量定義為一個α-葡萄糖苷酶活力單位.
1.4 酶學性質分析
1.4.1 酶的最適反應溫度及穩定性
將兩種畢赤酵母工程菌產α-葡萄糖苷酶酶液取2,mL分別置于10~90,℃的條件下取樣測定酶活,以最高酶活為相對酶活100%.在pH 5.0條件下,將酶液在不同的溫度下保溫 0.5,h,將不進行溫度處理的酶液作為相對酶活100%.
1.4.2 酶的最適反應pH及穩定性
在 4,℃反應條件下,用磷酸氫二鈉-檸檬酸緩沖液、磷酸氫二鈉-磷酸二氫鉀緩沖液配制 pH分別為2、3、4、5、6、7、8、9,質量濃度為 20,g/L的α-甲基-D-葡萄糖苷底物溶液.測定兩種酶的酶活力.以最高酶活計為 100%.在室溫條件下,將酶液分別置于不同 pH條件下,保溫 0.5,h,測定酶活力,將未進行處理的酶液計為100%.
1.5 轉苷實驗及產物成分分析
用pH為5的緩沖液配制質量濃度為200,g/L的麥芽糖溶液50,mL裝入250,mL三角瓶中.α-葡萄糖苷酶加酶量為 36,U/mL,封住瓶口,將三角瓶置于55,℃水浴搖床進行轉苷反應 30,h.取樣測定各種低聚糖的含量,分析轉苷結果.
轉苷產物成分分析采用高效液相色譜法.色譜條件:Prevail Carbohydrate色譜柱(250,mm× 4.6,mm),流動相為體積分數 75%乙腈水溶液,柱溫30,℃,流量 1,mL/min,進樣量 10,μL,蒸發溫度90,℃,蒸發氣體流量2.0,L/min.
2 結果與分析
2.1 兩種α-葡萄糖苷酶酶學性質
2.1.1 最適溫度及溫度穩定性
溫度對兩種α-葡萄糖苷酶的酶活力影響結果如圖1所示.由圖1可知:兩種α-葡萄糖苷酶的最適反應溫度均為50,℃.在溫度大于30,℃時,酶活力迅速上升,在 40~60,℃酶活保持較為穩定狀態.當溫度超過 60,℃時,兩種酶的酶活均迅速下降.α-葡萄糖苷酶 Glu-A在 80,℃時就已經失活,而 Glu-B在80,℃時的酶活也很低,在 90,℃時完全失活.將兩種酶液在不同的溫度條件下保溫 0.5,h后,測定酶活力結果如圖2所示.在10~60,℃時兩種酶酶活力保持相對穩定狀態,Glu-A穩定性高于 Glu-B.在溫度高于60,℃時,酶活力迅速下降.
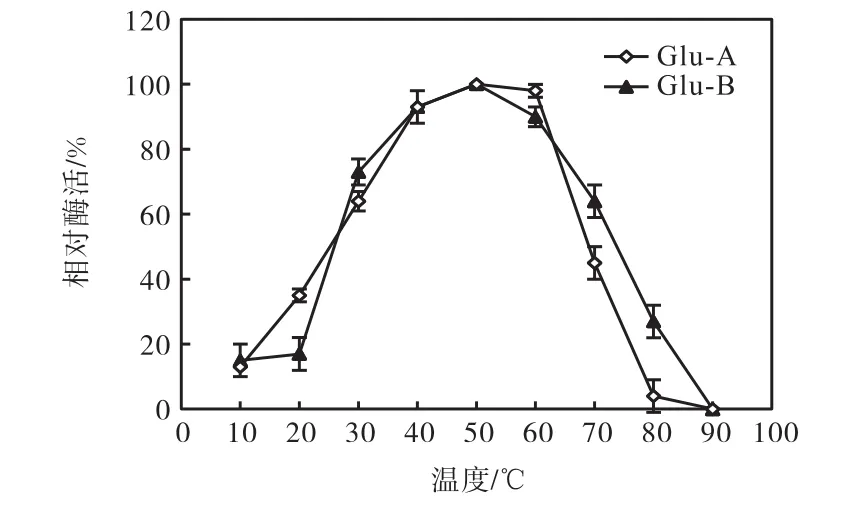
圖1 溫度-酶活力曲線Fig. 1 Temperature-enzyme activity curve
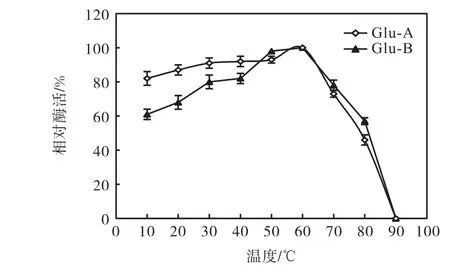
圖2 溫度-酶活力穩定性曲線Fig. 2 Temperature-enzyme stability curve
2.1.2 最適pH及pH穩定性
pH-酶活力曲線如圖 3所示.pH-酶活力穩定性曲線如圖4所示.
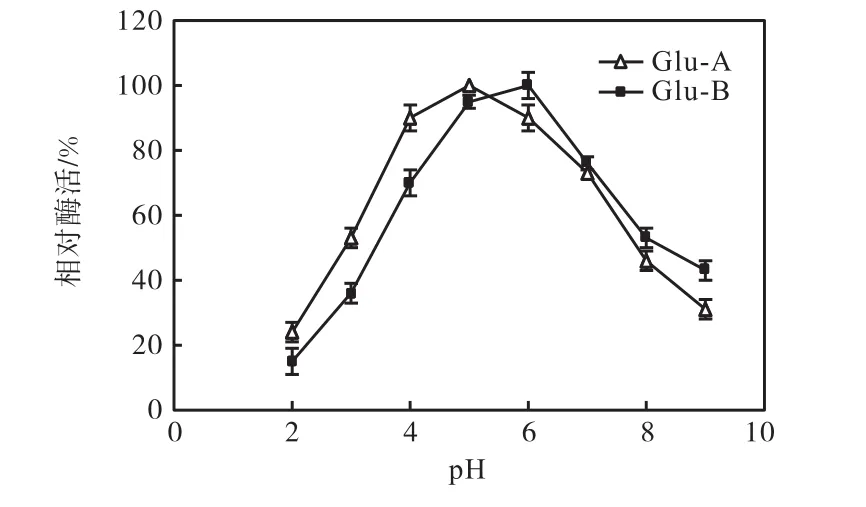
圖3 pH-酶活力曲線Fig. 3 pH-enzyme activity curve
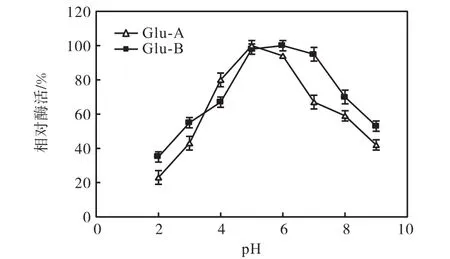
圖4 pH-酶活力穩定性曲線Fig. 4 pH-enzyme stability curve
由圖 3可知:α-葡萄糖苷酶 Glu-A的酶活最適pH為 5,α-葡萄糖苷酶 Glu-B的酶活最適 pH為6.由圖4可知:Glu-A的pH穩定范圍為5~6,穩定范圍較窄,當pH低于5或高于6時,酶活力迅速下降.Glu-B的pH穩定性范圍較寬,在pH 5~7之間均能保持一定的酶活力.
2.2 轉苷作用及產物分析
利用麥芽糖作為底物,配制質量濃度為 200,g/L的麥芽糖溶液,加入α-葡萄糖苷酶進行轉苷反應.反應結果用高效液相色譜(HPLC)進行分析[5],兩種α-葡萄糖苷酶轉苷麥芽糖結果如圖 5、圖 6所示,生成率數值見表1.
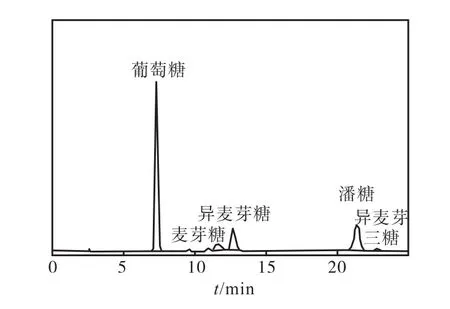
圖5 Glu-A轉苷作用產物液相分析圖譜Fig. 5 HPLC of Glu-A transferred maltose
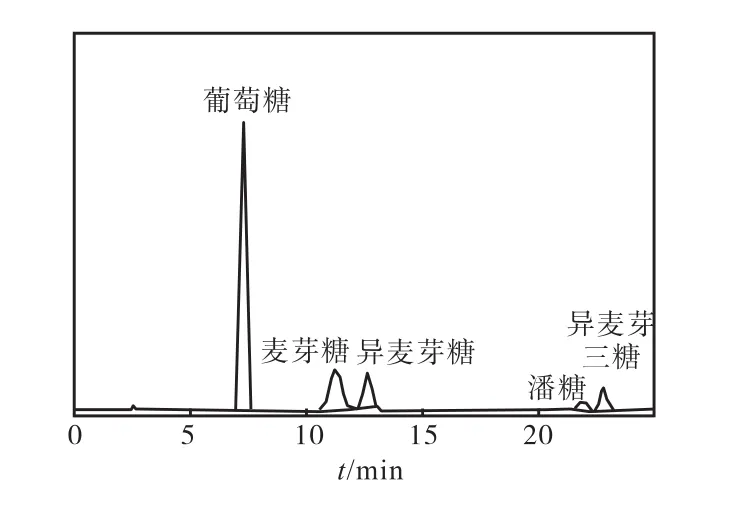
圖6 Glu-B轉苷作用產物液相分析圖譜Fig. 6 HPLC of Glu-B transferred maltose
通過圖5、圖6及表1可以發現,不同目的基因來源于黑曲霉的兩種畢赤酵母工程菌所產α-葡萄糖苷酶轉苷麥芽糖的結果不同.Glu-A轉化麥芽糖生成潘糖的效率最高,潘糖的生成率達到了 31.41%,其次為異麥芽糖的生成率為 15.79%,最低為異麥芽三糖,生成率為 4.18%.Glu-B轉化麥芽糖生成的產物中異麥芽糖及異麥芽三糖的生成率較高,分別為 16.71%、15.85%,潘糖最低,為4.15%.這一結果可能是由于這兩種不同的α-葡萄糖苷酶基因序列的差異,以及氨基酸組成的不同而導致轉苷過程中對葡萄糖苷元的偏好不同,出現了不同的轉苷結果[6].
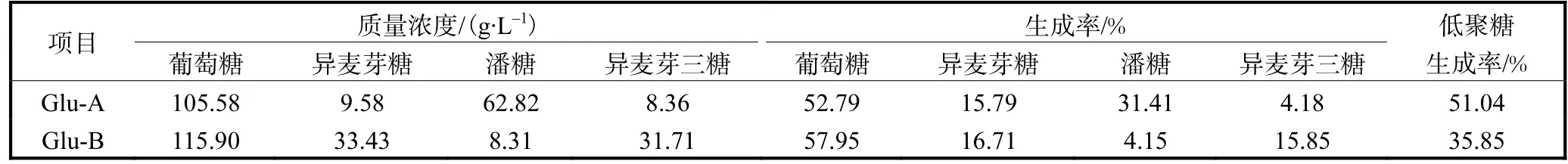
表1 兩種α-葡萄糖苷酶轉苷作用結果Tab. 1 Results of two α-transglucosidase transferred maltose
3 討 論
通過對本實驗室保存的畢赤酵母重組菌株P.,pastoris A和P.,pastoris B所表達的α-葡萄糖苷酶酶學性質進行研究發現,兩種酶的酶學性質基本相同.Glu-A和 Glu-B的最適溫度均為 50,℃,10~60,℃時酶活力均保持相對穩定狀態.最適溫度比報道中黑曲霉所產的α-葡萄糖苷酶最適反應溫度55,℃略低[7].兩種酶的最適pH分別為5、6;pH穩定性范圍分別為 5~6和 5~7,pH穩定范圍具有一定的差異性,Glu-B pH穩定范圍較Glu-A的pH穩定范圍寬.日本田野制藥株式會社所生產的α-葡萄糖苷酶最適反應溫度為 65,℃,最適 pH為 5.0[8].在轉苷作用方面,不同基因編碼的α-葡萄糖苷酶具有不同的轉苷效果,Glu-A和 Glu-B轉苷麥芽糖后,總低聚異麥芽糖生成率分別為51.04%和35.85%,Chen等[9]從黑曲霉中獲得α-葡萄糖苷酶基因構建載體并在畢赤酵母工程菌中表達,所得酶以異麥芽糖為底物進行轉苷反應,總低聚異麥芽糖生成率為 26%.本文中的Glu-A偏向于將α-1,4糖苷鍵打開,使游離出的葡萄糖殘基轉移到麥芽糖上形成α-1,6糖苷鍵,因而麥芽糖轉苷產物中潘糖的量高.而 Glu-B則偏向于將α-1,4糖苷鍵打開,使游離出的葡萄糖殘基轉移到葡萄糖和異麥芽糖上形成α-1,6糖苷鍵,最終轉苷產物中異麥芽糖及異麥芽三糖的量較高.本實驗證實Glu-A和 Glu-B雖然都來源于黑曲霉,但α-葡萄糖苷酶的酶學性質及轉苷作用存在著一定的差異性,這將為利用不同α-葡萄糖苷酶轉苷作用生產低聚異麥芽糖的研究提供依據和參考.
[1] 童星,唐秋嵩,吳玉飛,等. 黑曲霉α-葡萄糖苷酶基因的克隆及其在畢赤酵母中的表達[J]. 微生物學報,2009,49(2):262-268.
[2] 謝振榮,幕躍林,顏麗娟,等. α-葡萄糖苷酶高產菌株HB-9-5的選育及產酶條件的優化[J]. 生物技術通報,2010(6):206-211.
[3] 楊捷琳,孟遜,黃應峰,等. 阪崎腸桿菌α-葡萄糖苷酶基因克隆、表達及活性研究[J]. 食品科學,2008,29(2):213-217.
[4] 王繼瑞,張云開,覃曉娟,等. α-葡萄糖苷酶基因序列分析及真核表達載體的構建[J]. 生物技術,2009,19(5):1-4.
[5] 黃金蓮,黃秀娟,鐘振聲. α-轉移葡萄糖苷酶的轉苷作用機理探究[J]. 食品工業科技,2012,33(7):108-111.
[6] Krohn B M,Lindsay J A. Purification and characterization of a thermostable α-glucosidase from a Bacillus subtilis high-temperature growth transformant[J]. Current Microbiology,1991,22(5):273-278.
[7] 畢金峰,魏寶東. α-轉移葡萄糖苷酶粗酶液的酶學性質[J]. 食品科學,2005,26(2):75-78.
[8] B?er E,Steinborn G,Kunze G,et al. Yeast expression platforms[J]. Applied Microbiology and Biotechnology,2007,77(3):513-523.
[9] Chen D,Tong X,Chen S,et al. Heterologous expression and biochemical characterization of α-glucosidase from Aspergillus niger by Pichia pastroris[J] Journal of Agricultural and Food Chemistry,2010,58(8):4819-4824.
兩種α -葡萄糖苷酶的酶學性質及轉苷作用
王舒雅,胡頓吉,劉逸寒,李 玉
Enzymatic Properties and the Transglycosidation of Two α-glucosidase
WANG Shuya,HU Dunji,LIU Yihan,LI Yu
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,National Engineering Laboratory for Industrial Enzymes,Tianjin Key Laboratory of Industrial Microbiology,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
The hydrolytic and transglycosidational activities vary for different α-transglucisidases derived from Aspergillus niger. These differences can affect their practical applications. Two α-transglucosidases, Glu-A and Glu-B,were expressed in Pichia pastoris to investigate their enzymatic properties. Results showed that the optimum temperature for both αtransglucisidases Glu-A and Glu-B was 55,℃,with an optimum pH at 5 and 6,respectively. Studies of Glu-A and Glu-Bwith maltose as the substrate revealed significant differences in their transglycosidational activities in terms of the compositionof their products,with Glu-A producing 51.04% oligosaccharide,15.79% isomaltose,31.41% panose,and 4.18% isomaltotriose versus corresponding products of 35.85%,16.71%,4.15%,and 15.85% generated by Glu-B.
α-glucosidase;isomaltose;enzymatic properties;transglycosidation
Q814.9 文獻標志碼:A 文章編號:1672-6510(2015)02-0021-04
10.13364/j.issn.1672-6510.20140071
2014-05-07;
2014-07-16
國家高技術研究發展計劃(863計劃)資助項目(2013AA102106-07);教育部“長江學者和創新團隊發展計劃”項目(IRT1166)
王舒雅(1987—),女,山東煙臺人,碩士研究生;通信作者:李 玉,教授,liyu@tust.edu.cn.
周建軍

