例析電化學中多池問題的類型及解答要點
王開山
類型一、原電池型
原電池型是指多池構成原電池.根據電極及電解質溶液分析清楚正負極和電解質溶液中陰陽離子定向移動的方向是關鍵.
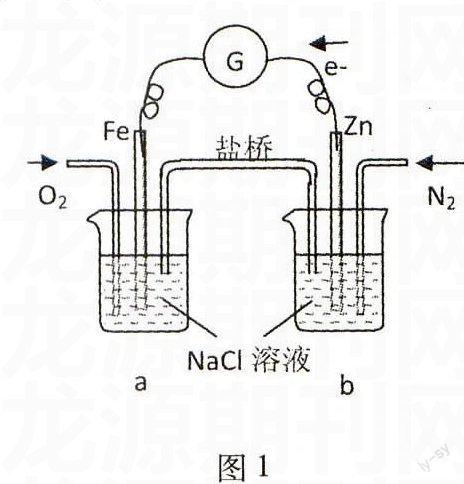
例1根據圖1,下列判斷中正確的是( ).
A.燒杯a中的溶液pH升高
B.燒杯b中發生氧化反應
C.燒杯a中發生的反應為2H++2e-H2
D.燒杯b中發生的反應為2Cl--2e-Cl2
解析由圖分析,外電路為負極Zn失去電子發生氧化反應:Zn-2e-Zn2+,O2在正極Fe上得到電子發生還原反應:O2+4e-+2H2O4OH-;內電路為鹽橋中陰陽離子定向移動(陽離子向a燒杯移動,陰離子向b燒杯移動).
答案:AB
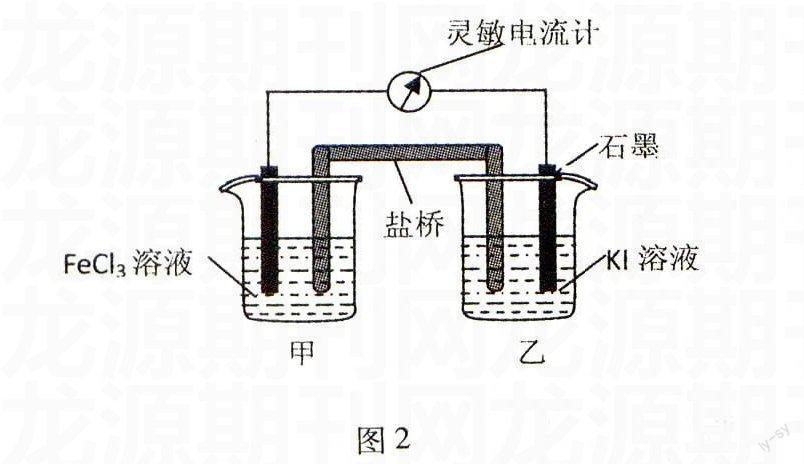
例2控制適合的條件,將反應2Fe3++2I-2Fe2++I2設計成如圖2所示的原電池.下列判斷不正確的是( ).
A.反應開始時,乙中石墨電極上發生氧化反應
B.反應開始時,甲中石墨電極上Fe3+被還原
C.電流計讀數為零時,反應達到化學平衡狀態
D.電流計讀數為零后,在甲中溶入FeCl2固體,乙中石墨電極為負極
解析由圖分析,反應開始時,I-在乙中石墨電極上失去電子,即2I--2e-I2,發生氧化反應,為負極.Fe3+在甲中石墨電極上得到電子.即2Fe3++2e-2Fe2+,發生還原反應,為正極.當2Fe3++2I-2Fe2++I2建立平衡時,電流計讀數為零.在甲中溶入FeCl2固體,Fe2+濃度增大,平衡向逆反應方向移動,甲燒杯中的Fe2+在石墨上失去電子發生氧化反應,為負極.乙燒杯中的I2得到電子發生還原反應,為正極.
答案:D.
類型二、外接電源電解池型
外接電源電解池型是指外接的一個電源,電解多個串聯在一起的燒杯中的電解質溶液.每個燒杯中電子轉移的數目相等.
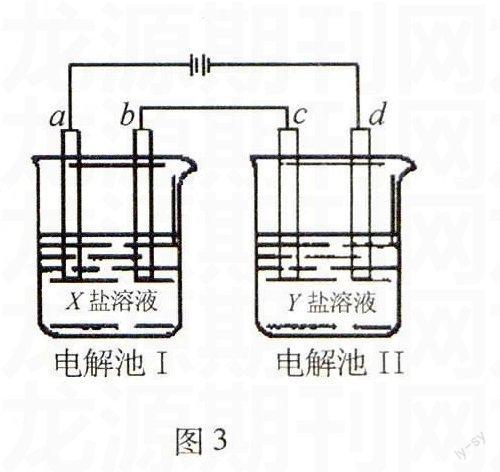
例3圖3所示的電解池Ⅰ和Ⅱ中,a、b、c和d均為Pt電極.電解過程中,電極b和d上沒有氣體逸出,但質量均增大,且增重b 選項XY A MgSO4CuSO4 B AgNO3Pb(NO3)2 CFeSO4Al2(SO4)3 D CuSO4AgNO3 解析圖中整套裝置為電解池,兩個燒杯為串聯,兩個燒杯中電子轉移的數目相等.根據電解池工作原理,四個選項逐個代入,符合題意的只有D項. 答案:D 例4圖4所示裝置中,甲、乙、丙三個燒杯依次分別盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,電極均為石墨電極. 圖4 (1)接通電源,經過一段時間后,測得丙中K2SO4濃度為10.47%,乙中c電極質量增加.據此回答問題: ①電源的N端為 極; ②電極b上發生的電極反應為 ; ③列式計算電極b上生成的氣體在標準狀態下的體積 ; ④電極c的質量變化是 g; ⑤電解前后各溶液的酸、堿性大小是否發生變化,簡述其原因: 甲溶液 ; 乙溶液 ; 丙溶液 ; (2)如果電解過程中銅全部析出,此時電解能否繼續進行,為什么? 解析圖中整套裝置為電解池,三個燒杯為串聯,三個燒杯中電子轉移的數目相等.根據c電極質量增加,可知c極上發生了Cu2++2e-Cu的反應,c極為陰極,則a極為陰極,b極為陽極,d極為陽極.電源的N端就為正極.電極b上發生的電極反應為:4OH--4e-O2+2H2O.經過一段時間后,測得丙中K2SO4濃度從10%變為10.47%.設電解掉的水為m g,即100×10%=(100-m)× 10.47%,解得m=4.5 g. 可建立如下關系式: 2H2O ~ 4e- ~O2 ~ 2Cu 36 22.4 128 4.5 g V m(Cu) 解得:V=2.8 Lm(Cu)=16 g 電解甲燒杯相當于電解水,NaOH溶液的濃度會增大,溶液的堿性增強; 電解乙燒杯會生成H2SO4,溶液的酸性增強; 電解丙燒杯相當于電解水,K2SO4溶液的濃度會增大,溶液的酸堿性不變. 電解過程中銅全部析出后,乙燒杯中的溶液為稀硫酸,電解過程還會繼續,此時相當于在電解稀硫酸溶液. 答案:⑴①正極;②4OH--4e-O2+2H2O;③2.8L;④增重16g;⑤電解甲燒杯相當于電解水,NaOH溶液的濃度會增大,溶液的堿性增強; 電解乙燒杯會生成H2SO4,溶液的酸性增強; 電解丙燒杯相當于電解水,K2SO4溶液的濃度會增大,溶液的酸堿性不變. (2)電解能繼續進行.因為當電解過程中銅全部析出后,乙燒杯中的溶液為稀硫酸,此時相當于在電解稀硫酸溶液(實質是電解水). 類型三、電解外部電解質溶液型 電解外部電解質溶液型是指多個池構成一個電源電解外部的電解質.分析清楚多個池構成電源的正負極是解答這一類試題的關鍵. 例5將圖5所示實驗裝置的K閉合,下列判斷正確的是( ). A.Cu電極上發生還原反應 B.電子沿Zn→a→b→Cu路徑流動 C.片刻后甲池中c(SO2-4)增大 D.片刻后可觀察到濾紙b點變紅色 解析甲、乙兩個燒杯構成原電池(電源)電解濾紙上的電解質溶液.其中Zn為負極,發生氧化反應:Zn-2e-Zn2+;Cu為正極,發生還原反應: Cu2++2e-Cu.a為陰極,a點處發生還原反應:2H++2e-H2,b為陽極,b點處發生氧化反應:4OH--4e-O2+2H2O .外電路電子的移動方向為Zn→a,b→Cu,內電路離子的移動方向為鹽橋中陰離子向甲燒杯移動,陽離子向乙燒杯移動;濾紙上的H+向a點移動,OH-向b點移動.
答案:A
類型四、自身電解型
自身電解型是指一部分池構成電源電解另外一部分池中的電解質,整套裝置為電解池.分析清楚電源的正負極以及電子的數目是解答這一類試題的關鍵.
例6新型高效的甲烷燃料電池采用鉑為電極材料,兩電極上分別通入CH4和O2,電解質為KOH溶液.某研究小組將兩個甲烷燃料電池串聯后作為電源,進行飽和氯化鈉溶液電解實驗,如圖6所示:
回答下列問題:
(1)甲烷燃料電池正極、負極的電極反應分別為 、 ;
(2)閉合K開關后,a、b電極上均有氣體產生,其中b電極上得到的是 ,電解氯化鈉溶液的總反應方程式為 ;
(3)若每個電池甲烷通入量為1L(標準狀況),且反應完全,則理論上通過電解池的電量為 (法拉第常數F=9.65×104C·mol-1,列式計算),最多能產生的氯氣體積為 L(標準狀況).
解析 該裝置是兩個串聯的燃料電池電解NaCl飽和溶液.CH4燃料電池的電解質溶液為KOH堿性環境,則正負極反應式分別為:2O2+4H2O+8e-8OH-,CH4+10OH--8e-CO2-3+7H2O.閉合K開關后,a電極為陽極,發生的電極反應式為:2Cl--2e-Cl2↑,b電極為陰極,發生的電極反應式為:2H++2e-H2↑.總反應式為:2NaCl+2H2O電解2NaOH+H2↑+Cl2↑.
根據通入甲烷的量和電子轉移的數目,可知理論上通過電解池的電量為:
1 L22.4 L·mol-1×8×
9.65×104C·mol-1,最多能產生氯氣的量為通入甲烷量的4倍,即4 L.
答案:(1) 2O2+4H2O +8e-8OH-
CH4+10OH--8e-CO2-3+7H2O
(2)H2
2NaCl+2H2O電解2NaOH+H2↑+Cl2↑
(3) 1L22.4 L·mol-1×8×9.65×104C·mol-1=3.45×104C 4 L
例7某同學組裝了圖7所示的電化學裝置,電極Ⅰ為Al,其它均為Cu,則( ).
A. 電流方向:電極Ⅳ→A→電極Ⅰ
B. 電極Ⅰ發生還原反應
C. 電極Ⅱ逐漸溶解
D. 電極Ⅲ的電極反應:Cu2++2e- Cu
解析由題意可知,該裝置的Ⅰ、Ⅱ是原電池的兩極,Ⅰ是負極,Ⅱ是正極,Ⅲ、Ⅳ是電解池的兩極,其中Ⅲ是陽極,Ⅳ是陰極,所以電流方向:電極Ⅳ→電流計→電極Ⅰ,A正確;電極I是原電池的負極,發生氧化反應,B錯誤;電極Ⅱ是原電池的正極,發生還原反應,有Cu析出,C錯誤;電極Ⅲ是陽極,發生氧化反應,電極反應是Cu-2e-Cu2+,D錯誤. 答案:A
解答要點
(1)通過分析外電路電子的定向移動和內電路離子的定向移動,判斷整套多池裝置是原電池還是電解池;
(2)在進行分析時要注意:“電子不下水,離子不上岸”的工作原理.如例6中電子的數目不能計算成2L甲烷產生的.
(3)多池裝置進行計算時,電子是其中的橋梁,通過電子的數目可搭建起已知量和未知量之間的關系.
跟蹤練習:
1.鉛蓄電池的工作原理為:Pb+PbO2+2H2SO42PbSO4+2H2O研讀右圖,下列判斷不正確的是( ).
A.K閉合時,d電極反應式:PbSO4+2H2O-2e-PbO2+4H++SO2-4
B.當電路中轉移0.2 mol電子時,Ⅰ中消耗的H2SO4為0.2 mol
C.K閉合時,Ⅱ中SO2-4向c電極遷移
D.K閉合一段時間后,Ⅱ可單獨作為原電池,d電極為正極
答案:C
(收稿日期:2015-01-10)

