毛細管電泳法在酶抑制劑篩選中的應用
劉冬梅 師彥平 陳娟

摘 要 毛細管電泳法以其分離效率高、耗時短、樣品用量少、靈敏度高以及易于實現自動化等諸多特點,在篩選酶抑制劑研究中有著不可替代的優勢。本文綜述了毛細管電泳法在酶抑制劑篩選中的應用。主要介紹了應用最廣泛的離線分析(Off-line assay)和在線分析(In-line assay),即柱前酶反應(Pre-capillary enzyme reaction)和在柱酶分析(In-capillary enzyme reaction)。并對該領域的未來發展進行了展望。
關鍵詞 毛細管電泳; 酶抑制劑; 柱前酶反應; 在柱酶反應; 綜述
1 引 言
人類疾病的產生往往與體內各種酶的異常表達有關,如果酶的活性異常高于正常水平,則會引起機體功能紊亂,引發疾病的產生。如乙酰膽堿酯酶(AChE)過多,則會過度分解神經遞質乙酰膽堿,從而引起阿爾茨海默癥(老年癡呆癥)和肌無力【1】; 酪氨酸酶(TRS)是黑色素合成的關鍵酶和限速酶,TRS活性過高則會引起黑色素沉積,引發皮膚色素性疾病【2】。通過抑制關鍵酶來干預治療已經成為現代醫學很有吸引力的戰略,目前有相當一部分臨床藥物來自酶抑制劑【3】。
酶抑制劑篩選的傳統途徑有放射性同位素法、薄層色譜法、電化學法、分光光度法和高效液相色譜法等,這些方法雖然已經非常成熟,但是仍然存在一些不可避免的缺陷【4】。毛細管電泳法以其分離效率高、耗時短、樣品用量少、易于實現自動化等諸多特點,特別是高效分離機制,在酶抑制劑篩選中顯示出傳統方法無法比擬的優勢。而且,毛細管電泳法可以結合多種檢測方法,如紫外、激光誘導熒光、質譜、電化學以及輻射檢測【5】等進行目標物的分析,其中,紫外檢測以其成本低、操作方便、環境友好等優勢成為最廣泛使用的檢測方法。
毛細管電泳-紫外檢測的靈敏度受到待分析物濃度的限制。通過增加檢測光程或樣品濃縮富集可提高檢測靈敏度【6】,例如改變檢測池的幾何形狀,包括泡形池、Z形池和多次反射池來增加檢測光程,以及零電壓效應、樣品堆積、場放大堆積和場放大進樣等濃縮富集技術提高檢測的靈敏度。Iqbal等【7】在監測核苷酸焦磷酸酶和磷酸二酯酶的反應時,在內壁涂層為聚凝胺陽離子的毛細管內,將聚凝胺加到緩沖溶液中,利用產物與聚凝胺電遷移方向相反,使得產物堆積來提高檢測靈敏度。也可以通過將樣品溶解在水中,或者采用稀釋的緩沖液使樣品堆積【8】。
毛細管電泳法篩選酶抑制劑主要有4種形式:柱前酶反應(Pre-capillary enzyme reaction)、毛細管進樣端反應(At-inlet reaction)、電泳中介微分析(EMMA)、層流剖面的橫向擴散(TDLFP)技術, 其中,At-inlet、EMMA和TDLFP都屬于在柱酶反應(In-capillary enzyme reaction)。下面將對這幾種形式進行總結論述。
2 柱前酶反應
離線分析(Off-line assay)就是反應物首先在毛細管之外混合,加入底物、酶或輔酶引發反應,經特定時間的孵育之后采取適當的方法猝滅酶促反應,然后將樣品注入毛細管電泳中進行分離檢測,通過測定產物或是底物的峰面積變化來進行酶促反應動力學、抑制動力學的研究以及抑制劑的篩選【9,10】。在柱前酶反應中,毛細管電泳只作為分離系統使用。
辛志宏等【11】利用毛細管離線分析測定了血管緊張素轉化酶抑制劑Captopril的活性,優化了反應、分離條件,可以準確、簡便、快速的分析Captopril的抑制活性,并且為進一步篩選血管緊張素轉化酶抑制劑提供了篩選模型。栗娜等【12】利用毛細管電泳法測定了雞肝二氫葉酸還原酶的活力,測定已知抑制劑的半數抑制濃度,與文獻數值相比較,證明該體系可用于二氫葉酸還原酶抑制劑的篩選。賈蕊等【13】使用柱前酶反應與EMMA進行了二氫葉酸還原酶抑制劑的篩選,比較兩種反應模式所得實驗結果,發現柱前反應模式檢測靈敏度高,遷移時間和峰面積重現性好,并且易于控制。種蕾等【14】由可口革囊星蟲粗提物中篩選出7種對神經氨酸酶有抑制活性的粗提物,實驗中優化了反應和分離分析條件,建立的模型可用于復雜體系中抗流感病毒藥物神經氨酸酶抑制劑的篩選。Iqbal等【15】使用離線毛細管電泳法篩選和鑒定了腺苷激酶的抑制劑和底物。實驗中底物和產物可以高效分離,使用標準抑制劑進行實驗,與標準放射方法相比,兩者抑制動力學常數Ki相近,證明了建立的篩選模型的可靠性和準確性。Chen等【16】測定了20S蛋白酶對多肽底物MG132和MG115的實時水解,以及一系列化合物對其抑制效果。37 ℃下混合底物和酶溶液引發酶促反應,冰浴中浸沒10 min猝滅反應,離心后將上清液注入毛細管內進行分離檢測。李冰等【17】使用蛋白-脂質體復合物進行柱外篩選單胺氧化酶(MAO)抑制劑,通過加入含EDTA和Na2S2O5的HClO4溶液猝滅反應,與傳統的MAO抑制劑篩選方法相比簡單、快速、節省酶源、干擾因素少。Bryant等【18】使用此模式研究了乙酰輔酶A羧化酶,實驗中將生物素羧化酶和羧基轉移酶加入含有抑制劑的反應混合物中,反應一段時間將混合物注入毛細管中分離。該研究允許同時篩選生物素羧化酶和羧基轉移酶的抑制劑。Iqbal等【19】使用柱前酶反應進行了碳酸酐酶的酶促反應動力學和抑制反應動力學研究。他們將碳酸酐酶和底物4-硝基苯基乙酸酯在37 ℃下孵育10 min,降溫終止反應,隨后將反應混合物注入毛細管內,施加電壓進行產物4-硝基苯酚的分離檢測。Malina等【20】也使用了柱前酶反應進行磷酸果糖激酶-1的酶促反應動力學和抑制反應動力學研究,使用毛細管電泳進行產物與底物的分離,減少了抑制劑對產物的干擾,從而減少了假陽性,所得半數抑制濃度與耦合分光光度法相符。
離線分析中酶促反應和毛細管電泳分離是兩個獨立的體系,因此其條件可以分別優化,不會對彼此產生干擾。但該方法存在局限性:第一,酶促反應很快,所以混合物在注入毛細管之前,必須通過加入試劑或者改變反應條件來猝滅反應; 第二,盡管毛細管分離檢測只需要納升級的樣品量,但是引發反應仍需要大量反應物,造成試劑浪費。在柱酶反應模式的出現彌補了上述不足。endprint
3 在柱酶反應
在柱酶反應,毛細管不僅可以用作分離通道,同時也可以用作反應容器,酶可以被固定,或以自由酶存在于溶液中。該模式具有以下優點:反應溶液體積只需納升級【21】,與柱前反應相比減少了試劑用量,大大降低了分析成本; 集進樣、混合、反應、分離和檢測于一個封閉的毛細管內,提高了分析效率; 有利于實現酶分析的自動化和微型化【22】。在柱酶反應可以分為EMMA、At-inlet和TDLFP三類。
3.1 電泳中介微分析(EMMA)
為解決柱前酶反應中樣品消耗量大、無法實現自動化等缺陷,Bao和Regnier【23】首次報導了在線電泳酶分析,該模式后來被命名為電泳中介微分析(EMMA)。EMMA是在電場作用下利用反應物在緩沖液中表觀遷移速率的差異來實現反應物在柱內混合,從而引發酶促反應,隨后反應物和產物在毛細管內被分離為獨立的區帶至檢測器被檢測。在該模式中,酶與試劑的混合是在電場作用下的混合,無額外稀釋和區帶展寬效應。根據電場下反應物在毛細管內進樣和混合模式,EMMA可以分為兩類,即連續模式和區帶-區帶模式。
3.1.1 連續模式
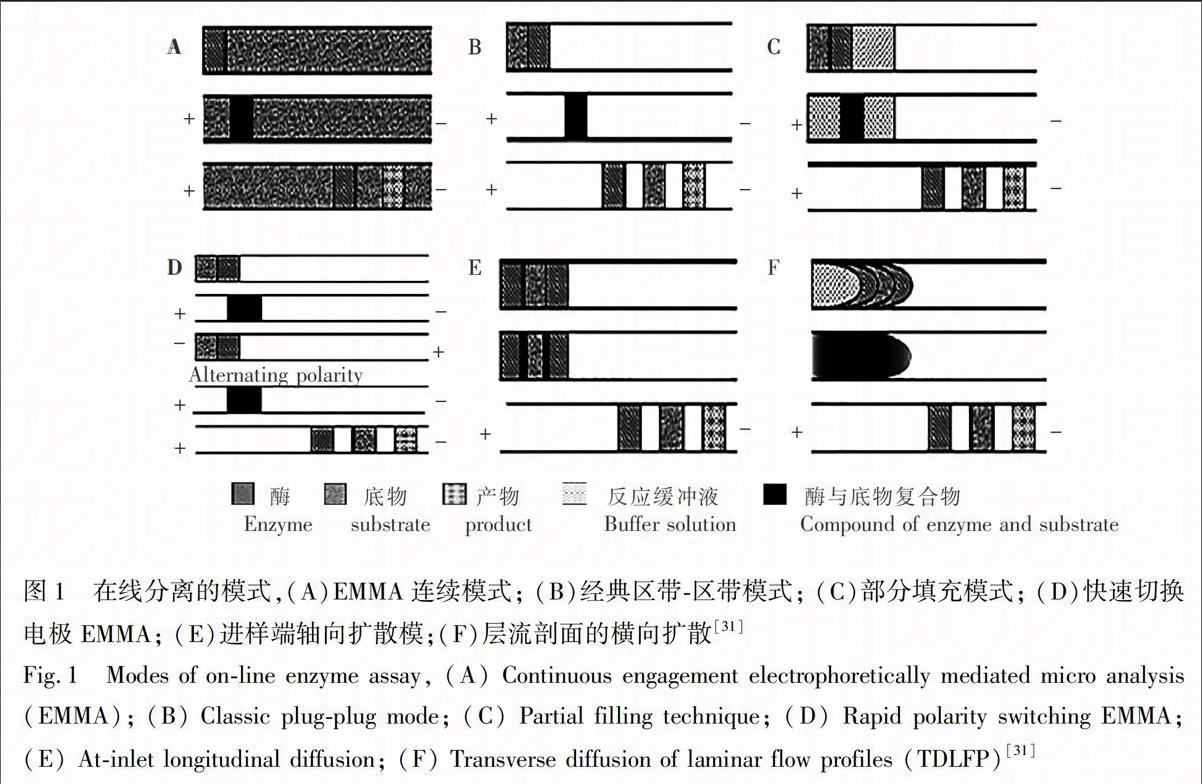
連續模式是毛細管內預先充滿一種反應物,根據第二種反應物的注射方式可分為兩類:帶狀注射法(圖1A)和移動界面注射法。Bao和Regnier【23】發展了帶狀注射法,并以葡萄糖-6-磷酸脫氫酶為模型對其進行驗證。毛細管內預先充滿含有底物葡萄糖-6-磷酸和輔酶NADH的運行緩沖液,酶溶液獨立存在于一個進樣瓶中,以區帶模式進樣,反應物在電場作用下混合引發酶促反應,隨后反應物和產物在毛細管內被分離為獨立的區帶至檢測器被檢測。Harmon等【24】發展了移動界面注射法,以亮氨酸氨肽酶為模型對其進行驗證。毛細管內預先充滿遷移速度小的酶溶液,遷移速度大的底物L-亮氨酸-4-硝基苯胺溶液保存于進樣端的緩沖液儲液瓶中連續進樣。帶狀注射法中,第二種反應物一旦進樣就不會再有新的反應物進入毛細管內,而移動界面注射法在整個運行過程中都有新的底物注入毛細管內,從而增加了底物與酶的接觸時間,增加產物產量,提高檢測靈敏度。
3.1.2 區帶-區帶模式 根據毛細管內孵育緩沖液和背景電解質溶液的異同,區帶-區帶模式可以分為兩類,即經典區帶-區帶模式和部分填充模式。
經典區帶-區帶模式(圖1B)中反應緩沖液和分離緩沖液為同一種緩沖液,預先在毛細管內充滿緩沖液,然后按照表觀遷移速度由小到大的順序將反應物以區帶模式注入毛細管內。施加較小的電壓之后,表觀遷移速度大的反應物在毛細管內流速快,與表觀遷移速度小的反應物混合重疊,從而引發酶促反應。可以通過關閉電壓來延長反應時間,從而增加產物量,提高檢測靈敏度。經孵育之后,增加電壓分離產物和殘余反應物。
與連續模式相比,區帶-區帶模式只需要一小段的反應物,反應物用量少,反應成本低,因此區帶-區帶模式是EMMA中最常用的。然而,在經典區帶-區帶模式中,緩沖液既要有利于酶促反應進行,又要有利于產物和反應物的分離,因此仍存在一定的局限性。van Dyck等【25】在研究牛血清胺氧化酶時,發現酶在背景電解質溶液中不能穩定存在,因此提出了部分填充模式,即毛細管的一部分填充有利于酶促反應的孵育緩沖液,剩余部分填充背景電解質溶液來實現產物和反應物的分離。一般,為了防止背景電解質溶液對酶促反應體系產生干擾,則在反應物之前注入一小段孵育緩沖液將酶與背景電解質溶液隔開(圖1C)。
EMMA在篩選中藥提取物中酶抑制劑時具有很大優勢。由于α-葡萄糖苷酶的酶促反應體系最適孵育緩沖液為磷酸緩沖液(pH 7.0),而有利于產物和反應物分離的最適分離緩沖液硼砂(pH 9.2)對酶有滅活作用,所以EMMA部分填充技術被應用于α-葡萄糖苷酶抑制劑的篩選【26】。盡管有報導稱電場作用下混合兩種以上的反應物優化過程繁瑣而且不切實際【27】,但是,Zhang等【5】在對細胞色素P450進行動力學研究時成功地發展了在柱電泳混合3個反應物區帶的方法。Zhao等【28】借鑒此方法由中藥中篩選了芳香化酶抑制劑,毛細管內樣品注射順序為輔酶、孵育緩沖液、芳香化酶、抑制劑和底物混合液,施加電壓混合反應物,通過產物的峰面積來確定酶活,以及篩選抑制劑。此外,在對甘油激酶進行動力學研究時,Nehmé等【29】在EMMA部分填充技術的基礎上首次發展了在線混合至少4個反應物區帶的方法,反應物的注射順序為:孵育緩沖液、抑制劑、ATP、甘油激酶、甘油,這種方法避免了預先混合底物和抑制劑這一步驟,從而減小了工作量。
為了提高EMMA的分離速度和靈敏度,Sanders等【30】基于區帶-區帶模式提出了快速轉換電壓極性的電泳中介微分析,如圖1D所示:順序進樣酶和底物,底物的表觀遷移速度較大,因此兩者混合; 然后反轉電極,酶和底物與原來相比反向遷移,因此底物與酶分離; 反轉電極,底物與酶再次混合。此模式中,由于兩種反應物的表觀遷移速度的不同,當交替施加正負電壓時,反應物持續快速混合,進而增加產物產量。
圖1 在線分離的模式,(A)EMMA連續模式; (B)經典區帶-區帶模式; (C)部分填充模式; (D)快速切換電極EMMA; (E)進樣端軸向擴散模;(F)層流剖面的橫向擴散【31】
4 結 論
毛細管電泳作為一種高效、快速的分離技術,近年來在酶促反應動力學和抑制動力學研究領域得到廣泛應用并得以快速發展。離線分析中可以對酶促反應條件和分離條件分別進行優化,因此限制因素少。在線分析集進樣、混合、反應、分離和檢測于一體,簡化了操作步驟,縮短了分析時間,與離線分析相比,不僅可以減少試劑消耗,而且可以實現酶反應和檢測的自動化和微型化。毛細管電泳法尤其是在線分析的優勢,使其廣泛地應用于酶抑制劑的篩選中。綜上,在線分析的各種模式都具有各自的優勢,但仍存在一些不足:如電泳中介微分析中酶不能夠被重復利用,與固定化酶微反應器相比也造成了試劑浪費; 但毛細管在線固定化酶微反應器又不能適用于反應緩沖液和分離緩沖液不同的酶促反應體系,而且各種固定方法也存在各自的缺陷; 層流剖面的橫向擴散優化條件繁瑣,而且不能消除由緩沖液造成的稀釋效應。因此,今后的發展方向是:(1)在現有的技術基礎上,尋找新的材料,設計新的酶固定方法,以此同時實現毛細管的再生利用,提高固定化酶的穩定性; (2)設計毛細管電泳篩選酶抑制劑新的在線模式,以彌補上述在線模式的不足之處。隨著毛細管電泳技術的不斷發展完善,該技術應用于酶抑制劑篩選的研究也會愈加成熟。endprint
References
1 da Silva J I, de Moraes M C, Vieira L C, Correa A G, Cass Q B, Cardoso C L. J. Pharm. Biomed. Anal., 2013, 73: 44-52
2 Jiang T F, Liang T T, Wang Y H, Zhang W H, Lv Z H. J. Pharm. Biomed. Anal., 2013, 84: 36-40
3 Brühlmann C, Marston A, Hostettmann K, Carrupt P A, Testa B. Chem. Biodivers., 2004, 1(6): 819-829
4 MI Xuan, ZHU Ruo-Hua, ZHANG Xin-Yue. Chemistry Online, 2010, 09: 778-786
米 璇, 朱若華, 張馨月. 化學通報, 2010, 09: 778-786
5 Zhang J, Hoogmartens J, van Schepdael A. Electrophoresis, 2008, 29(17): 3694-3700
6 Hempel G. Electrophoresis, 2000, 21(4): 691-698
7 Iqbal J, Levesque S A, Sevigny J, Muller C E. Electrophoresis, 2008, 29(17): 3685-3693
8 van Dyck S, Vissers S, van Schepdael A, Hoogmartens J. J. Chromatogr. A, 2003, 986(2): 303-311
9 Yeniceli D, Deng X, Adams E, Dogrukol-Ak D, van Schepdael A. Electrophoresis, 2013, 34(3): 463-470
10 Abromeit H, Kannan S, Sippl W, Scriba G K. Electrophoresis, 2012, 33(11): 1652-1659
11 XIN Zhin-Hong, MA Hai-Le, WU Shou-Yi, DAI Chun-Hua. Acta. Pharm. Suec., 2003, 38(11): 843-845
辛志宏, 馬海樂, 吳守一, 代春華. 藥學學報, 2003, 38(11): 843-845
12 LI Na, ZHANG Xin-Yue, ZHU Ruo-Hua. J. Anal. Sci., 2008, 24(6): 631-635
栗 娜, 張馨月, 朱若華. 分析科學學報, 2008, 24(6): 631-635
13 JIA Rui, LI Na, ZHU Ruo-Hua. Chinese Journal of Chromatography, 2007, 27(02): 189-192
賈 蕊,栗 娜,朱若華. 色譜, 2007, 27(02): 189-192
14 ZHONG Lei,ZHANG Ya-Xi, WANG Nan, JIANG Ting-Fu, LV Zhi-Hua. Chinese J. Mar. Drugs, 2014, 33(06): 47-51
種 蕾, 張亞西, 王 楠, 姜廷褔, 呂志華. 中國海洋藥物, 2014, 33(06): 47-51
15 Iqbal J, Burbiel J C, Muller C E. Electrophoresis, 2006, 27(12): 2505-2517
16 Chen W, Mou K, Xu B, Ling X, Cui J, Xu P. Anal. Biochem., 2009, 394(1): 62-67
17 LI Bing, LV Xue-Fei, QING Hong, DENG Yu-Lin. Chinese J. Anal. Chem., 2012, 40(9): 1336-1340
李 冰, 呂雪飛, 慶 宏, 鄧玉林. 分析化學, 2012, 40(9): 1336-1340
18 Bryant S K, Waldrop G L, Gilman S D. Anal. Biochem., 2013, 437(1): 32-38
19 Iqbal S, Nisar-ur-R, Iqbal J. Anal. Biochem., 2014, 444: 16-21
20 Malina A, Bryant S K, Chang S H, Waldrop G L, Gilman S D. Anal. Biochem., 2014, 447: 1-5
21 Urban P L, Goodall D M, Bergstrm E T, Bruce N C. Electrophoresis, 2007, 28(12): 1926-1936
22 Fan Y, Scriba G K. J. Pharm. Biomed. Anal., 2010, 53(5): 1076-1090
23 Bao J, Regnier F E. J. Chromatogr. A, 1992, 608(1): 217-224endprint
24 Harmon B J, Leesong I, Regnier F E. J. Chromatogr. A, 1996, 726: 193-204
25 Dyck SV,van Schepdael A, Hoogmartens J. Electrophoresis, 2001, 22(7): 1436-1442
26 Guo L P, Jiang T F, Lv Z H, Wang Y H. J. Pharm. Biomed. Anal., 2010, 53(5): 1250-1253
27 Krylova S M, Okhonin V, Krylov S N. J. Sep. Sci., 2009, 32(5-6): 742-756
28 Zhao H, Chen Z. J. Sep. Sci., 2013, 36(16): 2691-2697
29 Nehmé H, Nehmé R, Lafite P, Routier S, Morin P. J. Sep. Sci., 2013, 36(13): 2151-2157
30 Sanders B D, Slotcavage R L, Scheerbaum D L, Kochansky C J, Strein T G. Anal. Chem., 2005, 77(8): 2332-2337
31 Hai X, Yang B F, Schepdael A V. Electrophoresis, 2012, 33(1): 211-227
32 Taga A, Honda S. J. Chromatogr. A, 1996, 742(1-2): 243-250
33 Iqbal J, Vollmayer P, Braun N, Zimmermann H, Muller C E. Purinergic Signalling., 2005, 1(4): 349-358
34 Wang T, Zhang Q, Zhang Y, Kang J. J. Chromatogr. A, 2014, 1337: 188-193
35 Nehmé H, Nehmé R, Lafite P, Routier S, Morin P. Anal. Chim. Acta, 2012, 722: 127-135
36 Iqbal J, Iqbal S, Müller C E. Analyst, 2013, 138(11): 3104-3116
37 JI Xiao-Wen, ZHAO Shu-Lin, LIN Pin-Tan, YE Fang-Gui, HU Kun. Chinese J. Anal. Chem., 2009, 37(A02): 128
冀曉雯, 趙書林, 林娉毯, 葉芳貴, 胡 坤. 分析化學, 2009, 37(A02): 128
38 Iqbal J. Anal. Biochem., 2011, 414(2): 226-231
39 Tang Z M, Kang J W. Anal. Chem., 2006, 78(8): 2514-2520
40 Yin Z, Zhao W,Tian M, Zhang Q, Guo L, Yang L. Analyst., 2014, 139(8): 1973-1979
41 Zhao S, Ji X, Lin P, Liu Y M. Anal. Biochem., 2011, 411(1): 88-93
42 Lin P, Zhao S, Lu X, Ye F, Wang H. J. Sep. Sci., 2013, 36(15): 2538-2543
43 LIN Pin-Tan, LU Jun-Yu, YE Gui-Fang, ZHAO Shu-Lin. National Biomedical Chromatography and Related Techniques of Academic Exchanges (2012) the Conference Brochure, 2012
林娉毯, 陸俊宇, 葉芳貴, 趙書林. 全國生物醫藥色譜及相關技術學術交流會(2012)會議手冊, 2012
44 Zhang A, Ye F, Lu J, Zhao S. Food Chem., 2013, 141(3): 1854-1859
45 SHEN Gang-Yi, YU Wan-Ting, ZHANG Ai-Qin, LIU Mei-Rong, WANG Ning. Chinese J. Anal. Lab., 2014, 33(4): 392-394
申剛義, 于婉婷, 張愛芹, 劉美蓉, 王 寧. 分析試驗室, 2014, 33(4): 392-394
46 Min W, Cui S, Wang W, Chen J, Hu Z. Anal. Biochem., 2013, 438(1): 32-38
47 Wang S, Su P, Yang Y. Anal. Biochem., 2012, 427(2): 139-143
48 Zhao H, Chen Z. J. Chromatogr. A, 2014, 1340: 139-145
49 Liu L, Zhang B, Zhang Q, Shi Y, Guo L, Yang L. J. Chromatogr. A, 2014, 1352: 80-86
50 Mu X, Qiao J, Qi L, Liu Y, Ma H. ACS Appl. Mater. Interfaces, 2014, 6(15): 12979-12987
51 Wang S, Su P, Huang J, Wu J, Yang Y. J. Mater. Chem. B, 2013, 1(12): 1749-1754
52 Alex D, Mathew A, Sukumaran R K. Bioresour. Technol., 2014, 167: 547-550
53 Okhonin V, Liu X, Krylov S N. Anal. Chem., 2005, 77(18): 5925-5929
54 Nehmé H, Nehmé R, Lafite P, Routier S, Morin P. J. Chromatogr. A, 2013, 1314: 298-305
55 Nehmé R, Nehmé H, Roux G, Destandau E, Claude B, Morin P. J. Chromatogr. A, 2013, 1318: 257-264endprint

