臍帶間充質干細胞對博來霉素誘導實驗性小鼠肺纖維化模型影響的研究
馮麗君,張穎超
(天津醫科大學 寶坻臨床學院 呼吸科,天津 301800)
?
臍帶間充質干細胞對博來霉素誘導實驗性小鼠肺纖維化模型影響的研究
馮麗君Δ,張穎超
(天津醫科大學 寶坻臨床學院 呼吸科,天津 301800)
目的 探討臍帶間充質干細胞(umbilical cord-mesenchymal stem cells,UC-MSC)對博來霉素誘導的實驗性小鼠肺纖維化中羥基脯氨酸(hydroxyprine,HYP)、活性氧(superoxyde dismutase,SOD)及丙二醛(malonaldehyde,MDA)的含量的影響。方法 采用小鼠氣管內注人博來霉素誘導實驗性小鼠肺纖維化,取第四代UC-MSC細胞通過尾靜脈注射干預,給藥21 d后,處死小鼠獲取肺組織,對其進行病理學切片觀察以及檢測組織中HYP、SOD及MDA的含量來評價UC-MSC對小鼠肺纖維化的影響。結果 病理學染色結果表明,治療組(給予博來霉素+UC-MSC)較模型組(僅給予博來霉素)相比,治療組不僅可降低炎癥細胞的浸潤以及膠原沉積等病理特征,還可降低由博來霉素誘導實驗性小鼠肺纖維化模型中HYP(P<0.01)和MDA(P<0.05)的含量以及增高SOD的含量(P<0.01)。結論 UC-MSC可對由博來霉素誘導的實驗性小鼠肺纖維化具有一定的保護作用。
臍帶間充質干細胞;博來霉素;肺纖維化
特發性肺纖維化(idiopathic pulmonary fibrosis,IPF)一類以彌漫性肺泡炎和肺泡結構紊亂最終導致肺間質纖維化為特征的疾病[1]。目前臨床上尚無確切的治療手段并且其發病機制尚不清晰,因此,尋找治療IPF的治療措施成為研究熱點。間充質干細胞(mesenchymal stem cells,MSC)是一種存在于多種組織中的具有具有自我復制能力和多向分化潛能的干細胞[2]。MSC也是一種理想的種子細胞現已在諸多領域得到廣泛應用諸如組織工程等,其中MSC也可在用于治療與修復肺纖維化等相關疾病[3]。人臍帶來源的間充質干細胞(umbilical cord-mesenchymal stem cells,UC-MSC)是MSC一條重要的來源渠道,可作為細胞治療中一種非常有希望的干細胞替代來源[4]。本研究擬通過博來霉素誘導實驗性小鼠肺纖維化模型并給予UC-MSC干預后,通過檢測肺組織羥基脯氨酸(hydroxyprine,HPY)、活性氧(superoxyde dismutase,SOD)及丙二醛(malonaldehyde,MDA)的含量、組織病理學觀察來評價UC-MSC對肺纖維化的影響,為開發治療IPF新措施提供數據支持。
1 材料與方法
1.1 主要實驗試劑與儀器 新鮮臍帶由天津市寶坻區人民醫院提供(4 ℃保存備用),本試驗臍帶的獲取以及動物實驗[昆明種雌性小鼠150只,體質量(23±3)g,許可證號:TJBDRMH201510]的處置措施經院倫理委員會批準遵循《實驗動物保護條例》。博來霉素購自天津太河制藥有限公司;羥基脯氨酸(HYP)、活性氧(SOD)及丙二醛(MDA)試劑盒購自南京建成生物工程研究所;DMEM/F-12培養基、胎牛血清(fetal calf serum, FBS);胰蛋白酶購自美國Gibco公司;無菌操作臺購自蘇州凈化有限公司,CO2培養箱購自長沙長錦科技公司。其余國產試劑均為分析純。
1.2 方法
1.2.1 UC-MSC的培養與傳代:參照文獻[4],將取得的臍帶經處理后,用眼科剪剪碎成粘稠狀,取適量放人25 cm3的培養瓶中,覆蓋70%~80%培養瓶的底面積即可。然后加入完全培養基(10%胎牛血清的DMEM),吹打混勻。放人無菌培養箱中培養。待培養基變成微黃時更換新鮮培養基,再繼續培養一周可見具有梭形狀的細胞圍繞組織塊邊緣生長;待細胞長滿培養瓶一半時丟棄掉組織塊。每3天更換1次培養液,待細胞長慢瓶底時可進行傳代,按1︰2~1︰3的比例進行傳代,傳至第4代時收集細胞,并制成密度為5×106/mL細胞懸液備用。
1.2.2 實驗分組與處置:參照文獻[5],將實驗動物隨機分為4組每組30只(對照組、UC-MSC組、博來霉素組和博來霉素+UC-MSC組)。第1天,所有小鼠經腹腔內注射戊巴比妥鈉(30 mg/kg)對小鼠進行麻醉后,碘伏消毒,在無菌條件下,于頸部正中縱向剪開皮膚,逐層分離肌肉,暴露氣管。按體重2.5 mg/kg向博來霉素組及博來霉素+UC-MSC組小鼠氣管內一次性注人博來霉素,向對照組和UC-MSC組小鼠氣管內注入相同體積的PBS,最后縫合皮膚,碘伏消毒,注射抗生素,正常飼養,每天記錄小鼠的生長狀況。術后3 d向對照組和博來霉素組通過尾靜脈注入0.9%NaCl,UC-MSC組及博來霉素+UC-MSC組通過尾靜脈注射UC-MSC 0.2 mL(含細胞數1×106個)。治療結束(第21 d)后麻醉小鼠,12只小鼠取肺組織先經10% 福安馬林中保存后制備、脫水、制備石蠟切片進行HE染色和Masson 染色。18只小鼠處死后對肺組織中HYP、SOD及MDA的含量進行檢測。
1.2.3 UC-MSC形態學觀察:參照文獻[4],將UC-MSC傳代至第4代,待細胞長滿培養瓶底部時,棄掉培養基,PBS清洗3遍后更換新鮮的完全培養基。蓋緊瓶蓋,倒置顯微鏡下拍照觀察第4代UC-MSC形態。
1.2.4 小鼠肺組織的病理學變化:參照文獻[5],制備石蠟切片進行HE染色。肺組織經10% 福安馬林固定后,蒸餾水沖洗,經脫水(30%、50%、70%、80%、95%、100%乙醇),二甲苯透明,透臘后進行石蠟包埋,待石蠟完全凝固后取出蠟塊,在切片機上進行切片(厚度5 μm),烘片后經二甲苯脫蠟,梯度酒精水化(100%、95%、85%、75%乙醇),蘇木素染色,酒精分化,伊紅染色,中性樹膠封片。 Masson 染色具體過程如下:石蠟切片按上述脫蠟至水,鉻化處理或去汞鹽沉淀,依次自來水和蒸餾水洗,蘇木素液染核5~10 min。充分水洗,后用Masson 麗春紅酸性復紅液5~10 min,以2%冰醋酸水溶液浸洗片刻,1%磷鉬酸水溶液分化3~5 min,不經水洗,直接用苯胺藍染5 min,以0.2%冰醋酸水溶液浸洗片刻最后95%酒精、無水酒精、二甲苯透明、中性樹膠封片。
1.2.5 肺組織HPY、SOD及MDA含量檢測:參照文獻[5],用組織堿水解法及分光光度法測定各個樣本中HYP的含量,SOD及MDA含量檢測按照試劑盒操作步驟檢測。

2 結果
2.1 UC-MSC形態學觀察 倒置相差顯微鏡下,第4代UC-MSC形態均一,呈梭形的細胞,傳代6~7 d左右細胞長滿瓶底,鋪滿瓶底,可見“鋪路石”樣,細胞質回縮,分裂相少見。見圖1。
2.2 小鼠肺組織的病理學變化 HE結果表明,對照組(見圖2A)與UC-MSC組(見圖2B)小鼠肺組織結構基本正常,未見明顯炎癥細胞浸潤,肺間質未見膠原沉積。博來霉素組小鼠在滴注博來霉素后表現為明顯的急性炎癥反應,肺泡壁水腫,肺間質內可見炎癥細胞浸潤,肺泡間隔增厚,可見大量炎癥細胞浸潤(見圖2C),但是在博來霉素+UC-MSC組的小鼠肺臟炎癥細胞浸潤較博來霉素組減少(見圖2D)。Masson 染色顯示,對照組(見圖3A)與UC-MSC組(見圖3B)小鼠肺組織結構基本正常未見膠原蛋白沉積;博來霉素組小鼠在滴注博來霉素后可見肺泡間隔不同程度的,甚至出現肺實質大片融合性病變,病變區域及輕度病變區域與正常肺組織的混雜分布(見圖3C),但是在博來霉素+UC-MSC組的嚴重程度(見圖3D)較博來霉素組相比嚴重程度有所緩解。上述結果表明UC-MSC可保護博來霉素誘導的誘導實驗性小鼠肺纖維化。
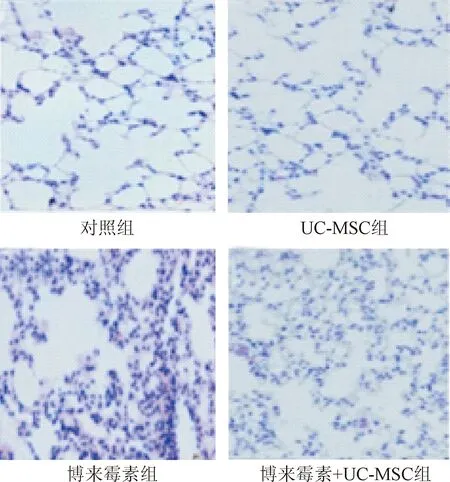
圖2 各組小鼠肺組織 HE 染色 (×200) Fig.2 Histologic evaluation of different groups mouse lung tissues(×200)
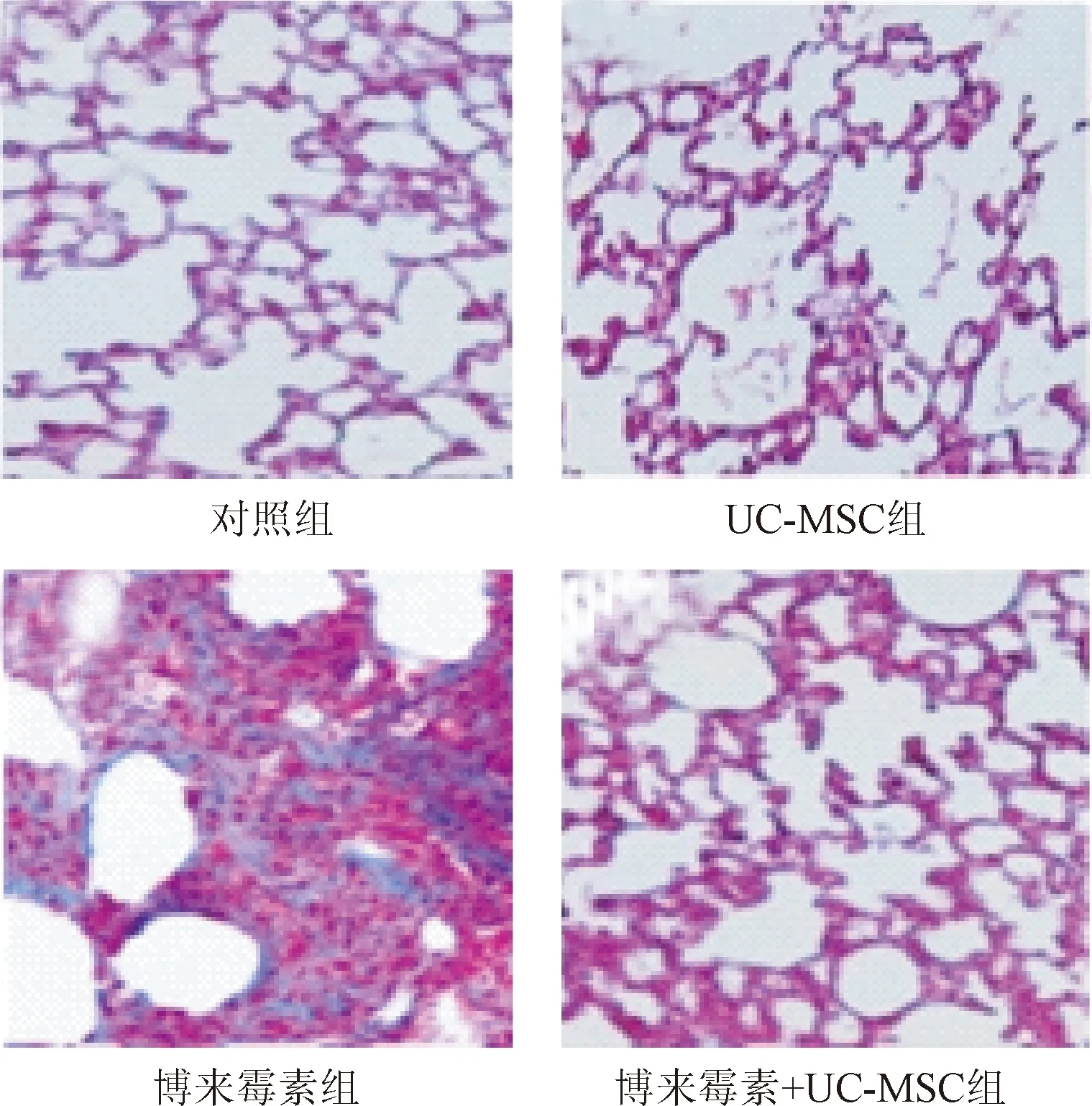
圖3 各組小鼠肺組織 Masson 染色(×200)Fig.3 Massontrichrome staining of different groups mouse lung tissues(×200)
2.3 肺組織HYP、SOD和MDA含量 肺組織HYP、SOD和MDA含量檢測結果見表1。對照組和UC-MSC組的HYP、SOD和MDA的含量相比較差異無統計學意義,表明單純注射UC-MSC不會對小鼠體內HYP、SOD和MDA含量產生影響。
HYP含量檢測中,博來霉素組中的含量明顯高于對照組(P<0.01),而給予UC-MSC治療的博來霉素+UC-MSC組中其HYP的含量與博來霉素組相比顯著降低(P<0.01),結果表明UC-MSC可降低由博來霉素引發的HYP含量增高。
SOD含量檢測中,博來霉素組中的含量明顯低于對照組(P<0.01),而給予UC-MSC治療的博來霉素+UC-MSC組中其SOD的含量與博來霉素組相比顯著提高(P<0.01),結果表明UC-MSC可提高由博來霉素引發的SOD含量降低。
MDA含量檢測中,同樣,博來霉素組中的含量明顯高于對照組(P<0.01),而給予UC-MSC治療的博來霉素+UC-MSC組中其MDA的含量與博來霉素組相比較低(P<0.05),結果表明UC-MSC可降低由博來霉素引發的MDA含量增高。
綜上所述,UC-MSC可降低由博來霉素誘導實驗性小鼠肺纖維化模型中HYP和MDA的含量以及增高SOD的含量。UC-MSC對博來霉素誘導實驗性小鼠肺纖維化具有一定的保護作用。
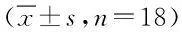
表1 各組小鼠肺組織HYP、SOD和MDA含量比較Tab.1 The content of HYP,SOD and MDA in different groups(±s,n=18)
*P<0.05,**P<0.01,與對照相比,compared with control group;#P<0.05,##P<0.01,與博來霉素組相比,compared with bleomycin group group
3 討論
目前,成體骨髓來源的間充質干細胞作為一種理想的種子細胞在組織工程和再生醫學中廣泛應用[6]。但研究表明[7],成入骨髓間充質干細胞存在來源限制、細胞的活力受限于成人的年齡等諸多問題,因此尋找一種新的更具優勢的替代細胞具有重要意義。
臍帶間充質干細胞作為間充質干細胞一重要來源具有以下優點:首先,利用胎兒分娩后的廢棄物來源易得;其次,其增殖能力較強,可不短傳代培養,細胞長量較大;再次,連續多次傳代后仍然維持干細胞特性[8]。臍帶間充質干細胞作為成體骨髓來源的間充質干細胞的替代來源,具有很好的應用市場。故本研究以臍帶間充質干細胞為研究對象,探討其對小鼠肺纖維化的影響。
肺纖維化具體發病機制尚不清晰。研究表明[9],博來霉素致肺纖維化是通過介導自由基損傷等機制,其中活性氧是肺纖維化進程中的重要因子,當氧化與抗氧化系統紊亂時,組織便會發生損傷。因此,阻斷過氧化反應,不僅可以促進肺損傷的修復,而且也可防止肺纖維化的發生和發展[10]。SOD是體內重要的清除氧自由基的酶,肺組織中SOD含量可以間接反映肺清除氧自由基的能力[5,11,12];本研究對肺組織SOD的含量進行了檢測,結果顯示,博來霉素組中的含量為(85.32±6.89)U/mg明顯低于對照組(170.36±4.68)U/mg(P<0.01),而給予UC-MSC治療的博來霉素+UC-MSC組中SOD的含量為(124.57±9.68)U/mg與博來霉素組相比顯著提高(P<0.01)。MDA是肺組織內一種脂質過氧化物,是氧自由基產生連鎖反應的一種重要成分,從而增強活性氧對肺組織的損傷,故對其含量進行檢測可了解組織受氧自由基損傷的狀況[13]。本研究對各組MDA的含量進行了檢測,結果顯示博來霉素組中的含量為(8.91±2.14)nmol/mg明顯高于對照組的(6.74±1.23)nmol/mg(P<0.01),而給予UC-MSC治療的博來霉素+UC-MSC組中其MDA的含量為(7.14±1.67)nmol/mg與博來霉素組相比較低(P<0.05)。HYP是肺組織膠原蛋白的重要成分,約占膠原蛋白氨基酸總量的13%,對HYP含量進行可評估肺纖維化的嚴重程度[14]。本研究對 HYP的含量進行了檢測,結果顯示博來霉素組中的含量為(697.15±65.36)μg/mg明顯高于對照組(310.54±32.23)μg/mg(P<0.01),而給予UC-MSC治療的博來霉素+UC-MSC組中其HYP的含量為(561.34±45.12)μg/mg與博來霉素組相比顯著降低(P<0.01)。
本研究通過體外培養臍帶間充質干細胞,采用第四代細胞經尾靜脈注射干預由博來霉素誘導實驗性小鼠肺纖維化模型,通過HE、Masson染色以及檢測肺組織中,HPY、SOD和MDA的含量來評價UC-MSC對肺纖維化的影響。結果初步顯示UC-MSC可減輕炎癥細胞浸潤以及肺間質膠原沉積,降低由博來霉素誘導實驗性小鼠肺纖維化模型中HYP(P<0.01)和MDA(P<0.05)的含量以及增高SOD的含量(P<0.01)。 臍帶間充質干細胞可保護博來霉素誘導的誘導實驗性小鼠肺纖維化。
[1] American Thoracic Society. Idiopathic pulmonary fibrosis:diagnosis and treatment. International consensus statement.American Thoracic Society(ATS), and the European Respiratory Society(ERS). Am J Respir Crit Care Med. 2000;161(2 Pt 1):646-664.
[2 ] Parekkadan B, van Poll D, Suganuma K, et al. Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure[J]. PLoS One, 2007,2(1): 941.
[3] 黃坤,吳曉梅,王欣燕,等.骨髓間充質干細胞移植對大鼠肺纖維化的影響[J].中華結核和呼吸雜志,2012(35):659-664.
[4] Lu LL, Liu YJ, Yang SG,et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J]. Haematologica, 2006, 91(2): l0l7-1026.
[5] 鄭金旭,盧坤琴,夏德剛,等. 柴胡皂甙d對博來霉素誘導肺纖維化小鼠的治療作用及機制研究[J]. 中華醫學雜志,2010,90(12):808-812.
[6] 吳軍,張燕燕. 骨髓間充質干細胞生物學特性及臨床應用進展[J]. 中國組織工程研究與臨床康復,2007(50):10134-10137.
[7] 王丁. CD14單核細胞增強人臍帶間充質干細胞的免疫抑制作用[D]. 北京:北京協和醫學院,2010.
[8] 戎麗娟. IFN-γ對人臍帶間充質干細胞生物學功能的影響[D]. 北京:北京協和醫學院,2012.
[9] 莊誼,張德平. 肺纖維化與Th1/Th2失衡[J]. 國際呼吸雜志,2005(5):349-351.
[10] 李婷. Ang(1-7)和AngⅡ通過氧化應激對肺成纖維細胞遷移和肺纖維化的影響及其機制[D]. 廣州:南方醫科大學,2014.
[11] 胡凡艷. 七氟醚預處理對肺葉切除術患者單肺通氣誘導的氧化應激損傷的影響[D]. 濟南:山東大學,2012.
[12] 梁永祺. 黃芪多糖對EAhy.926細胞的抗氧化及抗炎作用[D]. 廣州:南方醫科大學,2013.
[13] 遲梅英,潘曉軍,趙勇,等. 異丙酚對高氧肺損傷大鼠氧自由基、IL[J]. 齊魯醫學雜志,2007.
[14] 魏艷靜,武惠珍,韋再華,等. 肝硬化腹水中羥脯氨酸含量的觀察[J]. 河北醫科大學學報,2000,(2):109.
(編校:譚玲)
Study on effect of UC-MSC in IPF experimental model induced by bleomycin in mice
FENG Li-junΔ, ZHANG Ying-chao
(Department of Respiration, Baodi College of Clinical Medicine, Tianjin Medical University, Tianjin 301800, China)
ObjectiveTo investigate protective of umbilical cord-mesenchymal stem cells(UC-MSC) on idiopathic pulmonary fibrosis(IPF) experimental mode was induced by bleomycin in mice.MethodsIPF experimental mode induced by bleomycin with intratracheal injection, and then the fourth generation UC-MSC was injected in caudal vein. The lung tissues were obtained to evaluate the influence of UC-MSC on IPF by the observation of histological evaluation(HE) and Masson staining, the detection content of hydroxyprine(HYP), superoxyde dismutase(SOD) and malonaldehyde(MDA).ResultsThe HE and Masson staining showed that bleomycin+UC-MSC group could alleviate inflammatory cell infiltration and pulmonary interstitial collagen deposition. bleomycin+UC-MSC group could decline the content of HYP(P<0.01), MDA(P<0.05) and improve the content of SOD(P<0.01)compared with bleomycin group.ConclusionUC-MSC exhibits an protective effect on IPF experimental mode induced by bleomycin in mice.
umbilical cord-derivedumbilical cord-derived cell; bleomycin; idiopathic pulmonary fibrosis
馮麗君,通信作者,女,大專,主任醫師,研究方向:慢性阻塞性肺疾病,支氣管哮喘間質性肺疾病等,E-mail:tianjinfenglijun@sina.com。
R285.5
A
1005-1678(2015)11-0019-04

