Apelin-13通過ERK1/2信號通路促進MCF-7細胞的增殖及侵襲
彭雪微,孫麗麗,霍洪亮
(東北師范大學生命科學學院,吉林長春130024)
Apelin-13通過ERK1/2信號通路促進MCF-7細胞的增殖及侵襲
彭雪微,孫麗麗,霍洪亮
(東北師范大學生命科學學院,吉林長春130024)
采用MTT、Brdu流式細胞術(shù),Transwell侵襲實驗,ElISA、Western blot檢測實驗研究了apelin-13對乳腺癌MCF-7細胞增殖、侵襲的影響.結(jié)果表明:apelin-13能夠激活ERK1/2信號傳導(dǎo)通路,上調(diào)Cyclin D1和MMP-1的表達,進而促進MCF-7細胞的增殖及侵襲,可為臨床乳腺癌的診斷、防治及愈后評估提供新的思路和方法.
apelin-13;細胞外信號調(diào)節(jié)激酶1/2;細胞周期蛋白D1;基質(zhì)金屬蛋白酶1
1998年,Tatemoto等人[1]首次在牛胃分泌物中提取出G蛋白偶聯(lián)受體APJ(putative receptor protein related to ATJ)的內(nèi)源性配體,命名為apelin.迄今的研究表明,apelin是APJ唯一的天然配體.前體含77個氨基酸,可被ACE2水解成多種亞型:apelin-12,apelin-13,apelin-17,apelin-28,apelin-31,apelin-36.研究發(fā)現(xiàn)apelin在小鼠的肺、子宮、睪丸的主要存在形式是apelin-36,乳腺中則是apelin-13.另有研究表明,apelin與多種癌癥有密切關(guān)系,能夠促進癌細胞的發(fā)生、增殖、轉(zhuǎn)移;apelin還可以促進癌組織中血管新生,從而加速癌細胞的增殖及轉(zhuǎn)移;apelin在人的乳腺癌組織中含量高于正常組織[2].目前apelin在乳腺癌中的作用機制仍不是十分清楚.細胞的各種生理生化反應(yīng)均受到相關(guān)細胞因子的調(diào)控[3],因此,本文重點研究了外源性apelin-13對乳腺癌MCF-7細胞的作用及其分子機制.
細胞周期蛋白cyclin D1調(diào)控細胞周期由G1期向S期過渡,cyclin D1過度表達與癌細胞增殖密切相關(guān)[4-6].研究發(fā)現(xiàn),在正常生理狀態(tài)下,細胞進入S期后,cychin D1會迅速分解.細胞發(fā)生癌變時,cyclin D1蛋白高表達,使細胞周期的G1期縮短,提前進入S期,細胞異常增殖.因此,cyclin D1可能在乳腺癌發(fā)生及細胞增殖過程中起到了重要的調(diào)控作用.
基質(zhì)金屬蛋白酶1(metal matric proteinase,MMP-1)是一種間質(zhì)膠原酶,可以特異性降解Ⅰ,Ⅱ,Ⅲ型膠原蛋白,破壞基底膜促進腫瘤的發(fā)生、發(fā)展.正常情況下,MMP-1的表達量很低,但是當受到佛波醇酯類、生長因子、炎性因子等刺激時,表達量顯著升高.有研究表明,MMP-1在晚期乳腺癌組織中高表達,可作為預(yù)測侵潤性腫瘤的標志分子[7],抑制MMP-1的表達可明顯阻礙乳腺癌細胞的侵襲及轉(zhuǎn)移[8].因此,MMP-1已成為研究乳腺癌侵襲及轉(zhuǎn)移的重要靶點.
絲裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)是真核細胞內(nèi)重要的信號傳遞途徑.在哺乳動物體內(nèi)共鑒定出4個MAPK亞家族,包括:C-Jun N末端激酶、應(yīng)激活化蛋白激酶JNKs/SAPKs、細胞外信號調(diào)節(jié)蛋白激酶ERKs以及P38MAPK,他們之間的氨基酸序列同源性大于40%[9].其中ERK(extracellular signal-regulated kinase)信號轉(zhuǎn)導(dǎo)途徑被認為是經(jīng)典的MAPK信號轉(zhuǎn)導(dǎo)途徑.ERK在多種惡性腫瘤組織中均出現(xiàn)異常表達或活性增強[10-11].因此,研究ERK信號通路與乳腺癌的關(guān)系具有十分重要的意義.
1 材料方法
1.1 試劑
DMEM培養(yǎng)基(美國GIBCO公司);MTT,Tris,甘氨酸,SDS,apelin-13,ERK抑制劑PD98059(美國Sigma公司);單克隆抗兔Phospho-p44/42ERK1/2抗體(美國Cell Signaling Technology公司);單克隆抗體鼠β-肌動蛋白和ECL蛋白印跡試劑盒(美國Santa Cruz公司);冰醋酸、胰蛋白酶、甘油、蛋白酶抑制劑PMSF、β-巰基乙醇、溴酚藍、二甲基亞砜(DMSO)和結(jié)晶紫(北京鼎國生物公司),青霉素-鏈霉素溶液-雙抗(中國碧云天公司);DEPC水、反轉(zhuǎn)錄PCR試劑盒、Trizol裂解液(大連寶生物公司);人MMP-1和CyclinD1ELISA試劑盒(美國RD公司);Transwell侵襲小室(美國Corning公司);Brdu細胞增殖檢測試劑盒(北京中昊生物科技有限公司);脫脂奶粉、溴化乙啶EB(長春尚寶生物公司);BCA蛋白濃度測定試劑盒;PVDF膜(Millipore公司).
1.2 MTT法細胞增殖檢測
將200μL生長狀態(tài)良好的乳腺癌MCF-7細胞(1×104個)接種到96孔板中,加含10%胎牛血清的DMEM培養(yǎng)基培養(yǎng)12h;小心吸棄上清,按180μL/孔加入新鮮無血清培養(yǎng)基饑餓12h;加apelin-13(0.01,0.1,10μmol/L)刺激細胞24h或10μmol/L apelin-13和10μmol/L PD98059抑制劑;再分別向每孔加入20μL MTT溶液(終質(zhì)量濃度為0.5mg/mL),繼續(xù)孵育4h;小心吸棄上清,每孔加DMSO 150μL,震蕩10min,使孔中殘留的MTT-甲臜結(jié)晶充分溶解,采用終點法酶標儀檢測D(490)值.每組實驗5次重復(fù),以保證實驗數(shù)據(jù)的準確性.
1.3 Brdu流式細胞術(shù)
將2mL生長狀態(tài)良好的MCF-7細胞(1×106個)接種到6孔板中,加入含10%胎牛血清的DMEM培養(yǎng)基培養(yǎng)24h;小心吸棄上清,按2mL/孔加入新鮮無血清培養(yǎng)基饑餓12h;apelin-13(0.01,0.1,10μmol/L)刺激細胞12h,根據(jù)Brdu細胞增殖檢測試劑盒說明使用流式細胞儀檢測細胞增殖率.
1.4 Transwell侵襲實驗
將MCF-7細胞撤血清饑餓12h,用胰蛋白酶消化細胞,制備細胞懸液,以2×105個/mL的濃度接種于含有apelin-13(0.01,0.1,10μmol/L)或apelin-13和PD98059(均為10μmol/L)底部鋪有基質(zhì)膠的Transwell上室(小孔直徑8.0μm),24孔板下室中加入含有10%胎牛血清的培養(yǎng)基,在37℃、含5% CO2的培養(yǎng)箱中培養(yǎng)12h.用棉球擦除聚碳酸酯膜的上部細胞,用10%甲醇溶液固定聚碳酸酯膜下部的細胞30s,之后用0.1%結(jié)晶紫室溫染色20min.將內(nèi)置小室正置于載玻片上,倒置顯微鏡下隨機選取3個視野顯微拍照.按0.1mL/孔加入33%醋酸脫色,震蕩,使用酶標儀檢測D(570)值.
1.5 酶聯(lián)免疫吸附試驗(ELISA)
收集細胞培養(yǎng)上清液或裂解液,3 000r/min離心10min,取上清液,-20℃保存?zhèn)溆茫粡?℃冰箱中取出ELISA試劑盒室溫平衡20min,37℃水浴鍋中加熱溶解試劑盒中的濃縮洗滌液,并用蒸餾水按照1∶20的比例(體積比)稀釋;設(shè)置標準品孔和樣本孔,向包被待測抗體的微孔中一次加入樣本、標準品、辣根過氧化物酶標記的檢測抗體;封口膜封口,37℃溫浴1h;用洗滌液洗滌5次,1min/次;徹底洗滌之后加入TMB,37℃避光溫浴15min顯色(TMB能夠在過氧化物酶的作用下變成藍色、在酸的作用下轉(zhuǎn)變成最后的黃色),顏色的深淺和樣品中的蛋白量呈正相關(guān).加入終止液之后在酶標儀上使用終點法檢測D(450)值.根據(jù)標準品的濃度梯度曲線計算樣品濃度.
1.6 Western blot檢測實驗
將培養(yǎng)的細胞經(jīng)預(yù)冷的PBS(0.01mol/L,pH=7.2~7.3)漂洗2次.吸凈PBS,加入預(yù)冷的1mL RIPA裂解液,RIPA裂解液中加入蛋白酶抑制劑PMSF(終濃度1mmol/L).用細胞刮刮取貼壁細胞,將細胞及裂解液轉(zhuǎn)移至預(yù)冷的離心管中,冰上裂解30min.將超聲探頭沒入混懸液內(nèi),超聲破碎2min,破碎分4次進行,每次30s.4℃條件下12 000r/min離心10min.輕輕吸取上清,轉(zhuǎn)移至新的離心管中,置于冰上,吸取的上清即為提取蛋白;棄沉淀,使用BCA蛋白濃度測定試劑盒測定濃度.為確保每個蛋白樣品上樣量的一致性,-20℃保存?zhèn)溆茫粶y定前,100℃或沸水浴加熱3~5min,以充分變性蛋白.SDSPAGE電泳分離目的蛋白,根據(jù)蛋白的相對分子質(zhì)量標準切割凝膠并將膠上的蛋白轉(zhuǎn)移至PVDF膜上,5%脫脂奶粉封閉1h.一抗4℃孵育過夜,二抗37℃孵育60min.ECL檢測試劑盒曝光.
1.7 數(shù)據(jù)分析
實驗數(shù)據(jù)以平均數(shù)±標準差表示,應(yīng)用Sigma plot10.0軟件統(tǒng)計數(shù)據(jù).統(tǒng)計學分析采用樣本平均數(shù)t檢驗進行各組間數(shù)值的比較,P<0.05為差異顯著.
2 實驗結(jié)果
2.1 Apelin-13促進MCF-7細胞增殖和侵襲
Apelin-13刺激MCF-7細胞24h后檢測D(490)值.結(jié)果顯示,隨著apelin-13濃度的升高,D(490)值隨之增大,10μmol/L apelin-13刺激組D(490)值最大(見圖1A).Brdu標記的細胞增殖實驗結(jié)果顯示,與對照組比較,apelin-13刺激組細胞的增殖率明顯提高(見圖1B).Transwell侵襲小室檢測apelin-13促MCF-7細胞的侵潤作用:用不同濃度的apelin-13刺激MCF-7細胞6h,結(jié)晶紫染色.與對照組相比,apelin-13刺激組著色面積明顯升高,且隨著apelin-13濃度的升高著色程度逐漸加深.說明進入小室下室的細胞數(shù)量增多(見圖1C).再收集小室下室的細胞,檢測D(570)值,結(jié)果與侵襲小室實驗中各組結(jié)果一致,隨著Apelin-13濃度的增加,D(570)值隨之增大(見圖1D).細胞增殖和侵襲時cyclin D1和MMP-1基因異常活躍.因此,我們用ELISA檢測了apelin-13刺激MCF-7細胞后增殖基因cyclin D1和MMP-1的蛋白表達.結(jié)果顯示,cyclin D1和MMP-1的表達與apelin-13濃度呈正相關(guān)(見圖1E,F(xiàn)).
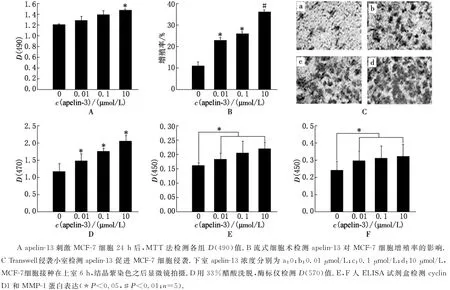
圖1 Apelin-13促進MCF-7細胞增殖和侵襲結(jié)果
2.2 ERK1/2信號通路調(diào)控apelin-13誘導(dǎo)的細胞增殖和侵襲
為了確定apelin-13促進MCF-7細胞增殖及侵襲所依賴的信號途徑,我們檢測了apelin-13刺激組MCF-7細胞ERK1/2的磷酸化水平.Western blot結(jié)果顯示,ERK1/2磷酸化水平與apelin-13刺激濃度呈正相關(guān),10μmol/L apelin-13刺激組ERK1/2磷酸化達到了顯著水平(見圖2A).apelin-13孵育MCF-7細胞12h后,再用10μmol/L ERK1/2抑制劑PD98059處理MCF-7細胞1h,ERK1/2磷酸化水平明顯降低,表明PD98059能夠阻斷ERK信號通路(見圖2B).
大量研究表明,ERK1/2調(diào)控異常與腫瘤的發(fā)生、發(fā)展關(guān)系密切.上述結(jié)果證明,外源性apelin-13能夠激活ERK1/2的表達,apelin-13可能通過激活ERK1/2信號通路促進MCF-7細胞的增殖及侵襲.因此,我們用PD98059預(yù)處理MCF-7細胞1h,利用MTT檢測細胞的增殖情況.結(jié)果顯示,apelin-13刺激組D(570)值明顯高于對照組,而PD98059處理組D(570)值均有明顯降低,且略低于對照組(見圖2C).說明apelin-13對MCF-7細胞的促增殖作用被PD98059所抑制.Transwell侵襲實驗結(jié)果顯示,apelin-13刺激組結(jié)晶紫著色面積明顯高于對照組,侵入到下室的細胞數(shù)量增加;PD98059處理后,結(jié)晶紫著色面積減少,侵入到下室的細胞數(shù)量明顯減少(見圖2D).ELISA結(jié)果顯示,PD98059能夠抑制cyclin D1和MMP-1的表達,使cyclin D1和MMP-1表達與對照組表達量幾乎一致(見圖2E,F(xiàn)).
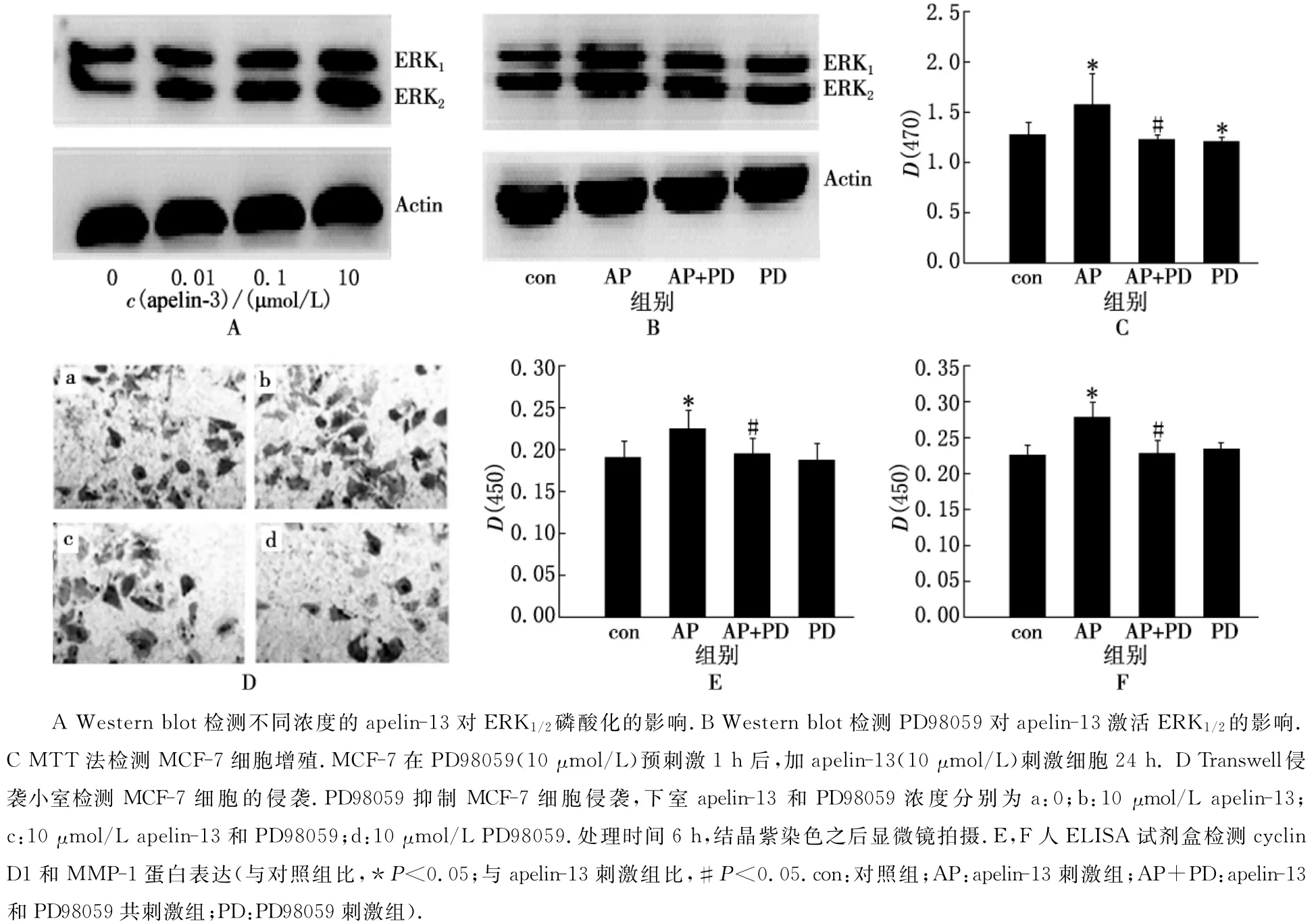
圖2 Apelin-13通過ERK1/2信號通路調(diào)控MCF-7細胞的增殖及侵襲
3 討論
近年來,大量實驗數(shù)據(jù)表明內(nèi)源性配體apelin在人體惡性腫瘤的發(fā)生、發(fā)展過程中發(fā)揮重要的作用.如apelin在人體結(jié)腸癌中過量表達,可促進結(jié)腸癌的發(fā)展[12].現(xiàn)已發(fā)現(xiàn)apelin在乳腺組織和乳汁中含量較高,在人乳腺癌細胞系MCF-7中也有高水平表達.但是,apelin對乳腺癌發(fā)生的作用機制還沒有明確結(jié)論,為此,我們做了大量實驗檢測外源性apelin-13對乳腺癌細胞MCF-7增殖和侵襲的影響.
不同濃度的apelin-13能夠促進MCF-7細胞的增殖(見圖1A,B)及侵襲(見圖1C,D).同時,能上調(diào)cyclin D1(見圖1E)及MMP-1(見圖1F)的表達且具有濃度依賴性,10μmol/L apelin-13刺激組cyclin D1和MMP-1蛋白表達增加量最為明顯.在細胞周期中,cyclin D1過度表達則會縮短G1期間隔,降低細胞對促細胞分裂劑的依賴性,從而促進腫瘤的發(fā)生和發(fā)展.MMP-1能夠刺激腫瘤細胞的侵襲和分化,抑制腫瘤細胞的凋亡,從而促進腫瘤的發(fā)生和轉(zhuǎn)移.為了進一步研究apelin-13促進MCF-7增殖及侵襲的分子機制,我們應(yīng)用ERK1/2抑制劑PD98059,檢測了ERK1/2與apelin-13刺激MCF-7細胞增殖及侵襲的關(guān)系.結(jié)果表明,PD98059能夠明顯抑制apelin-13誘導(dǎo)的MCF-7細胞增殖和cyclin D1的高水平表達(見圖2C,E).說明ERK1/2在apelin-13誘導(dǎo)MCF-7細胞增殖周期中起到了重要的調(diào)控作用.同樣,PD98059也能夠明顯抑制apelin-13誘導(dǎo)的MCF-7細胞侵襲及MMP-1的表達(見圖2D,F(xiàn)).Western blot結(jié)果進一步證實apelin-13刺激后ERK1/2磷酸化水平升高,apelin-13能夠激活ERK1/2信號傳導(dǎo)通路(見圖A,B).因此,apelin-13可能是通過激活ERK1/2信號通路促進MCF-7細胞增殖及侵襲的.
綜合以上結(jié)果,apelin-13激活ERK1/2作用于相關(guān)轉(zhuǎn)錄因子和蛋白激酶等多種底物進入細胞核,調(diào)節(jié)cyclin D1,MMP-1等相關(guān)基因的轉(zhuǎn)錄,進而參與MCF-7細胞生長、增殖、侵襲及轉(zhuǎn)移等多種生理過程,這一機制的闡明可為乳腺癌的治療及預(yù)防提供新方向.
[1] TATEMOTO K,HASOYA M,HABATA Y,et al.Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor[J].Biochem Biophys Res Commum,1998,251:471-476.
[2] WANG Z,GREELEY GH JR,QIU S,et al.Immunohistochemical localization of apelin in human normal breast and breast carcinoma[J].J Mol Histol,2008,39(1):121-124.
[3] 李文蕾,孫麗麗,霍洪亮.內(nèi)脂素對心肌細胞ICAM-1和VCAM-1及相關(guān)因子的影響[J].東北師大學報:自然科學版,2013,45(1):113-116.
[4] NOH J H,JUNG K H,KIM J K,et al.Aberrant regulation of HDAC2mediates proliferation of hepatocellular carcinoma cells by deregulating expression of G1/S cell cycle proteins[J].PLOS One,2011,6(11):28103.
[5] JUNG K H,NOH J H,KIM J K,et al.HDAC2overexpression confers oncogenic potential to human lung cancer cells by deregulating expression of apoptosis and cell cycle proteins[J].J Cell Biochem,2012,113(6):2167-2177.
[6] PANG M,MA L,LIU N,et al.Histone deacetylase 1/2mediates proliferation of renal interstitial fibroblasts and expression of cell cycle proteins[J].J Cell Biochem,2011,112(8):2138-2148.
[7] POOLA I,DEWITTY R L,MARSHALLECK J J,et al.Identification of MMP-1as a putative breast cancer predictive marker by global gene expression analysis[J].Nat Med,2005,11:481-483.
[8] RIDER L,OLADIMEJI P,DIAKONOVA M.PAK1regulates breast cancer cell invasion through secretion of matrix metalloproteinases in response to prolactin and three-dimensional collagen IV[J].Mol Endocrinol,2013,27(7):1048-1064.
[9] DAVIS R J.Signal transduction by the JNK group of MAP kinases[J].Cell,2000,103:239-252.
[10] LI L,LI L,XIE F,et al.Jagged-1/Notch3signaling transduction pathway is involved in apelin-13-induced vascular smooth muscle cells proliferation[J].Acta Biochim Biophys Sin,2013,45(10):875-81.
[11] QIN D,ZHENG X X,JIANG Y R.Apelin-13induces proliferation,migration,and collagen I mRNA expression in human RPE cells viaPI3K/Akt and MEK/Erk signaling pathways[J].Mol Vis,2013,19:2227-2236.
[12] PICAULT F X,CHAVES-ALMAGRO C,PROJETTI F,et al.Tumour co-expression of apelin and its receptor is the basis of an autocrine loop involved in the growth of colon adenocarcinomas[J].Eur J Cancer,2014,50:663-674.
The effect of apelin-13on breast MCF-7cell proliferation and invasion via activate ERK1/2signaling pathways
PENG Xue-wei,SUN Li-li,HUO Hong-liang
(School of Life Sciences,Northeast Normal University,Changchun 130024,China)
This papers researched the effect of apelin-13on breast MCF-7cell proliferation and invasion through MTT,Brdu flow cytometry assay,Transwell assay,Elisa,Western Blot.These results showed that apelin-13could increase cyclin D1and MMP-1and induce MCF-7cells proliferation and migration via activate ERK1/2signaling pathways.
apelin-13;ERK1/2;cyclin D1;MMP-1
Q 253 [學科代碼] 180·2130
A
(責任編輯:方 林)
2015-01-27
國家自然科學基金資助項目(51478096);吉林省重點科技攻關(guān)項目(20140204059YY).
彭雪微(1989—),女,碩士研究生;通訊作者:霍洪亮(1963—),男,博士,副教授,主要從事細胞生理學研究.

