新疆阿勒泰山地蜱傳腦炎疫源地調查
孫 響,張桂林,劉 然,劉曉明,楊靚靚,鄭 重,趙 焱
新疆阿勒泰山地蜱傳腦炎疫源地調查
孫 響1,張桂林1,劉 然1,劉曉明1,楊靚靚2,鄭 重1,趙 焱1
目的 調查新疆阿勒泰山地蜱傳腦炎疫源地特征,分離鑒定蜱傳腦炎病毒。方法 通過家畜體表撿法采集寄生蜱;利用間接免疫熒光法檢測當地健康人群血清中蜱傳腦炎病毒IgG抗體;通過將蜱研磨液接種實驗小鼠進行病原動物分離;通過接種BHK-21細胞對蜱傳腦炎病毒進行分離培養;利用RT-PCR方法對病毒E蛋白基因片段進行擴增和測序,通過序列分析明確病毒系統進化特征。結果 新疆阿勒泰山地白哈巴地區分布有2種蜱,森林革蜱為優勢種(55.6%),其次為邊緣革蜱(44.4%);當地人群蜱傳腦炎IgG抗體陽性率5.31%(6/113);通過動物試驗和細胞分離培養,從森林革蜱中分離出一株森林腦炎病毒;對病毒E蛋白基因序列的系統進化分析表明,蜱傳腦炎病毒阿勒泰分離株屬于遠東亞型。結論 首次從病原學上證實新疆阿勒泰山地存在蜱傳腦炎疫源地,媒介為森林革蜱,病毒流行株為遠東亞型。
蜱傳腦炎;蜱傳腦炎病毒;疫源地;阿勒泰
蜱傳腦炎(Tick-borne encephalitis,TBE)在我國又被稱為森林腦炎,是由蜱傳腦炎病毒(TBEV)引起的以中樞神經系統病變為主的自然疫源性疾病。臨床上多表現為高熱、劇烈頭痛、惡心、嘔吐、嗜睡、意識障礙及腦膜刺激征、肌張力減弱或消失等神經系統病征,重癥患者病死率較高。蜱傳腦炎經蜱叮咬傳播,蜱既是蜱傳腦炎病毒的傳播媒介,也是其宿主。蜱傳腦炎分布橫貫亞-歐大陸,根據地理分離株的基因組序列變異性可分3個亞型(Sub-types),包括為歐洲型、西伯利亞型與遠東型[1]。亞型間病毒毒力差異大,歐洲亞型和西伯利亞型的致死率分別為0.5%~2%與6%~8%,而遠東型致死率最高,為5%~20%[2]。
蜱傳腦炎在我國主要分布在東北林區(內蒙古、黑龍江和吉林)和新疆地區[3]。新疆蜱傳腦炎疫源地分布在北天山一帶以及阿拉套山南坡[4-5]。阿勒泰山通過血清學證實存在人群蜱傳腦炎感染,但未分離出病原體。為進一步調查阿勒泰山地蜱傳腦炎疫源地的分布、傳播媒介以及流行的病毒株亞型,我們于2011-2013年進行了蜱傳腦炎調查。
1 材料與方法
1.1 調查地點 白哈巴地區(東經86°47′,北緯48°41′)地處新疆阿勒泰地區阿爾泰山南麓,平均海拔1 300 m,屬北溫帶大陸性氣候。該地區與哈薩克斯坦接壤。為山地森林草原生境,主要是新疆針葉松、西伯利亞落葉松、云杉、冷杉等針葉林,間或與白樺等闊葉林混雜。
1.2 標本采集
1.2.1 蜱標本采集 2011年和2012年4-5月,通過家畜體表撿法采集家畜體外寄生蜱,通過布旗法采集游離蜱。蜱分類鑒定后,死蜱用70%酒精保存,活蜱液氮低溫保存。
1.2.2 人群血清標本采集 隨機選擇當地健康人群,肘靜脈采血3~5 mL,分離血清,-20 ℃保存。
1.3 血清TBE IgG抗體檢測 采用IFA方法。血清1∶10稀釋。TBEV IgG抗體IFA檢測試劑盒由歐蒙醫學實驗診斷股份公司(EUROIMMUN Medizinische Labordiagnostika AG)生產,產品編號No.FI2661-1005G,試劑盒內包括抗原片、羊抗人二抗、陽性對照、陰性對照等。按照使用說明操作。抗原片平衡至室溫,加樣板每個反應區加入30 μL稀釋血清,將抗原片覆有生物薄片的一面朝下,蓋在加樣板對應的凹槽里,室溫(18~25 ℃)溫育30 min。PBS-Tween緩沖液沖洗抗原片1 s,浸洗5 min。在另一潔凈加樣板的每個反應區加入25 μL FITC標記羊抗人IgG抗體,將抗原片蓋在加樣板的凹槽里,室溫避光溫育30 min;用PBS-Tween緩沖液流水沖洗抗原片1 s,浸洗5 min。甘油/PBS封片。每次實驗按說明書加入陽性和陰性對照。熒光信號通過熒光顯微鏡(Nikon ECLIPSE 80i)觀察。陽性參考值血清稀釋度≥ 1∶10。
1.4 動物接種分離病原 將液氮保存的100只森林革蜱置于75%酒精中浸泡30 min,滅菌生理鹽水漂洗3次,加入含青霉素的PBS研磨破碎,3 000 r/min離心,上清液經0.22 μm 濾器(Pall)過濾除菌。按0.5 mL/只劑量腹腔接種5~8周齡的BALB/c小鼠(購于新疆醫科大學實驗動物中心),共接種5只。接種后每日觀察小鼠發病情況,發病小鼠瀕死前無菌解剖,取肝脾和腦組織,液氮保存。取腦組織研磨上清液繼續接種小鼠傳代。連續觀察3周。
1.5 病毒細胞培養 取發病小鼠腦組織研磨,離心,過濾,取0.5 mL研磨上清液接種BHK-21細胞,37 ℃孵育1 h,培養7~10 d,反復凍融3次,按3 000 r/min離心收集細胞培養上清,再次接種細胞,盲傳3代后觀察細胞病變現象。BHK-21細胞(Baby hamster kiney-21)經含10%(v/v)胎牛血清(杭州四青)的DMEM培養基(Life technology)傳代培養分種于48孔細胞培養板。
1.6 病毒分子生物學鑒定
1.6.1 RNA提取及RT-PCR檢測 利用Trizol法對400 μL病變細胞培養上清液進行病毒RNA提取,提取物溶于40 μL DEPC處理的去離子水,置于-70 ℃度冷藏備用。按照一步法RT-PCR試劑盒(Takara)說明書操作,擴增體系為25 μL,其中包括5 μL上清RNA提取物,蜱傳腦炎病毒E蛋白特異引物5′-TGG AGC TYG ACA AGA CCT CA-3′與 5′-TCC CAC YAG GAT CTT GGG CAA-3′)各1 μL(10 μmol/L)。擴增條件如下:42 ℃反轉錄30 min。95 ℃熱變性5 min。30輪熱循環中,每輪循環95 ℃熱變性30 s,57 ℃退火30 s,72 ℃擴增90 s,最后72 ℃延伸10 min。取5 μL擴增產物進行1.7%(m/v)瓊脂糖凝膠電泳檢測[6]。
1.6.2 序列比對分析 陽性擴增產物交予上海生工公司進行測序。利用DNAstar 7.0進行測序比對,陽性測序結果提交GenBank。利用MEGA 6軟件按Clustal-W方法進行同源分析。
2 結 果
2.1 蜱種類組成 在阿勒泰山地白哈巴地區共采集成蜱2種2 160只,森林革蜱(Dermacentorsilvarum)為優勢種,占蜱數量組成的55.6%(1 200/2 160),其次為邊緣革蜱(Dermacentormarginatus),占蜱數量組成的44.4%(960/2 160)。4月中下旬至5月中旬,馬體上寄生有大量的蜱。
2.2 人群血清學調查 共檢測血清113份,其中男性104份,女性9份,年齡18~69歲,平均年齡25歲。陽性血清6份,陽性率5.31%(6/113)。陽性者均為男性,年齡分布在20至28歲,職業為林區工作人員,16名哈薩克族牧民血清檢測無陽性。
2.3 動物病原分離實驗結果 一組森林革蜱研磨液接種5只BALB/c小鼠,其中4只發病,發病率80%。1只觀察21 d未發病。小鼠接種后7~8 d開始發病,初始癥狀為拒食、不活潑、毛聳、蜷縮、消瘦,后發展為后肢麻痹、癱瘓、瀕死。發病小鼠解剖后發現,肝脾腫大,顱內出血。取發病小鼠腦組織研磨液接種2代BALB/c小鼠,共接種7只。其中發病4只,發病率57.1%;未發病3只。發病癥狀與一代發病小鼠一致。取二代發病小鼠腦組織提取RNA后進行一步法RT-PCR,黃病毒通用引物及TBEV E基因特異引物均擴增出陽性條帶,分別為250 bp及750 bp左右(見圖2)。
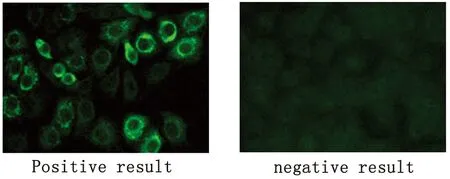
圖1 人血清TBE IgG抗體的間接免疫熒光檢測
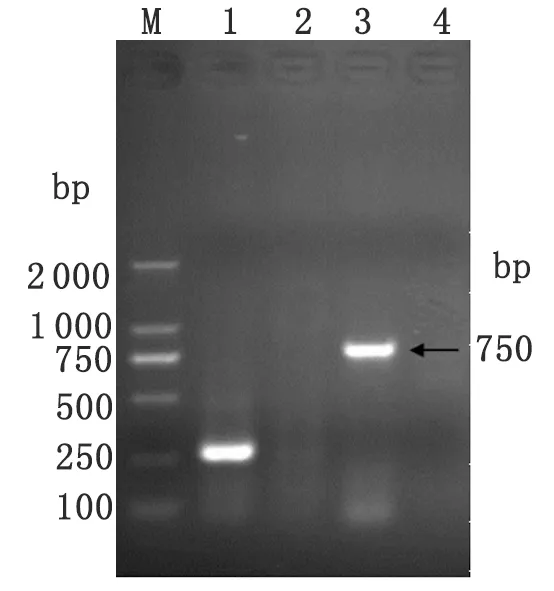
1: Positive result of flavivirus universal primers (250 bp); 2: Negative result; 3: Positive result of E protein gene primers (750 bp); 4: Negative control; M: DL2000 Marker.
圖2 森林腦炎病毒RT-PCR E蛋白基因片段擴增結果
Fig.2 RT-PCR to E protein gene fragment of TBEV
陽性結果測序后序列BLAST分析顯示,與我們從新疆博爾塔拉蒙古自治州夏爾希里自然保護區全溝硬蜱和森林革蜱中分離出的TBEV病毒株(JX534167)E蛋白基因核苷酸序列完全相同(100%,737/737)。
2.4 病毒細胞分離及分子生物學鑒定 將發病小鼠腦組織研磨、離心、過濾,上清接種BHK-21細胞,盲傳3代后,細胞出現圓縮、脫落等病變現象。病變細胞培養上清液進行病毒RNA提取,利用RT-PCR對蜱傳腦炎病毒E蛋白基因片段進行擴增,擴增出特異性條帶(約為750 bp)。測序后,與動物實驗發病小鼠腦組織RNA擴增陽性序列進行比對,兩者核苷酸序列完全相同,為同一條序列。由此,初步認為經過動物接種純化及細胞分離培養,已分離出阿勒泰白哈巴地區TBEV病毒株。
經比對分析,擴增序列與我們從新疆博爾塔拉蒙古自治州夏爾希里自然保護區全溝硬蜱和森林革蜱中分離出的TBEV病毒株(JX534167)E蛋白基因核苷酸序列相同。與我國東北分離毒株MDJ-01株(JQ650522)、武漢分離株WH2012(KJ755186)序列相似度為99%,與森張株(JQ650523)序列相似度為98%,表明阿勒泰分離毒株(Altai-01)為TBEV遠東亞型。
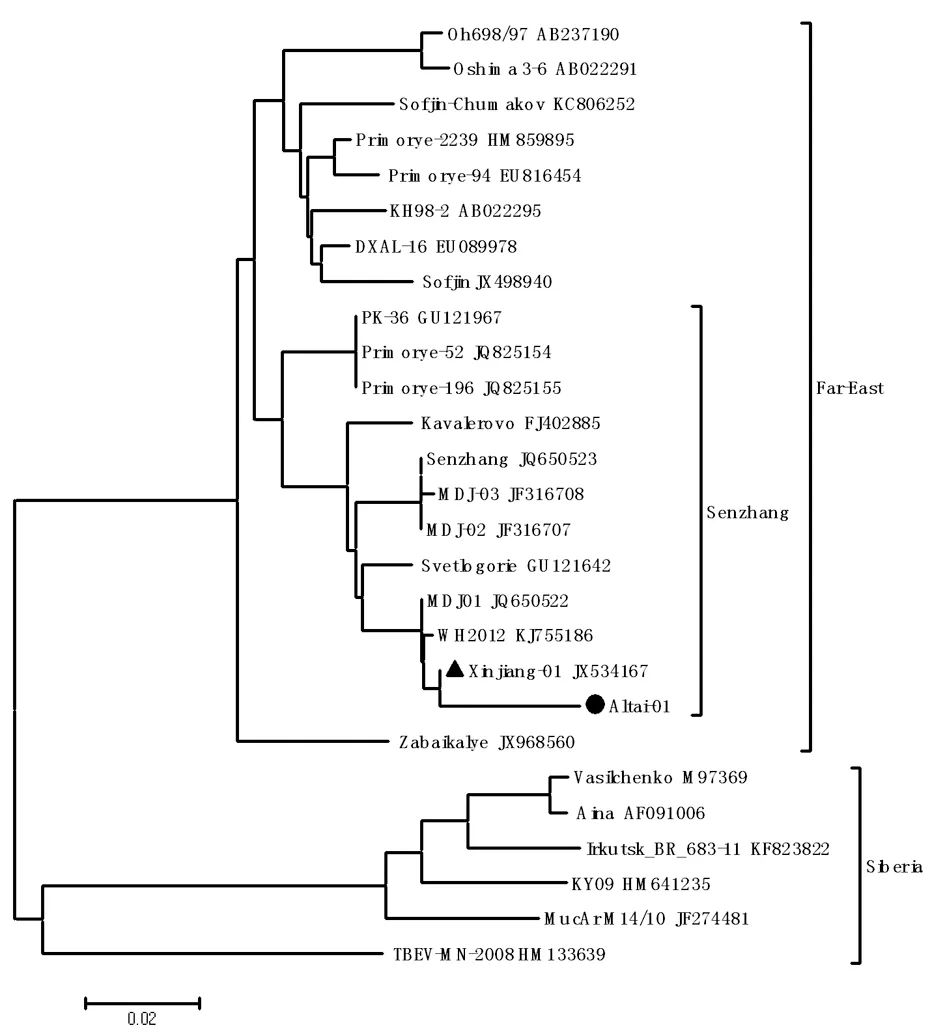
▲Xinjiang-01為分離自夏爾希里自然保護區全溝硬蜱的TBEV病毒株,●Altay-01為本研究分離自阿勒泰白哈巴地區森林革蜱的TBEV病毒株.
▲Xinjiang-01 was TBEV isolated fromIxodespersuleatusfrom Charles Hilary nature reserve;●Altay-01 was TBEV isolated fromDermacentorsilvarumfrom Baihaba area of Altai Mountains.
圖3 基于E蛋白基因的Neighbor-joining系統發生樹
Fig.3 Phylogenetic analysis of TBEV strain based on E protein gene with neighbor-joining method
3 討 論
既往對阿勒泰地區的研究在血清學上證實該地區人群中存在蜱傳腦炎感染,但未分離出病原體。本研究首次從阿勒泰山白哈巴地區的森林革蜱中分離到TBEV病毒株,從流行病學、血清學、病原學上證實了阿勒泰山地蜱傳腦炎疫源地的存在,并證實其病原體為TBEV遠東亞型。
蜱傳腦炎的分布與媒介蜱的分布密切相關。我國北方地區蜱傳腦炎的主要媒介為全溝硬蜱(Ixodespersuleatus),南方地區主要媒介為卵形硬蜱(Ixodesovatus),在少數地區森林革蜱(Dermacentorsilvarum)也可作為媒介[7]。新疆北天山以及阿拉套山蜱傳腦炎疫源地雖然從全溝硬蜱和森林革蜱中都分離出了蜱傳腦炎病毒,但全溝硬蜱為疫源地優勢蜱種,因此主要傳播媒介為全溝硬蜱。阿勒泰山地蜱傳腦炎疫源地與新疆其它疫源地不同,森林革蜱是優勢蜱種,未發現全溝硬蜱,因此主要傳播媒介為森林革蜱。
血清學檢測陽性者均為男性青壯年,在當地有1~5年生活史,職業均為外來林區工作人員,表明該職業人群為TBE感染高危人群。而當地長期生活的16名哈薩克族牧民血清檢測未發現陽性。調查中發現,16名牧民中僅1人有蜱叮咬史。不同人群血清陽性率的差異可能與蜱的叮咬習性、病毒致病性、人群敏感性及人群防護措施的差異有關,需要進一步的流行病學調查分析加以證實。
在新疆地區境內,除了本研究從阿勒泰山地白哈巴地區分離到TBEV病毒株外,我們還曾從夏爾希里自然保護區分離到4株TBEV病毒株[4]。兩地區在地理位置、生境、媒介蜱種等方面均存在差異。白哈巴地區屬阿勒泰山脈,主要生境為山地森林草原,森林革蜱為優勢蜱種,而夏爾希里自然保護區地處北天山西段阿拉套山南坡,屬天山山脈,主要生境為針闊葉混交林,全溝硬蜱為優勢蜱種。但基于E蛋白基因的序列比對分析顯示,阿勒泰白哈巴分離株與夏爾希里分離株E蛋白基因片段無堿基差異。提示新疆境內分布流行的TBEV遺傳基因可能比較穩定,地區間未發生變異。
從全球來說,TBEV主要在一個帶狀區域內分布流行,這個區域從西歐向東跨越俄羅斯、中國、蒙古直至日本。我國的新疆、內蒙古和東北地區均位于這個流行帶內[8-9]。通過對系統發育樹分析,新疆Altai-01 TBEV分離株與東北分離株(GenBank注冊號JQ650522)的相似度達99%,與蒙古TBEV-MN-2008分離株(HM133639)序列相似度僅為88%,但均為TBEV遠東亞型[10];而新疆周邊地區如俄羅斯新西伯利亞(Novosibirsk)Vasilchenko分離株(M97369)、伊爾庫茨克市(Irkutsk) Aina分離株(AF091006)、蒙古國境內MucAr M14/10 (JF274481)分離株、吉爾吉斯斯坦境內KY09分離株(HM641235)均為TBEV西伯利亞亞型[1,10-12]。由此可見新疆TBEV病毒株與地理距離較遠的東北TBEV病毒株有共同的祖先,而與地理距離相對較近的俄羅斯、吉爾吉斯斯坦、蒙古地區TBEV病毒株卻并不同源;提示新疆地區與東北地區之間存在著TBEV傳播感染的自然循環,而鳥類的遷徙在病毒的遠距離傳播中可能起到了重要作用[13]。
[1]Ecker M, Allison SI, Meixner T, et al. Sequence analysis and genetic classification of tick-borne encephalitis viruses from Europe and Asia[J]. J Gen Virol, 1999, 80: 179-185. DOI: 10.1099/0022-1317-80-1-179
[2]Gristsun TS, Frolova TV, Zhankov AI, et al. Characterization of a Siberian virus isolated from a patient with progressive chronic tick-borne encephalitis[J]. J Virol, 2003, 77: 25-36.DOI: 10.1128/JVI.77.1.25 36.2003
[3]Bi WM, Deng HP, Bu XY. Study on the partition of natural foci of tick-borne encephalitis[J]. J Capital Normal Univ (Nat Sci Ed), 1997, 18(2): 100-107. (in Chinese) 畢維銘,鄧厚培,卜笑妍.蜱傳腦炎自然疫源地區劃研究[J].首都師范大學學報:自然科學版,1997,18(2):100-107.
[4]Zhang GL, Liu R, Sun X, et al. Investigation on the endemic foci of new emerged tick-borne encephalitis in Charles Hilary, Xinjiang[J]. Chin J Epidemiol, 2013, 34(5): 438-442. DOI:10.3760/j.issn.0254-6450.2013.05.006.(in Chinese). 張桂林,劉然,孫響,等.新疆夏爾希里自然保護區蜱傳腦炎疫源地調查[J].中華流行病學雜志,2013,34(5):438-442.DOI:10.3760/j.issn.0254-6450.2013.05.006
[5]Xie XC, Yu X, Zhang TX, et al. A survey report on the natural foci of Russian Spring Summer Encephalitis in the Mountainous Areas of Tianshan and Altay Mountain in Xinjiang[J]. Endem Dis Bull, 1991, 6(3): 109-114. (in Chinese). 謝杏初,于心,張挺秀,等.新疆天山、阿爾泰山山地蜱傳腦炎自然疫源地考察報告[J].地方病通報,1991,6(3):109-114.
[6]Ruzek D,Stastn H,Kopecky J, et al. Rapid subtyping of tick-borne encephalitis virus isolates using multiplex RT-PCR[J]. J Virolog Methods, 2007, 144: 133-137.DOI:10.1016/j.jviromet.2007.04.010
[7]Lu Z, Broker M, Liang G. Tick-borne encephalitis in mainland China[J]. Vector Borne Zoonotic Dis, 2008, 8(5): 713-720.DOI:10.1089/vbz.2008.0028
[8]Lars L, Olli V. Tick-borne encephalitis[J]. Lancet, 2008, 371(9627): 1861-1871.DOI:10.1016/S0140-6736(08)60800-4
[9]Eckhardt P, Dieter G, Olaf Z. Tick-borne encephalitis (TBE) trends in epidemiology and current and future management[J]. Travel Med Infect Dis,2010,8:233-245.DOI:10.1016/j.tmaid.2010.08.001
[10]Stefan F, Ilona M, Damdin A, et al. Isolation, preliminary characterization, and full-genome analyses of tick-borne encephalitis virus from Mongolia[J]. Virus Genes, 2012, 45: 413-425.DOI:10.1007/s11262-012-0795-9
[11]Kovalev SY, Kokorev VS, Belyaeva IV. Distribution of far-eastern tick-borne encephalitis virus subtype strains in the former soviet union[J]. J Gen Virol, 2010, 91: 2941-2946.DOI:10.1099/vir.0.023879-0
[12]Briggs BJ, Atkinson B, Czechowski DM,et al. Tick-borne encephalitis virus, Kyrgyzstan[J]. Emerg Infect Dis, 2011, 17(5): 876-879.DOI:10.3201/eid1703.101183
[13]Waldenstrom J, Lundkvist A, Falk KI, et al. Migrating birds and tickborne encephalitis virus[J]. Emerg Infect Dis, 2007, 13(8): 1215-1218.DOI:10.3201/eid1308.061416
Tick-borne encephalitis endemic foci in Altai Mountains, Xinjiang, China
SUN Xiang1,ZHANG Gui-lin1,LIU Ran1,LIU Xiao-ming1,YANG Liang-liang2,ZHENG Zhong1, ZHAO Yan1
(1.CenterforDiseasePreventionandControlofXinjiangMilitaryCommandRegion,Urumuqi830011,China; 2.PLA16thHospital,Altai836599,China)
In order to investigate endemic region of tick-borne encephalitis in Altai Mountains of Northern Xinjiang and to isolate and characterize viral geographic strains, we collected 2 160 ticks from Baihaba area located in Altai Mountains with searching for hosts and 113 serum of local healthy residents. The detection of TBEV specific IgG antibodies from serum were performed by indirect fluorescent assay (IFA), and viruses were isolated from ticks samples by inoculating BALB/c mice and BHK-21 cells. The virus E protein gene fragments were amplified and sequenced using the RT-PCR method. Results showed thatDermacentorsilvarum(55.6%) were dominant species followed byDermacentormarginatus(44.4%). TBEV specific-IgG antibodies in serum were positive with the rate of 5.31% (6/113). ATBEV strain was isolated fromDermacentorsilvarumafter animal inoculation and cells culture. E protein gene alignment sequence and phylogenetic analyses showed that the virus was clustered into TBEV far-eastern sub-type. Results demonstrated a novel endemic foci of tick-borne encephalitis was firstly described in Altai Mountains, northern Xinjiang. The TBEV geographic isolates were belonged to TBEV far-eastern subtype.Dermacentorsilvarumplayed a crucial role for transmitting the disease.
tick-borne encephalitis; tick-borne encephalitis virus; endemic foci; Altai Mountains
Zhang Gui-lin, Email:xjglzhang@126.com
10.3969/j.issn.1002-2694.2015.12.021
國家自然科學基金項目(No.U1303104)
張桂林,Email:xjglzhang@126.com
1.新疆軍區疾病預防控制中心,烏魯木齊 830011; 2.新疆軍區第十六醫院,阿勒泰 836599
R384.4
A
1002-2694(2015)12-1189-04
2015-03-18;
2015-09-23
Supported by grants from the National Natural Science Fundation (No. U1303104)

