貴州省鉤端螺旋體血清群特異性PCR鑒定結果與分析
劉 英,陳 紅,李沛麗,馬 青,王定明,唐光鵬,姚光海,周敬祝,陳崢宏,李世軍
貴州省鉤端螺旋體血清群特異性PCR鑒定結果與分析
劉 英1,2,陳 紅3,李沛麗4,馬 青1,王定明1,唐光鵬1,姚光海1,周敬祝1,陳崢宏2,李世軍1
目的 采用血清群特異性PCR技術了解貴州省近年鉤端螺旋體(鉤體)流行菌群,為貴州省鉤體病的防控提供技術手段和科學依據。方法 采用致病性鉤體特異性PCR方法(G1/G2-PCR)對來自貴州省近年的鉤體分離菌株進行鑒定,進一步應用基于致病性鉤體O抗原基因的血清群特異性PCR(O-PCR)對貴州省近年的58株鉤體分離株進行血清群鑒定,并采用顯微凝集試驗(MAT)對O-PCR方法的檢測結果進行驗證。結果 G1/G2-PCR檢測結果顯示58株菌株均為致病性鉤體,O-PCR將58株致病性鉤體菌株鑒定為黃疸出血群,與傳統的MAT法鑒定結果一致。結論 O-PCR技術可作為我省鉤體快速分群鑒定可靠的實驗室診斷技術手段,貴州省近年的鉤體流行菌群為黃疸出血群。
鉤端螺旋體;血清群;PCR;貴州
Supported by the National Natural Science Foundation of China (Nos. 81260250 and 81401679), the Guizhou Provincial Talent Training Base Project of Infectious Diseases (No. [2013]15) “Sub-project: Research Team of Natural foci and Insect-borne Infectious Diseases Control and Prevention” (No. RCJD1401), and the Program of Natural Science Foundation of Guizhou Provincial Center for Disease Control and Prevention (No. 2013-E2-1) Corresponding authors: Li Shi-jun, Email:zjumedjun@163.com;Chen Zheng-hong:Email:chenzhenghong@gm.c.cdu.cn
由致病性鉤端螺旋體(簡稱鉤體)感染引起的鉤體病是全球流行的人獸共患傳染病。由于鉤體通過疫水迅速傳播,因而是洪澇、地震等自然災害發生時重點檢測的傳染病之一[1]。貴州省屬自然災害高發省份,近年來鉤體病發病率雖然有所下降,但散發和局部暴發疫情時有發生,疫情主要集中在黔東南、遵義和銅仁等地區,近幾年均有死亡病例報告。了解鉤體地方菌株的流行菌群對當地鉤體病的預防和控制至關重要,本研究采用新近報道的基于鉤體O抗原基因的我國6個鉤體血清群特異性PCR技術[2]對貴州省近年分離的58株菌株進行鑒定和分析,為貴州省鉤體病的防控提供技術手段和科學依據。
1 材料與方法
1.1 鉤體菌株與培養 鉤體菌株為2010-2014年間自貴州省榕江縣、黎平縣、錦平縣的黑線姬鼠Aa(Apodemusagrariuspallas)鼠腎中分離的58株鉤體疑似菌株(表1)。致病性鉤體黃疸出血群(Icterohaemorrhagiae)、賽羅群(Sejroe)、犬群(Canicola)、秋季群(Autumnalis)、流感傷寒群(Grippotyphosa)和七熱群(Hebdomadis)參考菌株,由中國疾病預防控制中心鉤體實驗室提供。鉤體參考菌株和分離菌株采用含8%兔血清的EMJH培養基于28 ℃培養5~7 d[3]。
表1 黑線姬鼠鉤端螺旋體分離菌株背景信息
Tab.1 Background information of 58 strains pathogenic Leptospira isolates isolated fromApodemusagrarius
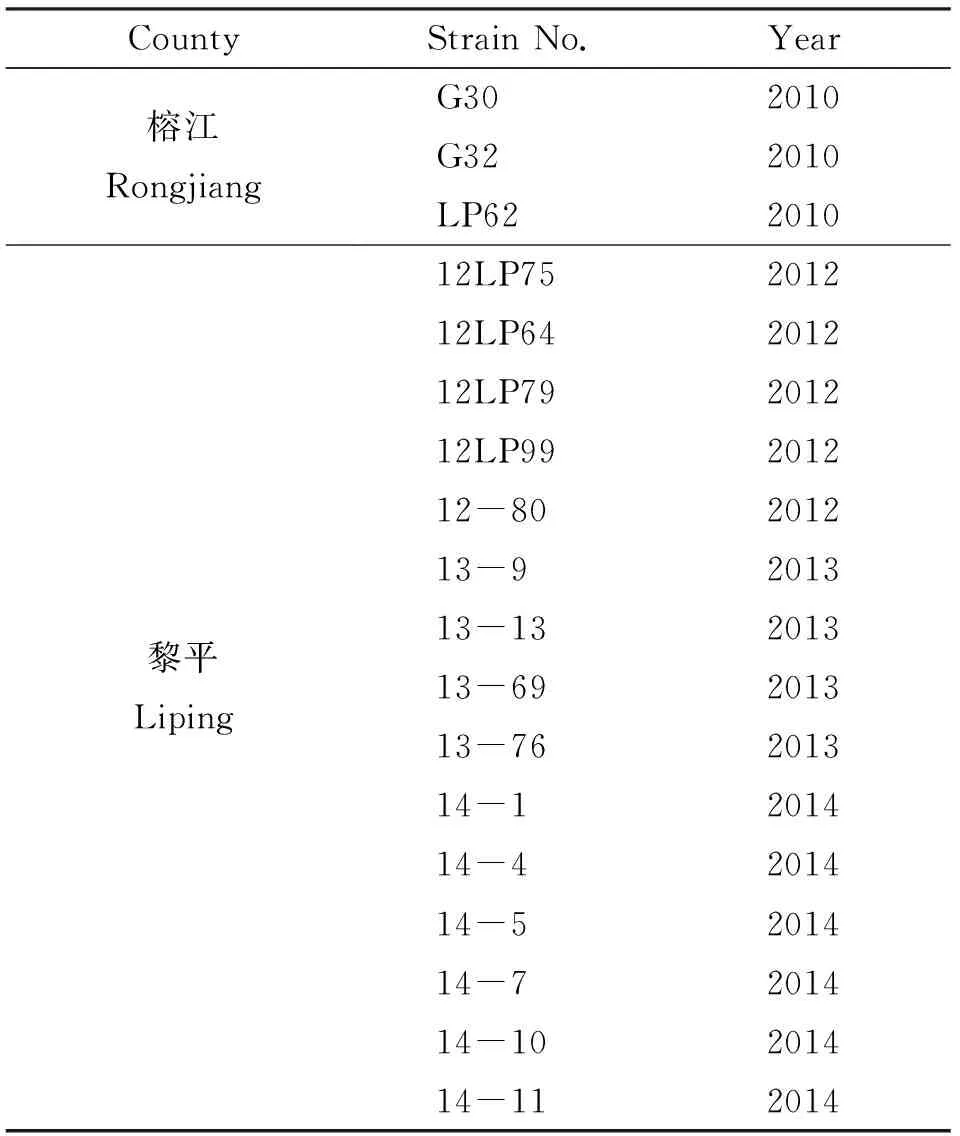
CountyStrainNo.Year榕江Rongjiang黎平LipingG302010G322010LP62201012LP75201212LP64201212LP79201212LP99201212-80201213-9201313-13201313-69201313-76201314-1201414-4201414-5201414-7201414-10201414-112014
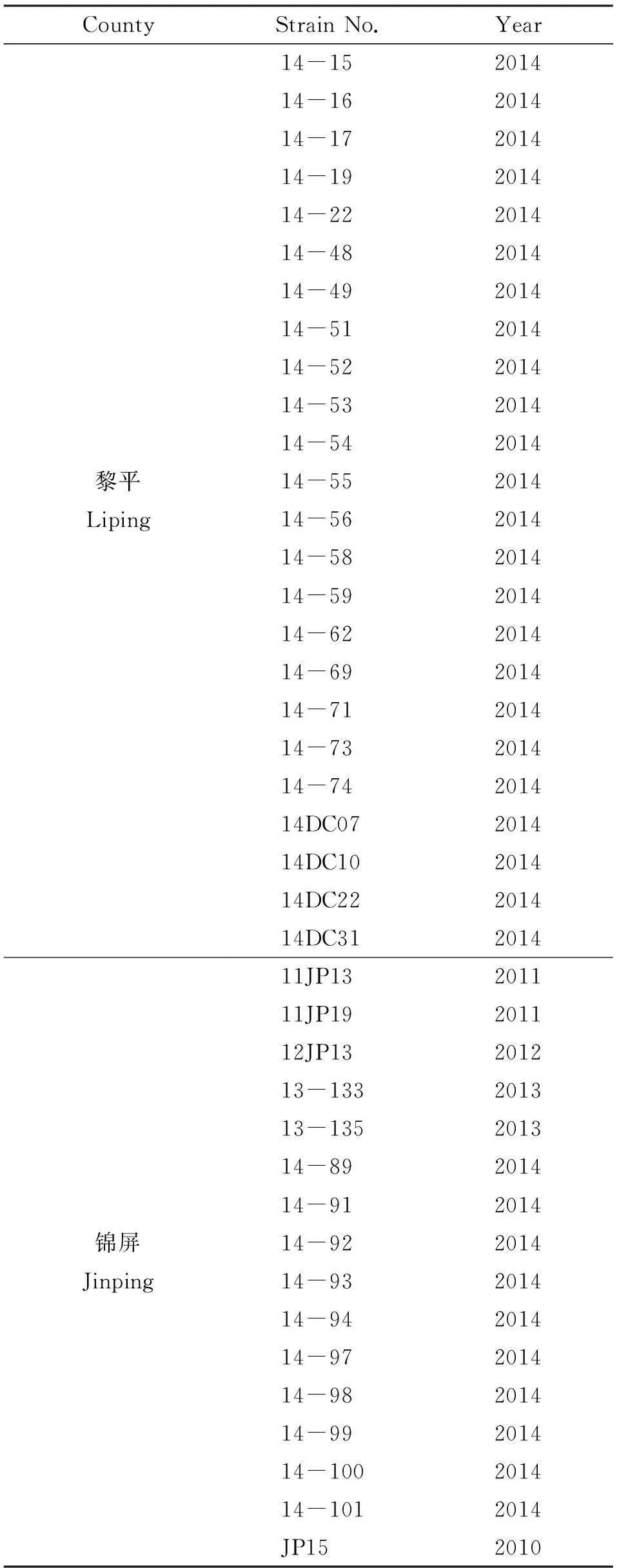
表1(續1)
1.2 診斷試劑 EMJH鉤體培養基為美國BD公司產品(批號:0010120),硅膠膜型TM基因組DNA提純試劑盒為北京賽百盛基因技術有限公司產品,實驗中所用PCR引物和PreMix反應體系由北京天一輝生物科技有限公司提供,DNA Marker為TaKaRa公司產品,鉤體分群診斷血清由中國藥品生物制品檢定所提供。
1.3 核酸提取 采用DNA提取試劑盒,按照說明書操作提取經培養5~7 d后的鉤體菌株DNA[4]。
1.4 致病性鉤體PCR鑒定 采用致病性鉤體特異的G1/G2-PCR方法對58株鉤體分離菌株進行鑒定[5]。采用25 μL PCR反應體系,其中含Pre Mix Taq 12.5 μL,上下游引物各2 μL,DNA模板1 μL,去離子水7.5 μL。PCR擴增參數為:95 ℃預變性5 min;94 ℃ 60 s、55 ℃ 60 s、72 ℃ 90 s、35個循環;72 ℃延伸10 min,產物采用1.2%瓊脂糖凝膠進行電泳檢測。
1.5 血清群特異性PCR鑒定 按照參考文獻[2]提供的我國常見的黃疸出血群、賽羅群、犬群、秋季群、流感傷寒群和七熱群特異性引物及參數對58株鉤體分離株進行檢測,同時采用6個鉤體血清群參考菌株做陽性對照,采用去離子水做陰性對照,擴增體系為25 μL,其中含Pre Mix Taq 12.5 μL,上下游引物各2 μL,DNA模板1 μL,去離子水7.5 μL,PCR擴增參數為95 ℃預變性2 min,95 ℃30 s、退火30 s(退火溫度見表2)、72 ℃1 min,30個循環,產物采用1.5%瓊脂糖凝膠進行電泳檢測。

表2 鉤端螺旋體血清群特異性PCR檢測目的基因及引物序列
1.6 驗證試驗 按照參考文獻提供方法對58株鉤體分離菌株采用MAT方法進行血清群鑒定[1]。
2 結 果
2.1 致病性鉤體PCR鑒定結果 基于G1/G2引物的致病性鉤體特異性PCR檢測結果顯示,58株鉤體疑似菌株和陽性對照菌株核酸均擴增285 bp大小的的擴增片段,而陰性對照未出現擴增條帶(圖1為部分分離菌株G1/G2-PCR擴增條帶)。
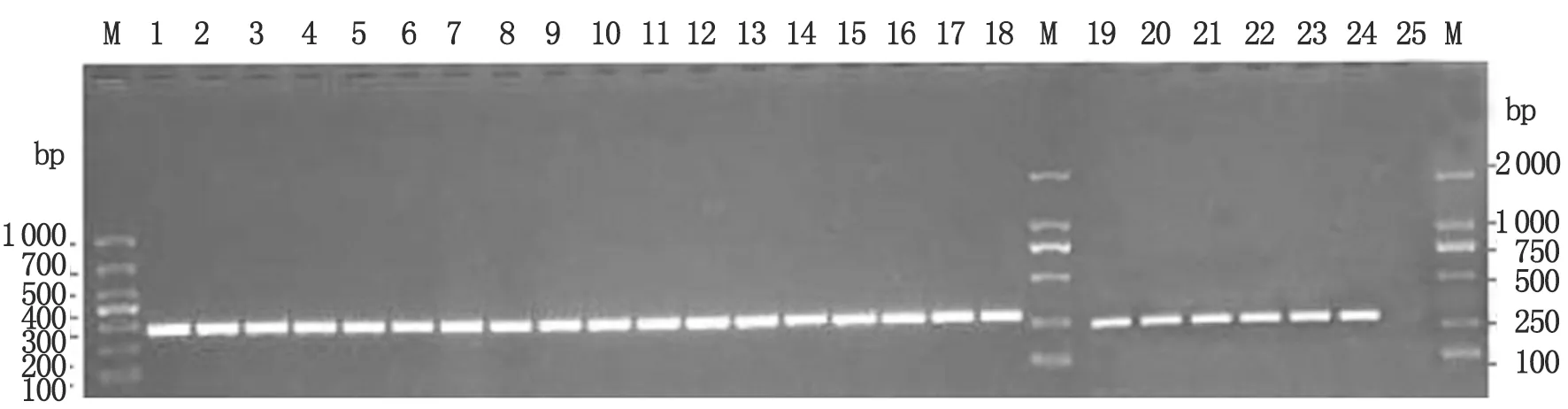
M: Mark; 1-18: Strain number G30, JP15, 11JP19, LP62, 12JP13, 12LP75, 12LP64, 12LP79, 12LP99, 12-80, 11JP13, 13-135, G32, 13-9, 13-13, 13-69, 13-76, 13-133; 19: Icterohaemorrhagiae; 20: Hebdomadis; 21: Autumnalis; 22: Grippotyphosa; 23: Canicola; 24: Sejroe; 25: Negative control.
圖1 致病性鉤體特異性PCR檢測結果
Fig.1 Identification ofLeptospirausing G1G2-PCR.
2.2 鉤體血清群特異性PCR鑒定結果 血清群特異性PCR鑒定結果顯示,58株鉤體菌株經鉤體黃疸出血群特異性引物檢測均出現590 bp的預期擴增片段(圖2為部分菌株黃疸出血群檢測結果),而經賽羅群、犬群、秋季群、流感傷寒群和七熱群特異性引物擴增后均未獲得擴增條帶。6個血清群參考菌株經相應的血清群特異性引物擴增后均出現預期的目標條帶,而其余引物及陰性對照均未出現擴增條帶(圖3)。
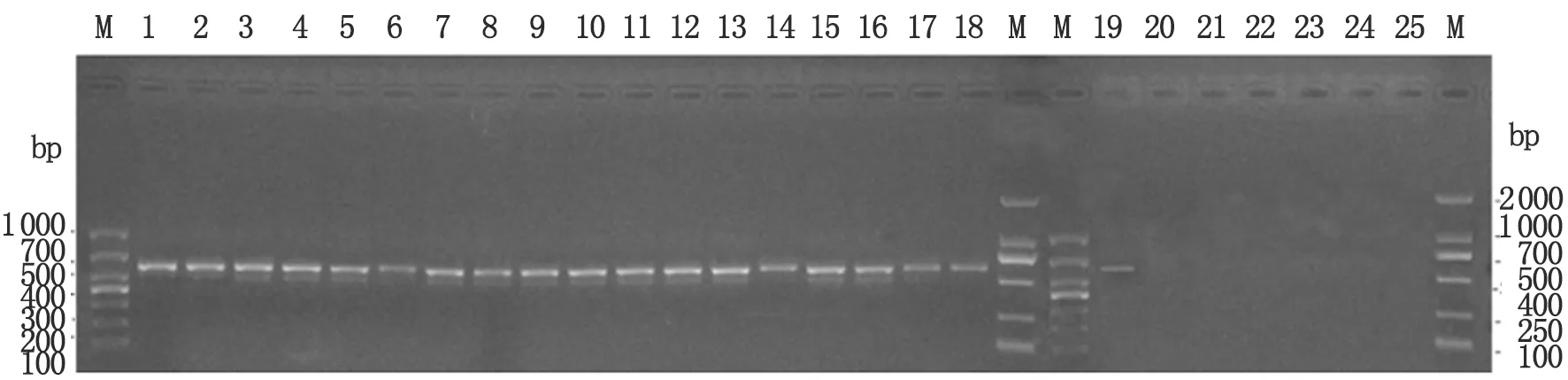
M: Mark; 1-18: G30, JP15, 11JP19, LP62, 12JP13, 12LP75, 12LP64, 12LP79, 12LP99, 12-80, 11JP13, 13-135, G32, 13-9, 13-13, 13-69, 13-76, 13-133; 19: Icterohaemorrhagiae; 20: Hebdomadis; 21: Autumnalis; 22: Grippotyphosa; 23: Canicola; 24: Sejroe; 25: Negative control.
圖2 鉤體分離株黃疸出血群特異引物PCR檢測結果
Fig.2 Identification ofLeptospirausingLeptospiraserogroup icterohaemorrhagiae specific PCR

M: Mark; 1: Icterohaemorrhagiae; 2: Hebdomadis; 3: Autumnalis; 4: Grippotyphosa; 5: Canicola; 6: sejroe; 7: Negative control.
2.3 MAT檢測結果 MAT檢測結果顯示,58株鉤體分離菌株均與我國鉤體15群15型鉤體參考菌株抗血清中的黃疸出血群代表菌株抗血清發生凝集反應,而與其余的賽羅群、犬、秋季、流感傷寒、七熱、爪哇、拜倫、致熱、澳洲、波摩那、明尼、巴達維亞、塔拉索夫和曼耗群代表菌株抗血清不發生凝集反應。
3 討 論
鉤體病是由致病性鉤體引起的一種全世界廣泛流行的人獸共患傳染病,鉤體血清群、型眾多,其自然宿主動物也多達200余種,其中以豬、牛等家畜和黑線姬鼠、黃毛鼠等嚙齒類帶菌動物對人類危害最大。帶菌動物從尿液或糞便排出致病性鉤體污染水源或土壤,人類接觸污染了致病性鉤體的疫水/疫土而感染[1,6]。
貴州省疾病監測網絡系統顯示,貴州省近年來鉤體病發病率雖然有所下降,但病死率卻呈上升趨勢,散發和局部暴發疫情時有發生,疫情主要集中在黔東南、遵義市和銅仁等地區,近幾年每年均有死亡病例報告。鉤體病疫情發生后,一項非常重要的工作就是迅速確定傳染源種類和病原體的鑒定,從而為病人治療和疫情控制提供科學依據。鉤體菌群菌型復雜、分布廣泛,現己發現致病性鉤體有18個血清群75個血清型[1, 7]。傳統的鉤體分群方法是顯微鏡凝集試驗[1],該方法存在工作繁瑣、耗費時間、主觀性較強等缺點,且需要保存大量的參考菌株并制備各菌株的免疫血清,目前國內一般的鉤體病實驗室均不能開展血清學分型鑒定,這對鉤體病暴發疫情的調查和應急處理十分不利。
隨著分子生物學技術的發展,相繼出現了一系列的分子分型技術如脈沖場凝膠電泳(PFGE)[8-9]、多位點重復序列分析(MLVA)[9-11]和多位點等位基因測序分型(MLST)[12-13]等技術,且分析結果與鉤體血清群具有較好的一致性,在鉤體的鑒定及傳染源的追蹤方面發揮了一定作用。然而, PFGE技術所需試劑種類與操作步驟繁多、技術要求較高、耗時較長、需要專業軟件分析和參考菌株PFGE數據庫進行結果判斷,MLVA 技術分辨能力雖高,但同樣需要專業軟件分析和參考菌株MLVA數據庫進行結果判斷,而MLST需要對各等位基因進行基因序列測定,采用專業軟件分析后與參考菌株MLST數據庫進行比對,該方法耗時較長,成本較高。以上分子生物學技術存在不利于鉤體菌株血清群的快速鑒別。近年來采用血清型PCR技術對病原微生物進行血清群/型鑒定的技術相繼出現,該項技術針對病原微生物脂多糖及其合成相關基因在微生物血清群或型水平上的特異性設計引物進行PCR檢測而達到血清群/型鑒定的目的,國內學者Cai Cheng-Song等[2]2010年報道,針對鉤體脂多糖O抗原特異基因設計的引物可以鑒別我國鉤體常見的6個血清群,包括黃疸出血群(Icterohaemorrhagiae)、Sejroe(賽羅群)、Canicola(犬群)、Autumnalis(秋季群)、Grippotyphosa、(流感傷寒群)和Hebdomadis(七熱群),并采用75株參考菌株和40株臨床菌株對該方法進行了驗證,但未見該方法的廣泛應用。
本研究中我們采用Cai Cheng-Song等設計的針對我國常見6個群的鉤體血清群鑒定引物對58株鉤體疑似菌株進行鑒定,結果顯示58株菌株均被擴增出黃疸出血群預期的590 bp的特異性條帶,而其余5個血清群特異性引物均未擴增出DNA條帶,表明58株菌均屬黃疸出血群。為了評估檢測結果的可靠性,我們采用MAT實驗對O-PCR檢測結果進行驗證,結果顯示O-PCR檢測結果與傳統的MAT檢測方法結果完全一致,符合率為100%。本研究結果提示O-PCR技術可作為鉤體快速分群鑒定可靠的實驗室診斷技術手段,貴州省近年的鉤體流行菌群為黃疸出血群,該研究結果將為貴州省鉤體病的預防和控制提供可靠的技術手段和科學依據,對當地鉤體病的有效防控具有重要意義。
[1]Yan J, Dai BM, Yu ES. Leptospirosis[M]. 3rd Ed, Beijing: People’s Medical Publishing House, 2006:1-3. (in Chinese) 嚴杰,戴保民,于恩庶.鉤端螺旋體病學[M].3版.北京:人民衛生出版社,2006:1-3.
[2]Cai CS, Zhu YZ, Zhong Y, et al. Development of O-antigen gene cluster-specific PCRs for rapid typing six epidemic serogroups ofLeptospirain China[J]. BMC Microbiol, 2010, 10: 67. DOI: 10.1186/1471-2180-10-67
[3]Li SJ, Zhang CC, Li XW, et al. Molecular typing ofLeptospirainterrogansstrains isolated fromRattustanezumiin Guizhou Province, Southwest of China[J]. Biomed Environ Sci, 2012, 25(5): 542-548.
[4]Li SJ, Wang DM, Zhang CC, et al. Molecular typing ofLeptospiraspp. strains isolated from field mice confirms a link to human leptospirosis[J]. Epidemiol Infect, 2013, 141(11): 2278-2785.
[5]Li SJ, Zhang CC, Tang GP, et al. Carrier monitoring of rodents and bacterial typing ofLeptospirainsolated in the leptospirosis epidemic areas of Guizhou Province[J]. Chin J Prevent Med, 2013, 47(3): 280-281. (in Chinese) 李世軍,張翠彩,唐光鵬,等.貴州省2011年鉤端螺旋體病疫區鼠類動物帶菌監測與菌株分型[J]. 中華預防醫學雜志,2013,47(3):280-281.
[6]Zhang C, Wang H, Yan J. Leptospirosis prevalence in Chinese populations in the last two decades[J]. Microbes Infect, 2011, 14: 1-7.
[7]Yersin C, Bovet P, Merien F, et al. Pulmonary haemorrhage as a predominant cause of death in leptospirosis in Seychelles[J]. Trans R Soc Trop Med Hyg, 2000, 94: 71-76.
[8]Jiang XG, Xiao YC, Nie YX, et al. Identification ofLeptospirainterrogansby pulsed field gel electrophoresis[J]. Chin J Microbiol Immunol, 2001, 21(4): 378-381. (in Chinese) 蔣秀高,肖玉春,聶一新,等.致病性鉤端螺旋體脈沖場凝膠電泳圖譜分型研究[J].中華微生物學和免疫學雜志,2001,21(4):378-381.
[9]Guo ZQ, Huang ZY, Chen N, et al. Molecular typing ofLeptospirainterrogansfrom Sichuan province by pulsed field gel electrophoresis[J]. J Prev Med Infor, 2007, 23(6): 644-646. (in Chinese) 郭宗琪,黃自英,陳娜,等.四川省致病性鉤端螺旋體脈沖場電泳分型分析[J].預防醫學情報雜志,2007,23(6):644-646.
[10]Slack A, Symonds M, Dohnt M, et al. An improved multiple-locus variable number of tandem repeats analysis forLeptospirainterrogansserovar Australis: a comparison with fluorescent amplified fragment length polymorphism analysis and its use to redefine the molecular epidemiology of this serovar in Queensland, Australia[J]. J Med Microbiol, 2006, 55(11): 1549-1457.
[11]Zhang CC, Nie YX, Li XW, et al. Study on the MLVA typing ofLeptospiraserogroup icterohaemorrhagiae[J]. Chin J Microbiol Immun, 2009, 29(12): 1144-1147. (in Chinese) 張翠彩,聶一新,李秀文,等.黃疸出血群鉤端螺旋體MLVA分型研究 [J].中華微生物學和免疫學雜志,2009,29(12): 1144-1147.
[12]Thaipadungpanit J, Wuthiekanun V, Chierakul W, et al. A dominant clone ofLeptospirainterrogansassociated with an outbreak of human leptospirosis in Thailand[J]. PLoS Negl Trop Dis, 2007, 1(1): e56.
[13]Li S, Wang D, Zhang C, et al. Source tracking of human leptospirosis: serotyping and genotyping ofLeptospiraisolated from rodents in the epidemic area of Guizhou province, China[J]. BMC Microbiol, 2013, 13: 75. DOI: 10.1186/1471-2180-13-75
Serogroup identification and analysis ofLeptospiraisolates using serogroup specific PCR in Guizhou Province, China
LIU Ying1,2,CHEN Hong3,LI Pei-li4,MA Qing1,WANG Ding-ming1, TANG Guang-peng1,YAO Guang-hai1,ZHOU Jing-zhu1,CHEN Zheng-hong2,LI Shi-jun1
(1.GuizhouProvincialCenterforDiseaseControlandPrevention,Guiyang50004,China; 2.GuizhouMedicalUniversity,Guiyang550025,China; 3.GuiyangCenterforAnimalDiseaseControlandPrevention,Guiyang50004,China4.AnimalScienceCollegeofGuizhouUniversity,Guiyang50004,China)
In order to understand the epidemic serogroup of pathogenicLeptospiraand provide technical methods and scientific basis for the control and prevention of leptospirosis, the serogroup ofLeptospiraisolates collected in Guizhou Province were identified and analyzed by using O-antigen gene based serogroup-specific PCR. A total of 58 strains of leptospires collected from Guizhou Province in recent years were detected with pathogenic leptospire specific PCR (G1/G2-PCR) and further identified using O-antigen gene based PCR (O-PCR) which is specific for the serogroups of pathogenicLeptospira. Results were then confirmed with conventional microscope agglutination test (MAT). G1/G2-PCR detection results showed that all of the 58 isolates were pathogenic leptospires. O-PCR identified the 58 isolates asLeptospiraserogroup icterohaemorrhagiae, which was consistent with the results of conventional MAT. Results of this study indicate that O-PCR can be used as a reliable tool forLeptospiraserogroup identification in Guizhou Province, and the results of O-PCR indicated thatLeptospiraserogroup icterohaemorrhagiae was the epidemic serogroup ofLeptospirain Guizhou Province in recent years.
Leptospira; serogroup; PCR; Guizhou
10.3969/j.issn.1002-2694.2015.12.012
國家自然科學基金項目(No.81260250, No.81401679)、貴州省傳染病人才培養基地項目(黔人領發 [2013]15)“自然疫源性和蟲媒傳染病研究團隊(No.RCJD1401)”和貴州省疾病預防控制中心科學技術基金項目(No.2013-E2-1)聯合資助
李世軍,Email:zjumedjun@163.com 陳崢宏,Email:chenzhenghong@gmc.edu.cn
1.貴州省疾病預防控制中心,貴陽 550004; 2.貴州醫科大學, 貴陽 550025; 3.貴陽市動物疫病預防控制中心,貴陽 550004; 4.貴州大學動物科學院,貴陽 550025
R514.4
A
1002-2694(2015)12-1146-05
2015-06-01;
2015-08-07

