膿毒癥大鼠急性肺損傷機制研究
黃立搜 樓黎明 王世強 胡丹丹 陳素珍 徐一凱 章 潛
膿毒癥大鼠急性肺損傷機制研究
黃立搜 樓黎明 王世強 胡丹丹 陳素珍 徐一凱 章 潛
目的 探討膿毒癥大鼠急性肺損傷的機制。方法 采用盲腸結扎穿孔術(CLP)建立大鼠膿毒癥模型。健康成年雄性SD大鼠48只,隨機分為假手術組、膿毒癥組,每組24只。動物模型制備成功后,于術后3、12、24h檢測肺組織勻漿標本黃嘌呤氧化酶(XO)、丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽過氧化物酶(GSH-Px)含量。光學顯微鏡下觀察肺組織病理改變。結果 術后3、12、24h假手術組XO分別為(2.4±0.3)U/g、(2.3±0.5)U/g、(2.4±0.4)U/g,MDA為(15.7±2.7)nmol/ mg、(15.2±2.9)nmol/mg、(15.6±2.6)nmol/mg,SOD為(58.8±8.0)U/mg、(58.1±10.1)U/mg、(58.7±9.5)U/ mg,GSH-Px為(33.2±5.4)U/mg、(32.5±7.0)U/mg、(33.1±6.3)U/mg;膿毒癥組XO分別為(4.2±0.6)U/ g、(5.5±0.7)U/g、(5.7±0.5)U/g,MDA為(29.3±5.7)nmol/mg、(36.3±6.6)nmol/mg、(41.4±7.3)nmol/mg,SOD為(43.3±7.0)U/mg、(41.8±6.9)U/mg、(38.2±7.4)U/mg,GSH-Px為(27.9±4.0)U/mg、(26.4±3.9)U/ mg、(24.3±3.3)U/mg。與假手術組比較,膿毒癥大鼠肺組織XO、MDA含量顯著升高,SOD、GSH-Px含量顯著降低,差異有統計學意義(P<0.01)。結論 膿毒癥大鼠存在急性肺損傷,其機制可能與氧化應激相關。
大鼠;膿毒癥;肺損傷;黃嘌呤氧化酶;丙二醛;超氧化物歧化酶;谷胱甘肽過氧化物酶
1 實驗材料
1.1 動 物 健康成年雄性SD大鼠48只,體質量280~350g,由浙江中醫藥大學動物實驗中心提供,實驗動物合格證號:SCXK(滬)2013-0016。
1.2 試 劑 黃嘌呤氧化酶(XO)試劑盒(美國RND公司,批號R3201L);丙二醛(MDA)試劑盒(美國RND公司,批號R4785L);超氧化物歧化酶(SOD)試劑盒(美國RND公司,批號R4421L);谷胱甘肽過氧化物酶(GSH-Px)試劑盒(美國RND公司,批號R7098L)。
2 實驗方法
2.1 分組及模型制備 健康成年雄性SD大鼠48只,隨機分為假手術組、膿毒癥組,每組24只。采用胡丹丹等[3]建立的盲腸結扎穿孔術(CLP)法制備大鼠膿毒癥模型:大鼠經2%戊巴比妥鈉(50mg/kg)麻醉后,沿腹正中作一長1.5cm的切口,打開腹腔后小心分離盲腸,避免碰觸腸系膜血管,在盲腸根部結扎,在與腸系膜相對的盲端腸壁漿膜面用9號針頭穿刺2次,輕擠出少量內容物,還納盲腸于腹腔,關閉腹腔,逐層縫合,術后即刻予以皮下注射生理鹽水10mL/kg補充手術過程中丟失的體液。假手術組除不結扎和穿刺盲腸外,其余操作同膿毒癥組。
2.2 標本采集與指標檢測 術后3、12、24h各組分別取8只大鼠,給予10%水合氯醛(0.3mL/100g)腹腔注射麻醉,經腹主動脈采血,處死。留取左肺固定于4%甲醛中石蠟包埋切片行HE染色,留取右肺置于-70℃冰箱,制作肺組織勻漿。酶聯免疫吸附(ELISA)法檢測肺組織勻漿標本黃嘌呤氧化酶(XO)、丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽過氧化物酶(GSH-Px)的含量。
2.3 肺組織病理觀察 肺組織用梯度酒精脫水、浸蠟和包埋,制成石蠟塊,用蘇木素染色,鹽酸酒精分化及自來水返藍,之后伊紅染色,再次脫水、透明、封片,于顯微鏡下觀察炎癥細胞浸潤,光學顯微鏡下觀察肺組織病理改變。
2.4 統計學方法 所有數據應用SPSS11.5統計軟件處理數據,計量資料用均數±標準差(±s) 表示,組間比較采用單因素方差分析(one-way ANOVA),P<0.05為差異有統計學意義。
3 實驗結果
3.1 大鼠肺組織病理結果 假手術組肺組織結構完整,肺泡腔清晰,水腫和炎癥滲出少;隨著時間的推移,與假手術組比較,模型組肺組織可見炎性細胞浸潤逐漸加重,肺水腫、出血以及肺不張逐漸加重,肺泡間隔逐漸增厚并破壞,見圖1(封二)。
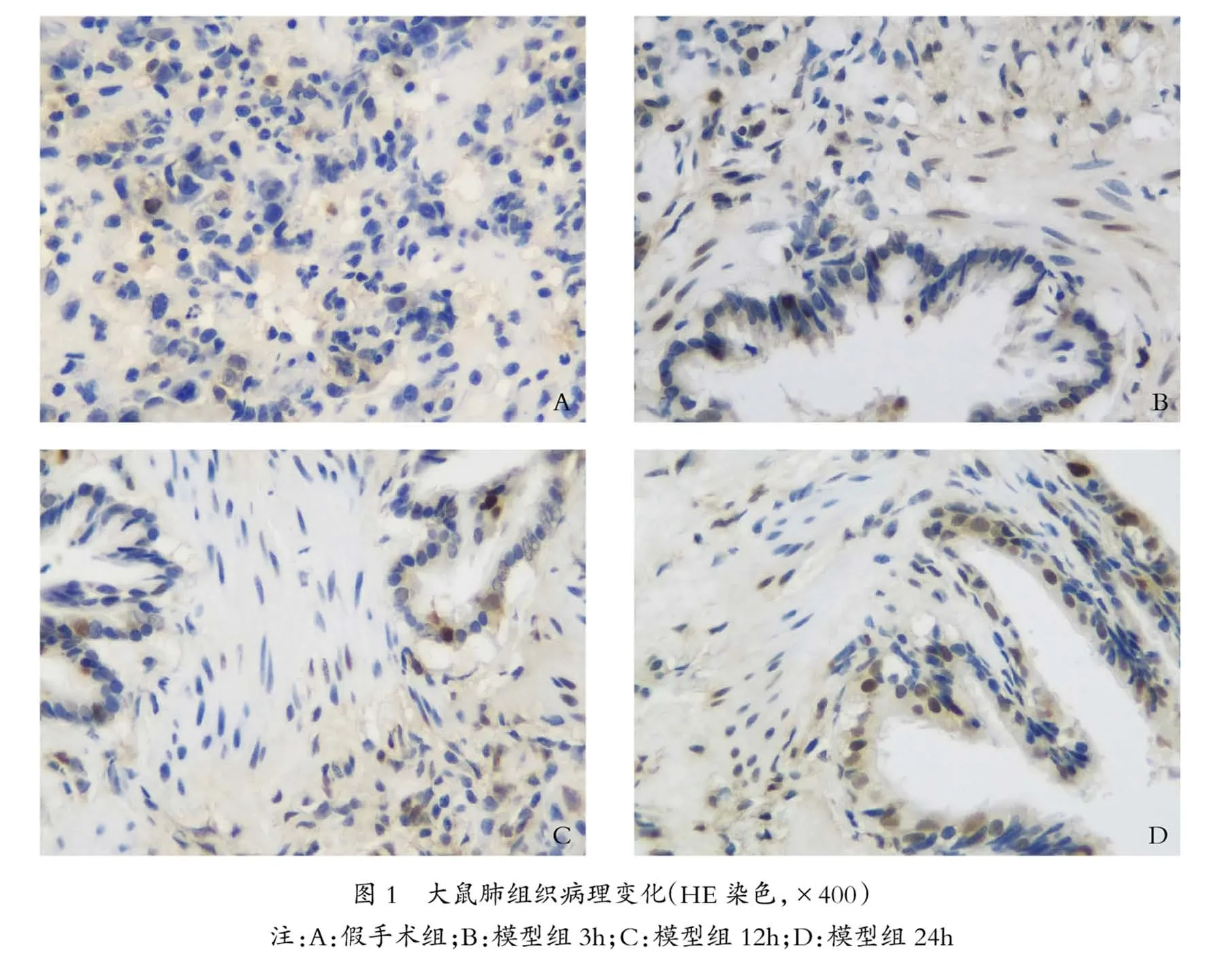
3.2 大鼠肺組織XO、MDA、SOD、GSH-Px含量比較
與假手術組比較,膿毒癥大鼠肺組織XO、MDA含量顯著升高,SOD、GSH-Px含量顯著降低,差異有統計學意義(P<0.01),見表1。
表1 兩組大鼠肺組織XO、MDA、SOD、GSH-Px含量比較(±s)

表1 兩組大鼠肺組織XO、MDA、SOD、GSH-Px含量比較(±s)
注:與假手術組比較,*P<0.01;XO:黃嘌呤氧化酶;MDA:丙二醛;SOD:超氧化物歧化酶;GSH-Px:谷胱甘肽過氧化物酶
假手術組膿毒癥組3h 12h 24h 3h 12h 24h 888888 2.4±0.3 2.3±0.5 2.4±0.4 4.2±0.6* 5.5±0.7* 5.7±0.5* 15.7±2.7 15.2±2.9 15.6±2.6 29.3±5.7* 36.3±6.6* 41.4±7.3* 58.8±8.0 58.1±10.1 58.7±9.5 43.3±7.0* 41.8±6.9* 38.2±7.4* 33.2±5.4 32.5±7.0 33.1±6.3 27.9±4.0* 26.4±3.9* 24.3±3.3*
4 討論
膿毒癥是臨床較為常見的一種危重癥,它除可引起劇烈的全身炎癥反應外,還常導致肺、肝、腎、腸道、腦等多個器官的功能失常。尤其是膿毒癥導致的肺損傷發生早、病情重,常是患者死亡的直接原因[4]。肺臟是膿毒癥時最易受累的靶器官,表現為急性肺損傷或急性呼吸窘迫綜合征。過度的炎性因子釋放與氧化應激,共同促進急性肺損傷發生發展,目前其機制尚未完全明了,缺乏針對性的治療措施。因而研究膿毒癥導致肺損傷機制具有重要的意義[5]。
氧化應激在膿毒癥的發生、發展中起重要作用,氧化應激產生大量自由基,可以和各種細胞成分發生不可逆反應,破壞細胞的結構和功能。氧化應激不但氧化蛋白質,改變蛋白質活性,導致蛋白酶釋放,使抗氧化劑和抗蛋白酶失活,而且可以直接損傷DNA導致斷裂和點突變;導致脂質過氧化,產生血管活性物質和前炎性物質如血栓素;改變轉錄因子,導致前炎性物質基因表達增強[6]。最終導致肺微血管完整性和肺泡屏障破壞,并且損傷Ⅱ型肺泡上皮細胞,引起板層狀小體水腫、崩解,肺表面活性物質減少、功能下降,從而導致急性肺損傷的發生[6]。黃嘌呤氧化酶(xanthine oxidase,XO)是嘌呤核苷酸的分解代謝酶,對自由基的產生有重要作用,反映缺氧損傷的情況[7]。急性肺損傷時,組織缺血/缺氧,組織中的黃嘌呤脫氫酶可變構為XO。機體內XO活性增高,意味著機體內黃嘌呤氧化酶系統的激活,氧自由基的生成增多。丙二醛(malondialdehyde,MDA)是自由基與細胞的膜性結構,如細胞膜、線粒體膜等發生脂質過氧化反應的產物,它反映體內氧自由基生成量及活性,間接地反映細胞受損的程度[8]。即機體內氧自由基的活性越高,脂質過氧化反應越強,則組織細胞的損傷越重。MDA含量的變化可代表體內氧自由基的變化,進而反應肺內氧化損傷程度。MDA含量增加表明CLP術后氧自由基產生增多,導致細胞膜脂質過氧化,損傷肺泡細胞[9]。超氧化物歧化酶(superoxide dismutase,SOD)是重要的抗氧化酶,其參與清除超氧陰離子、減少還原型亞硝酸鹽的形成及所致的損傷,對肺具有保護作用[10]。胞外SOD的表達活性水平與肺損傷的程度呈明顯負相關[11-12],而氧化應激產物可降低該酶活性[13]。本研究結果顯示,在CLP術后24h,膿毒癥組大鼠血清SOD活性水平顯著下降,即膿毒癥時機體存在抗氧化能力減弱的情況。谷胱甘肽過氧物酶(glutathione peroxidase,GSH-Px)是氧自由基清除酶,是肺組織重要的抗氧化防御因子,它能夠清除呼吸代謝過程中產生的大量過氧化物和羥自由基,從而減輕細胞膜多不飽和脂肪酸的脂質過氧化反應,清除脂類自由基,保護機體免受攝入脂質過氧化物的損害[14],從而保護細胞膜的結構及功能不受過氧化物的干擾及損害。CLP是比較公認的臨床相關性較強膿毒癥大鼠模型常用的方法,本研究顯示,CLP能使大鼠體內自由基產生過氧化反應增加,導致膿毒癥大鼠急性肺損傷,其具體機理有待進一步研究。
[1]Alastair G,Proudfoot,Danny F,et al.Human models of acute lung injury[J].Dis Mod&Mechan,2011,4(2):145-153.
[2]Wu L,Gokden N,Mayeux PR.Evidence of the role of reactive nitrogen species in polymicrobial sepsis-induced renal peritubular capillary dysfunction and tubular injury[J].J Am Soc Nephrol,2007,18(6):1807-1815.
[3]胡丹丹,楊國良,陳偉.益氣涼血化疲湯對膿毒癥大鼠心肌損傷的影響[J].浙江中西醫結合雜志,2012,22(11):856-858.
[4]Huang Y,Pettitt SJ,Guo G,et al.Isolation of homozygous mutantmouse embryonic stem cells using a dual selection system[J].Nucleic Acids Res,2012,40(3):e21.
[5]田蜜,劉芳芳,紀木火,等.富氫液對大鼠膿毒血癥引起急性肺損傷的影響[J].現代生物醫學進展,2012,12(32):6225-6227.
[6]Hybertson BM,Lee YM,Cho HG,et a1.Alveolar type II cell abnormalities and peroxide formation in Lungs ofrats given IL-1 intratracheally[J].Inflammation,2000,24(4):289-303.
[7]Warzecha Z,Dembinski A,Ceranowicz P,et al.Ischemic preconditioning of the hindlimb or kidney does not attenuate the severity of acute ischemia/reperfusion-induced pancreatitis in rats[J].J Physiol Pharmacol,2008,59(2):337-352.
[8]Yang G,Han Y,Tian X,et al.Pattern of expression of the CREG gene and CREG protein in the mouse embryo[J]. Mol Biol Rep,2011,38(3):2133-2140.
[9]馬春燕,陳麗.氯胺酮對膿毒癥大鼠肺組織HO-1表達的影響[J].中國醫療前沿,2011,6(22):15-16.
[10]Kinnula VL,Crapo JD.Superoxide dismutases in the lung and human lung diseases[J].Am J Respir Crit Care Med,2003,167(12):1600-1619.
[11]Yen CC,Lai YW,Chen HL,et al.Aerosolized human extracellular superoxide dismutase prevents hyperoxiainduced lung injury[J].PLoS One,2011,6(10):26870.
[12]Hassett P,Curley GF,Contreras M,et al.Over expression of pulmonary extracellular superoxide dismutase attenuates endotoxin-induced acute lung injury[J].Intensive Care Med,2011,37(10):1680-1687.
[13]Ware LB.Pathophysiology of acute lung injury and the acute respiratory distress syndrome[J].Semin Respir Crit Care Med,2006,27(4):337-349.
[14]Gemma FM,Paloma CS,Roberto E,et al.Antio xidant enzyme activity and coronary heart disease:meta-analyses of observational studies[J].Am J Epidemiol,2009,170(2):135-147.
(收稿:2015-06-15 修回:2015-07-28)
Mechanism of Acute Pulmonary Injury in Rats with Sepsis
HUANG Lisou,LOU Liming,WANG Shiqiang, HU Dandan,CHEN Suzhen,XU Yikai,ZHANG Qian Department of Respiratory Diseases,the Third Hospital Affiliated to Zhejiang Chinese Medical University,Hangzhou(310005),China
Objective To investigate the mechanism of acute pulmonary injury in sepsis rats.Methods Colon ligation perforation was applied to rats to establish sepsis model.Forty-eight healthy adult male SD rats were randomly divided into sham group and sepsis group(n=24 in each group).At 3,12,24h after surgery,every 8 rats in each group were sacrificed to obtain lung tissue for determination of xanthine oxidase(XO),malonaldehyde(MDA), superoxide dismutase(SOD),and glutathione peroxidase(GSH-Px).Pathological changes of lung tissue was observed with light microscopy.Results At 3,12,24h after surgery in sham group,XO were 2.4±0.3U/g,2.3±0.5U/g,and 2.4±0.4U/g,MDA were 15.7±2.7nmol/mg,15.2±2.9nmol/mg,15.6±2.6nmol/mg,SOD were 58.8±8.0U/mg,58.1±10.1U/ mg,58.7±9.5U/mg,and GSH-Px were 33.2±5.4U/mg,32.5±7.0U/mg,33.1±6.3U/mg;in sepsis group,XO were 4.2± 0.6U/g,5.5±0.7U/g,and 5.7±0.5U/g,MDA were 29.3±5.7nmol/mg,36.3±6.6nmol/mg,41.4±7.3nmol/mg,SOD were 43.3±7.0U/mg,41.8±6.9U/mg,38.2±7.4U/mg,and GSH-Px were 27.9±4.0U/mg,26.4±3.9U/mg,24.3±3.3U/mg.Compared with sham group,the concentration of XO and MDA were significantly increased and SOD and GSH-Px were significantly decreased in sepsis group(P<0.01).Conclusion Sepsis rats suffer from acute pulmonary injury,which may be related to oxidative stress.
rats;sepsis;pulmonary injury;xanthine oxidase;malonaldehyde;superoxide dismutase;glutathione peroxidase膿毒癥是細菌感染后引起的全身炎癥反應,是危重患者手術后常見并發癥,同時也是臨床危重病患者死亡的重要原因之一。在眾多膿毒癥并發的器官損傷中,膿毒癥導致的急性肺損傷(acute lung injury/acute respiratory distress syndrome,ALI/ARDS)發生早、病情重,也是加速患者死亡的重要原因[1]。盲腸結扎穿孔術(CLP)是目前公認的與臨床相關性較強的膿毒癥模型[2],本研究采用CLP制備大鼠膿毒癥模型,觀察膿毒癥大鼠肺損傷的機制,現報道如下。
浙江省中醫藥科技計劃項目(No.2010ZA047);浙江中醫藥大學附屬第三醫院院級醫藥衛生科技計劃項目(No. ZS10ZA04)
浙江中醫藥大學附屬第三醫院呼吸科(杭州310005)
樓黎明,Tel:13505712348;E-mail:llm2348@hotmail.com

