歐前胡素下調Mcl-1蛋白表達誘導人肝癌細胞HepG2凋亡實驗研究
俞方紅黃曉燕
歐前胡素下調Mcl-1蛋白表達誘導人肝癌細胞HepG2凋亡實驗研究
俞方紅1黃曉燕2
目的 探討歐前胡素對人肝癌細胞的抑制作用及機制。方法 將人肝癌細胞系HepG2用5、10、20、40、80μM的歐前胡素處理24h或48h,以相同培養條件不加歐前胡素的HepG2細胞為對照組,MTT法檢測歐前胡素治療后HepG2細胞的增殖抑制情況;HepG2細胞用10、20、40μM的歐前胡素處理24h,通過流式細胞術和Western blot檢測歐前胡素對HepG2細胞的凋亡誘導作用和Mcl-1(myeloid cell leukemia-1)的表達;在HepG2細胞中轉染pcDNA-3.1-Mcl-1真核表達載體后再用歐前胡素治療,檢測歐前胡素對HepG2細胞的增殖抑制作用和凋亡誘導效應。結果 10、20、40、80μM歐前胡素組增殖抑制率分別為24h:(7.2±1.7)%、(14.5±2.6)%、(37.4±3.7)%、(56.3± 4.3)%;48h:(14.5±2.1)%、(23.6±3.0)%、(52.3±4.8)%、(78.3±5.9)%,與對照組(0)比較,差異均有統計學意義(P<0.05);10、20、40μM歐前胡素組凋亡誘導率分別為(3.9±0.8)%、(12.4±1.8)%、(26.9± 2.5)%,與對照組(0.5±0.2)%比較,差異有統計學意義(P<0.05)。歐前胡素治療后,HepG2細胞的Mcl-1表達水平顯著下降,用pcDNA-3.1-Mcl-1真核表達載體轉染HepG2細胞后,歐前胡素對HepG2細胞的凋亡誘導率較空pcDNA3.1載體轉染組顯著下降[(6.8±1.2)%比(25.7±2.3)%,P<0.05]。結論 歐前胡素具有體外抗肝腫瘤的生物活性,其抗腫瘤效應的機制可能是通過下調Mcl-1蛋白表達從而誘導細胞凋亡。
人肝癌細胞HepG2;歐前胡素;Mcl-1;凋亡
肝癌是我國死亡率最高的癌癥之一[1],手術和肝移植是早期肝癌最常用的治療手段,且治愈率較高。但是超過80%的肝癌患者在被發現時已經處于中晚期,腫瘤組織往往難以切除并伴隨轉移灶,預后很差,只能采取化療手段治療[2]。誘導腫瘤細胞凋亡是化療藥物的重要機制,然而長期化療常常造成腫瘤細胞通過抵抗凋亡而對化療藥物耐藥[3],因此尋找新的治療方法十分重要。歐前胡素是從白芷根中提取的香豆素類天然活性物質,據報道有十分良好的抗腫瘤效應[4]。歐前胡素對肝腫瘤的抑制效應及機制目前仍不清楚,筆者觀察歐前胡素對人肝癌細胞的抑制作用及機制,發現歐前胡素可顯著抑制肝腫瘤細胞的生長,其機制可能在于通過下調Mcl-1(myeloid cell leukemia-1)的表達從而誘導腫瘤細胞凋亡。報道如下。
1 材料與方法
1.1 細胞培養 人肝癌細胞系HepG2為本院臨床檢驗實驗室保存,購于中國科學院生物化學與細胞生物學研究所,培養在DMEM培養基中,培養環境為37℃恒溫且通入5%的CO2。
1.2 試 劑 DMEM培養基(批號:11995-065),購于美國Gibco公司。歐前胡素(批號:I6659)、噻唑藍(MTT,批號:M2128),均購于Sigma-Aldrich。PI/AnnexinⅤ凋亡試劑盒(批號:88-8005-74),購于美國ebioscience。細胞蛋白裂解液(批號:#9803),切割型PARP抗體(cleaved PARP,批號:#9541,僅識別切割型PARP抗體,不能識別全長PARP),Mcl-1抗體(批號:#5453)及β-actin抗體(批號:#4967),均購于美國cell signaling公司。PVDF膜購于美國Millipore公司(批號:IPVH00010)。pcDNA3.1(批號:V790-20),轉染試劑Lipofectamine2000(批號:11668030),Trizol(批號:15596-018),均購于Invitrogen公司。ECL顯色試劑盒(批號:W1001),購于promega公司。
1.3 MTT試驗 將HepG2細胞按1000個/孔接種于96孔板,加入200μL DMEM培養,設置3個復孔,分別加入5、10、20、40、80μM的歐前胡素培養24、48h,對照組為不加歐前胡素同樣條件培養24、48h。之后加5mg/mL MTT 20μL,繼續培養4h。棄上清,往孔中加入150μL二甲亞砜,570nm波長下用酶標儀檢測OD值,細胞增殖抑制率用以下公式計算:抑制率=(對照組OD值-歐前胡素組OD值)/對照組OD值×100%。
1.4 細胞凋亡試驗 HepG2細胞的凋亡采用Annexin V/PI染色法檢測。在HepG2細胞培養瓶中分別加入10、20、40μM的歐前胡素培養24h,對照組為不加歐前胡素同樣條件培養24h,將5μL Annexin V/PI檢測液加入細胞中37℃孵育20min,采用流式細胞術檢測腫瘤細胞的凋亡。細胞凋亡率用Annexin V陽性細胞占所有細胞比值表示[5]。
1.5 Western blot試驗 在HepG2細胞培養瓶中分別加入10、20、40μM的歐前胡素培養24h,收集細胞并裂解,裂解后的蛋白提取液用12.5%的丙烯酰胺進行SDS-PAGE,之后將凝膠取下將蛋白轉膜到PVDF膜上。將膜在Mcl-1、cleaved PARP或β-actin一抗稀釋液中孵育過夜,之后在帶辣根過氧化物酶活性的二抗稀釋液中孵育2h,ECL試劑顯色曝光,以Mcl-1或cleaved PARP顯色條帶與β-actin顯色條帶的灰度比值表示蛋白的相對表達水平。
1.6 質粒構建及轉染 將HepG2細胞用Trizol試劑裂解后提取mRNA,用PCR法擴增Mcl-1基因的cDNA全長序列(Gene ID:NM_001197320.1)。引物如下:正向引物:5’-GAGAAGCTTGCCACTTCTCACTT CCGCT-3’,反向引物:5’-TGGAATTCATAATCC TCTTGCCACTTGC-3’(下劃線堿基分別為HindⅢ,EcoRI限制性內切酶位點)。將PCR擴增產物通過酶切位點與pcDNA3.1連接后構建成pcDNA3.1-Mcl-1重組真核表達質粒。將HepG2細胞接種在6孔板中,待細胞密度生長到鋪滿板面約80%時按Lipofectamine 2000操作說明書在HepG2細胞中轉染2μg pcDNA3.1-Mcl-1重組質粒或對照空pcDNA3.1質粒培養24h,之后加40μM的歐前胡素再培養24h,檢測細胞增殖抑制率,凋亡水平和cleaved PARP表達水平。
1.7 統計學方法 實驗重復3次,應用SPSS13.0統計分析軟件進行處理,計量資料以(±s) 表示,P值計算采用非配對雙邊t檢驗以及單因素方差分析,P<0.05為差異有統計學意義。
2 結 果
2.1 歐前胡素對人肝癌細胞系HepG2生長的抑制作用 歐前胡素呈劑量和時間依賴性地抑制HepG2細胞的生長,見表1。
2.2 歐前胡素下調HepG2細胞Mcl-1表達并誘導細胞凋亡 歐前胡素呈劑量依賴性誘導HepG2細胞凋亡,見表2。
2.3 外源性Mcl-1表達廢除歐前胡素對HepG2細胞的凋亡誘導效應 轉染pcDNA3.1-Mcl-1重組質粒可顯著升高Mcl-1的表達(P<0.05),減弱歐前胡素對HepG2細胞生長的抑制作用和凋亡誘導效應(P<0.05)。見表3~4。
表1 歐前胡素對HepG2細胞的抑制作用(±s)
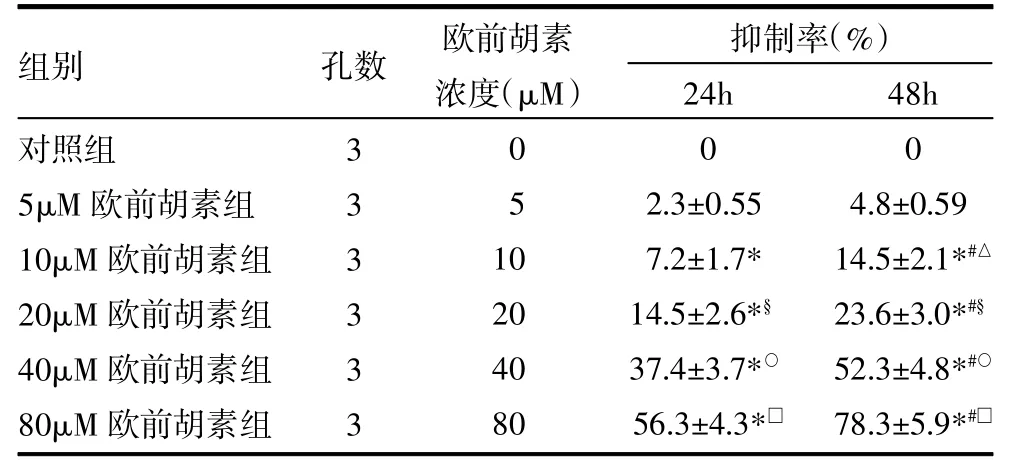
表1 歐前胡素對HepG2細胞的抑制作用(±s)
注:與對照組比較,*P<0.05;與5μM歐前胡素組比較,△P<0.05;與10μM歐前胡素組比較,§P<0.05;與20μM歐前胡素組比較,○P<0.05;與40μM歐前胡素組比較,□P<0.05;與同濃度歐前胡素處理24h比較,#P<0.05
對照組5μM歐前胡素組10μM歐前胡素組20μM歐前胡素組40μM歐前胡素組80μM歐前胡素組333333 051 0 20 40 80 0 2.3±0.55 7.2±1.7* 14.5±2.6*§37.4±3.7*○56.3±4.3*□0 4.8±0.59 14.5±2.1*#△23.6±3.0*#§52.3±4.8*#○78.3±5.9*#□
表2 歐前胡素下調HepG2細胞Mcl-1表達誘導凋亡(±s)
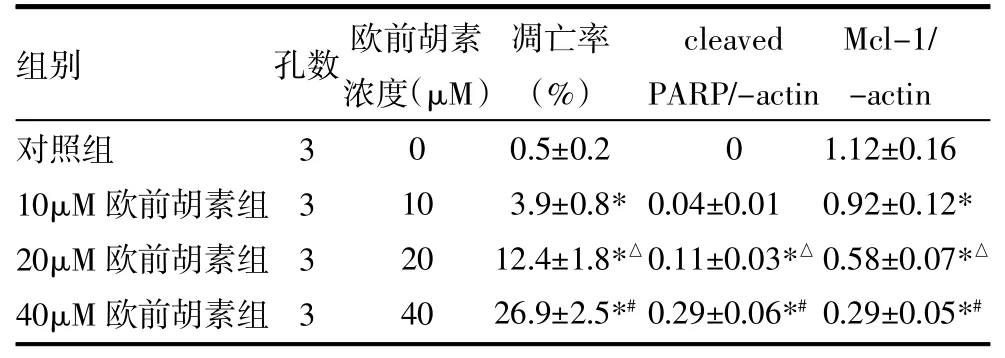
表2 歐前胡素下調HepG2細胞Mcl-1表達誘導凋亡(±s)
注:與對照組比較,*P<0.05;與10μM歐前胡素組比較,△P<0.05;與20μM歐前胡素組比較,#P<0.05
組別對照組10μM歐前胡素組20μM歐前胡素組40μM歐前胡素組3333 0 10 20 40 0.5±0.2 3.9±0.8* 12.4±1.8*△26.9±2.5*#0 0.04±0.01 0.11±0.03*△0.29±0.06*#1.12±0.16 0.92±0.12* 0.58±0.07*△0.29±0.05*#孔數歐前胡素濃度(μM)凋亡率(%)cleaved PARP/-actin Mcl-1/ -actin
表3 pcDNA3.1-Mcl-1重組質粒對歐前胡素抗腫瘤效應的影響(±s)

表3 pcDNA3.1-Mcl-1重組質粒對歐前胡素抗腫瘤效應的影響(±s)
注:與對照組比較,*P<0.05;與空pcDNA3.1組比較,#P<0.05
組別對照組空pcDNA3.1組pcDNA3.1-Mcl-1組孔數pcDNA3.1-Mcl-1質粒(μg) 空pcDNA3.1質粒(μg)333 002 220歐前胡素濃度(μM)0 40 40 Mcl-1/-actin 1.08±0.14 0.32±0.06* 1.34±0.21*#24h抑制率(%)0 36.5±4.1* 10.5±2.7*#
表4 pcDNA3.1-Mcl-1重組質粒對歐前胡素抗腫瘤效應的影響(±s)

表4 pcDNA3.1-Mcl-1重組質粒對歐前胡素抗腫瘤效應的影響(±s)
注:與對照組比較,*P<0.05;與空pcDNA3.1組比較,#P<0.05
組別對照組空pcDNA3.1組pcDNA3.1-Mcl-1組孔數pcDNA3.1-Mcl-1質粒(μg) 空pcDNA3.1質粒(μg)333 002 220歐前胡素濃度(μM)0 40 40凋亡率(%)0.6±0.2 25.7±2.3* 6.8±1.2*#cleaved PARP/-actin 0 0.31±0.06* 0.07±0.02*#
3 討論
腫瘤細胞耐藥的重要機制是對化療藥物誘導的凋亡效應的抵抗,因此研究腫瘤細胞抵抗凋亡的分子機制并開發新的治療藥物是中晚期肝癌治療的重要方法。Mcl-1最早在人髓白血病細胞系中被發現,其序列和功能與Bcl-2相似,但Mcl-1的半衰期很短且受多種內源性分子的調控[6]。Mcl-1定位于線粒體外膜,通過與一些促凋亡蛋白如Bim、Bak和NOXA等形成異二聚體使之失活,從而阻斷細胞色素C從線粒體中釋放,抑制細胞進入凋亡程序[7-8]。近些年研究[9-10]發現,Mcl-1的表達水平和腫瘤細胞存活與化療藥物耐藥密切相關,腫瘤細胞Mcl-1的高表達顯著降低了它們對化療藥物所致凋亡誘導效應的敏感性。歐前胡素是一種香豆素類化合物,提取于白芷根部,研究發現其有很強的抗腫瘤效應,能誘導人白血病細胞系HL-60的凋亡[11],與順鉑合用顯著殺傷人宮頸癌細胞等[12]。然而歐前胡素誘導人腫瘤細胞凋亡的具體機制至今仍不十分清楚。本研究發現歐前胡素具有顯著的體外抗肝腫瘤的生物效應,其機制為誘導肝癌細胞凋亡。歐前胡素還可顯著下調HepG2細胞Mcl-1的表達,當轉染外源性Mcl-1表達載體后,Mcl-1水平顯著上升并且廢除了歐前胡素的抗腫瘤效應,由此證明抑制Mcl-1的蛋白表達可能是歐前胡素誘導腫瘤細胞凋亡的機制之一。歐前胡素呈劑量依賴性誘導HepG2細胞凋亡。PARP(poly ADP-ribose polymerase)是DNA修復酶,是細胞凋亡核心成員天冬氨酸酶(caspase)的切割底物,因此切割型PARP(cleaved PARP)是細胞凋亡的標記蛋白[13]。Mcl-1是腫瘤細胞內高表達的抗凋亡蛋白,其高表達與腫瘤細胞抵抗凋亡和耐藥有關[14]。歐前胡素誘導HepG2細胞凋亡的機制可能和下調Mcl-1蛋白水平有關,本組結果顯示,歐前胡素有良好的抗肝腫瘤生物活性,為肝癌細胞的促凋亡治療提供了新的途徑和理論依據。
[1]Chen JG,Zhang SW.Liver cancer epi-demic in China:past,present and future,Semin[J].Cancer Biol,2011,21(1):59-69.
[2]Eskens FA,van Erpecum KJ,de Man RA,et al.Hepatocellular carcinoma:Dutch guideline for surveillance,diagnosis and therapy[J].Neth JMed,2014,72(6):299-304.
[3]Kang MH,Reynolds CP.Bcl-2 inhibitors:targetingmitochondrialapoptotic pathways in cancer therapy[J].Clin Cancer Res,2009,15(4):1126-1132.
[4]Thanh PN,Jin W,Song G,et al.Cytotoxic coumarins from the root of Angelica dahurica[J].Arch Pharm Res,2004,27(12):1211-1215.
[5]Gao M,Li Y,Li Y,et al.Down-regulation of CD59 inhibits proliferation and promotes apoptosis of HeLa cells[J].Xi Bao Yu Fen ZiMian Yi Xue Za Zhi,2014,30(6):585.
[6]Bose P,Grant S.Mcl-1 as a Therapeutic Target in Acute Myelogenous Leukemia(AML)[J].Leuk Res Rep,2013,2(1):12-14.
[7]Rahmani M,Aust MM,Grant S,et al.PI3K/mTOR inhibition markedly potentiates HDAC inhibitor activity in NHL cells through BIM-and MCL-1-dependentmechanisms in vitro and in vivo[J].Clin Cancer Res,2014,20(18):4849-4860.
[8]Geserick P,Wang J,Leverkus M,et al.The ratio of Mcl-1 and Noxa determines ABT737 resistance in squamous cell carcinoma of the skin[J].Cell Death Dis,2014,5:e1412.
[9]Liu XS,Jiang J,Cai YM,et al.Lycorine induces apoptosis and down-regulation of Mcl-1 in human leukemia cells[J]. Cancer Lett,2009,274(1):16-24.
[10]Pei XY,Dai Y,Grant S,et al.Circumvention of Mcl-1-dependent drug resistance by simultaneous Chk1 and MEK1/2 inhibition in human multiple myeloma cells[J]. PLoSOne,2014,9(3):e89064.
[11]Pae HO,Oh H,Chung HT,et al.Imperatorin,a furanocoumarin from Angelica dahurica(Umbelliferae),induces cytochrome c -dependent apoptosis in human promyelocytic leukaemia,HL -60 Cells[J].harmacol Toxicol,2002,91(1):40-48.
[12]Jakubowicz-Gil J,Paduch R,Gawron A,et al.Cell death in HeLa cells upon imperatorin and cisplatin treatment[J]. Folia Histochem Cytobiol,2012,50(3):381-391.
[13]Lee CJ,Yue CH,Chen YH,et al.Antitumor activity of acriflavine in lung adenocarcinoma cell line a549[J]. Anticancer Res,2014,34(11):6467-6472.
[14]Mattoo AR,Zhang J,Jessup JM,etal.Inhibition of NANOG/ NANOGP8 Downregulates MCL-1 in Colorectal Cancer Cells and Enhances the Therapeutic Efficacy of BH3 Mimetics[J].Clin Cancer Res,2014,20(21):5446-5455.
(收稿:2014-11-08 修回:2014-12-14)
Imperatorin Down-regulates the Expression of M cl-1 Inducing the Apoptosis in Hepatocellular Carcinoma Cell Line HepG2
YU Fanghong1,HUANG Xiaoyan2.1 Clinical Laboratory,Ningbo Municipal Women and Children's Hospital,Ningbo(315031),China;2 Central Laboratory,Ningbo Medical Treatment Center Lihuili Hospital, Ningbo(315040),China
Objective To investigate the inhibitory effect of imperatorin on human hepatocellular carcinoma cells and the underlying mechanism.M ethods HepG2 cells were treated with 0(control group),5,10,20,40,and 80 μM imperatorin for 24 or 48 h,then MTT assay was used to detect the proliferation of HepG2 cells.The apoptosis of HepG2 cells and the expression of Mcl-1 was assessed by flow cytometry and western blot in HepG2 cells treated with 10,20,40μM imperatorin for 24 h.The vector of pcDNA-3.1-Mcl-1 was transfected in HepG2 cells before treated with imperatorin,then the proliferation and apoptosis of cells were detected.Results The inhibition rate of proliferation of HepG2 cells treated with 10,20,40,and 80μM imperatorin was as follows:(7.2±1.7)%,(14.5±2.6)%,(37.4±3.7)%,and(56.3±4.3)%for 24h;(14.5±2.1)%,(23.6±3.0)%,(52.3±4.8)%,and(78.3± 5.9)%for 48h,all with significant difference compared with control group(P<0.05).The apoptosis rate of 10,20, and 40μM group was(3.9±0.8)%,(12.4±1.8)%,and(26.9±2.5)%,respective,all with significant differences compared with that of control group[(0.5±0.2)%,P<0.05].Imperatorin treatment significantly decreased the expression of Mcl-1.Transfection of pcDNA-3.1-Mcl-1 inhibited the anti-tumor effect of imperatorin [(6.8±1.2)%vs(25.7± 2.3)%,P<0.05].Conclusion Imperatorin exerts anti-tumor bio-activity.It may induce apoptosis of HepG2 cells via down-regulating the expression of Mcl-1.
Human hepatocellular carcinoma cell HepG2;Imperatorin;Mcl-1;Apoptosis
1浙江省寧波市婦女兒童醫院檢驗科(寧波 315031);2浙江省寧波市李惠利醫院中心實驗室(寧波 315040)
俞方紅,Tel:13957819709

