HME、AS在胃癌組織中的表達及臨床意義
盧 杰,石 海,程 芃,張楠楠,許建明,胡乃中
胃癌是目前世界上最常見的致死原因[1-2],由于目前胃癌發病機制尚未完全闡明,早期無特異性的癥狀和體征,所以患者的就診率低,早期胃癌檢出率低,死亡率高。故胃癌早期診斷和預后判定是胃癌研究急需解決的問題。人巨噬細胞金屬彈力酶(human macrophage metalloelastase,HME)是胃癌細胞穿透基底膜和腫瘤浸潤組織必不可少的一種活性物質,部分腫瘤細胞也具有分泌巨噬細胞金屬彈力酶的作用,HME能分解纖溶酶原生成血管抑素(gngiostatin,AS),其能抑制腫瘤的微血管內皮細胞增殖,對早期胃癌診斷及預后評估有重要意義。該研究對HME和AS在胃癌組織中的表達進行探討,并分析兩者在胃癌組織中表達的關聯性及其意義。
1 材料與方法
1.1 標本來源 收集2007年6月~2008年1月安徽醫科大學第一附屬醫院病理確診的30例胃癌患者病理蠟塊標本和癌旁正常胃黏膜;胃癌組織和癌旁組織均再次由病理科醫師經HE染色鏡檢確認診斷結果。患者術前均未接受放化療,術后均經病理證實,同時患者未合并其他惡性腫瘤。30例癌旁正常胃黏膜組織均取自距胃癌組織切緣5 cm以外的正常胃黏膜組織。所有病例臨床及病理資料完整,見表1。
1.2 主要試劑 兔抗人Anti-Angiomotin多克隆抗體購自美國 Abcam公司;基質金屬蛋白酶-12(MMP-12)兔抗人多克隆抗體、免疫組化試劑盒、DAB顯色液、檸檬酸鹽及PBS均購自北京中杉金橋生物技術有限公司。
1.3 實驗方法 采用免疫組化SP法對石蠟切片進行染色,石蠟包埋組織切片(厚為3 μm)經常規脫蠟、水化;按要求進行抗原修復后,滴加羊血清封閉抗原,滴加一抗、生物素標記的二抗及鏈霉素親和素-過氧化物酶,DAB顯色,常規梯度酒精脫水、封片、拍照;所用HME抗體的濃度為1∶50;所用AS抗體的濃度為1∶100。
1.4 結果判定 HME染色陽性位于細胞質和(或)細胞膜中呈棕黃色,顯色較強時呈棕褐色。AS染色陽性位于胞質中呈棕黃色,顯色強時呈棕褐色,光鏡下用高倍鏡視野對每例胃癌組織及癌旁組織切片區域連續計數500個細胞,計算胃癌細胞所占的陽性比例,其中無細胞被染色的為陰性(-),細胞染色陽性占比例<10%為(+),細胞染色陽性比例占10% ~50%為),細胞染色陽性>50%為()。為便于統計描述,對標本進行分類,0~+為弱染,定為陰性表達;()~()為強染,定為陽性表達。
1.5 統計學處理 采用SPSS 11.0軟件進行分析。計數資料分布采用χ2檢驗分析進行比較,HME和AS表達的關聯性采用2×2列聯分析進行比較。
2 結果
2.1 胃癌和癌旁組織中HME、AS的表達 胃癌組織和癌旁組織各30例。HME在正常的胃黏膜組織中大多部分表達為陰性,少部分表達為陽性;在胃癌組織中表達主要分布在細胞質和(或)細胞膜中,染色后呈棕黃色。在癌旁組織中HME陽性率為10.0%(3/30),胃癌組織中陽性率為 66.7%(20/30);明顯高于在癌旁中的表達(χ2=20.376,P <0.05),見表1、圖1。AS在正常胃黏膜中少部分表達為陽性,多部分表達為陰性;在胃癌組織中的表達主要位于胞質中,其染色陽性表達呈棕黃色顆粒。在癌旁組織中AS陽性率為16.7%(5/30);胃癌組織中陽性率為73.3%(22/30);顯著高于在癌旁中的表達(χ2=19.461,P <0.05),見表1、圖1。
2.2 HME和AS在胃癌組織中表達的關聯性分析
在30例胃癌組織HME和AS的聯合檢測中發現同時為陽性的為63.3%(19/30),同時為陰性的為23.3%(7/30);在HME表達陽性的例數中AS同時表達為陽性率95%(19/20),在AS表達陽性的例數中HME同時表達為陽性的為86.4%(19/22);HME和AS在胃癌組織中表達存在關聯 (r=0.570,P<0.05),見表2。
2.3 HME和AS在胃癌中的表達與胃癌臨床病理參數的關系 HME的陽性表達與胃癌的分化程度、血管浸潤有關(P<0.05),與其他臨床病理參數無顯著相關性;AS的陽性表達與腫瘤大小、浸潤程度、血管浸潤、淋巴及遠處轉移有關(P<0.05),與其他臨床病理參數無顯著相關性,見表1。
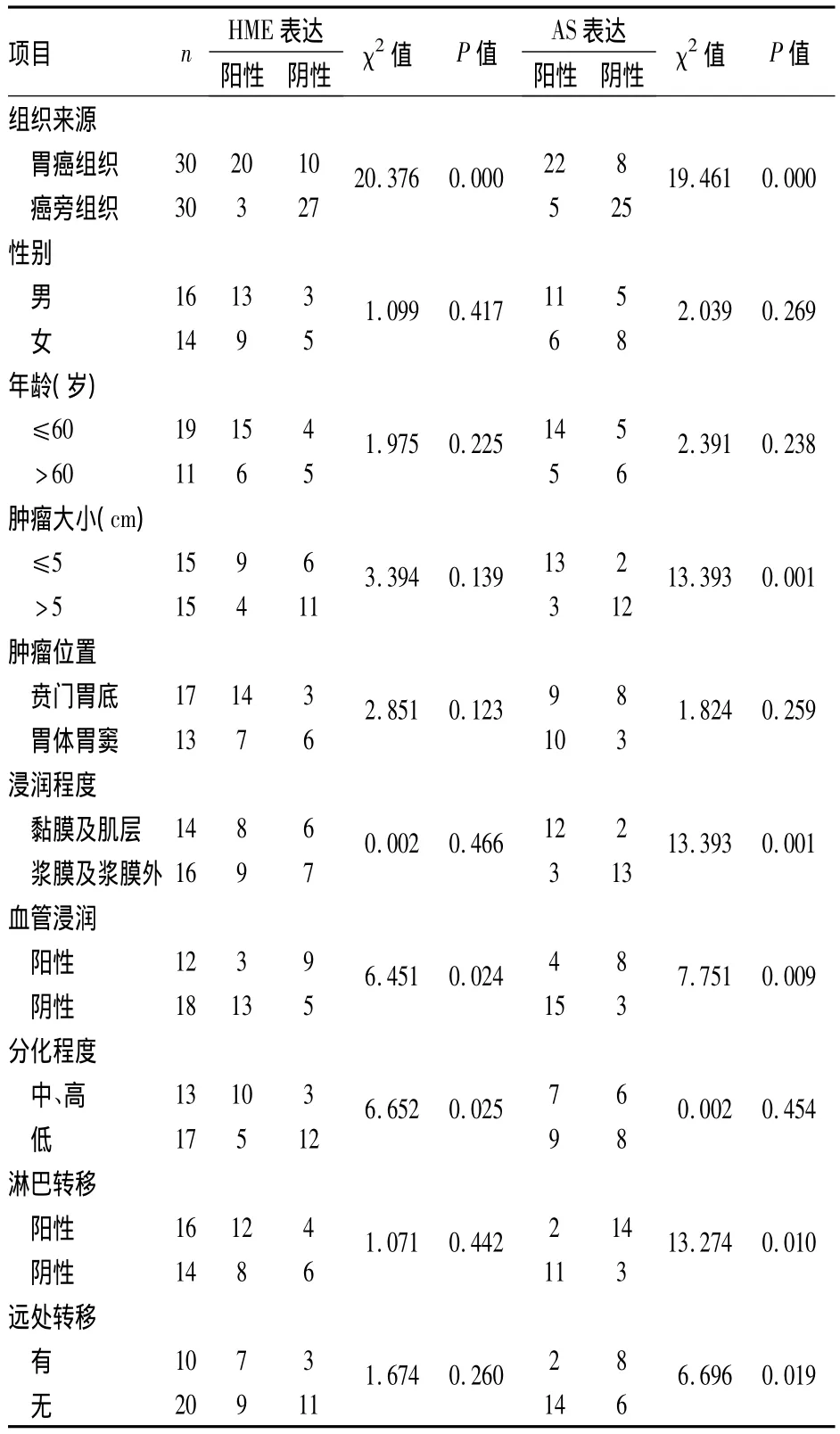
表1 胃癌組織中HME和AS的表達與臨床病理參數的關系

表2 HME和AS在30例胃癌組織中的表達情況
3 討論
惡性腫瘤的發生和致死主要是因為其能侵襲正常組織并向遠處轉移,降解破壞細胞外基質是腫瘤侵襲和轉移的必要條件,大部分細胞外基質的破壞是由基質彈性金屬蛋白酶完成的。基質金屬蛋白酶家族(matrix metalloproteinases family,MMPs)是一種細胞外基質膚鏈內切酶,其催化活性依賴于酶活性中心與金屬鋅離子的結合[3];MMPs最初都是以細胞分泌無活性的酶前體形式存在,只有當被激活時才發揮其作用,能影響機體多種生理和病理過程,如癌癥、創傷愈合、胚胎發育、組織形成、炎性疾病等疾病[4]。研究[5]表明,很多惡性腫瘤存在 MMPs高表達,MMPs通過降解細胞外基質從而促進腫瘤的侵襲和轉移[6-8]。
HME由活化的巨噬細胞分泌,是MMPs中的一員,又稱為MMP-12,能降解多種細胞外和非細胞外成分,彈性蛋白是其主要底物。一方面HME可以通過分解纖溶酶原和Ⅲ型、V型、X型膠原而產生血管抑素,抑制腫瘤血管生成、腫瘤的侵襲及生長;另一方面其還能分解細胞外基質,如Ⅳ型膠原和纖維蛋白,以促進血管生成,促進腫瘤侵襲和轉移[9]。研究[10]顯示,與其他MMP家族成員具有促進腫瘤浸潤轉移的作用不同,HME具有獨特的抗腫瘤生長及轉移的作用。AS并不是直接由腫瘤細胞分泌,而是腫瘤細胞可以產生或激活某種蛋白酶,這種蛋白酶可將體內的前體分解為血管生成抑制劑[11]。國外研究[12-14]顯示,HME 可分解纖溶酶原,從而促進AS生成,抑制腫瘤血管內皮細胞的增殖,促進腫瘤血管內皮細胞凋亡,抑制腫瘤浸潤。HME在AS生成的過程中直接作為關鍵分子發揮作用,使得HME與腫瘤的關系備受關注。
前期的研究[15]顯示,人胃癌細胞能表達HME,并因此減少腫瘤微血管的形成;同時表明HME高表達與抑制胃癌的血管浸潤及術后復發顯著相關,并可能減少淋巴管浸潤和淋巴結轉移,提高患者術后生存率;HME的高表達可以降低腫瘤組織的血管密度,并與較好的預后有密切相關,對抑制腫瘤新生血管形成、抑制胃癌的進一步發展及術后復發起著至關重要的作用,基于以上研究結果,設想HME抑制胃癌生長可能與其影響腫瘤血管生成機制有關,本研究將在以往的工作基礎上進一步探討HME抑制胃癌生長作用機制。本實驗顯示HME在胃癌組織中表達明顯高于正常的胃黏膜組織,差異有統計學意義,說明HME蛋白過表達與胃癌發生、發展、轉移及預后有著密切的聯系,HME的陽性表達與胃癌的分化程度、血管浸潤有關,胃癌分化程度越高,HME表達的越高;有血管浸潤組織的HME表達明顯低于無血管潤的組織,與其他臨床病理參數無顯著相關性;AS在胃癌組織中表達明顯高于正常的胃黏膜組織,差異有統計學意義,說明AS蛋白過表達也與胃癌的發生有著密切的聯系,AS的陽性表達與腫瘤的大小、浸潤程度、血管浸潤、淋巴及遠處轉移有關,在腫瘤較大的組織中AS的表達低于腫瘤較小的組織,在腫瘤浸潤程度較深,或者有血管浸潤,淋巴及遠處轉移的組織中陽性表達低于腫瘤浸潤程度淺,無血管浸潤,淋巴及遠處轉移的組織,與其他臨床病理參數無顯著相關性。通過對HME和AS在胃癌中表達的列聯分析表明HME和AS在胃癌組織表達存在相關性,說明HME表達抑制胃癌生長的機制可能是通過分解纖溶酶原生成AS所致,也為探討HME如何抑制腫瘤細胞生長的機制提供了線索。以及進一步研究胃癌生長作用及其作用途徑,探討胃癌的發生、發展及預后機理、開發判斷胃癌的早期診斷,分子靶向治療及預后等方面均具有重要意義。
[1]Hong L,Han Y,Liu J,et al.Fibroblast growth factor receptor 2:a therapeutic target in gastric cancer[J].Expert Rev Gastroenterol Hepatol,2013,7(8):759 -65.
[2]Giordano A,Cito L.Advances in gastric cancer prevention[J].World J Clin Oncol,2012,3(9):128 -36.
[3]Maréchal R,Demetter P,Nagy N,et al.High expression of CXCR4 may predict poor survival in resected pancreatic adenocarcinoma[J].Br J Cancer,2009,100(9):1444 -51.
[4]Valdivia A,Peralta R,Matute-González M,et al.Co-expression of metalloproteinases 11 and 12 in cervical scrapes cells from cervical precursor lesions[J].Int J Clin Exp Pathol,2011,4(7):674-82.
[5]Engers R,Gabbert H E.Mechanisms of tumor metastasis:cell biological aspects and clinical implications[J].J Cancer Res Clin Oncol,2000,126(12):682 -92.
[6]Hagemann T,Gunawan B,Schulz M,et al.mRNA expression of matrix metalloproteases and their inhibitors differs in subtypes of renal cell carcinomas[J].Eur J Cancer,2001,37(15):1839 -46.
[7]Kerkel? E,Ala-aho R,Klemi P,et al.Metalloelastase(MMP-12)expression by tumour cells in squamous cell carcinoma of the vulva correlates with invasiveness,while that by macrophages predicts better outcome[J].J Pathol,2002,198(2):258 -69.
[8]Hofmann H S,Hansen G,Richter G,et al.Matrix metalloproteinase-12 expression correlates with local recurrence and metastatic disease in non-small cell lung cancer patients[J].Clin Cancer Res,2005,11(3):1086 -92.
[9]Bradbury P A,Zhai R,Hopkins J,et al.Matrix metalloproteinase 1,3 and 12 polymorphisms and esophageal adenocarcinoma risk and prognosis[J].Carcinogenesis,2009,30(5):793 -8.
[10]Fan J,Wang X,Wu L,et al.Macrophage-specific overexpression of human matrix metalloproteinase-12 in transgenic rabbits[J].Transgenic Res,2004 13(3):261 -9.
[11]Houghton A M,Grisolano J L,Baumann M L,et al.Macrophage elastase(matrix metalloproteinase-12)suppresses growth of lung metastases[J].Cancer Res,2006,66(12):6149 -55.
[12]O'Reilly M S,Holmgren L,Shing Y,et al.Angiostatin:a novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma[J].Cell,1994,79(2):315 - 28.
[13]Cornelius L A,Nehring L C,Harding E,et al.Matrix metalloproteinases generate angiostatin:effects on neovascularization[J].J Immunol,1998,161(12):6845 -52.
[14]Dong Z,Kumar R,Yang X,et al.Macrophage-derived metalloelastase is responsible for the generation of angiostatin in Lewis lung carcinoma[J].Cell,1997,88(6):801 -10.
[15]Cheng P,Jiang F H,Zhao L M,et al.Human macrophage metalloelastase correlates with angiogenesis and prognosis of gastric carcinoma[J].Dig Dis Sci,2010,55(11):3138 -46.

