重組七鰓鰻PHB2蛋白的原核表達及純化
李鐵松, 王 穎, 高 楊, 李慶偉
(遼寧師范大學 生命科學學院, 遼寧大連 116081)
七鰓鰻(Lampetra japonica)屬無頜脊椎動物, 是現存脊椎動物中最古老、最原始的物種之一。其化石記錄可以追溯到志留紀及泥盆紀, 有現存的“活化石”之稱, 被認為是進化和發育生物學研究的新的模式生物, 是研究有頜脊椎動物起源和進化十分難得的實驗材料。
Prohibitin(PHB)是一種高度保守的蛋白, 廣泛分布于細菌、植物、酵母、原蟲、果蠅及哺乳類等多種生物細胞中[1]。目前已知人的 PHB家族包括PHB1和 PHB2, 其結構的保守性和功能的多樣性決定了其參與細胞的多種生物學進程。研究表明, PHB在細胞核內起負調節細胞周期的作用[2-5], 抑制細胞周期轉換和DNA合成[2,6], 從而抑制細胞增殖。同時,PHB蛋白也可以調控細胞凋亡, 且這種凋亡作用具有雙向性, 一方面能夠阻止細胞的過度增殖, 另一方面又能抵抗細胞凋亡的產生[7-11]。 PHB正是通過調節細胞增殖、凋亡與分化和調控激素及其受體活性而發揮著抗腫瘤作用。
近年來, 陸續又有研究發現 PHB2與由氧化應激因子(活性氧自由基, reactive oxygen species, ROS)作用引起的生物進程如衰老、Ⅱ型糖尿病、神經退行性疾病及心肌疾病等的改變密切相關[12]。PHB2在呼吸鏈復合物亞單位的裝配中充當分子伴侶, 參與能量代謝, 起到抗衰老的作用[13]。糖尿病病人體內ROS含量和氧化應激水平均顯著增高, 引發線粒體結構功能紊亂, 而 PHB可起到穩定線粒體結構功能的作用。PHB2也存在在人類淋巴細胞的線粒體內膜上, 不僅僅在保證電子轉運酶的穩定和維持線粒體結構完整性方面起作用, 也參與細胞的信號轉導通路, 同時也可作為細胞內 T細胞活化的重要生物標記[12]。PHB2作為PHB家族的重要成員, 它與PHB1相互作用共同構成嵌于線粒體內膜上的“花環”復合體結構, 維持細胞線粒體結構功能的穩定[13]。
隨著人們對 PHB2在各類生命活動發生、發展過程中所起重要作用的深入認識, 以 PHB2蛋白功能與疾病發展之間關系的研究也在不斷增加, 它的功能研究正逐漸被重視并成為熱點。本課題以pMD18-T-Lm-PHB2的克隆載體為模板進行前期實驗, 后期將Lm-PHB2與含有 His標簽的表達載體pET-32a連接, 以有利于目的蛋白在大腸桿菌內以可溶性形式高效表達并進行純化, 為滿足后期該蛋白抗體的制備及其生物學功能的研究奠定實驗基礎。
1 材料和方法
1.1 菌株和質粒
質粒pET-32a、表達菌Rosetta Blue為本實驗室保存, 感受態細菌 Rosetta Blue為課題組自己制備,重組質粒pMD18-T-Lm-PHB2為本室自己構建。
1.2 試劑和藥品
Taq 酶、限制性內切酶Hind III、EcoRI、T4-DNA Ligase、DNA Marker、質粒小提試劑盒、DNA純化試劑盒均購自大連TaKaRa公司; 本實驗所用引物由上海英濰捷基廣州分公司合成; His·Bind Column組氨酸親和層析柱、卡那霉素、IPTG、PVDF膜、Anti-PHB2抗體購自上海生工生物公司; 低分子量蛋白Marker購自大連綠竹生物工程有限公司; 考馬斯亮藍, 瓊脂糖, 瓊脂粉, 蛋白胨, 酵母膏, 氯化鈉,Tris, SDS, 甘油, 溴酚藍, 甲叉雙丙烯酰胺, 丙烯酰胺, Tween 20, 甘氨酸, 甲醇, 醋酸, 乙醇等其他生化藥品為國產分析純。辣根過氧化物酶標記山羊抗兔IgG(H+L)為本實驗室博士惠贈。
1.3 引物的設計及合成
根據 Ensembl提供的七鰓鰻 PHB2基因序列和課題組前期克隆得到的該基因序列, 按照一般引物設計原則和原核表達載體pET-32a克隆要求, 采用primer 6.0軟件設計PCR引物。正向引物引入HindIII酶切位點,反向引物引入EcoRI酶切位點, 其序列如下:
Forward(正向引物): 5'- GGAATTCCATGGCTCAGCAGCTCAAGGA-3’
Reverse(反向引物): 5’- CCCAAGCTTGGGCTTCTTTTTCACCGAC-3’
1.4 目的基因的擴增
以質粒 pMD18-T-Lm-PHB2為模板, 用上述引物擴增Lm-PHB2基因編碼序列(CDS區)。PCR反應條件為: 94℃預變性5 min; 94℃變性30 s, 56℃退火30 s, 72℃延伸1 min, 30個循環; 最后72℃延伸10 min。PCR產物經1%瓊脂糖凝膠電泳檢測, 并用DNA純化試劑盒進行純化。
1.5 表達載體的構建
將 PCR擴增產物和 pET-32a質粒用HindIII.和EcoRI進行雙酶切, 酶切回收的PCR產物和載體與DNA連接酶混合, 16℃連接6 h, 將連接產物轉化至感受態 Rosetta Blue, 篩選單菌落然后提取質粒, 進行 PCR和酶切鑒定, 將初步鑒定正確的重組質粒送上海生工生物公司進行測序。
1.6 重組蛋白的誘導表達及純化
將帶有重組質粒的菌落接種在含有 50 mg/L氨芐氰霉素(Amp)的 LB液體培養基中, 37℃振蕩培養過夜(12~16 h), 次日按1∶100的比例轉接至1 000 mL LB培養基(含 50 mg/L Amp), 37℃培養至 OD600≈0.4~0.6, 加入終濃度為1.0 mmol/L的IPTG, 37℃誘導表達5 h, 表達產物rLm-PHB2經12%SDS-PAGE電泳檢測, 并用 Western blotting進行鑒定。SDS-PAGE的分離膠經半干電轉化使蛋白從膠上全部轉移到PVDF膜上, 用預染彩色Marker作為轉移程度的依據, PVDF膜置于封閉液(含5%脫脂牛奶的TBST) 中37℃封閉, 分別加入一抗兔抗鼠PHB2單克隆抗體(1∶1000)和二抗羊抗兔 IgG(H+L) (1∶5000) 孵育, ECL顯色。
用His·Bind Column組氨酸親和層析柱進行純化,純化方法參照說明書進行。純化的重組蛋白經透析后, 再經SDS-PAGE電泳分析得到的目的蛋白rLm-PHB2。
2 實驗結果
2.1 Lm-PHB2基因的擴增
以前期構建的質粒為模板擴增Lm-PHB2基因CDS區, PCR產物用1%瓊脂糖凝膠電泳檢測, 結果顯示 PCR產物大小約為900 bp, 與Lm-PHB2基因CDS區序列大小相符(圖1), 表明PCR所擴增的片段為目的基因Lm-PHB2的全長CDS區。

圖1 Lm-PHB2基因 CDS區PCR擴增產物Fig.1 PCR products of Lm-PHB2 gene CDS region
2.2 重組質粒pET32a-Lm-PHB2的鑒定
2.2.1 陽性菌落的PCR鑒定
Lm-PHB2基因CDS區的PCR產物雙酶切后, 插入pET-32a載體中, 轉化感受態Rosetta blue, 得到數十個陽性菌落, 隨機挑取 1~3個單菌落進行培養, 并作PCR初步鑒定, 結果擴增出約900 bp的目標片段(圖2),表明Lm-PHB2基因CDS區已插入pET-32a載體。
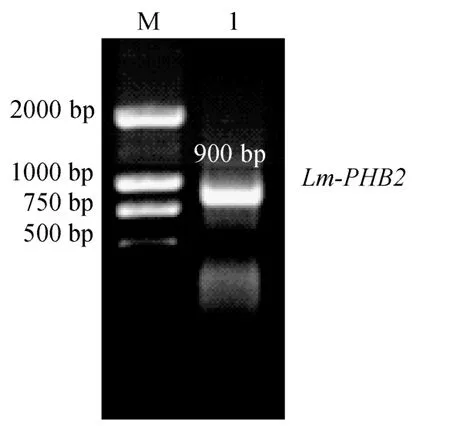
圖2 載體pET32a-Lm-PHB2的PCR鑒定Fig.2 Identification of pET32a-Lm-PHB2 by PCR
2.2.2 重組質粒的雙酶切鑒定
挑取經 PCR鑒定為陽性克隆的菌落, 挑菌培養后提取質粒, 用HindIII和EcoRI進行雙酶切鑒定(圖3)。電泳結果顯示, 與未酶切的質粒相比, 質粒雙酶切后出現兩個片段, 小片段分子量約為 900 bp,與Lm-PHB2基因CDS區的分子量相符; 大片段分子量約為5900 bp, 與線性化的pET-32a大小相符, 進一步證明重組質粒構建成功。
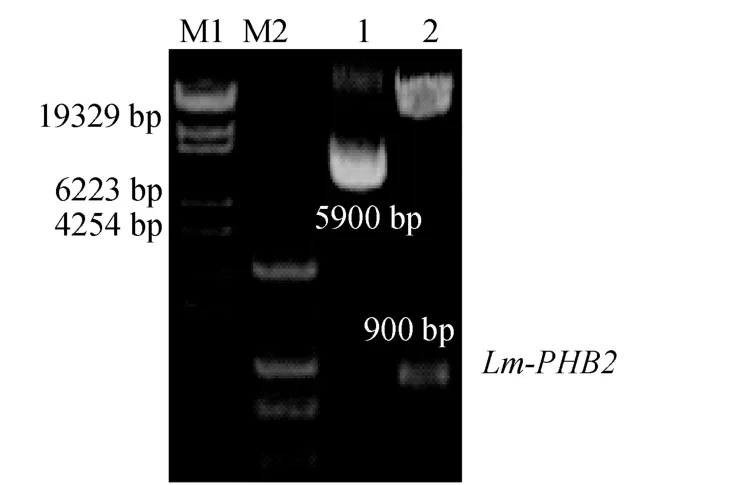
圖3 EcoR I和Hind III雙酶切鑒定Fig.3 Identification of pET-32a-Lm-PHB2 by restriction enzyme digestion
2.2.3 重組質粒的測序鑒定
將經 PCR和酶切鑒定的重組質粒 pET-32a-Lm-PHB2送上海生工生物公司測序, 測序結果與Ensembl提供的海七鰓鰻PHB2基因和課題組前期克隆得到的該基因序列進行比對, 結果表明Lm-PHB2編碼序列正確, 并且沒有發生移碼突變, 重組質粒構建成功。
2.3 重組蛋白rLm-PHB2的表達及純化
2.3.1 重組蛋白rLm-PHB2的SDS-PAGE分析
含有重組質粒的陽性菌落經 IPTG誘導表達后,表達產物的SDS-PAGE電泳分析結果顯示, 在約47 ku處出現融合蛋白條帶(圖4, 如箭頭所示), 與預期的分子量基本相符。表達產物存在于裂解菌液上清和沉淀中, 說明重組蛋白 rLm-PHB2在大腸桿菌中可以以可溶蛋白形式表達。
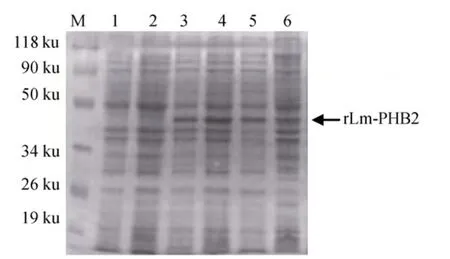
圖4 SDS-PAGE電泳檢測rLm-PHB2在Rosetta Blue菌中的表達Fig.4 Expression of rLm-PHB2 in Rosetta Blue tested by SDS-PAGE
2.3.2 重組蛋白rLm-PHB2的純化
誘導表達得到的 rLm-PHB2重組蛋白用 His·Bind Column組氨酸親和層析柱進行純化, 然后用不同濃度的咪唑洗脫層析柱。純化產物經SDS-PAGE分析, 在約47 ku處出現融合蛋白條帶(圖5), 與預期的分子量基本相符,表明純化得到即為重組蛋白rLm-PHB2。純化后的蛋白經透析后, 用考馬斯亮藍法測得質量濃度為210 mg/L。
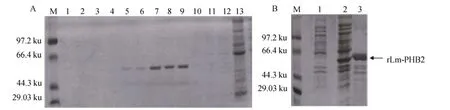
圖5 rLm-PHB2的洗脫及純化Fig.5 Elution and purification of rLm-PHB2 by His system
2.4 重組蛋白rLm-PHB2的Western Blotting分析
利用兔抗鼠PHB2單克隆抗體(1: 1000)對表達的重組蛋白進行Western blotting鑒定, 結果表明誘導的蛋白提取液中有目的蛋白的存在(圖6), 重組蛋白正確表達。

圖6 rLm-PHB2的Western blotting鑒定Fig.6 Identification of rLm-PHB2 by Western blotting
3 討論與結論
PHB在多種疾病、尤其是腫瘤和退行性疾病的發生、發展中起關鍵作用, 因此近年來受到越來越多的關注。Jang等[14]發現在早期胃癌和肝癌組織中PHB表達下調。Gamble等[15]也發現在雄激素刺激增殖的前列腺癌組織中PHB下調超過50%。然而在乳腺癌、肺癌、結腸癌、膀胱癌、子宮頸癌、卵巢癌等多數腫瘤的研究中證實PHB的表達均顯著上調[16],推測其原因可能與PHB的磷酸化狀態、細胞內濃度、細胞的類型以及腫瘤分期有關。由于在腫瘤發生早期 PHB表達缺陷, 造成了細胞的過度增生而發生癌變。隨著腫瘤的發展, 由于腫瘤細胞代謝旺盛, 線粒體含量豐富, 進而主要在線粒體中表達的PHB也隨之上調, 可能起到一定的負反饋作用[17]。目前認為 PHB可以作為腫瘤的早期診斷的一個標志分子[12-13]。對于糖尿病病人, 有研究證實檢測到其體內 ROS含量和氧化應激水平均顯著增高, 引發線粒體結構功能紊亂,而 PHB可起到穩定線粒體結構功能的作用[12-13]。同樣, 在心肌疾病中, 氧化應激能造成多種心肌細胞損傷和凋亡, 并且能引起心肌病、心力衰竭和房顫等[18]。Liu[18]通過給予幼鼠心肌細胞過氧化氫刺激發現,PHB的表達量代償性增加, 且PHB定位發生一定的轉移, 從而保護心肌細胞免受氧化應激損傷。并且發現丹參酮Ⅱ A可以降低在氧化應激條件下的PHB的代償性增加, 這可以起到對心肌細胞的保護作用, 并且還會下調引起心肌炎癥發生的一些分子[19-20], 而其中IL6和TNF-a又與mapk通路有關, 并且均能調節PHB的表達[21]。作者的研究也證實了七鰓鰻PHB在心肌細胞中具有抗氧化活性。因而在未來PHB可作為抗心肌氧化損傷的藥物靶標而得到應用。另外,Sripathi[22]等發現了在過氧化氫刺激的氧化應激脅迫下視網膜色素上皮細胞中PHB定位從線粒體往細胞核遷移, 作為抗凋亡因子和轉錄調節因子發揮功能。這些表明PHB在氧化應激脅迫中可以通過定位的變化, 在細胞核和線粒體及其他細胞亞結構中擔當不同的功能分子發揮不同功能, 從而增強細胞的氧化應激耐受性。本研究初期擴增了七鰓鰻PHB2基因, 并純化出純度較高的rLm-PHB2蛋白, 有利于深入探究七鰓鰻的 rLm-PHB2蛋白在七鰓鰻體內氧化應激狀態下發揮的功能。后期還可以構建PHB2的真核過表達載體, 有助于七鰓鰻 rLm-PHB2蛋白在細胞水平上的功能初探。
鑒于PHB在腫瘤發生發展等病理過程及慢性疾病中的重要作用[13], 本課題組對PHB家庭成員之一PHB2的結構和功能進行了系統研究, 為了獲得足量可用于體內活性研究的蛋白, 作者選擇 pET-32a載體構建rLm-PHB2的表達系統, 采用His標簽融合表達, 不僅能增加靶蛋白的溶解性和穩定性, 還有利于蛋白的進一步純化和檢測。在本研究中作者利用pET-32a載體, 成功表達了可溶性重組蛋白, 并制備了足夠的純度較高的可溶性重組蛋白rLm-PHB2, 為其后續的相關功能研究提供了必要基礎。
[1] 陳操, 劉欣, 孫晶, 等.抗增殖蛋白研究進展[J].生命科學, 2010, 22(5): 405-410.
[2] Nuell M J, Stewart D A, Walker L, et al.PHB, an evolutionarily conserved intracellular protein that block DNA synthesis in normal fibroblasts and Hela cells[J].Mol Cell Biol, 1991, 11(3): 1372-1381.
[3] Upe E R, Liu X T, Kiehlbauch J L, et al.Prohibitin antiproliferative activity and lack of heterozygosity in immortalized cell lines[J].Exp Cell Res, 1995, 218(2):577-580.
[4] Roskams A J, Friedman V, Wood C M J, et al.Cell cycle activity and expression of prohibitin mRNA[J].J Cell Physiol, 1993, 157(2): 289-295.
[5] Wang S, Nath N, Fusaro G, et al.Rb and prohibitin target distinct regions of E2F1 for repression and respond to different upstream signals[J].Molecular and Cellular Biology, 1999, 19(11): 7447-7460.
[6] Joshi B, Ko D, Ordonez-Ercan D, et al.A putative coiled-coil domain of prohibitin is sufficient to repress E2F1-mediated transcription and induce apoptosis[J].Biochem Biophys Res Commun, 2003, 312(2): 459-466.
[7] Fusaro G, Dasgup T P, Rastogi S, et al.PHB induces the transcriptional activity of 0p53 and is exported from the nucleus upon apoptotic signaling [J].J Biol Chem,2003, 278(48): 47853- 47861.
[8] 石松林, 李祺福, 劉慶榕, 等.人參皂苷 Rg1組合誘導人成骨肉瘤MG-63細胞分化過程中Prohibitin的表達與定位變化[J].中國生物化學與分子生物學報.2008, 24(2): 180-187.
[9] Fusaro G, Wang S, Chellappan S.Differential regulation of Rb family proteins and prohibitin during camp tothecin-induced apoptosis[J].Oncogene, 2002,21(29): 4539-4548.
[10] Wang S, Zhang B H, Faller D V.Prohibitin requires Brg-1 and Brm for the repression of E2F and cell growth[J].The EMBO Journal, 2002, 21(12): 3019-3028.
[11] Choi D, Lee S J, Hong S, et al.Prohibitin interacts with RNF2 and regulates E2F1 function via dual pathways[J].Oncogene, 2008, 27(12): 1716-1725.
[12] 李鐵松, 高楊, 王穎, 等.抗增殖蛋白與氧化應激[J].生物技術通報, 2013, 10: 34-39.
[13] 祝麗晶, 潘旭東, 王翎.抗增殖蛋白抗腫瘤及抗衰老的研究進展[J].中國老年學雜志, 2010, 30(21):3197-3201.
[14] Jang J S, Cho H Y, Lee Y J, et al.The differential proteome profile of stomach cancer identification of the biomarker candidates[J].Oncology Res, 2004; 14:491-499.
[15] Gamble S C, Odontiadis M, Waxman J, et.al Androgens target prohibitin to regulate proliferation of prostate cancer cells[J].Oncogene, 2004: 23(17): 2996-3004.
[16] Wu T F, Wu H, Wang Y W, et al.Prohibitin in the pathogenesis of transitional cell bladder cancer[J].Andcaneer Res, 2007; 27(2): 895-900.
[17] 郭維, 黃文彥, 徐虹.Prohibitin的研究進展[J].國外醫學·生理、病理科學與臨床分冊, 2005, 25(3):254-257.
[18] Liu X H, Ren Z, Zhan R, et al.Prohibitin protects against oxidative stress-induced cell injury in cultured neonatal cardiomyocyte[J].Cell Stress and Chaperones,2009, 14: 311-319.
[19] Muraguchi T, Kawawa A, Kubota S.Prohibitin protects against hypoxia-induced H9c2 cardiomyocyte cell death[J].Biomed Res, 2010, 31: 113-122.
[20] 楊萍, 賈鈺華.丹參酮ⅡA抗心肌細胞氧化應激作用及抗增殖蛋白功能研究[J].中國實驗方劑學雜志,2011, 6: 145-150.
[21] Rajalingam K, Wunder C, Brinkmann V, et al.Prohibitin is required for Ras-induced Raf-MEK-ERK activation and epithelial cell migration[J].Nat Cell Biol,2005, 7(8): 837-843.
[22] Sripathi S R, He W, Atkinson C L, et al.Mitochondrial-Nuclear communication by prohibitin shuttling under oxidative stress[J].Biochemistry, 2011,50: 8342-8351.

