秦皇島海域“褐潮”海水對鹵蟲、輪蟲存活和攝食的影響研究
公 晗 , 孔凡洲 王云峰 顏 天 周名江
(1.中國科學院 海洋研究所 海洋生態與環境科學重點實驗室, 山東 青島266071; 2.中國科學院大學, 北京100049)
褐潮通常是指由于海金藻綱(Pelagophyceae)微藻抑食金球藻(Aureococcus anophagefferens)或Aureoumbra lagunensis暴發性增殖而形成的藻華現象[1], 藻華發生期間, 水體呈現黃褐色。抑食金球藻呈金黃色, 球形, 直徑約為 2 μm[2]。A.lagunensis與抑食金球藻的形態相似, 直徑為4~5 μm[3]。
自1985年起, 美國東海岸抑食金球藻頻頻暴發,暴發密度高于1.0 ×106個/mL[4], 給貝類養殖業造成了巨大損失; 1990年~1996年, 德克薩斯州A.lagunensis暴發時, 細胞密度最高達到1.0×107個/mL[5], 給海洋生態系統造成了巨大危害。自2009年起, 中國渤海秦皇島沿岸海域連續 5年暴發了褐潮, 導致當地養殖貝類大量滯長甚至死亡; 2010年, 河北省直接經濟損失達2億元[6]。褐潮的一個優勢種為抑食金球藻, 其細胞密度最高達1.0×106個/mL[7]。
褐潮藻的不同株系毒性有差異[8], 中國褐潮毒性的研究還未見被報道, 相關研究亟待開展。浮游動物是微藻的初級消費者, 與藻華的發生及生態效應有密切關系。國外已有研究表明, 褐潮會影響中、小型浮游動物的生長、發育、攝食及繁殖等[9]。作者選取了海洋生態毒理學研究中常用的模式生物——鹵蟲(Artemia salina)、褶皺臂尾輪蟲(Brachionus plicatilis, 以下稱輪蟲)為對象, 研究了秦皇島褐潮現場海水對其存活、攝食的影響; 同時以3株室內培養的褐潮藻(抑食金球藻CCMP 1984、CCMP 1850,A.lagunensisCCMP 1507)為參照, 首次初步評價了秦皇島褐潮的毒性, 為今后有關中國褐潮毒理的研究提供基礎。
1 材料與方法
褐潮海水于2013年7月2日(褐潮暴發高峰期)采自秦皇島, 采集站位坐標為119°25’54’E, 39°46’37’N。從采集至用于實驗, 時間約為1 h。
3株褐潮藻購于美國海藻及微生物中心(NCMA,原 CCMP), 球等鞭金藻(Isochrysis galbana, 以下簡寫為ISO)、小球藻(Chlorellasp., 以下簡寫為CHL)由中國科學院海洋研究所藻種中心提供。藻培養溫度為18℃, 光暗比為14 h: 10 h。用于藻類培養的海水引自青島膠州灣外太平角無污染海水, 使用前經沉淀沙濾、0.45 μm混合纖維濾膜過濾, 高溫煮沸消毒。選擇生長良好的指數期藻液在顯微鏡下用血球計數板計數后用于實驗。
實驗用鹵蟲為鹵蟲卵經23 ℃海水孵化得到的無節幼體 (instar II-Ⅲ)。輪蟲由中國科學院海洋研究所培養中心提供, 為實驗室常年培養種。
1.1 褐潮海水中浮游植物色素及類群分析
褐潮海水經 20 μm篩絹過濾后, 在血球計數板下進行鏡檢。過濾50 mL于GF/F玻璃纖維濾膜(平均孔徑0.68 μm), 取6個平行樣用于色素分析。色素分析用內標(Internal Standard, IS)為 8′-阿樸-β, ψ-胡蘿卜醛(Apocarotenal, Apo)。所用材料與試劑、樣品的預處理、高效液相色譜(HPLC)分析及浮游植物類群的 CHEMTAX分析方法參照孔凡洲等[10]。根據Kong等[11]中給出的But含量與褐潮藻的細胞密度關系, 計算得到現場海水中褐潮藻的細胞密度。
1.2 浮游動物存活實驗
1.2.1 鹵蟲存活實驗
實驗選用24孔培養板, 每孔加入1 mL測試藻液。在解剖鏡下用滴管將鹵蟲轉移到培養板各孔中,每孔分別放10只鹵蟲。
秦皇島褐潮海水及 3株美國褐潮藻分別用于實驗中, 現場海水中褐潮藻、CCMP1984、CCMP 1850、CCMP 1507密度分別為8.0 × 105(HPLC計算結果)、1.5 × 107、1.5 × 107、1.0× 106個/mL。以球等鞭金藻(1.0 × 105個/mL)為對照組, 另設滅菌海水為饑餓組,每組3個平行。實驗共進行48 h, 24 h 時更換新鮮實驗液, 分別于24、48 h記錄鹵蟲存活數。
CCMP 1507(1.0 × 106個/mL)經 0.45 μm 混合纖維濾膜過濾濃縮后(過濾負壓不超過 5 kPa), 將藻細胞重新懸浮于與原藻液等體積的新鮮海水中; 取部分藻細胞重懸液, 用超聲波細胞粉碎機破碎; 藻細胞重懸液、藻細胞破碎液和去藻過濾液分別用于實驗中。實驗共進行60 h, 24 h 時更換新鮮實驗液, 分別于12、24、36、48、60 h 記錄鹵蟲存活數。
1.2.2 輪蟲存活實驗
實驗容器、實驗體積、實驗對象數目及實驗用藻密度設置同 1.2.1。實驗前, 挑選掛卵輪蟲置于滅菌海水中培養24 h, 吸取剛出生4 h以內的幼體用于實驗。實驗以小球藻(1.0 × 106個/mL)為對照組, 實驗進行24 h, 實驗結束后記錄輪蟲存活數。
1.3 浮游動物攝食實驗
1.3.1 鹵蟲攝食實驗
實驗在黑暗條件下進行, 實驗溫度為 20 ℃, 實驗時間為8 h, 實驗容器為500 mL燒杯, 實驗體積為300 mL, 每個燒杯分別加入鹵蟲 600~700只。實驗結束時, 以篩絹濾出鹵蟲, 用滅菌海水反復沖洗后,取100只濾于GF/F 玻璃纖維濾膜上。將濾膜放入棕色瓶中, 加入5 mL 90%的丙酮溶液, 冰浴超聲破碎,放入 4 ℃冰箱中避光萃取 24 h, 采用特納(Turner Designs) 熒光計測出熒光值求出鹵蟲體內色素含量。按照王榮[12]所做改進, 以葉綠素 a 與脫鎂葉綠酸 a 的絕對含量(ng/個)來定量鹵蟲體內色素。將攝食量定義為:
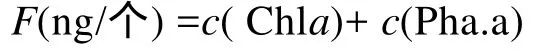
式中,F為實驗時間內每只鹵蟲的攝食量;c(Chla)和c(Pha.A) 分別為實驗時間內每只鹵蟲體內葉綠素 a和脫鎂葉綠酸a 含量。
實驗分為兩個部分: (1)單獨投喂褐潮海水或美國褐潮藻; (2)投喂褐潮海水或美國褐潮藻與球等鞭金藻混合餌料。現場海水中褐潮藻、CCMP 1984、CCMP 1850、CCMP 1507 密度分別為 8.0 × 105、5.0 ×105、5.0 × 105、5.0 × 104個/mL。所有實驗都設置等生物量的球等鞭金藻(5.0 × 104個/mL)為對照組、滅菌海水為饑餓組, 每組3個平行。
1.3.2 輪蟲攝食實驗
實驗材料與方法類似于 1.3.1, 不同之處為: 實驗前, 將輪蟲置于滅菌海水中饑餓處理 24 h; 每個燒杯分別加入輪蟲1 000~1 200只; 實驗采用小球藻(3.0 × 105個/mL)為對照組。
1.4 數據分析與統計
使用SPSS 16.0 進行單因素方差分析(One-Way ANOVA), 采用 LSD和 Duncans比較各處理組的顯著性差異。
2 結果與分析
2.1 褐潮現場海水分析結果
2.1.1 鏡檢結果
過濾后的樣品在顯微鏡下觀察, 樣品中主要為2~4 μm金黃色球形藻, 在血球計數板下計數得到細胞密度約為1.0× 106個/mL。
2.1.2 色素組成
如圖1所示, 在微型和微微型浮游植物樣品中,主要色素組分是 19’-丁酰氧基巖藻黃素(19’-butanoyloxyfucoxanthin, But)、巖藻黃素(Fucoxanthin,Fuco)、硅甲藻黃素(Diadinoxanthin, Diad)和葉綠素a(Chlorophylla, Chla), 此外還有微量的多甲藻素(Peridinin, Peri)、19’-己酰氧基巖藻黃素(19’-hexanoyloxyFucoxanthin, Hex)、別黃素(Alloxanthin, Allo)、玉米黃素(Zeaxanthin, Zea)、葉黃素(Lutein, Lut)。結合鏡檢結果, 表明現場海水中有海金藻、硅藻、定鞭藻、隱藻、綠藻、藍藻、甲藻, 且主要為海金藻。
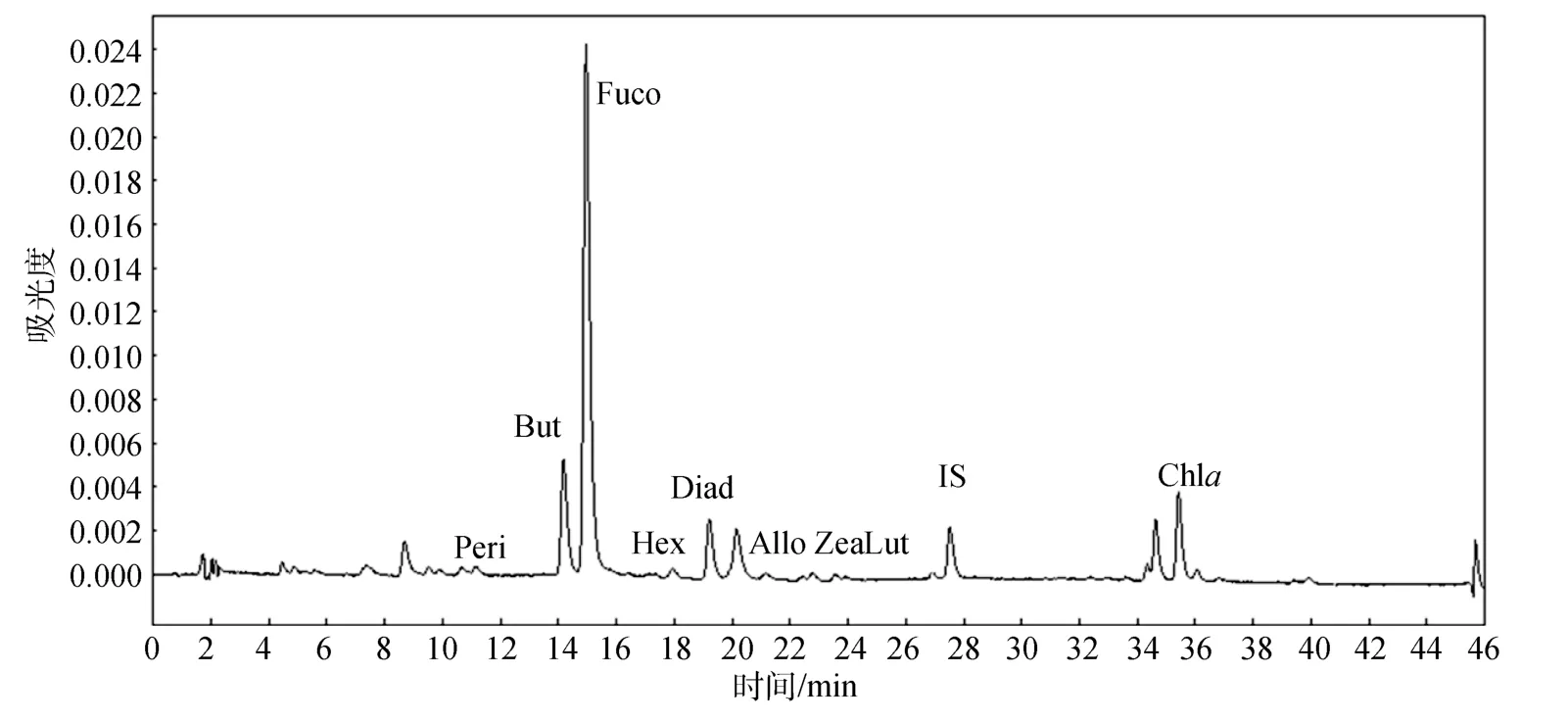
圖1 微型及微微型浮游植物樣品的色素分析色譜(檢測波長440 nm)Fig.1 HPLC chromatograms of nano-sized and pico-sized phytoplankton samples (Detection wave length at 440 nm)
2.1.3 不同浮游植物類群對Chla含量的貢獻
應用 CHEMTAX軟件, 構建海金藻、硅藻、定鞭藻、隱藻、綠藻、藍藻、甲藻 7類微藻的色素比率初始矩陣如表1初始色素, 對該矩陣進行優化后得到最終矩陣如表1最終色素所示。應用這一矩陣,計算了不同浮游植物類群的 Chla含量, 得到各類群Chla含量占總Chla含量比例, 做圖2。可以看出, 浮游植物樣品中主要為海金藻, 比例高達72.6%。
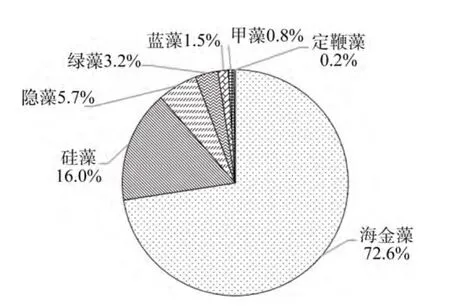
圖2 基于CHEMTAX分析的各微藻類群比例Fig.2 Ratios of different phytoplankton groups based on the results of CHEMTAX
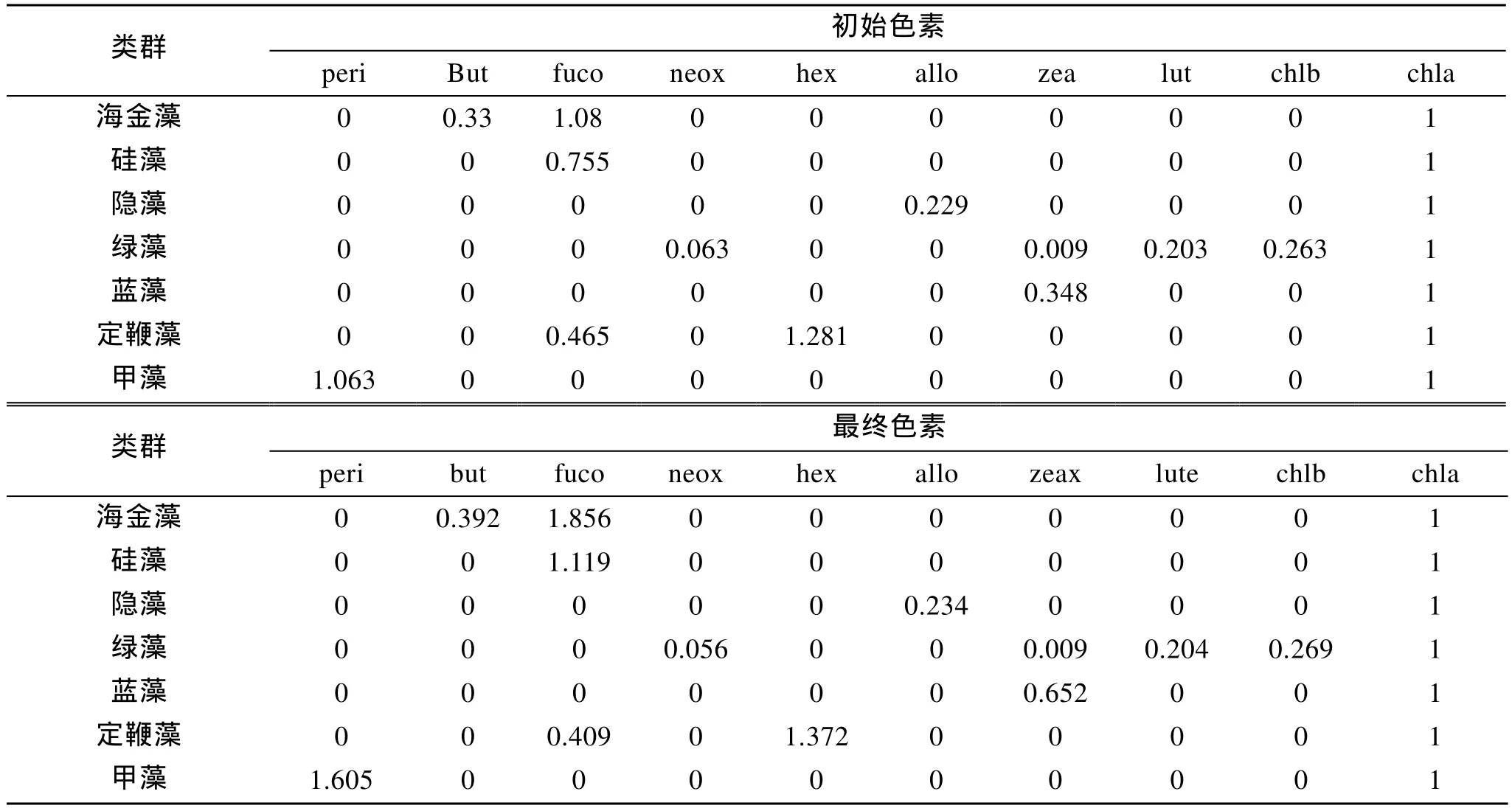
表1 CHEMTAX分析中不同微藻類群的初始和最終色素比率矩陣Tab.1 Input and output ratios of marker pigments to Chla for the selected phytoplankton groups
2.2 褐潮對浮游動物存活的影響
2.2.1 褐潮對鹵蟲存活的影響
鹵蟲無節幼體在各處理組中24、48 h的存活率如圖3所示。在褐潮海水中, 鹵蟲48 h存活率下降至 77%, 與對照組有顯著差異, 與饑餓組無顯著差異。在CCMP 1507中, 鹵蟲24 h存活率僅為60%, 48 h存活率僅為 30%, 與對照組有顯著差異。在 CCMP 1984、CCMP 1850實驗組中, 鹵蟲48 h存活率與對照組無顯著差異, 存活率在90%以上。
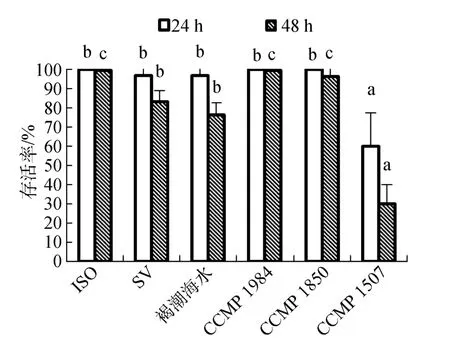
圖3 投喂單一餌料時鹵蟲的存活率Fig.3 Survival of Artemia salina exposed to a unialgal diet
依據上述實驗結果, 探究CCMP 1507不同組分對鹵蟲存活的影響。實驗表明(圖4), 鹵蟲在藻細胞重懸液、藻細胞破碎液中的存活率急劇下降, 60 h 內全部死亡, 存活率顯著低于對照組及饑餓組; 鹵蟲在藻濾液中的存活率下降趨勢與饑餓組無顯著差異。即藻細胞重懸液、藻細胞破碎液顯著降低鹵蟲存活率, 藻濾液對鹵蟲的存活無顯著影響。表明該藻的毒性主要來自藻細胞。
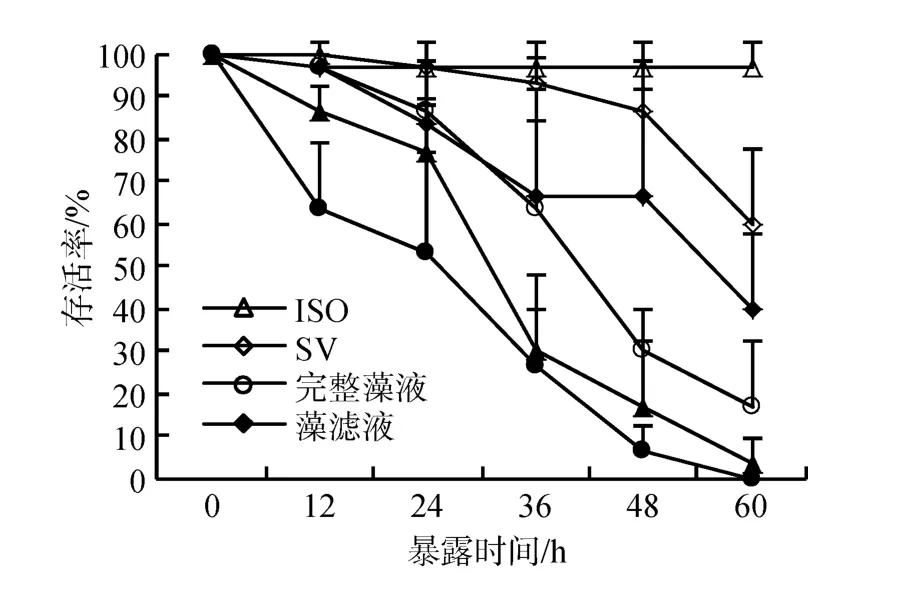
圖4 鹵蟲在CCMP 1507不同組分中的存活率Fig.4 Survival of Artemia salina exposed to different components of CCMP 1507
2.2.2 褐潮對輪蟲存活的影響
各實驗組輪蟲24 h存活率均為100%(圖5), 褐潮海水及美國3株褐潮藻對輪蟲都沒有急性致死效應。
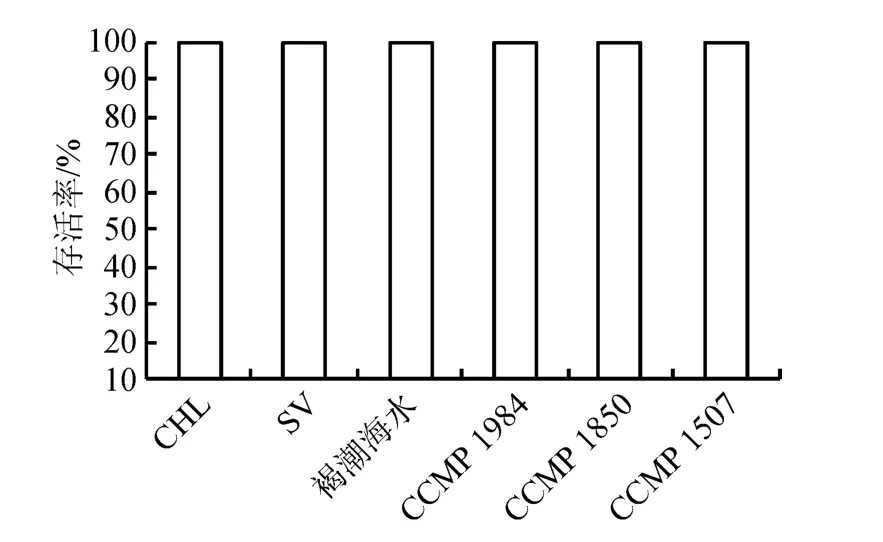
圖5 投喂單一餌料時輪蟲的存活率Fig.5 Survival of Brachionus plicatilis exposed to a unialgal diet
2.3 褐潮對浮游動物攝食的影響
2.3.1 褐潮對鹵蟲攝食的影響
圖6表示分別單獨投喂褐潮海水、CCMP 1984、CCMP 1850、CCMP 1507時, 鹵蟲8 h的攝食量。可見鹵蟲在褐潮海水中的攝食量與饑餓組無顯著差異,表明鹵蟲不攝食褐潮海水中微藻。鹵蟲在 3株美國褐潮藻中的攝食量顯著低于對照組。
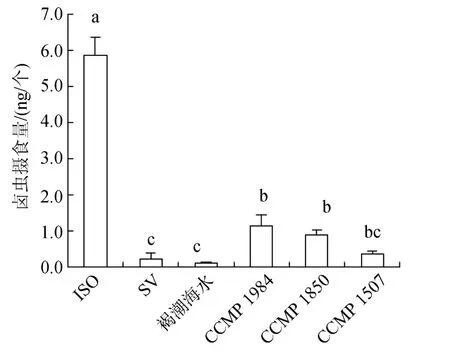
圖6 投喂單一餌料時鹵蟲的攝食量Fig.6 Ingestion of Artemia salina on a unialgal diet
圖7表示分別投喂褐潮海水、CCMP 1984、CCMP 1850、CCMP 1507與金藻混合餌料時, 鹵蟲8 h的攝食量。結果表明, 在褐潮海水與金藻混合餌料中, 鹵蟲可以攝食, 但攝食量顯著低于對照組, 8 h內攝食量由(5.5±0.4)ng/個降至(2.4±0.4)ng/個。表明褐潮海水對鹵蟲的攝食有抑制作用。CCMP 1507具有相同的效應。在CCMP 1984與金藻的混合餌料中, 鹵蟲的攝食量高于對照組; 在CCMP 1850與金藻的混合餌料中, 鹵蟲的攝食量與對照組無顯著差異, 表明這兩株藻對鹵蟲的攝食沒有抑制作用。

圖7 投喂混合餌料時鹵蟲的攝食量Fig.7 Ingestion of Artemia salina on a mix diet
2.3.2 褐潮對輪蟲攝食的影響
圖8表示分別單獨投喂褐潮海水、CCMP 1984、CCMP 1850、CCMP 1507時, 輪蟲8 h的攝食量。可見輪蟲在褐潮海水中攝食量顯著低于對照組, 與饑餓組無顯著差異, 表明輪蟲不攝食現場海水中微藻。輪蟲對CCMP 1507的攝食量顯著低于對照組。輪蟲對CCMP 1984、CCMP 1850的攝食量與對照組無顯著差異。
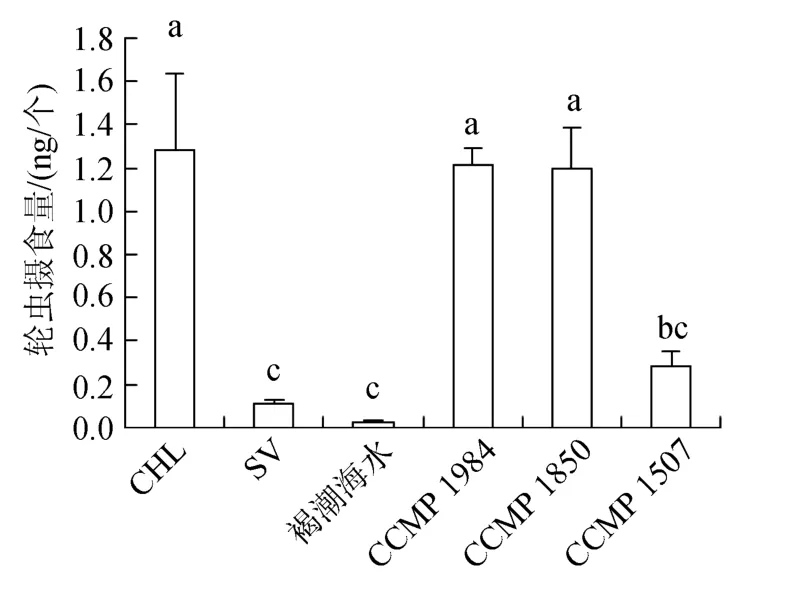
圖8 投喂單一餌料時輪蟲的攝食量Fig.8 Ingestion of Brachionus plicatilis on a unialgal diet
圖9表示分別投喂褐潮海水、CCMP 1507與小球藻混合餌料時, 輪蟲8 h的攝食量。結果表明, 輪蟲在混合餌料中, 8 h內攝食量由(1.5±0.2)ng/個分別下降至(0.9±0.1)ng/個、(0.5±0.3)ng/個。表明褐潮海水及CCMP 1507對鹵蟲的攝食有抑制作用。
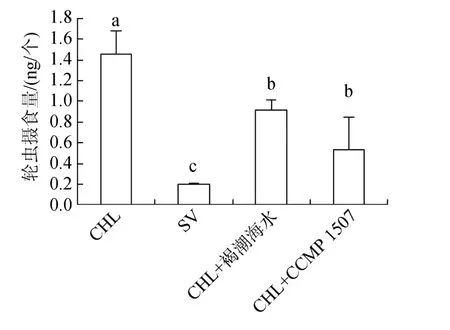
圖9 投喂混合餌料時輪蟲的攝食量Fig.9 Ingestion of Brachionus plicatilis on a mix diet
3 討論
3.1 秦皇島褐潮對浮游動物的潛在危害
本研究首次初步評價了秦皇島褐潮對兩種浮游動物——鹵蟲及輪蟲存活、攝食的毒性。結果表明, 秦皇島褐潮會影響鹵蟲的存活, 抑制鹵蟲、輪蟲的攝食。
暴露于褐潮海水中, 鹵蟲24 h存活率未受到影響, 而 48 h存活率與饑餓組無顯著差異, 表明鹵蟲48 h存活率的下降可能是饑餓導致的, 這一點也得到了鹵蟲攝食實驗的證實。結合現場實驗與室內實驗結果分析表明, 與以往赤潮藻毒性特點不同, 褐潮藻的急性致死效應不明顯, 其危害主要表現為對海洋生物攝食的影響。
秦皇島褐潮藻不僅影響兩種浮游動物攝食, 而且抑制浮游動物對其他餌料藻的攝食。長期暴露于褐潮發生海域, 浮游動物的生長很可能受到抑制,進而導致浮游動物生物量的降低, 從而更有利于微藻的生長使得藻華得以長時間持續。由于浮游動物對藻細胞大小具有攝食選擇性, 所以褐潮對與鹵蟲、輪蟲大小相近的其他浮游動物或者貝類的階段性浮游幼蟲也可能會產生一定的危害效應, 進而對整個浮游動物群落結構產生影響, 最終通過食物鏈影響整個海洋生態系統。因此秦皇島褐潮對海洋生態系統的影響值得密切關注。
就浮游動物的毒性而言, 秦皇島褐潮的毒性效應與CCMP 1507毒性效應相似, CCMP 1984、CCMP 1850的毒性相對較弱。實驗所用CCMP 1507密度遠低于現場密度, 對鹵蟲的存活、攝食產生了顯著抑制效應。實驗所用CCMP 1984、CCMP 1850密度遠高于現場密度, 對鹵蟲沒有產生致死效應, 并且在本研究中沒有發現這兩株藻對鹵蟲、輪蟲攝食的抑制效應。
在本研究中, 鹵蟲、輪蟲對 CCMP 1984、CCMP 1850的攝食表現出了不同的效應: 前者對兩株藻的攝食量較低, 而后者可以正常攝食。Smith等[13]曾報道湯氏紡錘水蚤(Acatia tonsa)無節幼蟲不攝食 CCMP 1850。這些不同效應可能與浮游動物的攝食選擇性有關。此外, Bricelj[9]曾報道CCMP 1784 (CCMP 1984的無菌株)降低猛水蚤(Coullana canadensis)無節幼蟲及紡錘水蚤橈足幼蟲的存活率, 但是本研究中作者并未觀察到CCMP 1984對鹵蟲、輪蟲的致死效應, 表明不同的浮游動物對褐潮藻的敏感性可能不同。
3.2 褐潮藻的毒性來源
本研究結果表明, CCMP 1507的毒性主要來源于藻細胞。但是這種毒性物質具體是何種物質, 目前相關的研究還很少。
有學者[14-15]認為,A.lagunensis可能產生一種抑制浮游動物攝食的物質[3]。例如, 抑食金球藻和A.lagunensis都含有高濃度的二甲頸基丙酸內鹽(DMSP)。但是目前有關 DMSP對浮游動物攝食的抑制作用并不清楚, 例如Chrysochromulina polylepis與Phaeocystis pouchetii都產生大量的 DMSP, 前者抑制挺挺蟲(Tintinnid)的生長及攝食, 后者卻可以被多種浮游動物攝食[16-17]。
在本實驗中, 作者只觀察到在 CCMP 1984、CCMP 1850中鹵蟲的攝食量低, 但并未發現這兩株藻抑制鹵蟲攝食其他藻, 因此無法推斷二者是否產生藻毒素。盡管有學者[18-19]認為, 抑食金球藻對捕食者的抑制作用主要是細胞產生毒素引起的, 但是這一觀點主要是通過研究抑食金球藻對貝的危害效應得出的推論。例如, 目前有很多學者認同抑食金球藻產生的抑制物質可能是存在于胞外多糖聚合物(EPS)層中類似多巴胺(DA)的一種物質。但是, 目前并未檢測到該藻產生的毒素物質[4,20], 因此有關抑食金球藻產毒的結論依舊存在爭議。鑒于中國還未分離到褐潮藻的純種藻株, 有關中國褐潮藻的分離、毒害效應、影響機制的研究還有待進一步開展。
[1] Sieburth J M, Johnson P W, Hargraves P E, et al.Ultrastructure and ecology ofAureococcus anophagefferensgen.et sp.nov.(Chrysophyceae) the dominant picoplankter during a bloom in Narragansett Bay, Rhode Island,summer 1985[J].J Phycol, 1988, 24: 416-425.
[2] Hudson R, DeYoe D A S, Robert R.Description and characterzation of the algal speciesAureoumbra LagunensisGen.en.et Sp.Nov.and referral ofAureoumbraandAureococcusto the Pelagophyceae[J].Phycol, 1997, 33: 1042-1048.
[3] Edward J, Buskey, C J H.Effects of the Texas (USA)'brown tide' alga on planktonic grazers[J].Marine Ecology Progress Series, 1995, 126: 285-292.
[4] Greenfield D I, Lonsdale D J, Cerrato R M, et al.Effects of background concentrations ofAureococcus anophagefferens(brown tide) on growth and feeding in the bivalveMercenaria mercenaria[J].Mar Ecol Prog Ser, 2004, 274: 171-181.
[5] Landon A W, Paul A M, Richard D K, et al.Sublethal effects of Texas brown tide onStreblospio lychaetalarvae[J].Journal of Experimental Marine Biology and Ecology, 2000, 248: 121-129.
[6] 國家海洋局, 2011年中國海洋災害公報[R].北京: 國家海洋局, 2012.
[7] Zhang Q C, Qiu L M, Yu R C, et al.Emergence of brown tides caused byAureococcus anophagefferensHargraves et Sieburth in China[J].Harmful Algae, 2012, 19:117-124.
[8] Bricelj V M, MacQuarrie S P, Schaffner R A.Differential effects ofAureococcus anophagefferensisolates (“brown tide”) in unialgal and mixed suspensions on bivalve feeding[J].Mar Biol, 2001, 139: 605-615.
[9] Bricelj V M, Lonsdale D J.Causes and ecological consequences of brown tides[J].Limnology and Oceanography, 1997, 42(5): 1023-1038.
[10] 孔凡洲, 于仁成, 張清春, 等.對桑溝灣海域一次藻華事件原因種的初步分析[J].海洋環境科學, 2012,31(6): 824-829.
[11] Kong F Z, Yu R C, Zhang Q C, et al.Pigment characterization for the 2011 bloom in Qinhuangdaoimplicated “brown tide” events in China[J].Chinese Journal of Oceanology and Limnology, 2012, 30(3): 361-370.
[12] 王榮.熒光法測定浮游植物色素計算公式的修正[J].海洋科學, 1986, 10(8): 1-5.
[13] Smith J K, Lonsdale D J, Gobler C J, et al.Feeding behavior and development ofAcartia tonsanauplii on the brown tide algaAureococcus anophagefferens[J].Journal of Plankton Research, 2008, 30(8): 937-950.
[14] Keller M D, Bellows W K, Guillard R R L.Dimethylsulfide production and marine phytoplankton:An additional impact of unusual blooms[J].Novel Phytoplankton Blooms, 1989, 35: 101-115.
[15] Stockwell D A, Buskey E, Whitledge T.Toxic phytoplankton blooms in the sea[C]// Proceedings 5th International Conference on Toxic Marine Phytoplankton.Amsterdam: Elsevier Science Publishers, 1993: 693-698.
[16] Admiraal W, Venekamp L.Significance of tintinnid grazing during blooms ofPhaeocystis pouchetii(Haptophyceae) in Dutch coastal waters[J].Netherlands Journal of Sea Research, 1986, 20(1): 61-66.
[17] Carlsson P, Graneli E, Olsson P.Toxic marine phytoplankton[C]//Proceedings of the Fourth International Conference on Toxic Marine Phytoplankton.New York:Elsevier, 1990, 116-122.
[18] Bricelj V M, MacQuarrie S P, Smolowitz R.Concentration-dependent effects of toxic and non-toxic isolates of the brown tide algaAureococcus anophagefferenson growth of juvenile bivalves[J].Mar Ecol Prog Ser, 2004, 282: 101-114.
[19] Gainey L F, Shumway S E.The physiological effect ofAureococcus anophagefferens(brown tide) on the lateral cilia [J].Biol Bull, 1991, 181: 298-306.
[20] Harke M J, Gobler C J, Shumway S E.Suspension feeding by the Atlantic slipper limpet (Crepidula fornicata) and the northern quahog (Mercenaria mercenaria) in the presence of cultured and wild populations of the harmful brown tide alga,Aureococcus anophagefferens[J].Harmful Algae, 2011, 10(5): 503-511.

