泥蚶人工選育群體的微衛(wèi)星分析
田 野 , 邵艷卿, , 肖國強, , 滕爽爽, , 柴雪良 , , 張炯明, , 方 軍,
(1.溫州醫(yī)科大學 檢驗醫(yī)學院 生命科學學院, 浙江 溫州 325005; 2.浙江省海洋水產養(yǎng)殖研究所, 浙江 溫州 325005; 3.浙江省近岸水域生物資源開發(fā)和保護重點實驗室, 浙江 溫州 325005)
泥蚶(Tegillarca granosa)屬軟體動物門(Mollusca)、雙殼綱(Bivalvia)、蚶目(Arcoida)、蚶科(Arcidae)動物,廣泛分布于我國南北各沿海地區(qū)及韓國、越南、馬來西亞等, 為我國傳統(tǒng)四大養(yǎng)殖經濟貝類之一。因其具有獨特的風味及豐富的營養(yǎng)價值而深受人們喜愛。20世紀90年代初期, 浙江省海洋水產養(yǎng)殖研究所等單位率先突破了泥蚶規(guī)模化生產性人工育苗技術, 自此以后, 泥蚶養(yǎng)殖獲得快速發(fā)展, 泥蚶養(yǎng)殖所用苗種也絕大部分由人工苗種所替代[1]。浙江樂清灣一帶也成為國內最主要的泥蚶人工苗種產地。
但近年來研究發(fā)現(xiàn), 因長期以來生產性養(yǎng)殖的泥蚶, 主要通過人工育苗提供苗種, 苗種繁育所用親貝均為人工養(yǎng)成, 經過多年自繁自養(yǎng)和親貝的隨意選留, 加劇了泥蚶的近交衰退, 已不同程度地出現(xiàn)了遺傳多樣性減低、雜合度下降、生長速度減緩、抗逆性差、性狀退化等問題[2]。微衛(wèi)星標記(simple sequence repeat, SSR), 具有多態(tài)性豐富、共顯性遺傳、重復性好、操作分析簡單等優(yōu)點, 已被廣泛用于群體遺傳多樣性評價、遺傳連鎖圖譜構建、分子標記輔助育種等領域[3]。進行選育時, 因近交機率增加和有效親本數(shù)的減少, 可能導致選育群體的遺傳多樣性下降, 進而引起選育群體的性狀衰退[4], 雖然一些研究報道了貝類養(yǎng)殖群體的遺傳多樣性與野生群體相比未發(fā)生明顯變化[5-8], 但貝類的苗種培育和群體選育過程中, 常因親本數(shù)量過少、雌雄比例不當、親本貢獻不均、配子質量差異、配子競爭、人工選優(yōu)和選型交配等因素, 引起有效群體數(shù)量的減少,從而降低選育群體的遺傳多樣性[9-14]。
目前國內對于貝類選育群體遺傳多樣性的分析已有不少報道: 王慶志等[15]對長牡蠣人工選育群體的微衛(wèi)星分析; 王學穎等[16]對馬氏珠母貝金黃殼色系和基礎群體遺傳結構進行比較; 本研究利用微衛(wèi)星標記對泥蚶連續(xù) 3代選育群體的遺傳多樣性進行分析, 與基礎群體進行比較, 考查隨著選育代數(shù)的進行群體各種遺傳指數(shù)的變化規(guī)律, 為進一步優(yōu)化育種方案提供參考。
1 材料與方法
1.1 樣本的采集
本研究采集的泥蚶樣品為經浙江省海洋水產養(yǎng)殖研究所連續(xù)多年選育的F3代, F4代, F5代速生群體, 選育策略為群體內個體選擇結合家系/亞群選擇,同時以最早保存的未經選育的基礎群體作為對照組。F3, F4, F5代個體均從群體中隨機選取65個, 于–70℃冰箱中保存?zhèn)溆? 基礎群體35個于2007年保存在–70℃冰箱備用。
1.2 DNA提取
采用常規(guī)的蛋白酶 K 消化, 酚-氯仿-異戊醇抽提, 無水乙醇沉淀的方法提取基因組 DNA; 用瓊脂糖凝膠電泳檢測后, 用紫外分光光度計檢測DNA純度與濃度, 選取電泳條帶較亮且濃度較高的DNA稀釋成統(tǒng)一濃度, 保存于4℃冰箱中用于后續(xù)實驗。
1.3 PCR擴增及產物檢測
從39對泥蚶微衛(wèi)星引物中[17]篩選出12對作為本研究使用的引物, 并對引物退火溫度進行優(yōu)化。引物由上海生工公司合成, 其編號及序列見表1。

表1 引物編號及序列Tab.1 Primer number and sequences
PCR反應體系為15 μL, 包含100 ng模板DNA,1×PCR緩沖液, 0.4UTaKaRa Taq DNA聚合酶, 2.5 mmol/L MgCl2, 0.25 mmol/L dNTP混合液, 上下游引物各0.7 μmol/L。PCR擴增條件為: 94℃ 預變性5 min,然后30個循環(huán), 每個循環(huán)包括: 94℃ 30 S, 49~56℃退火30 S, 72℃延伸45 S。PCR產物在6%變性聚丙烯酰胺凝膠上電泳, 50 bp DNA ladder (Takara)作為Marker檢測產物位置, 硝酸銀法染色, 條帶結果由人工讀取、統(tǒng)計。
1.4 數(shù)據(jù)統(tǒng)計與分析
統(tǒng)計每個位點的等位基因數(shù)量(Observed number of allele,No), 用 Popgene 32(1.32)分析數(shù)據(jù), 計算有效等位基因數(shù)(Effective number of allele,Ne),Shannon遺傳多樣性指數(shù)(Shannon genetic ranged index,Rs), 近交系數(shù)(Wright's fixation index,Fis), 觀測雜合度(Observed heterozygosity,Ho), 期望雜合度(Expected heterozygosity,He)以及哈迪-溫伯格平衡(Hardy-Weinberg equilibrium, HWE)。PIC_Calc 0.6(http://www.bbioo.com/download/58-247-1.html)計算多態(tài)信息含量(Polymorphism information content,PIC)。
2 結果
2.1 遺傳多樣性
泥蚶基礎群體和選育群體的遺傳參數(shù)結果如表2所示。12個位點均表現(xiàn)出多態(tài)性: 基礎群體各位點有效等位基因數(shù)1.69~6.30個, 平均3.16個; F3代為1.52~3.88個, 平均2.71個; F4代1.15~4.75個, 平均2.73個; F5代1.57~5.17個, 平均2.58個; 表明隨著群體選育的進行, 等位基因數(shù)總體呈現(xiàn)下降趨勢。所有群體12個位點觀測雜合度(Ho)均小于期望雜合度(He)。觀測雜合度平均范圍為 0.4195~0.4725, 期望雜合度平均范圍為 0.5700~0.6323, 表明各位點有一定程度的雜合子缺失。在 48個群體-位點組合中有32個群體-位點組合顯著偏離平衡(P<0.05), 約占總數(shù) 66.67%。Shannon遺傳多樣性指數(shù)平均值為1.06~1.22。各位點多態(tài)信息含量范圍0.1119~0.8209。
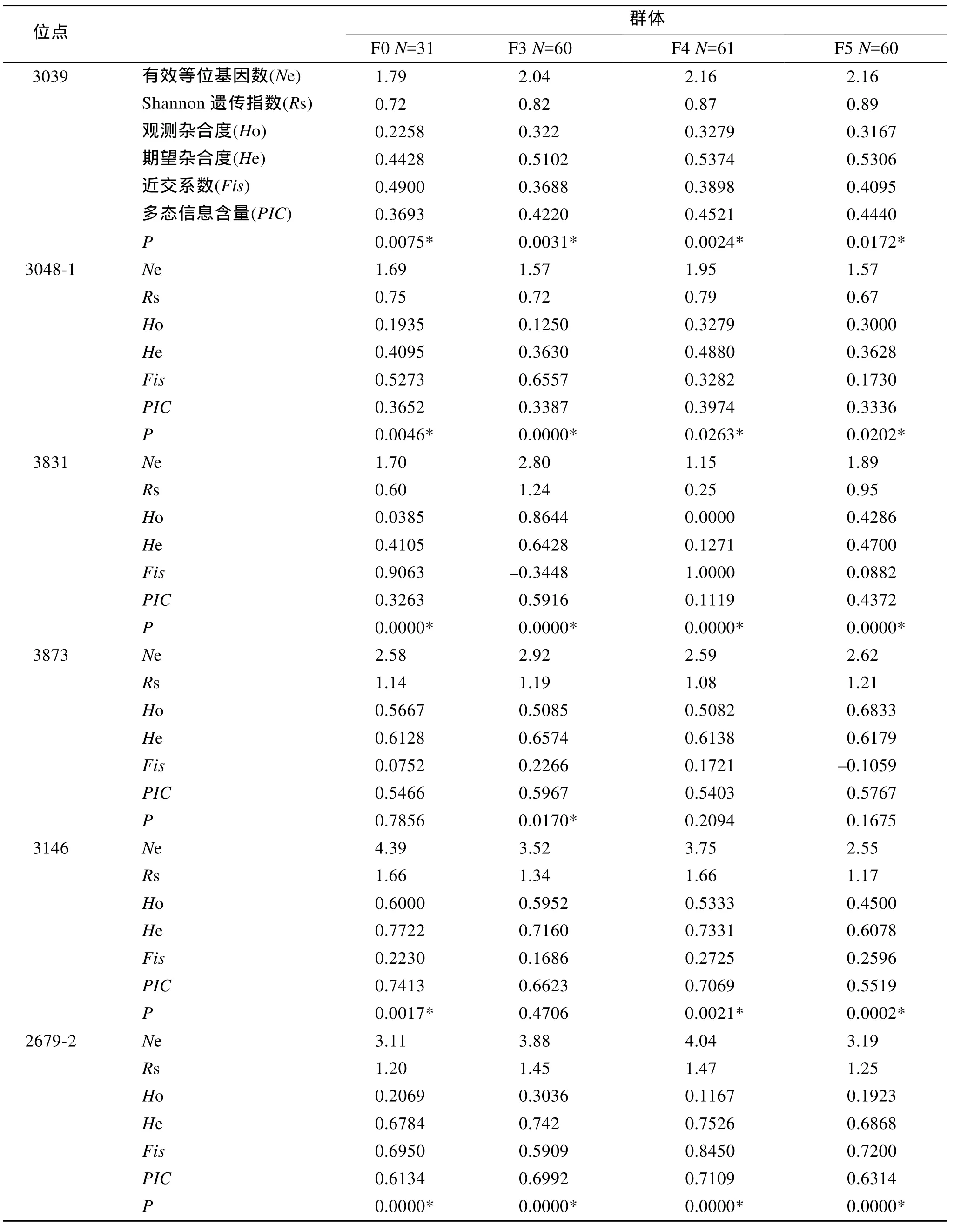
表2 泥蚶4個群體的遺傳多樣性分析Tab.2 Genetic variability analysis of 4 blood clam T.granosa populations
2.2 遺傳分化
4個群體間不同位點的遺傳分化系數(shù) Fst值從0.0347~0.4549, 平均值 0.1930, 相關文獻認為遺傳分化程度比較大(處于 0.15~0.25之間); 基因流Nm值為 0.2996~6.9617, 平均值 2.3367; 群體近交系數(shù)Fis范圍0.0052~0.7135, 平均值0.2468, 表明群體的近交程度較高。
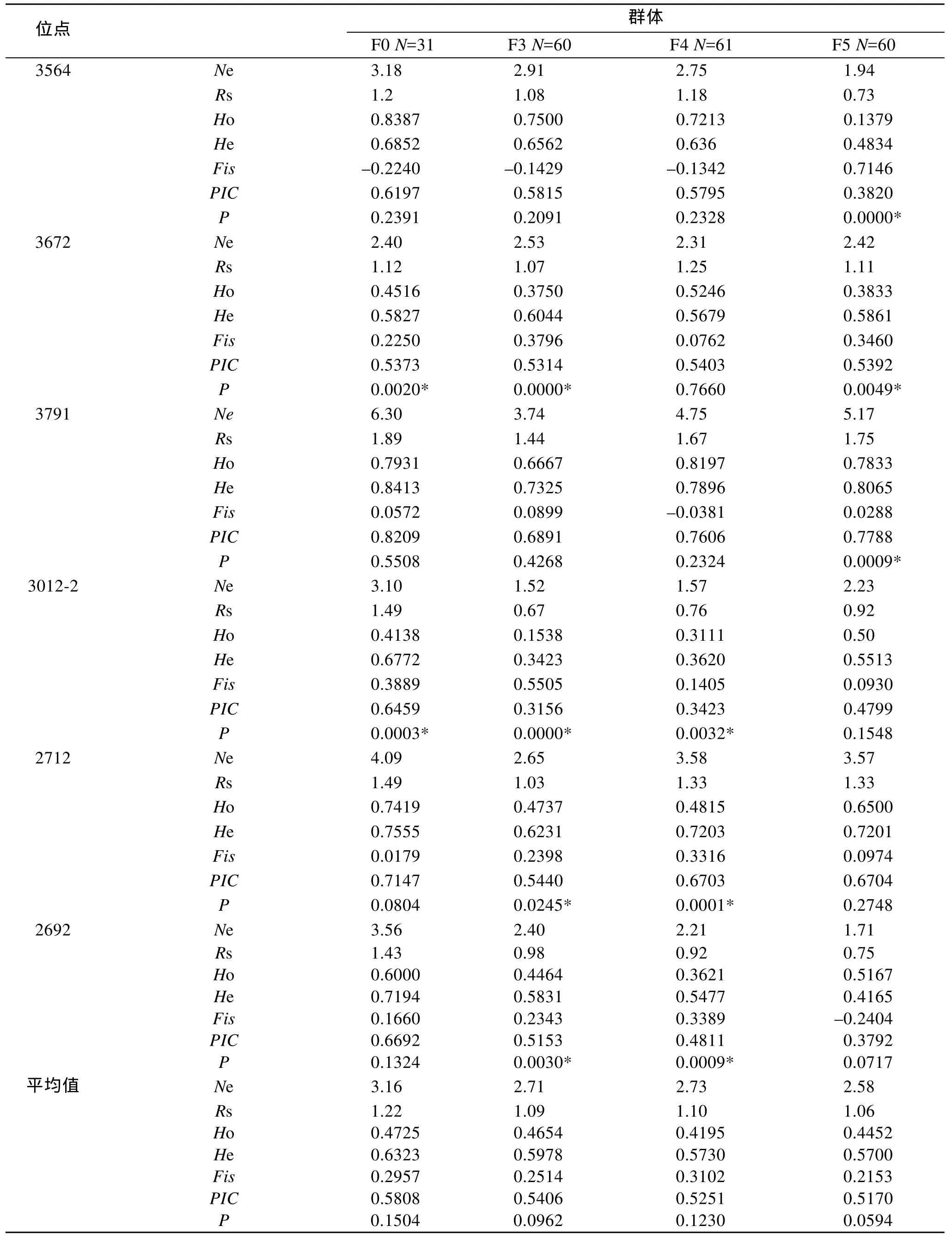
續(xù)表
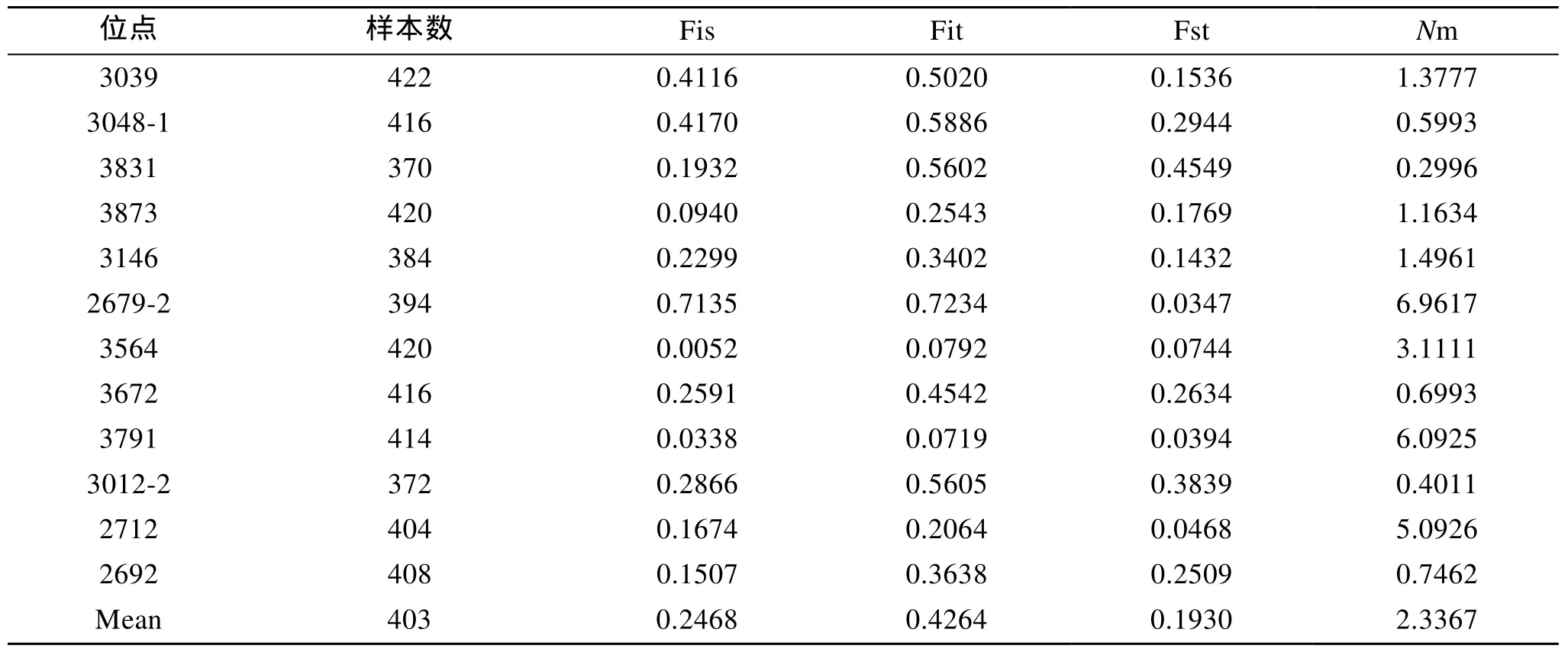
表3 4個泥蚶群體的基因分化與基因流Tab.3 Gene differentiation and gene flow of 4 blood clam T.granosa populations
3 討論
遺傳育種、保護種質資源等相關工作能順利開展的前提和基礎是維持群體的遺傳多樣性, 群體遺傳多樣性的高低與其適應能力、生存能力和進化潛力密切相關。遺傳多樣性降低可導致其適應能力降低、有害隱性基因表達增加及經濟性狀衰退, 最終導致物種退化[18]。因此, 為了保證選育工作的順利進行并獲得高質量的選育新品種, 保持群體的遺傳多樣性是非常重要的。
3.1 泥蚶群體的遺傳多樣性分析
多態(tài)信息含量、等位基因數(shù)、遺傳多樣性指數(shù)都是體現(xiàn)群體遺傳多樣性的量度參數(shù)。文獻中認為PIC>0.5時為高度多態(tài)性位點, 0.25 Shannon遺傳多樣性指數(shù)(Rs)在3個選育群體中的變化不大, 而與基礎群體相比較略有下降, 在王慶志[15]對長牡蠣的報道中的數(shù)據(jù)比較發(fā)現(xiàn)結果是相似的。說明隨著選育的進行, 遺傳多樣性指數(shù)趨于穩(wěn)定。3代連續(xù)選育的群體平均有效等位基因數(shù)與基礎群體相比有所下降, 但選育群體之間變化不大, 基本穩(wěn)定。12個位點PIC平均值: F3、F4、F5代分別為0.5406、0.5251、0.5170; 基礎群體PIC平均值為0.5808。以上結果表明與基礎群體相比較, 選育的遺傳多樣性雖有一定程度的下降, 但是隨著選育的進行, 群體多樣性各指標趨于穩(wěn)定。 遺傳分化指數(shù)(Fst)反映群體間遺傳分化程度的重要參數(shù)。從本研究的結果來看: 4個群體中12個位點的Fst值范圍0.0347~0.4549, 平均值為0.1930。表明有19.3%的變異是由群體分化導致的, 而80.7%的變異來源于群體內, 群體間的遺傳變異程度處于一般水平。Wright[21]認為, 基因流Nm大于1時, 能夠發(fā)揮其均質化作用, 從而抑制由遺傳漂變引起的群體間分化。而在本研究中, 12個位點中有8個位點的Nm值大于1, 說明群體間的交流程度比較高。馬春艷等[22]對凡納濱對蝦引進群體和 2個養(yǎng)殖群體遺傳變異的微衛(wèi)星分析中得到的Fst值為0.0500~0.1657,王學穎等[16]對馬氏珠母貝金黃殼色系F3和基礎群體遺傳結構比較研究中得到的Fst值范圍為 0.0031~0.1478, 李云霞等[23]對刺參群體遺傳結構分析及與經濟性狀的相關性研究中的Fst值為0.0130~0.1805,湯健等[24]對馬氏珠母貝家系遺傳結構的微衛(wèi)星分析中的Fst值 0.0375~0.2733, 這些結果都比本研究的結果要低, 產生此差異的原因可能是由于引物設計的不同產生結果差異, 由于引物定位的位置不同,生物群體在該位置發(fā)生不同變異。 本研究結果表明, 在經過連續(xù)的人工選育過程,對群體的遺傳多樣性與基礎群體相比有一定程度的降低, 但仍處于較高水平。這與我們育種選取的方式有關: 因為采用群體選育方式確保了有效繁育群體數(shù)量所以遺傳多樣性下降較慢, 但針對某個性狀選育的進展較慢, 若采用家系選育方式, 雖然就某個性狀而言選育進展較快, 但遺傳多樣性也下降較快。因此, 我們采用群體選育結合家系選擇的方式, 雖然有一定程度的下降, 但下降程度不顯著。從研究的結果來看, 經連續(xù)選育的泥蚶群體遺傳分化程度還比較低, 并且其遺傳多樣性和遺傳分化程度逐漸趨于穩(wěn)定。所以, 泥蚶育種仍有非常大的潛力進行優(yōu)良性狀的篩選。但今后應避免近交繁殖對選育群體的優(yōu)良性狀產生的不良影響, 確保泥蚶育種工作的持續(xù)健康進行。 [1] 劉博, 滕爽爽, 柴雪良, 等.泥蚶遺傳連鎖圖譜的構建[J].海洋與湖沼, 2012, 43(5): 983-991. [2] 呂振明, 李太武, 蘇秀榕.泥蚶遺傳多樣性的研究[J].高技術通訊, 2005, 15(12): 104-110. [3] Wright J M, Bentzen P.Microsatellites: genetic markers for future[J].Reviews in Fish Biology and Fisheries, 1994, 4(3): 384-388. [4] Beaumont A, Boudry P, Hoare K.Biotechnology and genetics in fisheries and aquaculture[M].Singapore:Wiley-Blackwell, 2010. [5] Durand P, Wada K T, Blanc F.Genetic variation in wild and hatchery stocks of the black pearl oyster,Pinctada margarififera, from Japan[J].Aquaculture,1993, 110(1) : 27-40. [6] English L J, Maguire G B, Ward R D.Genetic variation of wild and hatchery populations of the Pacific oyster,Crassostrea gigas(Thunberg), in Australia[J].Aquaculture,2000, 187(3-4): 283-298. [7] Li Q, Yu H, Yu R H.Genetic variability assessed by microsatellites in cultured populations of the Pacific oyster(Crassostrea gigas) in China[J].Aquaculture,2006, 259(1-4): 95-102. [8] Zhao C, Li Q, Kong L F.Inheritance of AFLP markers and their use for genetic diversity analysis in wild and farmed scallop (Chlamys farreri)[J].Aquaculture, 2009,287(1-2): 67-74. [9] Hedgecock D, Sly F.Genetic drift and effective population sizes of hatchery-propagated stocks of the Pacific oyster,Crassostrea gigas[J].Aquaculture, 1990, 88(1): 21-38. [10] Boudry P, Collet B, Cornette F, et al.High variance in reproductive success of the Pacific oyster (Crassostrea gigas, Thunberg)revealed by microsatellite-based parentage analysis of multifactorial crosses[J].Aquaculture,2002, 204 (3-4): 283-296. [11] Taris N, Ernande B, McCombie H, et al.Phenotypic and genetic consequences of size selection at the larval stage in the Pacific oyster(Crassostrea gigas)[J].Journal of Experimental Marine Biology and Ecology,2006, 333(1): 147-158. [12] Appleyard S A, Ward R D.Genetic diversity and effective population size in mass selection lines of Pacific oyster(Crassostrea gigas)[J].Aquaculture, 2006,254(1-4): 148-159. [13] Lind C E, Evans B S, Knauer J, et al.Decreased genetic diversity and a reduced effective population size in cultured silver-lipped pearl oysters(Pinctada maxima)[J].Aquaculture, 2009, 286(1-2): 12-19. [14] Li R H, Li Q, Yu R H.Parentage determination and effective population size estimation in mass spawning Pacific oyster(Crassostrea gigas)based on microsatellite loci analysis[J].Journal of the World Aquaculture Society, 2009, 40(5): 667-677. [15] 王慶志, 李琪, 孔令鋒.長牡蠣3代人工選育群體的微衛(wèi)星分析[J].水產學報, 2012, 36(10): 1529-1536. [16] 王學穎, 高遠鎮(zhèn), 杜曉東, 等.馬氏珠母貝金黃殼色系 F3和基礎群體遺傳結構比較[J].海洋通報, 2012,31(3): 324-328. [17] Liu B, Teng S S, Shao Y Q, et al.Isolation and characterization of 39 novel polymorphic EST-SSR loci for the blood clam,Tegillarca granosa[J].Conservation Genet Resour, 2012, 4: 375-378. [18] Beaumont A, Boudry P, Hoare K.Biotechnology and genetics in fisheries and aquaculture[M].Singapore:Wiley-Blackwell, 2010. [19] Botstein D, White R L, Skolnick M, et al.Construction of a genetic linkage map in mall using restriction fragment length polymorphisms[J].Am J Hum Genet,1980, 32: 314-331. [20] 劉博, 邵艷卿, 王侃, 等.4個縊蟶群體遺傳多樣性和系統(tǒng)發(fā)生關系的微衛(wèi)星分析[J].海洋科學, 2013, 37(8),96-102. [21] Wright S.Evolution in Mendelian population[J].Genetics, 1931, 16: 91-159. [22] 馬春艷, 馬洪雨, 馬凌波, 等.凡納濱對蝦引進群體和2個養(yǎng)殖群體遺傳變異的微衛(wèi)星分析[J].海洋漁業(yè),2011, 33(1): 1-8. [23] 李云霞, 李嬌, 丁君, 等.基于微衛(wèi)星標記的刺參群體遺傳結構分析及與經濟性狀的相關性研究[J].大連海洋大學學報, 2013, 28(5): 438-444. [24] 湯健, 管云雁, 劉文廣, 等.馬氏珠母貝家系遺傳結構的微衛(wèi)星分析[J].海洋科學, 2013, 37(8): 35-41.3.2 泥蚶群體遺傳分化分析

