Rho 型GTPase 激活蛋白MoBem2 在稻瘟病菌分生孢子形態建成中的功能
齊中強, 杜 艷, 劉永鋒
(江蘇省農業科學院植物保護研究所,江蘇 南京210014)
稻瘟病已經成為危害世界糧食安全生產的一種重要病害[1-4]。由于經濟重要性和遺傳轉化的易操作性以及全序列的公布,稻瘟病菌-植物互作模式已經成為研究的熱點課題[5]。稻瘟病菌分生孢子在其侵染水稻的過程中扮演著重要角色[6]。分生孢子首先在其頂端產生粘性物質,隨后便萌發產生芽管,最后分化形成附著胞。附著胞的分化主要受細胞周期和程序性死亡等因素調控。附著胞內部通過甘油的積累可以產生大約8 MPa 的膨壓,從而產生侵入釘,穿破寄主表皮進入細胞內。侵入后,侵入釘會分化成侵染菌絲,進而在植物細胞內定殖,隨著時間的延長,就會形成可見的典型稻瘟病斑。當外界條件(溫度、濕度)適宜時,病組織上會重新長出孢子梗,進而產生分生孢子,繼續進行再侵染[7]。Rho 蛋白是Ras 超家族中最早被克隆出來的一類蛋白質,它們是一組相對分子質量約為2.0×104~2.5×104的三磷酸鳥苷結合蛋白,具有GTP 酶活性,主要調控細胞骨架的形成及細胞形態建成[8]。Rho 蛋白和其他類型的G 蛋白具有相似的功能,作為一種分子開關,具有GTP 結合的活性狀態和GDP 結合的失活狀態。激活蛋白Bem2主要行使GTPase 激活功能,促使GTP 向GDP 的轉換,加速Rho 蛋白的失活。為了明確Rho 蛋白GTPase 激活蛋白在稻瘟病菌中的功能,本研究通過基因敲除的方法,對稻瘟病菌中Rho 型GTPase 激活蛋白MoBem2 功能進行解析。
1 材料與方法
1.1 供試材料
稻瘟病菌(Magnaporthe oryzae)Guy11 和水稻品種CO39(感病品種)由南京農業大學植物保護學院真菌與卵菌實驗室提供。完全培養基CM、產孢培養基SDC 的配制方法參照文獻[9]。
1.2 試驗方法
1.2.1 敲除載體構建及稻瘟病菌敲除轉化 通過稻瘟病菌全基因組序列公布網站,下載預測到的MoBEM2 基因序列。將稻瘟病菌基因組數據庫中MoBEM2 基因上、下游各1 kb 左右的DNA 序列作為同源重組的上、下兩臂,構建基因敲除載體。以野生型Guy11 基因組DNA 為模板,分別用引物bem2-p1(F)/bem2-p2(R)和bem2-p3(F)/bem2-p4 (R)擴增上、下臂片段,經電泳、切膠回收將PCR 產物純化。再以這兩臂片段為模板,用引物bem2-p1(F)/bem2-p4(R)進行Over-lap PCR 擴增。PCR 產物切膠回收后連接到pMD19-T simple vector(TaKaRa,Dalian,China)得到質粒pMD∶∶BEM2,并送交上海Invitrogen 公司測序,其中引物bem2-p2 和bem2-p3序列中設有EcoRV 酶切位點。以質粒pCB1003 為模板,用引物FL1111 (F)/FL1112 (R)高保真PCR擴增抗性篩選基因—潮霉素磷酸轉移酶基因(HPH),所用的高保真酶為Primer STAR(TaKaRa,Dalian,China),反應程序為:98 ℃10 s,56 ℃15 s,72 ℃1 min,30 個循環。擴增得到的平末端PCR 產物切膠回收后插入EcoR V 酶切過的質粒pMD∶∶BEM2 中,得到敲除載體pMD∶∶BEM2∶∶HPH。以該質粒為模板,用引物bem2-p1(F)/bem2-p4(R)擴增得到約3.4 kb 的敲除片段用于稻瘟病菌的原生質體轉化,原生質體轉化方法參照文獻[10]。
1.2.2 轉化子驗證及Southern 雜交 提取轉化得到的轉化子基因組DNA(CTAB 法),用引物bem2-p5(F)/bem2-p6(R)進行驗證,隨后將驗證得到的候選突變體進行Southern 雜交。以稻瘟病菌野生型Guy11 基因組DNA 為模板,用引物bem2-p5(F)/bem2-p6(R)擴增出MoBEM2 基因內部889 bp 片段,以此片段作為探針,并用地高辛標記。Guy11 菌絲基因組DNA 經EcoR I 酶切于1.0%瓊脂糖凝膠中過夜電泳,充分分離酶解片段,然后轉移至帶正電的尼龍膜(HybondTM-N+,Amersham,Biosciences UK Limited)上,與地高辛標記的探針于58 ℃雜交過夜。Southern 雜交過程參照Digoxigenin high-prime DNA labeling and the detection starter kit 1(Roche,Germany)的操作手冊。以上引物序列見表1。
1.2.3 分生孢子的誘導產生 將野生型Guy11 及敲除突變體接種在SDC 培養基上,28 ℃黑暗培養7 d 左右,待菌絲體長滿平板后,用手術刀將表面氣生菌絲刮掉,于黑光燈下照射3 d,誘導分生孢子產生。收集孢子時,向培養基內加入3 ml 無菌水,輕輕用1.5 ml EP 管底部將表面氣生菌絲和孢子刷下,再經過4 層擦鏡紙過濾收集孢子。
1.2.4 附著胞形成的觀測 將蓋玻片(Fisherbrand,12-540-A 18 ×18-2)放置在載玻片上(下面滴加無菌水),取40 μl 濃度為1 ml 5 ×104個的分生孢子液,滴加于蓋玻片中央,隨后將載玻片放入培養皿中28 ℃黑暗保濕培養2 h、4 h、6 h、8 h、24 h 和48 h后分別制片觀測附著胞形成率。設置3 個重復。
1.2.5 水稻噴霧接種及大麥離體致病性測定 將刷下的分生孢子液濃度調至1 ml 5 ×104個,加入0.25%明膠,噴霧接種生長14 d 的水稻,28 ℃黑暗培養24 h,隨后16 h 光照,8 h 黑暗,處理期間需要保持高溫高濕狀態。接種5 ~7 d 后,觀察結果。大麥離體致病性測定:剪取生長14 d 的大麥葉片鋪于含有保濕濾紙的培養皿中,將孢子液濃度調至1 ml 5 ×104個,加入0.25%明膠,每片葉片滴3 滴孢子液,以清水做對照,置于28 ℃黑暗培養24 h,隨后16 h 光照,8 h 黑暗處理。接種5 ~7 d 后,觀察結果。試驗重復3 次。

表1 本研究中使用的引物Table 1 Primers used in this study
1.2.6 水稻葉鞘侵染 取生長28 d 的水稻植株,剝去外面葉片,留存倒數第2 片葉鞘和新葉,將新葉慢慢取出,保留葉鞘部分。收集野生型和突變體分生孢子,調配孢子液濃度為1 ml 1 ×105個,用1 ml注射器將孢子液注入葉鞘內,隨后放入保濕培養皿中保濕培養,水稻根部覆蓋脫脂棉保濕。48 h 后,用手術刀將葉鞘切斷,選取距根部較近部位用眼科鑷撕取葉鞘內表皮,隨后制片觀察并拍照。每個菌株處理10 株水稻葉鞘。
1.2.7 分生孢子熒光增白劑(CFW)染色 將10 mg/ml的CFW 染色液稀釋1 000倍,加入準備好的孢子懸浮液中,避光染色5 min,隨后用無菌水沖洗數次,置于熒光顯微鏡下觀察。
2 結果與分析
2.1 稻瘟病菌MoBEM2 基因敲除突變體的獲得
利用同源重組原理對稻瘟病菌中的MoBEM2基因進行了定向敲除(圖1),經初步驗證獲得#23和#32 2 個轉化子。Southern 雜交結果(圖2)顯示,兩個突變體用基因探針沒有雜交出4.7 Kb 條帶,說明已被成功敲除,進一步用潮霉素探針雜交出了約6.7 Kb 條帶,證明MoBEM2 基因已被潮霉素基因成功替換。
2.2 MoBEM2 基因敲除突變體的孢子形態
將稻瘟病菌野生型Guy11 和#23 突變體及互補轉化子分別接種到SDC 培養基中,隨后誘導產孢。發現突變體分生孢子產量顯著降低(下降40%左右)(圖3),孢子形態發生改變(圖4),分生孢子只形成一個隔膜(約占40%左右),而野生型中超過90%均為正常孢子(圖5),說明MoBem2 參與了稻瘟病菌分生孢子的形態建成。
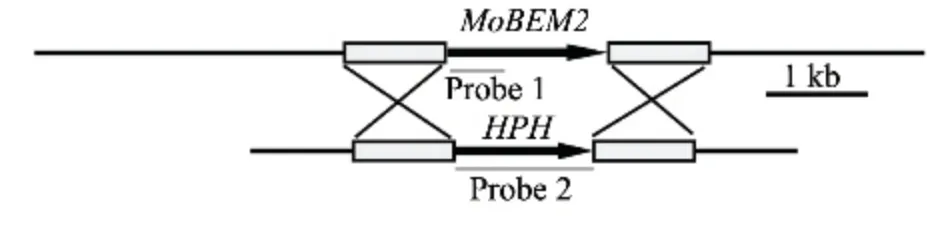
圖1 MoBEM2 基因替換策略簡圖Fig.1 Schematic illustration of MoBEM2 targeted gene replacement
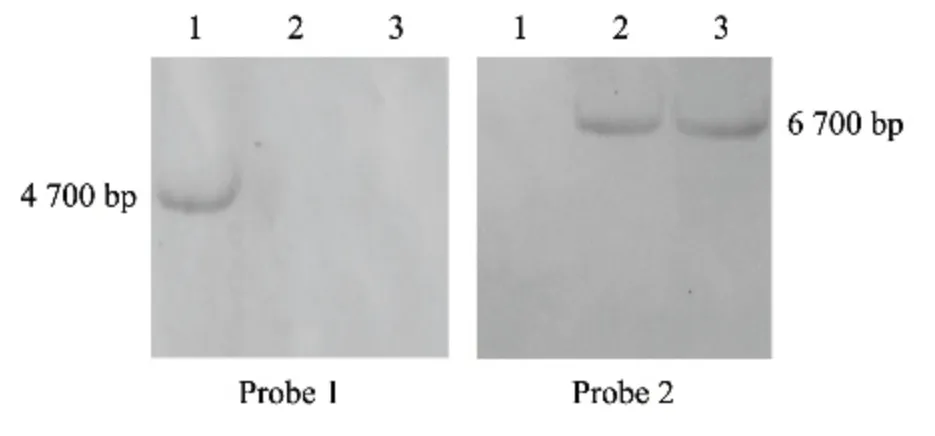
圖2 MoBEM2 敲除突變體Southern 雜交驗證Fig.2 Southern blot of MoBEM2 deletion mutant
2.3 MoBEM2 基因敲除突變體附著胞的形成率
稻瘟病菌附著胞的形成對其致病性是必須的[11],因此檢測了MoBEM2 敲除突變體附著胞形成情況。結果(圖6)表明,突變體分生孢子在培養8 h時附著胞形成率顯著低于野生型和互補轉化子,但隨著時間延長,該缺陷恢復,至24 h,突變體附著胞形成率與野生型沒有差異。說明MoBEM2 基因敲除延緩了稻瘟病菌附著胞的形成。
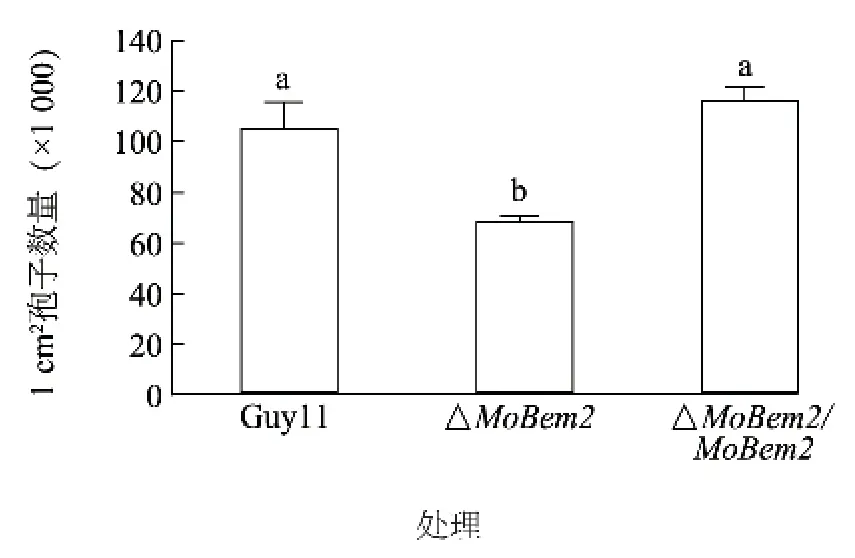
圖3 MoBEM2 敲除突變體分生孢子產量Fig.3 Conidial production of MoBEM2 deletion mutant
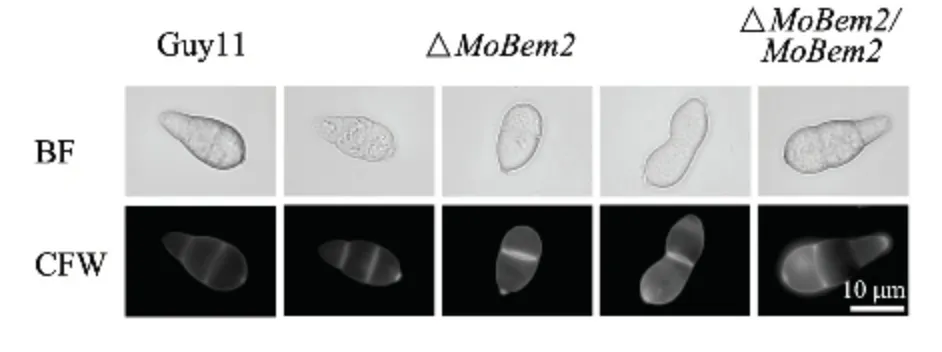
圖4 MoBEM2 敲除突變體分生孢子形態Fig.4 Conidial morphology of MoBEM2 deletion mutant
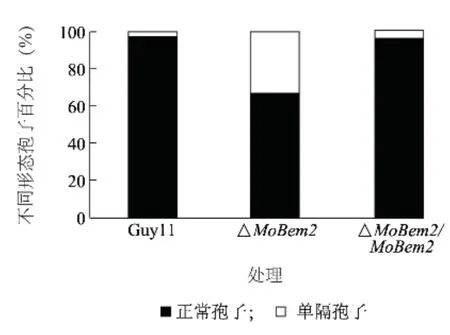
圖5 MoBEM2 敲除突變體不同形態分生孢子百分比Fig.5 Percentage of uniseptate and normal conidial morphology of MoBEM2 deletion mutant
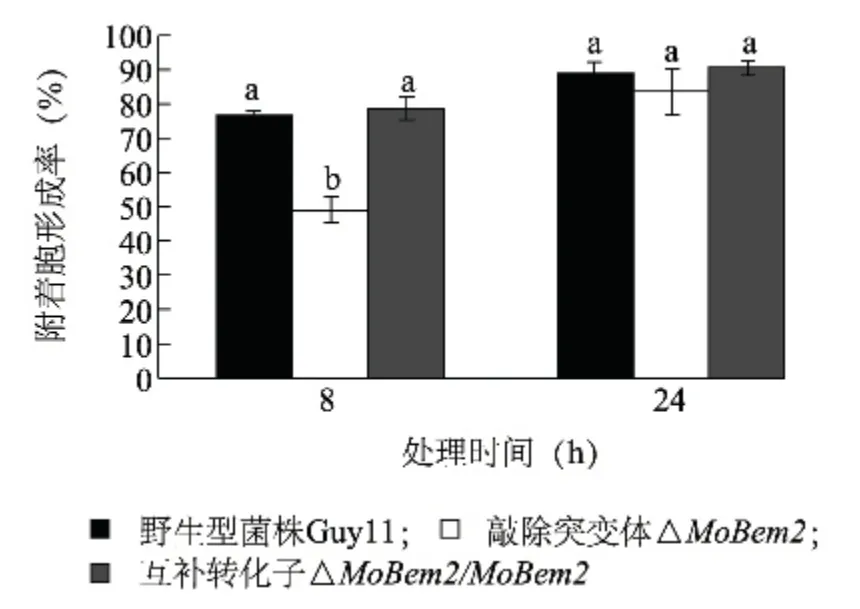
圖6 MoBEM2 突變體附著胞形成率Fig.6 Appressorium formation rate of MoBEM2 deletion mutant
2.4 MoBEM2 基因敲除突變體的致病性
將野生型、敲除突變體和互補轉化子的分生孢子配制成濃度為1 ml 5.0 ×104個的孢子懸浮液(含0.25%明膠),分別采用水稻植株噴霧和大麥離體葉片點滴的方法進行致病性測定。結果顯示,在兩種接種條件下,敲除突變體發病情況與野生型、互補轉化子均無差異,表明MoBEM2 基因在稻瘟病菌致病過程中不起作用(圖7)。
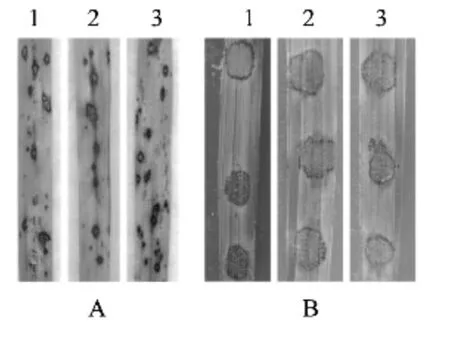
圖7 MoBEM2 敲除突變體對水稻和大麥的致病性Fig.7 Pathogenicity to rice (A)and barley (B)of MoBEM2 deletion mutant
3 討論
Rho 型蛋白通過與特異性的鳥嘌呤核苷酸轉換因子(GEF)結合而被激活,與GTP 酶激活蛋白(GAPs)結合而失活[12]。本試驗以稻瘟病菌中一個Rho 型蛋白GTP 酶激活蛋白MoBem2 為研究對象,通過基因敲除,發現MoBem2 參與稻瘟病菌分生孢子的形態建成,延緩附著胞的形成。
分生孢子在稻瘟病菌的致病過程中具有重要作用[13]。稻瘟病菌中,MoRac1 主要參與稻瘟病菌分生孢子的形成以及形態建成,并且調控稻瘟病菌對水稻的致病力[14]。本研究中,敲除Rho 型GTP 酶激活蛋白編碼基因MoBEM2 后,該突變體出現單隔的分生孢子,分生孢子產量也顯著下降,推測該基因參與分生孢子的形成及形態建成。上述結果表明Rho 蛋白主要通過其激活和失活調控稻瘟病菌分生孢子的形態建成,在這個過程中,GTP 酶的作用尤為明顯。此外,MoHOX2 作為Homeobox 轉錄因子家族的成員,敲除后稻瘟病菌喪失產孢能力[15]。2 個SNARE 蛋白MoVam7[16]和MoSec22[17]同樣參與了稻瘟病菌的產孢過程,兩者的敲除突變體均喪失產孢能力。說明了稻瘟病菌分生孢子的調控涉及多種機制。
附著胞在稻瘟病菌侵染過程中起著至關重要的作用[18]。MoBEM2 敲除突變體分生孢子在誘導界面上能夠形成附著胞,但在附著胞形成早期,突變體附著胞形成率顯著降低,但在后期與野生型沒有差別。說明該基因一定程度上影響稻瘟病菌附著胞早期的形成,但不影響稻瘟病菌的致病性。綜上所述,MoBem2 參與了稻瘟病菌分生孢子的形成及形態建成過程,這對認識稻瘟病菌致病過程有重要意義。
[1] WILSON R A,TALBOT N J. Under pressure:investigating the biology of plant infection by Magnaporthe oryzae[J]. Nature Reviews Microbiology,2009,7:185-195.
[2] 于 濤,張海樓,雋英華,等.施肥模式對水稻稻瘟病抗性的影響[J].江蘇農業科學,2014,42(7):113-116.
[3] 張曉娟,張 羽,張辰露,等.分子標記在稻瘟病抗性育種中應用的研究進展[J].江蘇農業科學,2013,41(8):73-75.
[4] 唐 成,陳 露,安敏敏,等.稻瘟病誘導水稻幼苗葉片氧化還原系統的特征譜變化[J]. 江蘇農業科學,2014,42(12):141-144.
[5] DEAN R A,TALBOT N J,EBBOLE D J,et al. The genome sequence of the rice blast fungus Magnaporthe grisea[J]. Nature,2005,434:980-986.
[6] HAMER J E,HOWARD R J,CHUMLEY F G,et al. A mechanism for surface attachment in spores of a plant pathogenic fungus[J]. Science,1988,239,288-290.
[7] TALBOT N J. On the trail of a cereal killer:Exploring the biology of Magnaporthe grisea[J]. Annu Rev Microbiol,2003,57:177-202.
[8] JOHNSON D I. Cdc42:An essential Rho-type GTPase controlling eukaryotic cell polarity[J]. Microbiol Mol Biol Rev,1999,63:54-105.
[9] ZHANG H,TANG W,LIU K,et al. Eight RGS and RGS-like proteins orchestrate growth,differentiation,and pathogenicity of Magnaporthe oryzae[J]. PLoS Pathogens,2011,7:e1002450.
[10] QI Z,WANG Q,DOU X,et al. MoSwi6,an APSES family transcription factor,interacts with MoMps1 and is required for hyphal and conidial morphogenesis,appressorial function and pathogenicity of Magnaporthe oryzae[J]. Molecular Plant Pathology,2012,13:677-689.
[11] THINES E,WEBER R W,TALBOT N J. MAP kinase and protein kinase A-dependent mobilization of triacylglycerol and glycogen during appressorium turgor generation by Magnaporthe grisea[J]. Plant Cell,2000,12:1703-1718.
[12] JAFFE A B,HALL A. Rho GTPases:biochemistry and biology[J]. Ann Rev Cell Dev Biol,2005,21:247-269.
[13] TALBOT N J,EBBOLE D J,HAMER J E. Identification and characterization of MPG1,a gene involved in pathogenicity from the rice blast fungus Magnaporthe grisea[J]. The Plant cell,1993,5:1575-1590.
[14] CHEN J,ZHENG W,ZHENG S,et al. Rac1 is required for pathogenicity and Chm1-dependent conidiogenesis in rice fungal pathogen Magnaporthe grisea [J]. PLoS Pathogens,2008,4:e1000202.
[15] KIM S,PARK S Y,KIM K S,et al. Homeobox transcription factors are required for conidiation and appressorium development in the rice blast fungus Magnaporthe oryzae[J]. PLoS Genetics,2009,5:e1000757.
[16] DOU X,WANG Q,QI Z,et al. MoVam7,a conserved SNARE involved in vacuole assembly,is required for growth,endocytosis,ROS accumulation,and pathogenesis of Magnaporthe oryzae[J].Plos One,2011,6 :e16439.
[17] SONG W W,DOU X Y,QI Z Q,et al. R-SNARE homolog moSec22 is required for conidiogenesis,cell wall integrity,and pathogenesis of Magnaporthe oryzae[J]. PLoS One,2010,5:e13193.
[18] JEON J,GOH J,YOO S,et al. A putative MAP kinase kinase kinase,MCK1,is required for cell wall integrity and pathogenicity of the rice blast fungus,Magnaporthe oryzae[J]. Mol Plant Microbe Interact,2008,21,525-534.

