pH值對Bi2MoO6晶體形貌和可見光催化性能的影響
王敏 楊長秀 鄭浩巖 郎紅霞 鮑琦 宋宛益 宋恩軍
(沈陽理工大學環境與化學工程學院,沈陽110159)
pH值對Bi2MoO6晶體形貌和可見光催化性能的影響
王敏*楊長秀 鄭浩巖 郎紅霞 鮑琦 宋宛益 宋恩軍
(沈陽理工大學環境與化學工程學院,沈陽110159)
以(NH4)6Mo7O24·4H2O和Bi(NO3)3·5H2O為原料,采用普通水熱法制備Bi2MoO6光催化劑,研究pH值對制備該光催化劑的影響。對所制備的系列樣品,采用X-射線衍射儀(XRD)、掃描電子顯微鏡(SEM)、比表面積分析儀、X射線光電子能譜儀(XPS)和紫外-可見漫反射(UV-Vis DRS)進行表征。結果表明:pH值對Bi2MoO6晶體的物相組成、形貌和光催化性能均有顯著影響。pH值為1~7時,所制備的樣品為純相Bi2MoO6,pH值為9或11時,出現第二相Bi3.64Mo0.36O6.55;隨著pH值的升高,形貌依次為納米棒、納米片和無規則納米顆粒。在可見光(λ≥420 nm)照射下,通過光催化降解羅丹明B(Rhodamine B,RhB),探討了制備Bi2MoO6的pH值對其可見光催化活性的影響。當pH=7時,制備的樣品光催化效果最好,光照50 min后對初始濃度為5 mg·L-1的羅丹明B溶液的降解率為85%。
鉬酸鉍;水熱合成;光催化;pH值;羅丹明B
鉬酸鉍是一種具有可見光響應的新型半導體光催化材料,它具有獨特的物理化學性能,可以用作光導體、離子導體、氣體傳感器、聲光材料及光催化劑[1-4]。由于其具有優異的光催化性能,在可見光的照射下,鉬酸鉍可以光催化分解水和降解有機污染物[3-7]。
鉬酸鉍的化學通式是Bi2O3·nMoO3,其中n=3, 2,1,分別對應它的3種形式α-Bi2Mo3O12、β-Bi2Mo2O9和γ-Bi2MoO6[8-16]。相關研究表明,γ-Bi2MoO6的光催化性能優于α-Bi2Mo3O12和β-Bi2Mo2O9[8]。γ-Bi2MoO6是一種最簡單的奧里維里斯(Aurivillius)型氧化物,它是由交替的(Bi2O2)2+層和共角的MoO6鈣鈦礦片層構成的一種具有層狀結構的復合氧化物[17-23]。
Bi2MoO6禁帶寬度較小,約為2.5~2.8 eV,能被可見光(420~500 nm)激發,并在可見光下表現出較高的催化活性[24-27],是一種具有重要研究前景的半導體光催化材料,引起眾多研究學者的廣泛關注。目前,對鉬酸鉍的研究主要側重于通過各種制備方法進行形貌調控,如Miao等[23]利用噴霧法制備出表面有小孔的籠狀Bi2MoO6微球;Zhang等[24]采用HMT輔助微波水熱法合成了由許多納米薄片組裝成的花狀結構的Bi2MoO6;Chen等[25]利用乙二胺四乙酸(EDTA)的結構導向作用,結合水熱法得到匕首狀的Bi2MoO6晶體。不同結構Bi2MoO6的光催化性能各不相同,表明可以通過調節形貌結構來提高Bi2MoO6的光催化性能。上述研究為Bi2MoO6的制備奠定了基礎,但也存在一定的局限性:如噴霧法對設備及工藝參數的要求很高,花狀結構和匕首狀結構的Bi2MoO6均要利用模板劑制備。
本工作以(NH4)6Mo7O24·4H2O和Bi(NO3)3·5H2O為原料,采用普通水熱法合成了Bi2MoO6微晶,通過改變pH值,制備了不同大小及形貌的Bi2MoO6。本工作不添加任何模板劑,合成方法簡單易行;獲得的純相Bi2MoO6具有較高的光催化性能,篩選出了具有最好光催化活性的樣品。同時借助X-射線衍射儀(XRD)、掃描電子顯微鏡(SEM)、比表面積分析儀、X射線光電子能譜(XPS)和紫外可見漫反射(UV-Vis DRS)對樣品進行表征,以降解羅丹明B為探針反應,研究不同pH值對Bi2MoO6光催化活性的影響。
1 實驗部分
1.1 主要試劑和儀器
試劑:硝酸鉍(Bi(NO3)3·5H2O)(國藥集團化學試劑有限公司,分析純AR)、鉬酸銨((NH4)6Mo7O24·4H2O)(國藥集團化學試劑有限公司,分析純AR)、氫氧化鈉(NaOH)(國藥集團化學試劑有限公司,分析純AR)、硝酸(HNO3)(國藥集團化學試劑有限公司,分析純AR)、羅丹明B(RhB)(國藥集團化學試劑有限公司,分析純AR);實驗用水為Ⅰ級蒸餾水。
儀器:D/max-rB X射線衍射儀(日本理學公司,輻射源Cu Kα射線(λ=0.154 18 nm),工作電壓40 kV,工作電流40 mA,掃描范圍2θ為10°~80°,掃描步長0.02°,掃描速度6°·min-1,固體探測器),Hitach S-3400N掃描電子顯微鏡(日立公司,加速電壓20 kV,放大倍數20000),F-Sorb 3400比表面積分析儀(北京金埃譜科技公司,載氣為高純He氣(99.99%),吸附質為高純N2(99.99%),測試前樣品在120℃的條件下處理2 h),MULTILAB2000 X射線光電子能譜儀(英國VG公司,激發源Al Kα射線(λ=0.833 9 nm),射線能量1 487 eV,線寬1.0 eV,真空度5.0× 10-8Pa,以污染碳(C1s,Eb=284.6 eV)校正結合能值,Hitach 1800紫外-可見吸收光譜儀(日立公司,使用積分球,以BaSO4作為參比,掃描速度為200 nm· min-1,掃描范圍300~800 nm),85-2數顯恒溫磁力攪拌器(江蘇金壇市江南儀器廠),721紫外-可見分光光度計(上海菁華科技儀器有限公司)。
1.2 樣品制備
室溫下取10 mmol Bi(NO3)3·5H2O溶于25 mL的稀硝酸(3 mol·L-1)中,記為A液。另外取5/7 mmol(NH4)6Mo7O24·4H2O溶于25 mL NaOH溶液(2 mol·L-1)中,記為B液。在磁力攪拌下,將B液緩慢滴加到A液中,攪拌均勻后用稀HNO3(3 mol·L-1)和NaOH溶液(6 mol·L-1)調節pH值(pH值分別調節為1、3、5、7、9、11),繼續磁力攪拌30 min。將混合物轉移到有聚四氟乙烯內襯的高壓釜中密封,160℃反應16 h。反應結束后自然冷卻至室溫,將所得淡黃色沉淀抽濾,并用蒸餾水和無水乙醇洗滌固體至中性。80℃烘干12 h,用瑪瑙研缽研碎得到產物。
1.3 樣品表征
采用X射線衍射儀(XRD)測定催化劑的物相。用掃描電子顯微鏡(SEM)觀察樣品的微觀形貌。用比表面積分析儀測定樣品的比表面積。用X射線光電子能譜儀(XPS)確定催化劑的表面組成和相應元素的結合能。用紫外-可見漫反射(UV-Vis DRS)測定催化劑對可見光的響應程度。
1.4 可見光催化活性評價
用250 W金鹵燈作為可見光光源,以羅丹明B作為目標降解物,液面與光源距離約14 cm,進行光催化實驗測試,考察樣品的可見光光催化活性。具體步驟如下:取0.03 g光催化劑分散在100 mL初始濃度為5 mg·L-1的RhB溶液中,并加入0.1 mL濃度為10%的H2O2。所得懸濁液在磁力攪拌作用下暗反應30 min以達到溶解-吸附平衡。然后將懸濁液進行光照,磁力攪拌,使用濾光片濾去除420 nm以下的光確保反應在可見光(λ≥420 nm)下進行。反應時間為50 min,每隔10 min取樣一次,每次取上清液5 mL,微濾膜過濾后,在羅丹明B最大吸收波長554 nm處測其吸光度。
2 結果與討論
2.1 物相分析
圖1是不同pH值下制備的系列樣品X射線衍射(XRD)圖。由圖1可知,pH=1、3、5和7時合成的是Bi2MoO6純相,樣品的所有衍射峰均與斜方相的γ-Bi2MoO6(PDF No.77-1246)的衍射峰吻合,無其他雜質峰出現,說明樣品的純度較高。當pH=1~7時,隨著pH的升高,(020)、(060)和(191)晶面的衍射峰強度逐漸增強,半峰寬逐漸減小,峰逐漸變得尖銳,說明產物的結晶性逐漸提高,晶體生長更加完整;pH=7時,衍射峰的強度達到最大,半峰寬最小,且峰最尖銳,說明產物的結晶性最好。但當pH=9時,樣品的物相轉變為Bi2MoO6和Bi3.64Mo0.36O6.55的混合物;其中Bi2MoO6的衍射峰與標準卡PDF No. 77-1246相一致,Bi3.64Mo0.36O6.55的衍射峰與標準卡PDF No.43-446相一致。當pH值=11時,粉體的物相為純的Bi3.64Mo0.36O6.55(PDF No.43-446)。

圖1 樣品的XRD圖Fig.1XRD patterns of the samples
通過物相表征結果以及參考相關文獻,推測出Bi2MoO6粉體制備過程中主要反應如下[28]:
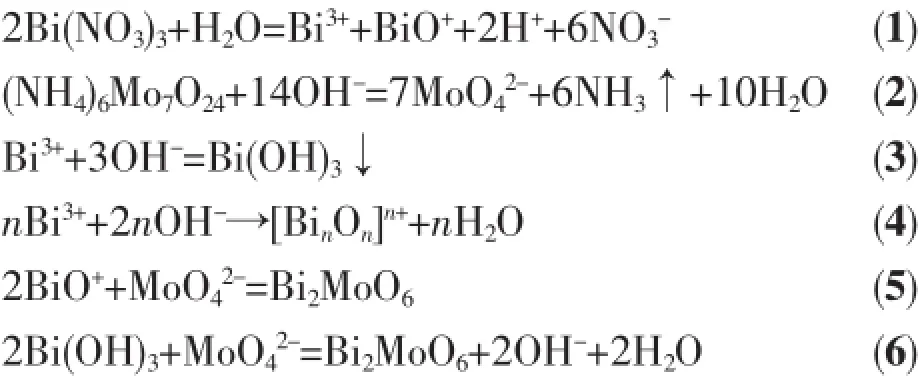
在實驗開始時硝酸鉍溶于稀硝酸,而鉬酸銨溶于氫氧化鈉溶液,混合后形成沉淀。鉍可以形成兩種離子:Bi+和BiO+。鉍氧離子微溶于水,因此鉍以鉍氧鹽的形式沉淀。溶液中鉬以MoO42-的形式存在。當pH=1時,水熱體系中易發生式(5)反應生成Bi2MoO6;當pH=3~7時,溶液中加入NaOH后,部分Bi3+同NaOH反應生成了Bi(OH)3,如式(3)所示,此時易發生式(5)與式(6)的反應,所以Bi2MoO6的(020)、(060)和(191)晶面衍射峰強度明顯增強;當pH=9時,由于堿性很強,Bi3+容易水解并聚合形成高聚體(如式(4)所示),與MoO42-結合,造成反應物中Bi多Mo少,所以生成了Bi3.64Mo0.36O6.55;當pH=11時,堿環境極強,式(4)極易發生,故產物完全生成Bi3.64Mo0.36O6.55。
由于pH=1、3、5、7和9生成的物相主要為Bi2MoO6,而pH=11時生成的物相為Bi3.64Mo0.36O6.55,2種物質的最強峰分別為(131)和(111),所以根據Scherrer公式,pH=1、3、5、7和9時以(131)晶面計算,pH=11時以(111)晶面計算,對應的晶粒的平均粒徑分別為41 nm,46 nm,51 nm,52 nm,51 nm,16 nm。當pH=1~7時,隨著pH的升高,樣品的晶體粒徑逐漸增大。當pH=9和11時,樣品的晶體粒徑開始減小。計算得到樣品的晶胞參數及晶胞體積見表1。其晶胞體積與平均粒徑變化規律一致。
2.2 形貌分析和比表面積分析
圖2是不同pH值下合成系列樣品的SEM圖。從圖2可以看出:pH值是影響樣品形貌的一個重要因素,不同pH值條件下Bi2MoO6晶體的形貌存在很大差異。pH=1時,合成的Bi2MoO6為大量的短棒狀,夾雜著極少的小片;pH=3時,片狀結構尺寸有所增加且數量增多,其中混雜的棒狀結構尺寸增加但數量減少;pH=5時,Bi2MoO6晶體是由大量不規則的小片組成,棒狀結構消失;pH=7時,片狀結構充分發育,Bi2MoO6生長為尺寸較大的不規則薄片。結果表明:pH=1~7,片狀結構隨著pH的升高而逐漸生長,對應于XRD圖中Bi2MoO6晶體的(020)、(060)和(191)晶面的衍射峰強度逐漸增強,表明其有沿(020)、(060)和(191)晶面擇優生長趨勢,從而利于片狀結構的發育。且隨著pH的升高,樣品的顆粒大小逐漸增大;pH=9時,片狀尺寸降低且數量減少,其平均粒徑為51 nm,此外開始出現大量非均勻的細小顆粒,推測可能是由于第二相出現;pH=11時,樣品由許多細小顆粒團聚成的不規則形貌粉體組成。由圖2可以看出,SEM表征的各樣品顆粒大小的變化規律與XRD分析結果的變化規律一致。經孔徑分析儀測定比表面積:pH=1、3、5、7、9和11時樣品的比表面積分別為:8、7、6、4、6和12 m2·g-1。當pH=1~7時,樣品的比表面積逐漸減小,是由于片狀結構尺寸逐漸增加;pH=9和11時,隨著第二相的出現,樣品的比表面積逐漸增大,是因為片狀結構尺寸開始降低、第二相為非均勻的細小顆粒,因此其比表面積增加較多。

表1 標準卡和樣品的點陣參數及晶胞體積Table 1Lattice parameters and crystal cell volume of standard cards and samples
2.3 XPS分析
圖3是pH=7時樣品的X射線光電子能譜圖(XPS)。圖3(a)為全程譜,從圖中可以看出,樣品表面主要存在Bi、O、Mo、C等元素,其中C元素主要由檢測儀器C污染所致。圖3(b)~(d)分別為所測樣品中Bi4f、Mo3d和O1s的XPS高分辨譜。圖3(b)顯示,樣品的Bi4f在Eb=159.0 eV和159.7 eV(Eb為結合能)處出現Bi4f7/2的不對稱峰,分別歸屬于Bi3+和Bi5+物種,在Eb=164.4 eV和165.0 eV處出現Bi4f5/2的不對稱峰,分別對應于Bi3+和Bi5+物種。這表明Bi2MoO6樣品中的Bi物種以Bi3+和Bi5+的形式存在。根據電中性原理,可以推測Bi2MoO6樣品存在氧空位[29]。從圖3(c)可以看出,樣品的Mo3d在Eb=232.4 eV和235.6 eV處出現2個明顯的對稱峰,分別為Mo3d5/2和Mo3d3/2。這意味著Bi2MoO6樣品中的Mo物種以Mo6+的形式存在[30]。由圖3(d)可見,樣品的O1s在Eb=529.8 eV和530.5 eV處出現2個不對稱峰,說明有2個氧物種,分別歸屬于晶格氧(Olatt)和表面吸附氧(Oads)物種[31]。
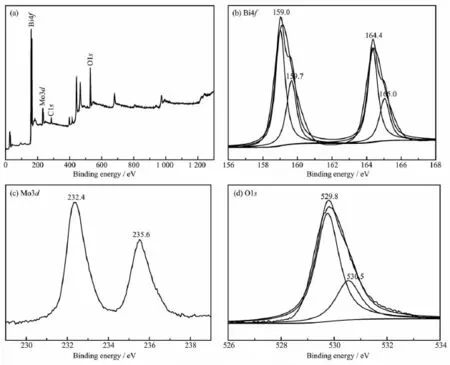
圖3pH=7時樣品的XPS譜圖Fig.3XPS spectra of the sample with the pH value of 7
Bi2MoO6樣品的表面nBi/nMo、nBi5+/nBi3+和nOads/nOlatt分別為2.23,0.53和0.39。樣品的nBi/nMo接近2,表明所制得的Bi2MoO6樣品較均勻。nBi5+/nBi3+和nOads/nOlatt標志著氧空位濃度的高低,氧空位的存在有助于提高樣品的光催化活性。
2.4 光學性質分析
圖4為不同pH值下制備的樣品的紫外-可見漫反射吸收光譜圖。從圖4可以看出,所有樣品在紫外-可見光區均有較強的吸收。陡峭的光譜形狀說明催化劑對可見光的吸收是由于帶隙的過渡而不是雜質所造成的。當pH=1~7時,樣品在480 nm左右出現了強吸收帶。由此可見鉬酸鉍能吸收波長大于420 nm的可見光,顯示其具有較好的可見光催化性能。當pH值升高到9時,由于第二相的生成,樣品的吸收帶邊略有減小,光吸收譜藍移。當pH=11時,樣品完全轉變為第二相,其吸收帶邊約為440 nm,進一步藍移。
半導體的本征吸收系數α是入射光波長和固體能帶間躍遷類型的函數,α與光子能量hν的關系可表示為如下公式:

式中,αhν為光吸收系數,A為常數,hν為光子能量,Eg為能帶隙,n值由躍遷類型決定,直接躍遷型n=1,間接躍遷型n=4,由于鉬酸鉍是一種直接躍遷型半導體,故n=1。根據式(7)做光吸收系數(αhν)2對光子能量(hν)的變化關系曲線(見圖b),并對其做切線,利用直線部分外推至橫坐標交點,即為直接禁帶寬度值。pH=1、3、5、7、9和11時,樣品的直接禁帶值分別為2.7、2.7、2.6、2.6、2.7和2.8 eV。結果表明:pH=1~7時,樣品的禁帶寬度隨著pH的升高而減小。當pH繼續升高時,開始出現第二相,樣品的禁帶寬度開始增大。從對可見光的利用來說,pH=7時制備的樣品比之其他更能有效的吸收入射光的能量,因此也有利于其催化活性的增強。

圖4 樣品紫外-可見漫反射吸收光譜圖Fig.4UV-Vis DRS spectra of the samples
2.5 光催化性能測試

圖5 各樣品對RhB的可見光催化降解率Fig.5Photocatalytic degradation of RhB under visible light irradiation in the presence of the asprepared photocatalysts
圖5 為不同pH值下制備的樣品對羅丹明B的光催化降解圖。由圖5可以看出:無催化劑,直接光照羅丹明B時,其降解率僅為2%,說明羅丹明B在實驗采用的光照下不能自我降解。當僅加入0.1 mL 10%的H2O2,由于H2O2具有氧化性,對羅丹明B有一定的氧化作用,羅丹明B有一定的降解,但由于實驗添加H2O2量小,羅丹明B的降解率很低,僅為4%。當添加實驗制備的光催化劑,對羅丹明B均有一定程度的降解,且隨著制備時pH值的變化,其降解率也發生變化,pH=1、3、5、7、9和11時所制備的樣品,光照50 min對羅丹明B溶液的降解率分別為80%、52%、74%、85%、55%和29%。由此可見,pH=7時制備樣品的光催化性能最好,說明pH值過高或過低都會使光催化活性降低,這一現象可能與樣品的晶面生長、結晶度、形貌結構和禁帶寬度有關。當pH=3~7時,隨著pH的升高,(020)、(060)和(191)晶面的衍射峰強度逐漸增強,半峰寬逐漸減小,衍射峰逐漸尖銳,產物的結晶性逐漸提高,片狀結構生長逐漸成熟,禁帶寬度逐漸減小,同時樣品的光催化降解率隨之逐漸提高;pH=7時,(020)、(060)和(191)晶面的衍射峰的強度達到最大,產物的結晶性最好,片狀結構生長最成熟,禁帶寬度最小,其光催化效果最好;但當pH=9時,第二相開始生成,(020)、(060)和(191)晶面的衍射峰強度減弱,產物的結晶性降低,出現大量非均勻的細小顆粒,禁帶寬度增大,光催化降解率隨之降低;pH=11時樣品完全轉變為第二相,(020)、(060)和(191)晶面消失,樣品由許多細小顆粒團聚成的不規則形貌粉體組成,禁帶寬度最大,此時光催化效果最差。故推測,片狀結構的生長和低禁帶寬度有利于提高樣品的光催化活性。此外,盡管pH=1時制備的樣品的結晶程度最低,禁帶寬度和其他樣品接近,但其比表面積相對其他pH值制備的純相鉬酸鉍樣品為最大,因此推測它相對較好的催化活性可能與其比表面積有關,因為光催化反應發生在催化劑的表面,適當增大比表面積能提高對羅丹明B染料的初始吸附,從而加速光催化反應,提高其催化性能[32]。
同時探討了不同pH值下制備的樣品對羅丹明B的可見光催化降解反應動力學。假設羅丹明B的降解為一級反應,則其速率方程可以表示為:-ln(C/ C0)=kt,其中C0為RhB的初始濃度,C為任意時刻濃度。對圖5的數據用-ln(C/C0)~t的關系曲線進行擬合(見圖6)。由圖6可知,所擬合的-ln(C/C0)~t的關系曲線為直線,其線性相關系數R均大于0.98,說明羅丹明B的光催化降解遵循一級反應動力學方程。一級光催化降解反應動力學常數與其光催化活性呈正相關性。故在確定的實驗條件下,樣品的光催化活性為:pH=7>pH=1>pH=5>pH=9>pH=3>pH=11。

圖6 各樣品的-ln(C/C0)與可見光照射時間t的關系曲線Fig.6-ln(C/C0)as a function of irradiation time on the samples under visible light
3 結論
以(NH4)6Mo7O24·4H2O和Bi(NO3)3·5H2O為原料,采用普通水熱法在160℃反應16 h,制備了Bi2MoO6系列樣品,并研究了pH值對制備鉬酸鉍的影響。pH值低于7制備的樣品均為純γ-Bi2MoO6相,pH值為9或11時,樣品中出現Bi3.64Mo0.36O6.55相。隨著pH值的變化其形貌也發生變化,依次為棒狀、片狀、無規則顆粒;光吸收性能隨著pH值增高,逐漸少量紅移,但當pH值為9或11時,由于雜質相的出現,則發生藍移(圖4b)。pH=7時制備的樣品光催化性能最好,在可見光下50 min內對RhB的降解率為85%。
[1]Adhikari R,Gyawali G,Cho S H,et al.J.Solid State Chem., 2014,209:74-81
[2]Sun Y Y,Wang W Z,Sun S M,et al.Mater.Res.Bull., 2014,52:50-55
[3]Zou J P,Ma J,Huang Q,et al.Appl.Catal.B:Environ., 2014,156-157:447-455
[4]Zhou T F,Hu J C,Li J L.Appl.Catal.B:Environ.,2011, 110:221-230
[5]Adhikari R,Joshi B,Narro-Garcia R,et al.J.Lumin.,2014, 145:866-871
[6]Xu Y S,Zhang W D.Appl.Catal.B:Environ.,2013,140-141:306-316
[7]Zhang P,Shao C L,Zhang M Y,et al.J.Hazard.Mater., 2012,217-218:422-428
[8]Park J H,Noh H,Park J W,et al.Appl.Catal.A:Gen., 2012,431-432:137-143
[9]Masteri-Farahani M,Hosseini H S.Powder Technol.,2012, 228:228-230
[10]Guan M Y,He X H,Shang T M,et al.Prog.Nat.Sci.: Mater.Int.,2012,22(4):334-340
[11]Wang P F,Ao Y H,Wang C,et al.Carbon,2012,50:5256-5264
[12]Gruar R,Tighe C J,Reilly L M,et al.Solid State Sci., 2010,12:1683-1686
[13]Ono T,Utsumi K,Tsukamoto,et al.J.Mol.Catal.A:Chem., 2010,318:94-100
[14]Li H H,Li K W,Wang H.Mater.Chem.Phys.,2009,116: 134-142
[15]Zhao X,Xu T G,Yao W Q,et al.Thin Solid Films,2009, 517:5813-5818
[16]LI Hong-Hua(李紅花),LI Kun-Wei(李坤威),WANG Hao (汪浩),et al.Chinese J.Inorg.Chem.(無機化學學報),2009, 25(3):512-516
[17]Cruz A M L,Alfaro S O.Solid State Sci.,2009,11:829-835
[18]Mikhailovskaya Z A,Buyanova E S,Petrova S A,et al.J. Solid State Chem.,2013,204:9-15
[19]Scott P R,Crow J A,Maczka M,et al.J.Solid State Chem., 2012,194:15-18
[20]Zheng K B,Zhou Y,Gu L L,et al.Sens.Actuators B:Chem., 2010,148:240-246
[21]Xu C,Zou D B,Wang L H,et al.Ceram.Int.,2009,35: 2099-2102
[22]Zheng Y,Duan F,Wu J,et al.J.Mol.Catal.A:Chem., 2009,303:9-14
[23]Miao Y C,Pan G F,Huo Y N,et al.Dyes Pigm.,2013,99: 382-389
[24]Zhang T,Huang J F,Zhou S,et al.Ceram.Int.,2013,39: 7391-7394
[25]CHEN Yuan(陳淵),YANG Jia-Tian(楊家添),XIE Zu-Fang(謝祖芳),et al.J.Chinese Ceram.Soc.(硅酸鹽學報),2014, 42(1):80-88
[26]Liu T X,Li B X,Hao Y G,et al.Chem.Eng.J.,2014,244: 382-390
[27]Sun Y Y,Wang W Z,Zhang L,et al.Mater.Res.Bull., 2013,48:4357-4361
[28]Zou J P,Luo S L,Zhang L Z,et al.Appl.Catal.B:Environ., 2013,140-141:608-618
[29]Zhao Z X,Dai H X,Deng J G,et al.Chin.J.Catal.,2013, 34:1617-1626
[30]Lv W Z,Huang D Z,Chen Y M,et al.Ceram.Int.,2014,40: 12661-12668
[31]Xie F X,Mao X M,Fan C M,et al.Mater.Sci.Semicond. Process.,2014,27:380-389
[32]Ma Y F,Jiang H Q,Zhang X C,et al.Cream.Int.,2014,40: 16485-16493
Effect of pH value on Morphology and Visible-light Photocatalytic Performance of Bi2MoO6Crystallites
WANG Min*YANG Chang-XiuZHENG Hao-Yan
LANG Hong-XiaBAO QiSONG Wan-YiSONG En-Jun
(College of Environmental and Chemical Engineering,Shenyang Ligong University,Shenyang 110159,China)
The Bi2MoO6crystallites were synthesized by a simple hydrothermal method using(NH4)6Mo7O24·4H2O and Bi(NO3)3·5H2O as source materials and the effect of the pH value was studied on preparation of Bi2MoO6crystallites.The samples were characterized by X-ray diffraction(XRD),scanning electron microscope(SEM),low temperature nitrogen adsorption-desorption,X-ray photoelectron spectroscopy(XPS)and UV-Vis diffuse reflectance spectroscopy(UV-Vis DRS).The results show that the pH value has great influence on the phase composition,morphology and photocatalytic performance of Bi2MoO6crystallites.Pure Bi2MoO6is obtained with pH values of 1 to 7 and Bi3.64Mo0.36O6.55is produced when the pH value is 9 or 11.The morphology of Bi2MoO6can be controlled from nanorods,nanosheets to nanoparticles by adjusting the pH value.The photocatalytic activity under visible light(λ≥420 nm)and the effect of the pH value on the activity were evaluated using photocatalytic degradation of the Rhodamine B(RhB).The results indicate that the highest photocatalytic activity is obtained with the pH value of 7.Under visible light irradiation,the degradation rate of 5 mg·L-1RhB within 50 min is 85%.
bismuth molybdate crystallites;simple hydrothermal;photocatalysis;pH value;Rhodam B
O643
A
1001-4861(2015)02-0309-08
10.11862/CJIC.2015.055
2014-09-30。收修改稿日期:2014-11-03。
國家自然科學基金青年基金(No.21207093),遼寧省高等學校優秀人才支持計劃(No.LJQ2014023),沈陽理工大學創新創業訓練項目(No.14hh014)資助。
*通訊聯系人。E-mail:minwang62@msn.com,Tel:13352451281

