比色生物傳感器檢測Cd2+*
張婷婷,張瑞英,陳 鎮,羅義庭,熊興良
(重慶醫科大學 生物醫學工程研究室,重慶400016)
0 引 言
鎘離子(Cd2+)是一種廣泛存在于空氣、水和食物中的對人體健康危害極大的重金屬污染物。Cd 中毒能導致腎功能衰退、生殖障礙、Itai-Itai 病、骨質疏松、呼吸系統疾病等。長期、低劑量Cd2+暴露能顯著增加患癌的危險[1],因此,國際抗癌聯盟(IARC)將其確定為Ⅰ類致癌物。傳統的重金屬檢測方法主要有原子吸收法(AAS)、陽極溶出伏安法(ASV)、電感耦合等離子體發射光譜法(ICP-AES)等[2]。這些方法靈敏度高、特異性強,但存在樣品前處理復雜、操作耗時、儀器昂貴、需要專業人員操作等缺陷,難以滿足快速、實時的檢測[3]。美國環境保護署(EPA)規定飲用水中Cd2+含量不超過10×10-9,但基于應急檢測的某些特殊水質標準(如軍隊戰時飲用水衛生標準)將上述Cd 含量的限值放寬10 倍甚至100 倍以上[4]。因此,開發一種快速、簡便、高靈敏和高選擇性的Cd2+檢測技術具有重要的意義。
納米金(AuNPs)是尺寸在1~100 nm 的金顆粒,具有局部表面等離子共振性質,顆粒聚集能使溶液的顏色發生裸眼可視的變化[5]。Wang A J 等人[6]、Xue Y 等人[7]、Zhang M 等人[8]分別利用小分子、縮氨酸功能化制備AuNPs 探針檢測Cd2+,選擇性不好。有報道利用DNA 修飾的AuNPs比色檢測Hg2+[9,10],Pb2+[11,12]等重金屬離子,此方法選擇性和靈敏度更好,但對Cd2+的檢測尚未見報道。本文提出了一種新型的基于AuNPs 的比色傳感器檢測Cd2+。
1 實驗部分
1.1 試劑與儀器
AuNPs 選 購 自 Sigma-Aldrich 公 司;Cd(NO3)2,Pb(NO3)2,Cu(NO3)2及其它金屬離子的固體樣品購自上海強順化學試劑有限公司;ssDNA(DNA1:5’-GGGGCAGTGC-CTCACAACCT-3’DNA2 :5’-GAAAAGTTTTGCTAACTACGA-3’DNA3:5’-TTTTTTTTTTAAAAACCCCC-3’)購自寶生物工程(大連)有限公司;其余試劑均為分析純,實驗用水為超純水,電阻大于或等于18.3 MΩ·cm。
UV-2550 UV-Vis 紫外—可見分光光度計(日本島津公司);HT7700 型透射電子顯微鏡(日本日立公司);水浴鍋(上海普渡生化科技有限公司);佳能A640 數碼相機;優普超純水制造系統(西安優普儀器設備有限公司)。
1.2 檢測方法
實驗選用的DNA1 能與Cd2+發生特異性結合[13]。參照Li D 等人[14]提出的檢測Hg2+的方法進行改進,將2.1 μmol/L DNA 與0.5 μmol/L Cd(NO3)2混合,85 ℃水浴加熱5 min 以防止DNA 形成雙鏈并加速DNA 與Cd2+的反應,冷卻至室溫后加入6 nmol/L AuNPs,5 min 后再加入0.2 mol/L NaCl,20 min 后觀察溶液的顏色變化,實驗溶劑為pH=7.4 的Tris-HCl。有Cd2+存在時,DNA1 與Cd2+特異性結合,AuNPs 暴露在鹽溶液中發生聚集;沒有Cd2+存在時,DNA 通過Au-N 鍵與AuNPs 發生非共價鍵吸附[15],阻止AuNPs 的聚集(圖1)。
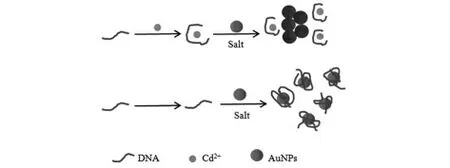
圖1 Cd2+-ssDNA 復合物介導AuNPs 聚集Fig 1 Cd2+-ssDNA compound mediated AuNPs gathered
2 結果與討論
2.1 NaCl 濃度的影響
比色檢測法的靈敏度與AuNPs 抗聚集能力有關,在高離子強度下,AuNPs 之間的靜電排斥較弱,金屬離子更容易介導AuNPs 聚集[16]。NaCl 濃度是使AuNPs 不穩定的顯著因素,使其濃度最優化,能得到更低的檢測限。圖2 插圖顯示了在DNA 與AuNPs 的混合溶液中加入不同濃度的NaCl(0,0.1,0.2,0.3,0.4,0.5,0.6,0.7 mol/L)80 min 后的顏色變化,明顯看出0.4 mol/L 及以上濃度的NaCl 使AuNPs 聚集,溶液變紫。為使未添加Cd2+時溶液顏色穩定,本文研究NaCl 濃度為0,0.05,0.10,0.15,0.20,0.25,0.30 mol/L時,DNA-AuNPs 溶液對1 μmol/L Cd2+的反應,記錄紫外—可見吸收光譜如圖2(a)所示,波峰隨著NaCl 濃度的升高而右移,在620 nm 左右出現新的吸收峰。利用A620/A520的比值來表示AuNPs 的聚集程度,相同濃度Cd2+條件下,A620/A520與NaCl 濃度的關系如圖2(b)所示,隨著NaCl 濃度升高,AuNPs 的聚集程度增加,直到0.2 mol/L 之后趨于穩定,考慮到NaCl 濃度過高會影響溶液的背景顏色,本實驗選擇0.2 mol/L 為NaCl 的最佳濃度。
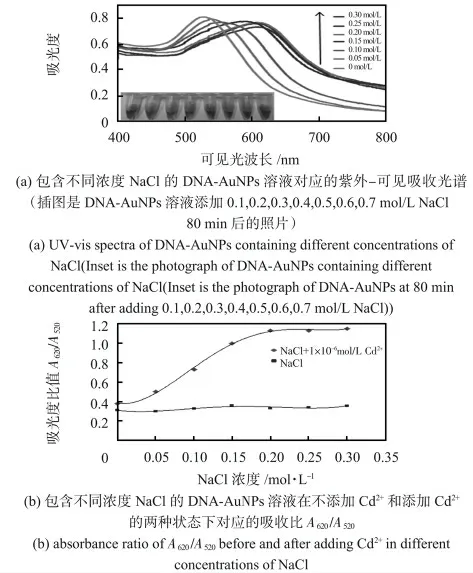
圖2 NaCl 濃度的影響Fig 2 Influence of different concentrations of NaCl
2.2 靈敏度
在最佳實驗條件下(2.1 μmol/L DNA1,0.2 mol/L NaCl,pH=7.4 Tris-HCl)添加0~40 μmol/L 的Cd2+,分別培養20 min 后的紫外—可見吸收光譜記錄如圖3,隨著Cd2+濃度的升高,520 nm 左右的吸收峰逐漸減小,在640 nm 左右出現了新的吸收峰,且明顯的紅移。溶液的顏色由紅變藍紫,如圖3 插圖所示,Cd2+濃度為0.5 μmol/L 時開始觀察到肉眼可見的由紅到紫的顏色變化,證明了AuNPs 在Cd2+-DNA 復合物的介導下發生了聚集。
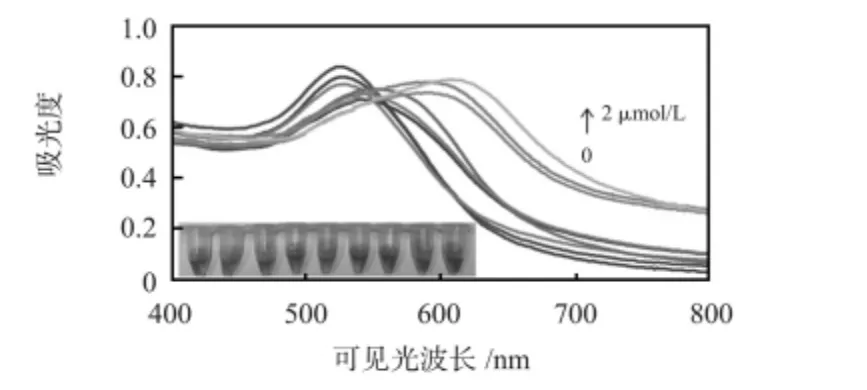
圖3 添加不同濃度Cd2+(0,0.25,0.5,0.75,1,1.25,1.5,1.75,2 μmol/L)的DNA-AuNPs 溶液紫外—可見吸收光譜和照片Fig 3 UV-vis spectra and photograph of DNA-AuNPs in the presence of different of Cd2+(0,0.25,0.5,0.75,1,1.25,1.5,1.75,2 μmol/L)
2.3 選擇性
用相同濃度的其它離子(K+,Ca2+,Co2+,Al3+,Zn2+,Cr3+,Mn2+,Cu2+,Pb2+)代替2 μmol/L Cd2+在最佳條件下實驗,顏色變化如圖4 插圖,Cd2+溶液顏色完全變紫,Cu2+,Pb2+有輕微顏色干擾,吸光度比A640/A520看出只有添加Cd2+的溶液中AuNPs 發生聚集,Cu2+,Pb2+干擾輕微。

圖4 1 μmol/L Cd2+以及其它金屬分別得到AuNPs 的吸光度比A640/A520(培養時間20 min)Fig 4 The ratio of A640/A520 of AuNPs in the presence of 1 μmol/L Cd2+or other metal ions(incubation time is 20 min)
3 結 論
本文建立了一種新的基于Cd2+-DNA 復合物介導AuNPs 聚集檢測Cd2+的比色生物傳感器。該傳感器利用AuNPs 局部表面等離子共振性質將化學能轉換為裸眼可見的光信號,并放大,最佳實驗條件下檢測限可低至0.5 μmol/L,且對與Cd2+性質極其相似的Zn2+不響應,Cu2+,Pb2+有輕微干擾。該傳感器操作簡單、成本低,且十分新穎,實際應用潛力巨大。
[1] Sinicropi M S,Amantea D,Caruso A,et al.Chemical and biological properties of toxic metals and use of chelating agents for the pharmacological treatment of metal poisoning[J].Arch Toxicol,2010,84(7):501-520.
[2] 江天久,牛 濤.重金屬污染物的免疫學檢測技術研究進展[J].生態環境,2005,14(4):590-595.
[3] 寇冬梅,張進忠,楊 兵,等.檢測重金屬離子的酶膜生物傳感器的構建[J].環境科學與技術,2008,31(9):24-28.
[4] 戚紅卷,陳雯雯,岳麗君,等.納米金比色法快速檢測水中重金屬的研究進展[J].環境化學,2013,32(1):21-28.
[5] Saha K,Agasti S S,Kim C,et al.Gold nanoparticles in chemical and biological sensing[J].Chem Rev,2012,112(5):2739-2779.
[6] Wang A J,Guo H,Zhang M,et al.Sensitive and selective colorimetric detection of cadmium(II)using gold nanoparticles modified with 4-amino-3-hydrazino-5-mercapto-1,2,4-triazole[J].Microchimica Acta,2013,180(11/12):1051-1057.
[7] Xue Y,Zhao H,Wu Z,et al.Colorimetric detection of Cd2+using gold nanoparticles cofunctionalized with 6-mercaptonicotinic acid and L-Cysteine[J].Analyst,2011,136(18):3725-3730.
[8] Zhang M,Liu Y Q,Ye B C.Colorimetric assay for parallel detection of Cd2+,Ni2+and Co2+using peptide-modified gold nanoparticles[J].Analyst,2012,137(3):601-607.
[9] Liu C W,Hsieh Y T,Huang C C,et al.Detection of mercury(II)based on Hg2+-DNA complexes inducing the aggregation of gold nanoparticles[J].Chem Commun,2008,21(19):2242-2244.
[10]Fang C,Wang C G,Wang T T,et al.L-cysteine functionalized gold nanoparticles for the colorimetric detection of Hg2+induced by ultraviolet light[J].Nanotechnology,2010,21(2):1-6.
[11]Liu J,Lu Y.A colorimetric lead biosensor using DNAzyme-directed assembly of gold nanoparticles[J].J Am Chem Soc,2003,125(22):6642-6643.
[12]Ding N,Cao Q,Zhao H,et al.Colorimetric assay for determination of lead(II)based on its incorporation into gold nanoparticles during their synthesis[J].Sensor,2010,10(12):11144 -11155.
[13]Wong E L,Chow E,Gooding J J.The electrochemical detection of cadmium using surface-immobilized DNA[J].Electrochemistry Communications,2007,9(4):845-849.
[14]Li D,Wieckowska A,Willner I.Optical analysis of Hg2+ions by oligonucleotide-gold-nanoparticle hybrids and DNA-based machines[J].Angew Chem,2008,120(21):3991-3995.
[15]Zhang X,Servos M R,Liu J W.Surface science of DNA adsorption onto citrate-capped gold nanoparticles[J].Langmuir,2012,28(8):3896-3902.
[16]Lin C Y,Yu C J,Lin Y H,et al.Colorimetric sensing of silver(I)and mercury(II)ions based on an assembly of Tween 20-stabilized gold nanoparticles[J].Anal Chem,2010,82(16):6830-6837.

