黑米花青素體內抗氧化研究
石 娟,張曼莉,孫漢巨,陳曉燕,婁秋燕,劉 寧,王 霄
(合肥工業大學生物與食品工程學院,安徽合肥 230009)
?
黑米花青素體內抗氧化研究
石 娟,張曼莉,孫漢巨*,陳曉燕,婁秋燕,劉 寧,王 霄
(合肥工業大學生物與食品工程學院,安徽合肥 230009)
本文研究了黑米花青素對小白鼠的抗氧化及免疫調節作用。以生理鹽水為載體,維生素C作為陽性對照,分別采用高、中、低三種劑量的黑米花青素粗提物及其純化物,灌胃喂養小白鼠30d后,測定小白鼠的脾和胸腺指數,血清、肝臟、心臟和腎臟中總抗氧化力(T-AOC)、超氧化物歧化酶(SOD)和谷胱甘肽過氧化酶(GSH-Px)的活力,丙二醛(MDA)和羥自由基含量。研究結果表明:該花青素能增加小白鼠的脾和胸腺指數,顯著提高其體內T-AOC水平和SOD、GSH-Px的活性,降低MDA和羥自由基的含量。因此,黑米花青素具有提高小白鼠的體內抗氧化及免疫調節作用。
黑米,花青素,小白鼠,抗氧化
黑米是一種特殊的稻種,屬于糯米類,俗稱“藥米”、“長壽米”、“神仙米”及“補血米”[1]。在我國廣西、廣東、云南等地較為集中,近年來其種植范圍已擴展到陜、浙、蘇、川、鄂、湘等省。黑米中含有豐富的營養及功效成分,含有人體所必需的氨基酸、不飽和脂肪酸、蛋白質、VB1、VB2及VC,以及鐵、鋅、銅、鈣等礦物營養元素[2]。值得一提的是,其含有大量的花青素[3]。古農醫書記載:黑米有“滋陰補腎,健身暖胃,明目活血,清肝潤腸,滑濕益精,補肺緩筋”功效。
花青素(Anthocyanin),又叫花色素,是自然界中廣泛存在于植物中的一類水溶性天然色素,屬于酚類化合物中的類黃酮類物質[4]。其基本結構中含兩個苯環,形成典型的C6-C3-C6共軛體系,是2-苯基苯并吡喃的衍生物[5]。現代研究表明,花青素具有抗氧化,清除自由基,改善貧血,降低血脂和預防動脈粥樣硬化,保護血管內皮以及抗疲勞、抗缺氧、抗癌及抗腫瘤等作用。其對眼疾、血液循環失調、冠心病、發炎性等疾病有一定的療效[6]。
目前,國內外關于黑米花青素的抗氧化及免疫特性方面的報道較少。本研究擬以黑米為原料,采用水浸提、膜分離及大孔樹脂等提取和純化方法得到花青素[7]。以小白鼠為實驗對象,考察該花青素對動物的體內抗氧化及免疫調節作用的影響,為其產業化開發提供技術支撐。
1 材料與方法
1.1 材料與儀器
黑米 安徽省合肥中科小陶食品有限公司提供;黑米花青素 制備純化前的粗花青素粉和純化后的純花青素粉(記為粗花青素和粗花青素純化物),提取及純化方法參照石娟[7]的方法;小白鼠,昆明種,6~8周齡,體重20±2g 安徽醫科大學實驗動物飼養中心購買,實驗動物生產許可證號:SCXK(皖)2011-002,實驗動物使用許可證號:SYXK(皖)2011-002;T-AOC、SOD、MDA、GSH-Px以及羥自由基試劑盒 南京建成生物工程研究所;考馬斯亮藍G250 中國醫藥上海試劑公司;牛血清蛋白 廈門星隆達公司。
JM型膠體磨 上海愛思杰制泵有限公司;600×16mm層析柱 北京瑞達恒輝科技發展有限公司;JY601型電子天平 上海民橋精密科學儀器有限公司;TDL-50B高速離心機 上海儀器廠;722E可見分光光度計 上海光譜儀器有限公司;HH-2數顯恒溫水浴鍋 江蘇金壇市杰瑞爾電器有限公司;PHS-2C精密pH計 上海精密科學儀器有限公司;KRT-NT-2-1多功能膜設備 合肥科瑞特環保工程有限公司;LGJ-12冷凍干燥機 北京松源華興科技發展有限公司。
1.2 實驗方法
1.2.1 水溶性蛋白測定 考馬斯亮藍法[8]。
1.2.2 花青素測定 分光光度法[9]。
1.2.3 實驗小白鼠的分組和飼養方式 小白鼠在22℃和50%相對濕度環境下飼養,每天保持12h光照,12h黑夜,自由飲食和飲水[10]。隨機分成10組,每組10只。黑米花青素粗品、粗品純化物和維生素C分別溶解在生理鹽水中,灌胃生理鹽水作為空白對照組,維生素C作為陽性對照組[11]。根據沙棘原花青素膠囊推薦人體攝入量0.043g/kg·BW[12],設置低、中、高劑量組分別為50、100、200mg/kg·BW,采用灌胃的方式,喂養相應濃度的維生素C、花青素粗品和純化物各三組,對照組則灌胃同樣劑量的生理鹽水,連續30d。
1.2.4 實驗血清和組織的制備 在小白鼠末次灌胃后,禁食一夜。然后,眼眶取血,收集血液,離心,得上清液即為血清[13]。收集脾臟、胸腺、腎臟、肝臟和心臟。其中,脾和胸腺分別稱重,腎臟、肝臟和心臟組織分別與冷卻的0.9%氯化鈉溶液,按1∶9的比例(m/v),加入勻漿器中,制成勻漿,在4000r/min及4℃下,離心10min,收集上清液備用。
1.2.5 脾指數和胸腺指數的測定

(1)

(2)
由于VC是作為體內抗氧化實驗的陽性對照,所以胸、脾臟指數實驗就沒有以VC另作對照。
1.2.6 小白鼠體內抗氧化指標的測定 T-AOC、SOD、GSH-Px、MDA及羥自由基測定的具體操作見試劑盒說明。
2 結果與分析
2.1 蛋白質的標準曲線
水溶性蛋白測定:采用考馬斯亮藍法[8]。取0.1mL小鼠血清,加入到5mL考馬斯亮藍溶液中,混勻,靜置3min,在595nm波長下測其吸光度:根據蛋白質標準曲線回歸方程A=6.54C+0.0267(R2=0.9932)計算水溶性蛋白的含量。蛋白質的標準曲線如圖1所示。

圖1 蛋白質標準曲線Fig.1 Standard curve of protein
2.2 花青素含量測定結果
以矢車菊素-3-葡糖苷為標品,測得粗花青素中花青素含量為367.9mg/g,粗花青素純化物中花青素的含量為638.7mg/g。
2.3 花青素對小白鼠胸腺和脾臟指數的影響
由表1可見,與對照組相比,粗花青素及其純化物使胸腺和脾(除粗花青素低劑量組)指數均有提高。其中,中、高劑量組與對照組相比,脾指數都有顯著差異,但中、高劑量組間沒有顯著性差異。胸腺指數結果中,粗花青素高劑量組及純化物各組與對照組相比有顯著差異,但粗花青素高劑量組及純化物之間沒有顯著性差異。研究表明,該花青素使小白鼠的胸腺和脾臟指數增加,具有免疫調節功能。
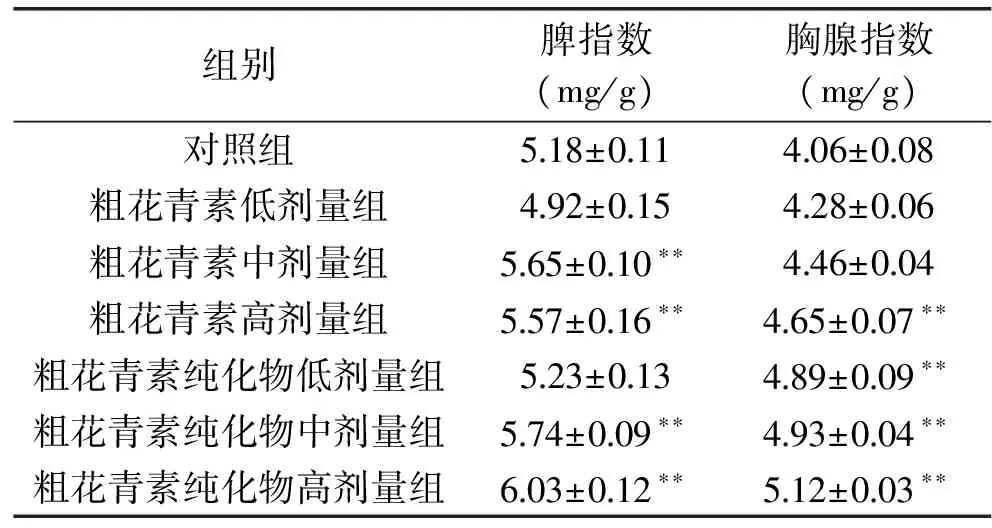
表1 花青素對胸腺和脾臟指數的影響Table 1 Effect of anthocyanins on thymic and splenetic indexes
注:*與對照組比較,p<0.05;**與對照組比較,p<0.01,圖2~圖6同。
2.4 花青素對T-AOC的影響

表2 花青素對總抗氧化力的影響Table 2 Effect of anthocyanins on total antioxidant capacity(T-AOC)
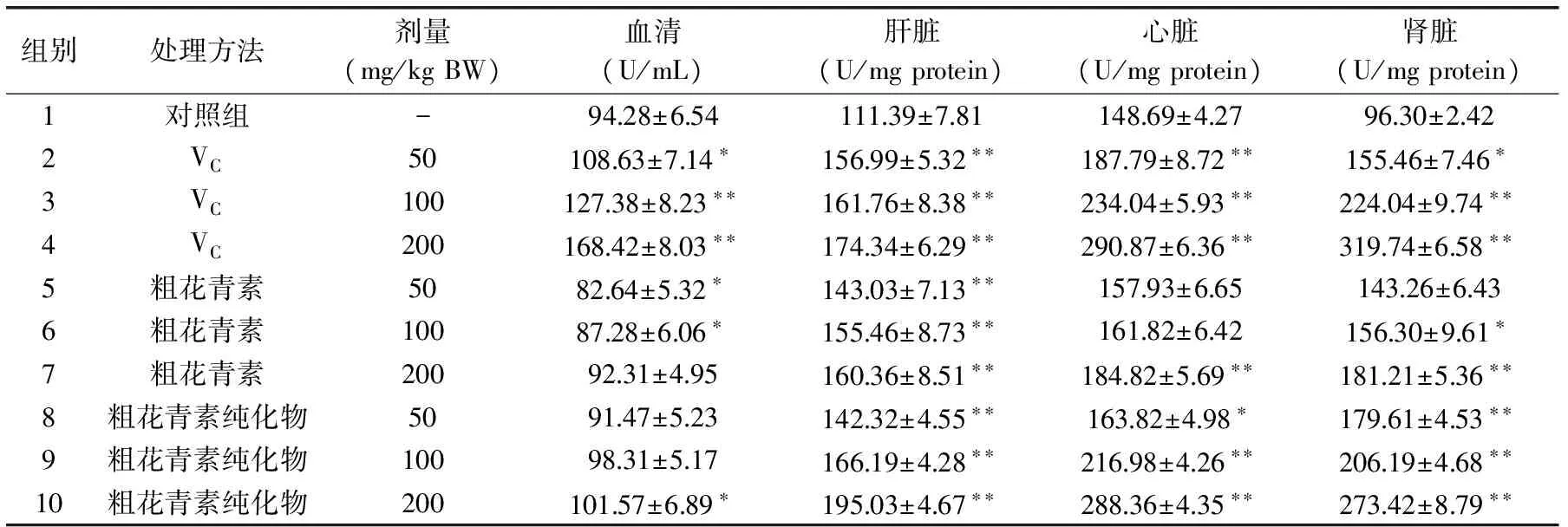
表3 花青素對超氧化物歧化酶活性的影響Table 3 Effect of anthocyanins on SOD activity
如表2所示,與對照組相比,灌胃粗花青素及其純化物組中,小白鼠血清、肝臟、心臟和腎臟中T-AOC水平大都得到增加。特別是粗花青素純化物高劑量組中T-AOC水平增加最為顯著。另外,與同等劑量的粗花青素組相比,粗花青素純化物組中T-AOC水平提高更為顯著。
花青素能夠提高非酶體系的T-AOC原因可能為:第一,其直接與活性氧類物質和自由基發生反應來保護生物體免受氧化損害;第二,花青素是多酚類物質,具有多個羥基,其三環形成的共軛體系屬于多共軛芳香體系,有很高的生物活性[15]。由于產生共軛效應,酚羥基上的氫原子活性明顯提高,尤其是鄰位-OH脫氫產生自由基后,使得分子內氫鍵較穩定,抗氧化活性提高,除此之外,鄰位羥基的自由基通過共振作用形成鄰苯醌,有利于酚式向醌式轉化,形成酚醌平衡,成醌后的C=O和鄰位的羥基形成分子內的氫鍵更加穩定。因此,機體的T-AOC更高[16]。
2.5 花青素對SOD活性的影響
表3反映了VC、粗花青素及其純化物對小白鼠血清、肝臟、心臟和腎臟中SOD的影響。很顯然,隨著花青素劑量的增加,該酶的活性逐漸增加。與VC組相比,花青素也能較顯著地提高該酶的活性。另外,與同等劑量的粗花青素組相比,粗花青素純化物組能更顯著地提高SOD的活性。研究結果表明該花青素具有較好的提高SOD活性的效果。
2.6 花青素對GSH-Px活性的影響
黑米花青素對GSH-Px活性的影響如表4所示。隨著劑量的增大,血清、肝臟、心臟和腎臟中GSH-Px的活力逐漸增高。與對照組相比,粗花青素純化物組中GSH-Px的活力增加顯著。并且,GSH-Px的活力與花青素的劑量成正相關性。很顯然,花青素能明顯地促進小白鼠中GSH-Px的活性。

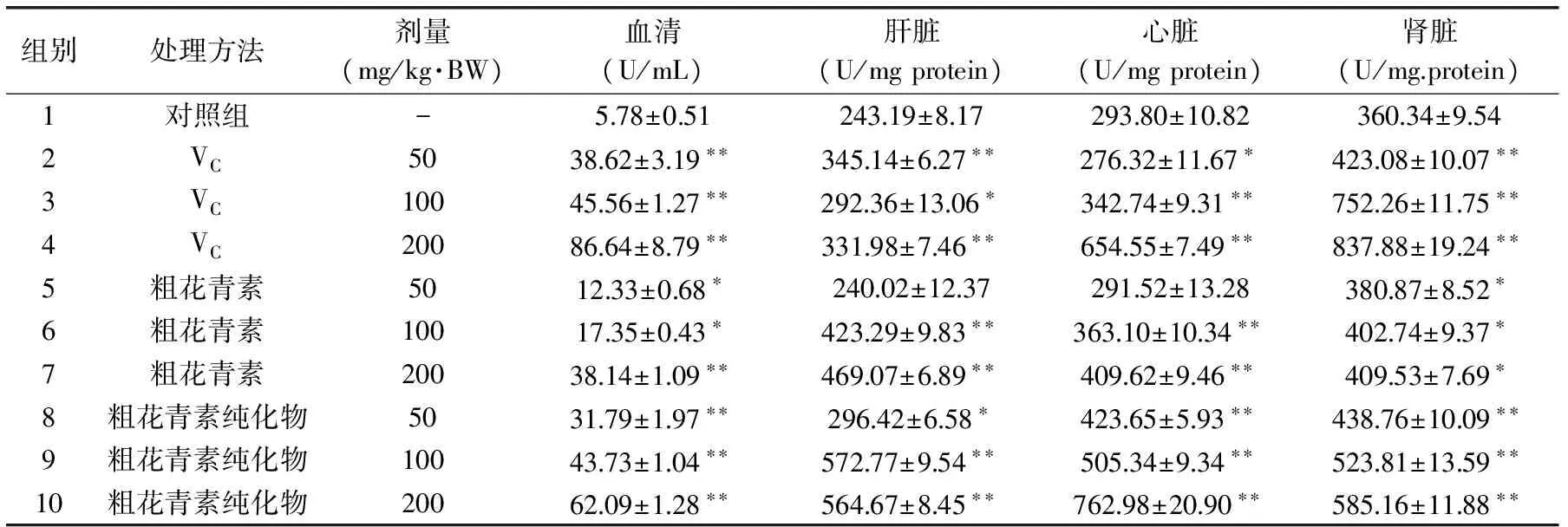
表4 花青素對谷胱甘肽過氧化酶活性的影響Table 4 Effect of anthocyanins on GSH-Px activity
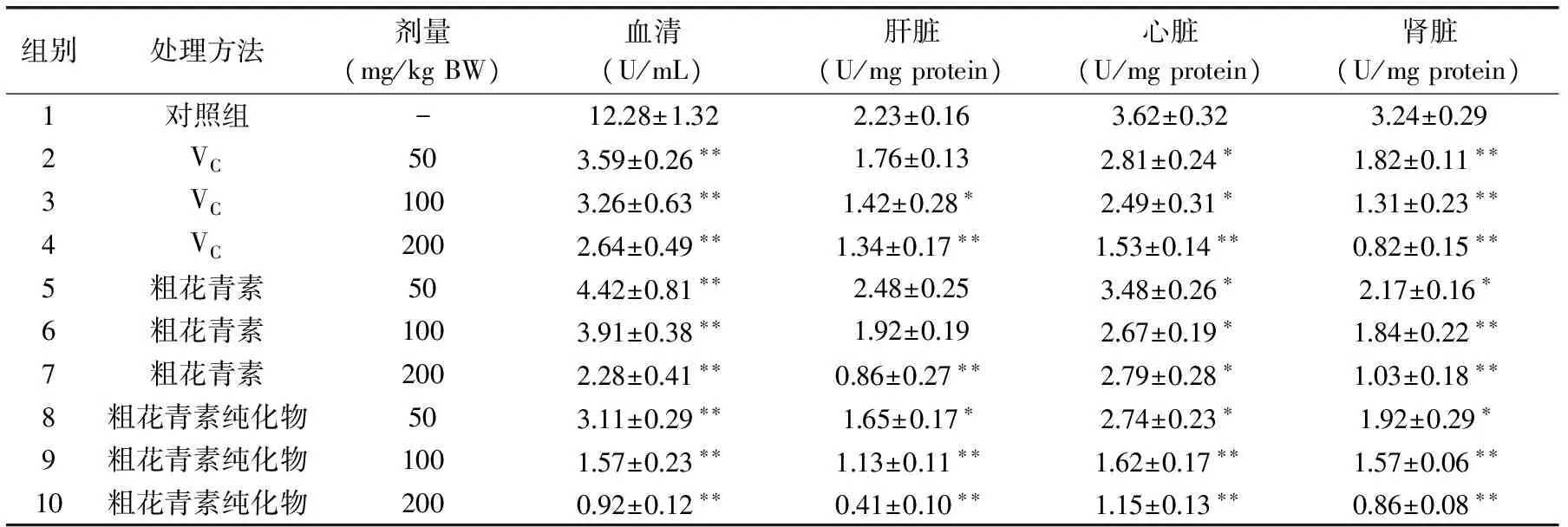
表5 花青素對脂質氧化的抑制作用Table 5 Effect of anthocyanins on lipid peroxidation

表6 花青素對羥自由基的抑制作用Table 6 Effect of anthocyanins on hydroxy radical
2.7 花青素對脂質氧化的抑制作用
過氧化脂質降解產物中的丙二醛(MDA)可與硫代巴比妥酸(TBA)縮合,形成紅色產物,在532nm處有最大吸收峰。花青素對小白鼠體內脂質氧化(以MDA含量計)的影響如表5所示。顯而易見,VC組、粗花青素及其純化物組的3個劑量組中,小白鼠血清、肝臟、心臟和腎臟中MDA的含量均低于對照組。另外,與VC組和粗花青素組相比,粗花青素純化物組中血清MDA的含量更低,粗花青素純化物組中肝臟和心臟中MDA含量的降低也有同樣的效果。
其可能原因可分析如下為:第一,花青素能夠直接與酶和非酶系統產生的氧自由基發生反應,避免其攻擊生物膜中的多不飽和脂肪酸(PUFA)而產生脂質過氧化反應,從而形成脂質過氧化物;第二,從結構上分析,張名位等[16-17]從黑米中分離純化并鑒定了4種黑米花色苷類化合物,其中矢車菊素-3-葡萄糖苷的含量最高。王金亭等[18]在這4種花色苷化合物的基礎上,進一步證明了矢車菊素-3-葡萄糖苷的抗氧化活性最高,發揮主要的抗氧化作用。矢車菊素-3-葡萄糖苷是多酚類物質,有鄰位羥基且羥基數目較多,形成酚醌平衡的穩定特性,使其生物活性提高;第三,花青素由于產生共軛效應,氧原子上的不成對電子不固定于氧,而是靠近苯環,從而削弱了氫氧鍵,使酚羥基上氫原子的活性提高,易于脫氫而成為氫供體,氫供體可以和脂類化合物自由基發生反應,轉變成酚自由基,酚自由基氧上的不成對的電子分散于整個共軛體系中非常穩定,從而降低了自動氧化鏈反應的傳遞速度,抑制脂類的進一步氧化[19]。由于花青素的喂養,小白鼠體內血清、肝臟、心臟和腎臟中MDA的含量顯著降低,小白鼠較好地免受氧化損害。因此,花青素對小白鼠體內脂質的氧化有一定的抑制作用。
2.8 花青素對羥自由基的抑制作用
黑米花青素對羥自由基的抑制作用如表6所示。隨著花青素劑量的增加,抑制羥自由基的能力基本上呈逐漸提高趨勢。與對照組相比,粗花青素中等劑量和純化物組能顯著地抑制羥自由基產生;三種藥物的高劑量組相比,對心臟中羥自由基抑制效果由大到小是:粗花青素純化物>VC>粗花青素。花青素有較強的抑制羥自由基能力主要原因可能是,其C6-C3-C6三環共軛體系使得酚羥基上的氫原子更為活躍,有利于脫氫形成氫供體,當機體在氧化還原反應中生成過量的羥自由基時,花青素提供氫能與之相結合,從而保護機體免遭羥自由基的損傷。
3 結論
用黑米花青素連續灌胃30d后,小白鼠的脾和胸腺指數都得到增加,肝臟、腎臟、心臟和血清中T-AOC、SOD和GSH-Px活性顯著地增加,羥自由基的清除能力明顯提高,而且MDA含量有所下降。在高劑量組中,與VC相比,粗花青素純化物對肝臟和心臟中羥自由基抑制能力提高最為顯著,SOD活性也顯著地提高;與同等劑量的粗花青素相比,其純化物對SOD活性的提高效果更顯著。粗花青素純化物對小白鼠T-AOC的提高效果與VC相似。因此,黑米花青素具有體內抗氧化及免疫調節作用,且純化后的花青素體內抗氧化及免疫調節效果更好。
[1]趙騰芳.黑糯稻品種資源的考察和研究[J].農業考古,1984,2:296-298.
[2]雷永燁.黑稻的開發利用價值[J].上海農學院學報,1988,6(4):325-328.
[3]高如嵩.陜西黑米的主要營養成分及其利用價值[J].西北農學院學報,1984,6(1):97-101.
[4]Pourrat H. Drogues a anthocyanes et maladies vassculaires[J].Plant Med Phytother,1997,11(9):143.
[5]Vincieri F,Romani A,Baldi A,et al. Analysis HPLC of anthocyanins present in fluid extracts from Malya sylvestris L.flowers and leaves[J]. Bull Liaison-Groupe Polyphenols,1992,16(1):339-342.
[6]高愛紅,童華榮.天然食用色素-花青素研究進展[J].保鮮與加工,2001(3):25-27.
[7]石娟.黑米中花青素的提取、純化及其體內抗氧化活性研究[D].合肥:合肥工業大學,2011.
[8]余冰賓.基礎生物化學實驗指導[M].北京:清華大學出版社,2004:131-141.
[9]張澤生,林紀偉,王志平,等. 比色法測定不同產地黑豆皮中花青素含量[J].食品研究與開發,2012,33(5):143-145.
[10]孫漢巨.菜籽多糖的分離、純化及特性研究[D].合肥:合肥工業大學,2009.
[11]Sun H,Jiang S,Mu P,et al.Invivoantioxidative capacities of rapeseed meal polysaccharides[J]. Journal of Food,Agriculture & Environment,2009,7(2):97-102.
[12]鄒元生,徐瑞,溫中平,等.沙棘籽原花青素提取物對小白鼠免疫調節實驗研究[J].國際沙棘研究與開發,2012,10(1):5-11.
[13]孫漢巨,姜紹通,趙榮敏.菜籽餅粕多糖對小白鼠免疫功能的影響[J].食品科學,2008,29(11):567-571.
[14]Sun H,Jiang S,Zi M,et al. Purification,chemical composition andinvitroantioxidant activity of two protein-bound polysaccharides from rapeseed meal[J]. Food Science and Biotechnology,2009,18(6):1386-1391.
[15]成紹鑫.腐植酸分子結構與生物活性的關系[J].腐植酸,2002,3:38-43.
[16]張名位,郭寶江,張瑞芬,等. 黑米抗氧化活性成分的分離純化和結構鑒定[J].中國農業科學,2006,39(1):153-160.
[17]張名位,張瑞芬,郭寶江,等.黑米皮提取物的抗氧化與降血脂作用及其成分分析[J].中國農業科學,2006,39(11):2368-2373.
[18]王金亭,楊敏一.黑米色素苷化學結構與抗氧化活性的關系[J].重慶文理學院學報:自然科學版,2007,26(6):59-61.
[19]張甘良,王釗,鄢洪德.生物類黃酮化合物的結構與生物活性的關系[J].生物學雜志,2005,22(1):4-7.
Study oninvivoantioxidation of anthocyanins from black rice
SHI Juan,ZHANG Man-li,SUN Han-ju*,CHEN Xiao-yan,LOU Qiu-yan,LIU Ning,WANG Xiao
(College of Biotechnology and Food Engineering,Hefei University of Technology,Hefei 230009,China)
This paper studied theinvivoantioxidation and immune modulation functions of anthocyanins from black rice. Saline solution was used as carriers,while vitamin C was used as positive control. Mice were fed with crude and pure anthocyanins at high,medium and low doses,respectively. After feeding for 30 days by mean of irrigation,the spleen and thymus indexes were detected,while T-AOC,SOD,GSH-Px,MDA and hydroxyl radical contents of serum,liver,heart and kidney were also determined. The results indicated that the anthocyanins could increase the spleen and thymus indexes,significantly increase the level of T-AOC,the activity of SOD and GSH-PX,and reduce the contents of MDA and hydroxyl radical. Therefore,the anthocyanins have the functions ofinvivoantioxidation and immune modulation.
black rice;anthocyanins;mouse;antioxidation
2014-05-14
石娟(1986-),女,碩士,研究方向:食品科學。
*通訊作者:孫漢巨(1966-),男,博士,教授,研究方向:農產品的綜合利用。
2011年國家自然科學基金項目“31171787”;2012年安徽省長三角聯合攻關項目“1201c0602005”。
TS201.4
A
1002-0306(2015)05-0348-05
10.13386/j.issn1002-0306.2015.05.065

