耐熱β-葡聚糖酶發酵培養基的優化
孫軍濤,王洪新,呂文平,*
(1.許昌學院食品與生物工程學院,河南許昌 461000; 2.江南大學食品學院,江蘇無錫 214122)
?
耐熱β-葡聚糖酶發酵培養基的優化
孫軍濤1,2,王洪新2,呂文平2,*
(1.許昌學院食品與生物工程學院,河南許昌 461000; 2.江南大學食品學院,江蘇無錫 214122)
本文利用響應面分析對耐熱β-葡聚糖酶的發酵培養基進行優化,結果表明:最適發酵培養基組成為大麥粉43.48g/L、豆粉34.40g/L、NaCl 2.4g/L、磷酸二氫鉀2.4g/L和磷酸氫二鉀12.5g/L;優化后的發酵培養基發酵產β-葡聚糖酶的量為(110±2.67)U/mL,比初始發酵培養基提高了11%。優化后的發酵培養基中的碳源和氮源是廉價的大麥粉和豆粉,大大降低了β-葡聚糖酶的生產成本,具有很好的實際應用價值。
耐熱β-葡聚糖酶,培養基優化,響應面法
在工業發酵生產中,微生物發酵產酶量一方面取決于菌株本身;另一方面取決于菌株的培養條件,如培養基的組成以及濃度等[1-2],發酵培養基的優化是從實驗室到工業化生產中的必要環節,具有舉足輕重的作用,篩選得到一個合適的發酵培養基,是發酵產物工業化生產中非常重要的一步。本課題組已構建了產耐熱、高活性的耐熱β-葡聚糖酶的基因工程菌,在應用過程中,還需要對其發酵培養基和發酵條件進行優化,為生產應用奠定基礎。
響應面分析方法(Response Surface Methodology,RSM)在培養基優化方面的優越性已經得到證實[3-5]。不同菌株發酵產β-葡聚糖酶所用的發酵培養基不同[6-7],選擇已構建的產耐熱高活性的耐熱β-葡聚糖酶的基因工程菌為研究對象,分別對其發酵培養基的碳源、氮源和無機鹽進行篩選,利用響應面分析方法對其發酵培養基進行優化,為耐熱β-葡聚糖酶的工業應用提供基本參數。
1 材料與方法
1.1 材料與儀器
表達宿主菌E.coliBL21(DE3)和表達載體pET-30a(+) 購自Invitrogen公司;外源基因為解淀粉芽孢桿菌和熱纖梭菌的融合基因 由本實驗室保存;大麥、麥麩、豆粕、玉米和大豆 購自無錫市場;可溶性淀粉、糊精、乳糖、麥芽糖、葡萄糖、蔗糖和甘油 購于國藥集團上海化學試劑有限公司;硫酸卡那霉素(Kan) 購自鄭州羚銳制藥有限股份公司;種子培養基(g/L) 胰蛋白胨10、酵母膏5和NaCl 10,調pH至7.0;初始發酵培養基[8](g/L) 胰蛋白胨12、酵母膏24、甘油6、NaCl 10、KH2PO42.4和K2HPO412.5。
冷凍高速離心機(5430R,5804R) Eppendorf;UV-2100紫外可見分光光度計 尤尼柯(上海)儀器有限公司;超聲波細胞破碎儀 上海寧波科生儀器廠;冷凍氣浴恒溫振蕩器(BS-1E) 金壇市瑞華儀器有限公司;全自動高壓滅菌鍋(SYQ-DSX-280B) 上海申安醫療器械廠;梅特勒pH計 梅特勒-托利多儀器有限公司;超凈工作臺(SW-CJ-2D) 蘇潔凈化有限公司;培養箱 上海精宏實驗設備公司。
1.2 基因工程菌生長曲線
將活化的種子菌液按照1%(V/V)的接種量接種于裝有50mL含有Kan的LB液體培養基的250mL三角瓶中,在37℃、200r/min轉速下的搖床培養,分別間隔1h取菌體培養液測定其在600nm處的OD值,以培養時間為橫坐標,以OD值為縱坐標繪制基因工程菌的生長曲線。
1.3 基因工程菌的培養方法
將活化后的種子菌株按1%(V/V)的接種量接種于裝有50mL培養基的250mL三角瓶中,在37℃溫度下,200r/min搖床培養至菌體對數生長期時,加入終濃度為1mmol/L的IPTG誘導6h,發酵液經超聲波破壁后,在8000r/min轉速下離心5min,上清液即為粗酶液。
1.4 酶活性的測定
酶活性測定采用DNS法[9],酶活力單位定義為:在最適反應條件下,單位時間內水解葡聚糖產生1μmol葡萄糖需要的酶量定義為一個酶活力單位(U)。
1.5 培養基的優化
分別研究不同碳源、氮源和無機鹽以及其濃度對基因工程菌產β-葡聚糖酶活性的影響,并確定三因素三水平的最佳參數進行響應面分析,建立優化模型,確定最佳發酵培養基。因素水平表見表1。
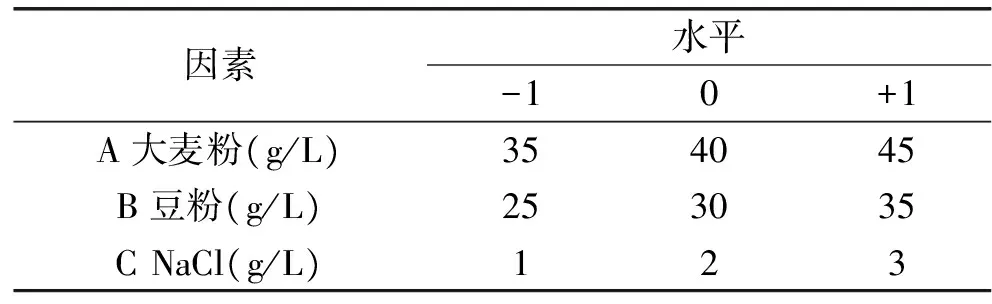
表1 響應面實驗因素水平表Table 1 Level and factors of response surface design experiment
2 結果與討論
2.1 基因工程菌生長曲線
基因工程菌生長曲線如圖1所示,從生長曲線圖中可以看出:0~4h為延滯期;4~8h為對數生長期;8~11h為穩定期;11h以后為衰亡期。處于對數生長期的菌,尤其是處于對數生長期的中、后期的菌的細胞活力大,適應性強,有利于菌體細胞的生長繁殖和發酵產物的合成。因此選擇該基因工程菌培養生長時間為5~7h的菌液為種子液進行發酵培養。
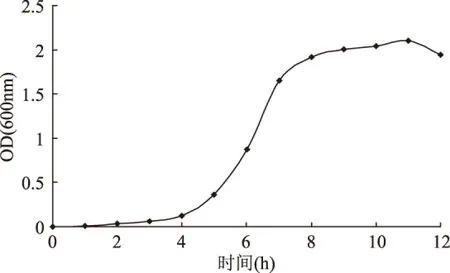
圖1 基因工程菌的生長曲線Fig.1 Growth curve of gene engineering bacteria
2.2 發酵培養基的優化
2.2.1 最佳碳源、氮源和無機鹽的選擇
2.2.1.1 碳源 碳源在微生物生長過程中,不僅是構成微生物細胞結構的主要成分,而且為微生物的生長提供能量。在微生物生長過程中需求量較大。在初始發酵培養基中分別用葡萄糖、麥芽糖、乳糖、蔗糖、甘油、可溶淀粉、糊精、麥麩、玉米粉和大麥粉為碳源,代替初始發酵培養基中的甘油,研究不同碳源對基因工程菌產β-葡聚糖酶的影響。結果見圖2,以大麥粉作為碳源時,基因工程菌產β-葡聚糖酶的量最高,可溶性淀粉次之,以葡萄糖作為碳源時,產β-葡聚糖酶的量最低。以大麥為碳源時酶活性高,可能是因為基因工程菌誘導后表達的β-葡聚糖酶將大麥中的β-葡聚糖降解成小分子量的糖,進而不斷為菌體的生長繁殖提夠足夠的碳源,保證基因工程菌更好的誘導發酵產酶。因此發酵培養基中選擇大麥粉作為最佳碳源。

圖2 不同碳源對發酵產β-葡聚糖酶的影響Fig.2 Effect of different carbon sources on the production of β-glucanase
2.2.1.2 氮源 氮源是組成菌體細胞和代謝產物的必需營養物質,一般分為無機和有機兩種氮源,其中無機氮源是菌體生長的速效氮源,而有機氮源不僅為菌體生長提供氮元素而且還提供必需的生長因子[10]。以大麥粉為碳源,分別用魚粉蛋白胨、胰蛋白胨、豆粉、豆粕、酵母膏、NaNO3、(NH4)2SO4和CO(NH2)2為氮源代替初始發酵培養基中的胰蛋白胨和酵母膏,對最佳氮源進行篩選,結果見圖3,利用蛋白胨、豆粉、豆粕和酵母膏有機氮源作為發酵培養基的氮源時,基因工程菌產β-葡聚糖酶的量明顯高于無機氮源,這可能是因為有機氮源不僅能為菌細胞生長代謝提供氮源,而且還能夠為菌細胞的生長代謝提供生長因子。其中以豆粉作為氮源時,產β-葡聚糖酶的量最高。因此選擇豆粉作為發酵培養基的最佳氮源。

圖3 不同氮源對發酵產β-葡聚糖酶的影響Fig.3 Effect of different nitrogen sources on the production of β-glucanase
2.2.1.3 無機鹽 無機鹽是微生物生長繁殖不可缺少的物質,其主要功能是參與構成菌體成分、作為酶的組成部分、維持酶的活性或調解滲透壓等[11]。分別以大麥粉和豆粉作為碳源和氮源,用CaCl2、MgSO4·7H2O、K2SO4、NaCl、FeSO4·7H2O、CuSO4·5H2O和MnSO4·5H2O等無機鹽分別代替初始發酵培養基中的無機鹽NaCl,研究不同無機鹽對基因工程菌產β-葡聚糖酶的影響。結果見圖4,發酵培養基中添加CuSO4·5H2O和K2SO4時的產酶量最低,而添加NaCl和FeSO4·7H2O時的產酶量最高,選擇NaCl為發酵培養基的最適無機鹽。

圖4 無機鹽對發酵產β-葡聚糖酶的影響Fig.4 Effect of inorganic salts on the production of β-glucanase
2.2.2 發酵培養基中主要成分的單因素實驗
2.2.2.1 大麥粉濃度對發酵產β-葡聚糖酶的影響 用大麥粉和豆粉作為最佳碳源和氮源,代替初始發酵培養基中的甘油、酵母膏和蛋白胨,研究不同大麥粉濃度對基因工程菌發酵產β-葡聚糖酶的影響,結果見圖5。培養基中大麥粉濃度在5~40g/L之間,隨著大麥粉濃度的增加發酵產β-葡聚糖酶的量也隨著增加,當大麥粉濃度達到40g/L時,發酵產β-葡聚糖酶的量達到最高;超過40g/L時,隨大麥粉濃度的提高產酶的量逐步降低,可能是因為大麥粉中含有大量的葡聚糖,當培養基中含有過多的大麥粉時,就會增加了培養基的粘度,降低培養基中的溶氧量,抑制菌體的生長,進而導致發酵產β-葡聚糖酶的量的降低。

圖5 大麥粉濃度對發酵產β-葡聚糖酶的影響Fig.5 Effect of the concentration of barley powder on the production of β-glucanase
2.2.2.2 豆粉濃度對發酵產β-葡聚糖酶的影響 選擇濃度為40g/L的大麥粉為碳源,研究不同豆粉濃度對基因工程菌發酵產β-葡聚糖酶的影響。從圖6可以看出,當豆粉濃度達到30g/L時,基因工程菌發酵產β-葡聚糖酶的量最高,發酵培養基中豆粉濃度低于30g/L時,因不能為菌體的生長提供足夠的氮源,而影響基因工程菌發酵產β-葡聚糖酶的量;豆粉濃度高于30g/L時,導致氮源過剩,容易使培養基中氨的過分積累,使pH的升高,抑制菌體的生長繁殖,最終導致菌體發酵產β-葡聚糖酶的量相應的降低。
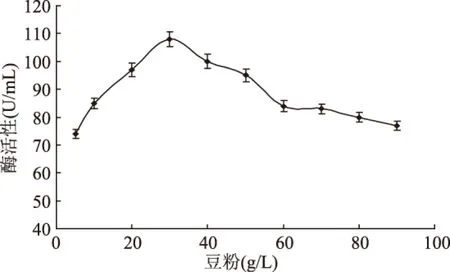
圖6 豆粉濃度對發酵產β-葡聚糖酶的影響Fig.6 Effect of the concentration of soybean powder on the production of β-glucanase
2.2.2.3 NaCl濃度對發酵產β-葡聚糖酶的影響 分別用濃度為40g/L的大麥粉和30g/L的豆粉作為碳源和氮源,研究不同濃度的NaCl對基因工程菌發酵產β-葡聚糖酶的影響,結果見圖7,當NaCl濃度為2.0g/L時,基因工程菌發酵產β-葡聚糖酶的量最高。低于2.0g/L時,因為不能為菌體的生長提供足夠的無機鹽,而導致基因工程菌發酵產β-葡聚糖酶的量逐漸降低;當NaCl的濃度過高時,引起發酵培養基中具有較高的滲透壓,不利于基因工程菌細胞膜的穩定,進而影響菌體的生長繁殖和發酵產酶[12]。

表3 回歸方程的方差分析表Table 3 Variance analysis of the regression equation

圖7 NaCl濃度對發酵產β-葡聚糖酶的影響Fig.7 Effect of the concentration of sodium chloride on the production of β-glucanase
2.2.3 響應面實驗設計
2.2.3.1 回歸方程的建立與分析 根據單因素的實驗結果,選擇培養基中的大麥粉、豆粉和NaCl三個因素作為主要研究對象,進行響應面分析。用Design Expert 軟件[13],根據Box-Behnken 實驗設計,以產β-葡聚糖酶的活性為響應值,設計15組實驗,實驗測定結果見表2。根據測定的實驗數據進行二次多項式方程的回歸擬合,得到基因工程菌產β-葡聚糖酶的回歸方程:
Y=112.67+4.62A+11.12B+1.25C-4.50AB-2.25AC-3.25BC-4.58A2-8.58B2-5.83C2
其中:A-大麥粉的濃度(g/L),B-豆粉的濃度(g/L),C-NaCl的濃度(g/L),Y-發酵產β-葡聚糖酶的酶活(U/mL)。

表2 實驗設計及結果Table 2 Experimental design and results
為了檢驗回歸方程的可靠性,對擬合的回歸方程進行了方差分析(Analysis of Variance,ANOVA),方程分析結果見表3。該模型顯著(p<0.01),失擬項在a=0.05的水平上不顯著,相關系數R2=0.9920,說明該模型的擬合程度較好,可以用此模型來預測基因工程菌產β-葡聚糖酶的情況。
2.2.3.2 響應面交互與優化 等高線圖中趨勢線的形狀可以說明兩個因素間交互作用是否顯著,形狀為圓形的交互作用弱,形狀為橢圓形的交互作用強,預測的最大值通常出現在最小橢圓區域內[14]。從得到的響應面圖中可以看出各因素在發酵產酶過程中的相互作用,確定最佳的發酵條件。
圖8、圖9和圖10為分析得到的響應面圖,各因素以及各因素間交互作用對響應值的影響可以直觀地顯示出來。從圖8可以看出,在選定的濃度范圍內,基因工程菌產β-葡聚糖酶的酶活隨著大麥粉和豆粉濃度的升高而增加,大麥粉和豆粉濃度分別增加到43g/L和34g/L時酶活性趨于穩定;從圖9可以看出,基因工程菌產β-葡聚糖酶的酶活隨著大麥粉和NaCl濃度的增加出現先增大后降低,響應較高值落在大麥粉濃度較高而NaCl濃度居中的范圍內;圖10顯示,基因工程菌產β-葡聚糖酶的酶活性隨豆粉濃度的增加呈現逐步增大的趨勢,而NaCl的濃度對發酵產酶的影響不是很明顯。

圖8 大麥粉和豆粉濃度對發酵產β-葡聚糖酶的響應面Fig.8 Response surface plot of effect of barley and soybean powder concentration on production of β-glucanase

圖9 大麥粉和NaCl濃度對發酵產β-葡聚糖酶的響應面Fig.9 Response surface plot of effect of barley powder and sodium chloride concentration on production of β-glucanase
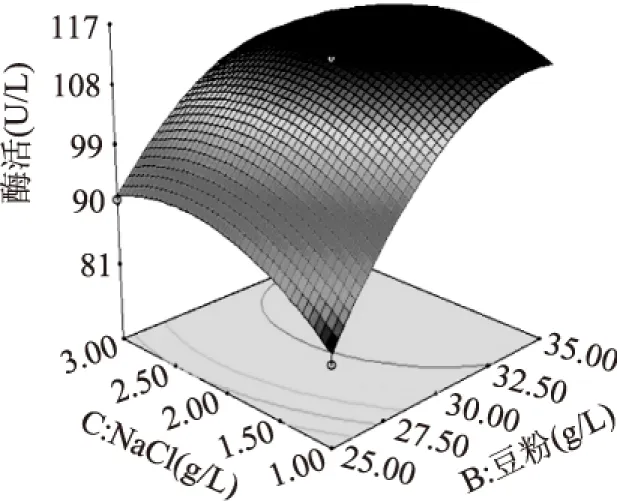
圖10 豆粉和NaCl濃度對發酵產β-葡聚糖酶的響應面Fig.10 Response surface plot of effect of soybean powder and sodium chloride concentration on production of β-glucanase
2.2.3.3 驗證實驗 利用Design Expert軟件分析,得到發酵培養基中大麥粉、豆粉和NaCl的最佳條件分別為:大麥粉43.48g/L、豆粉34.40g/L、NaCl 2.4g/L,在此發酵培養基條件下預測基因工程菌產β-葡聚糖酶的活性為111.84U/mL。
為了驗證模型的準確性,按照模型優化的最佳發酵培養基條件,進行3組平行實驗,最終測得發酵液的平均酶活性為(110±2.67)U/mL,與構建的模型預測值基本一致,證明該模型可以較好地預測基因工程菌產β-葡聚糖酶的情況。優化后的發酵培養基比初始發酵培養基發酵產β-葡聚糖酶的量(99±1.98)U/mL提高了11%。與初始發酵培養基相比,優化后的發酵培養基產β-葡聚糖酶的量雖然沒有得到大幅度的提高,但是優化后的發酵培養基中的碳源和氮源分別用的是廉價的大麥粉和豆粉,大大降低了發酵產β-葡聚糖酶的生產成本,從經濟價值方面考慮,優化后的發酵培養基具有更好的實際應用價值。
3 結論
本文選擇已構建的耐熱β-葡聚糖酶的基因工程菌為出發菌株,對其發酵條件進行系統的優化,篩選確定基因工程菌發酵產β-葡聚糖酶的最佳碳源、氮源和無機鹽分別為大麥粉、豆粉和NaCl。通過響應面實驗確定發酵培養基中大麥粉、豆粉和NaCl的最適用量。優化后的發酵培養基組成為:大麥粉43.48g/L、豆粉34.40g/L、NaCl 2.4g/L、KH2PO42.4g/L和K2HPO412.5g/L。優化后的發酵培養基產β-葡聚糖酶的量為(110±2.67)U/mL,比初始發酵培養基提高了11%。優化后的發酵培養基的碳源和氮源是大麥粉和豆粉,大大降低了β-葡聚糖酶的生產成本,具有很好的實際應用價值。
[1]Giese EC,Dekker RFH,Scarminio IS,et al. Comparison of β-1,3-glucanase production by Botryosphaeria rhodina MAMB-05 and Trichoderma harzianum Rifai and its optimization using a statistical mixture-design[J]. Biochem Eng J,2011,53:239-243.
[2]Chen XC,Bai JX,Cao JM,et al. Medium optimization for the production of cyclic adenosine 3,5-monophosphate by Microbacterium sp. no. 205 using response surface methodology[J].Bioresource Technol,2009,100:919-924.
[3]Su JJ,Zhou Q,Zhang HY,et al. Medium optimization for phenazine-1-carboxylic acid production by a gacA qscR double mutant ofPseudomonassp. M18 using response surface methodology[J]. Bioresource Technol,2010,101:4089-4095.
[4]Liu J,Luo JG,Ye H,et al. Medium optimization and structural characterization of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J]. Carbohyd Polym,2010,79:206-213.
[5]Anuradha Jabasingh S,ValliNachiyar C. Optimization of cellulose production by Aspergillus nidulans:application in the biosoftening of cotton fibers[J]. World J Microb Biot,2011,27:85-97.
[6]程志敬,鄧旭,盧英華,等.重組大腸桿菌生產β-1,3-1,4-葡聚糖酶培養基優化研究[J].工業微生物,2006,36(2):26-30.
[7]湯興俊.熱穩定性β-葡聚糖酶發酵工藝及發酵動力學研究[D].杭州:浙江大學,2003.
[8]陳亞蘭,黃偉強,周曉波,等.重組大腸桿菌產β-1,3-1,4-葡聚糖酶的培養基優化[J].廈門大學學報:自然科學版,2011,50(5):896-902.
[9]Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry,1959,31(3):426-428.
[10]黃靜,史建明,霍文婷,等.氮源對L-色氨酸發酵的影響[J].食品與發酵工業,2011,37(5):21-25.
[11]呂欣,段作營,毛忠貴.氮源與無機鹽對高濃度酒精發酵的影響[J].西北農林科技大學學報:自然科學版,2003,31(4):159-162.
[12]Beshay U,Enshasy HE,Ismail IMK,et al. β-glucanase production from genetically modified recombinant E. coli:Effect of growth substrates and development of a culture medium in shake flasks and stirred tank bioreactor[J]. Process Biochem,2003,39:307-313.
[13]Ambati P,Ayyanna C. Optimizing medium constituents and fermentation conditions for citric acid production from palmyra jaggery using response surface method[J]. World J Microb Biot,2011,17:331-335.
[14]Wang YH,Li YP,Zhang Q,et al. Enhance antibiotic activity of Xenorhabdus nematophila by medium optimization[J]. Bioresource Technol,2008,99:1708-1715.
Optimization of culture medium for thermostable β-glucanase
SUN Jun-tao1,2,WANG Hong-xin2,LV Wen-ping2,*
(1.College of Food and Biological Engineering,Xuchang University,Xuchang 461000,China;2. School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
In this study,culture medium for thermostable β-glucanase was optimized using response surface methodology. The results indicated that the highest production of β-glucanase could be obtained in the medium containing(g/L):barley powder 43.48,soybean powder 34.40,sodium chloride 2.40,potassium dihydrogen phosphate 2.40 and dipotassium hydrogen phosphate 12.50. Compared with the initial fermentation medium,the product of β-glucanase cultivated by optimized fermentation medium increased by 11%,which was(110±2.67)U/mL. Barley powder and soybean powder were chosen as carbon and nitrogen sources in optimization fermentation medium,which are cheap materials. All of this can significantly reduce the costs of β-glucanase,and has good practical value.
thermostable β-glucanase;culture medium optimization;response surface methodology
2014-06-16
孫軍濤(1982-),博士,講師,主要從事生物技術方面的研究工作。
*通訊作者:呂文平(1968-),男,博士,副教授,研究方向:食品營養與功能因子。
國家自然科學基金(30972120);河南省教育廳科學技術研究重點項目(14B416007);許昌學院重點科研基金項目(2014081);許昌市科技發展計劃科技攻關項目(140202053)。
TS201.3
B
1002-0306(2015)05-0218-05
10.13386/j.issn1002-0306.2015.05.037

