番茄黃化曲葉病毒在湖北首次報道
湯亞飛,何自福*,杜振國,佘小漫,藍國兵,羅方芳
(1.廣東省農業科學院植物保護研究所,廣州 510640;2.廣東省植物保護新技術重點實驗室,廣州 510640)
番茄黃化曲葉病是世界范圍內嚴重影響番茄生產的一種重要病害,已給熱帶和亞熱帶地區的番茄生產造成嚴重損失[1]。田間番茄染病后表現為植株矮化,葉片黃化、變小,葉片邊緣向上卷曲。生長發育早期染病時,植株無法正常開花結果;后期染病,植株上部新葉表現癥狀,結果量減少,果實變小,失去市場價值。
番茄黃化曲葉病毒(Tomatoyellowleafcurl virus,TYLCV)是引起全球各地番茄黃化曲葉病的主要病原之一。該病毒屬雙生病毒科(Geminiviri-dae)菜豆金色花葉病毒屬(Begomovirus)成員,其基因組僅含A 組分(DNA-A),為單鏈環狀;該病毒由煙粉虱以持久方式傳播,同時可經嫁接傳播,不能經機械摩擦或種子傳毒;其寄主有番茄、曼陀羅、辣椒、菜豆、煙草等[2]。TYLCV 最先在以色列發現,之后隨著煙粉虱在全球范圍暴發而蔓延至中東、地中海沿岸、非洲、美洲、澳洲和亞洲等多個國家和地區[3]。2006年,該病毒傳入我國上海[4],之后在浙江、江蘇、安徽、山東、河北、天津及北京等多個省市發生,造成嚴重損失[5-15]。2014年春季,湖北省武漢市田間番茄病株表現出嚴重的黃化、曲葉癥狀,疑似感染了雙生病毒。為了明確引起湖北省武漢市番茄黃化曲葉病的病原種類,筆者對6份病樣進行了病原分子鑒定,對代表分離物的全基因組進行了克隆及序列分析。
1 材料與方法
1.1 供試樣品
6份疑似番茄黃化曲葉病的病葉片(編號分別為HB01~06)采自湖北省武漢市一個試驗大棚,病株表現為植株矮縮,葉片皺縮、葉緣黃化;3 份陽性樣品為本實驗室通過農桿菌介導TYLCV 侵染性克隆注射接種發病的番茄葉片;2 份陰性樣品為本實驗室保存的健康番茄葉片。
1.2 供試番茄樣品總DNA 提取
利用CTAB方法[16]提取各供試番茄葉片組織的總DNA。
1.3 PCR 檢測
利用菜豆金色花葉病毒屬病毒通用簡并引物AV 494/CoPR[17-18],對11份供試樣品進行PCR檢測。
1.4 RCA擴增及酶切分析
隨機挑取PCR 檢測為陽性的病樣HB01 和HB02總DNA,分別取1.0μL 為模板,利用TempliPhiTMRCA Kit(GE Healthcare)進行滾環擴增(rolling circle amplification,RCA),以獲得病毒的全基因組。具體方法按照試劑盒說明書上的步驟進行。
RCA 反應結束后,擴增產物分別用BamH I、Hind Ⅲ、PstI限制性內切酶進行酶切。酶切反應體系為:RCA 產物2μL、內切酶1μL、10×內切酶緩沖液1μL,總酶切反應體系為10μL。在37 ℃條件下酶切2h以上,然后進行電泳分析。若某個內切酶的酶切產物為2.5~3.0kb,或同時還產生1.3 kb左右的條帶,則克隆這些特異性條帶。
1.5 序列分析
利用DNAStar 軟件(DNASTAR Inc,Madison,USA)進行序列拼接,利用BLAST 程序進行序列相似性搜索,進一步用DNAStar的MegAlign進行序列比較分析,進化樹構建采用MEGA 5.05 的鄰接法(neighbor joining,NJ)。
2 結果與分析
2.1 PCR 檢測結果
利用菜豆金色花葉病毒屬病毒特異簡并引物AV494和CoPR 進行PCR 檢測,從6份表現黃化、曲葉癥狀的番茄病樣(編號分別為HB01~06)總DNA 中均擴增到1條與陽性對照大小一致的特異片段,長度為570bp,而健康植株樣品總DNA 中未擴增出任何片段(見圖1)。表明6份樣品中均含有菜豆金色花葉病毒屬病毒。

圖1 番茄樣品PCR 檢測結果Fig.1 PCR detection result of tomato samples
2.2 病毒分離物基因組的克隆與序列分析
選取病樣HB01 和HB02 的總DNA 分別進行RCA 和酶切反應,結果顯示,其RCA 產物均能被BamH I切出1條約2.7kb大小的單一條帶。克隆和序列測定結果表明,這2 個片段序列全長均為2 781nt,且兩者的序列同源率為99.8%,即為病毒分離物DNA-A的全基因組。以HB01的全長序列代表該病毒分離物基因組,其GenBank登錄號為KJ850344。
病毒分離物HB01的基因組全長序列具有單組分菜豆金色花葉病毒屬成員基因組DNA-A 的典型特征,為單鏈閉合環狀,推導編碼6個ORFs。基因組病毒鏈含AV1基因(308~1 084nt,編碼CP)和AV2基因(148~498nt,編碼與病毒移動相關蛋白),互補鏈含有AC1基因(1 542~2 615nt,編碼復制酶)、AC2基因(1 226~1 633nt,轉錄激活蛋白)和AC3基因(1 081~1 485nt,編碼復制增強蛋白)和AC4基因(2 171~2 464nt)。在AV2與AC1之間有一個313nt的非編碼區(位于2 616~147nt),其中含有與雙生病毒復制起始有關的保守序列TAATATTAC[19](位于2 775~2nt)。
BLAST結果顯示,與HB01DNA-A 序列有較高同源性的序列均為TYLCV 分離物DNA-A。進一步比較結果顯示,HB01DNA-A與來自中國不同地區的TYLCV分離物的同源性均在97%以上,其中與來自上海(TYLCV-SH2,AM282874)、浙江(TYLCV-ZJ3,AM698117)和安徽(TYLCV-AH-HB1,FN650807)3個分離物DNA-A的同源性最高,均為99.4%。
為了分析病毒分離物HB01與已報道的各TYL-CV 分離物的親緣關系,本文選取了來自我國不同地區的12 個分離物以及國外不同國家來源的19 個TYLCV 代表分離物,以我國臺灣番茄曲葉病毒白沙分離物(TomatoleafcurlTaiwanvirus,ToLCTWV,DQ237918)為外組構建系統進化樹。從該系統進化樹(圖1)可以看出,HB01與來自中國不同地區的12個分離物及國外的11個分離物親緣關系較近,聚在一個分支,進一步與來自科威特的KISR分離物形成一個大的分支;而與日本Mild[Tokai]分離物、西班牙Mild[Spain7297]分離物、留尼汪島分離物、日本Sz分離物、阿巴代分離物、伊朗分離物及阿曼Tom-48分離物等7個分離物的親緣關系相對較遠。
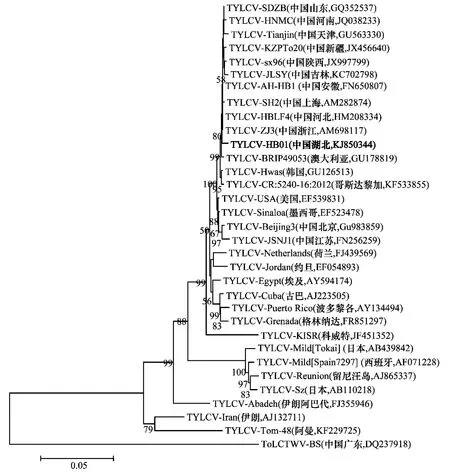
圖2 HB01與其他31個TYLCV分離物的系統進化樹Fig.2 Phylogenetic tree of HB01and 31isolates of TYLCV
3 討論
雖然番茄黃化曲葉病已在我國上海、浙江、江蘇、安徽、山東、河北、河南、天津、北京、吉林、陜西、廣東、廣西、福建、海南、云南、新疆、寧夏、重慶、遼寧、甘肅、四川等20多個省(市、自治區)相繼發生,但對于湖北來說還是一個新病害。本文應用RCA 方法從來自湖北的番茄病樣中擴增獲得病毒分離物HB01的全基因組序列,該序列與國際上已報道的TYLCV各分離物同源性均在89%以上,其中與來自我國其他地區的TYLCV 分離物的同源率均在97%以上。因此,根據目前國際雙生病毒分類方案[2],確定侵染湖北番茄的病毒分離物HB01屬于TYLCV的一個分離物,這是首次在湖北省檢測到該病毒。
自2006年Wu等[4]首次報道TYLCV入侵我國以來,該病毒已擴散到我國20多個省(市、自治區),并造成嚴重損失。本研究通過比較病毒分離物基因組序列發現,我國各地分離物的同源性在97%以上。這說明:雖然該病毒入侵我國將近10年,但其種群的遺傳依然比較穩定。當然,由于該病毒在田間與其他雙生病毒存在復合侵染[20],TYLCV是否會與其他病毒進行重組產生新株系或新病毒,還需要進一步監測。
近年來,湖北番茄栽培面積呈擴大趨勢,尤其是高山番茄,市場效益好,發展迅速,面積逐年擴大,現已成為湖北省高山蔬菜高效栽培的主要品種之一。本研究首次在湖北番茄上發現番茄黃化曲葉病疫情,說明該病毒也開始入侵到湖北省,應引起有關部門和生產者的重視。積極采取有效的防范措施,預防與控制該病在湖北省傳播、擴散和流行。
[1]Hanssen I M,Lapidot M,Thomma B P H J.Emerging viral diseases of tomato crops[J].Molecular Plant-Microbe Interactions,2010,23:539-548.
[2]Fauquet C M,Briddon R W,Brown J K et al.Geminivirus strain demarcation and nomenclature[J].Archives of Virology,2008,153:783-821.
[3]Moriones E,Navas-Castillo J.Tomatoyellowleafcurlvirus,an emerging virus complex causing epidemics worldwide[J].Virus Research,2000,71:123-134.
[4]Wu J B,Dai F M,Zhou X P.First report ofTomatoyellowleaf curlvirusin China[J].Plant Disease,2006,90(10):1359.
[5]宋晰,師迎春,張世晨,等.北京地區番茄黃化曲葉病病毒分離物測定及株系的初步鑒定[J].植物病理學報,2013,43(2):113-119.
[6]周瑩,李興紅,劉建華,等.河北省番茄黃化曲葉病毒病的分子鑒定初報[J].植物保護,2010,36(1):60-64.
[7]王祥,李剛,趙黎明,等.吉林番茄黃化曲葉病毒分離物的檢測及其DNA-A全基因組序列分析[J].植物保護,2014,40(2):76-80.
[8]阮濤,楊會房,楊水英,等.分離陜西涇陽番茄的番茄黃化曲葉病毒(TYLCD)的分子特征[J].農業生物技術學報,2013,21(1):97-105.
[9]金鳳媚,薛俊,郟艷紅,等.天津地區番茄黃化曲葉病毒DNA-A的克隆和序列分析[J].華北農學報,2011,26(1):58-62.
[10]于云奇,阮濤,楊水英,等.河南省番茄黃化曲葉病病原分子鑒定及全基因組序列分析[J].西南大學學報(自然科學版),2014,36(1):13-17.
[11]袁偉,萬紅建,王榮青,等.浙江省番茄黃化曲葉病毒的分子鑒定及序列分析[J].分子植物育種,2013,11(2):185-192.
[12]季英華,熊如意,程兆榜,等.江蘇省番茄黃化曲葉病的病原分子診斷[J].園藝學報,2008,35(12):1815-1818.
[13]王喜剛,黃家風,都業娟.南疆溫室番茄黃化曲葉病病毒種類的分子鑒定[J].植物保護學報,2013,40(3):237-242.
[14]褚棟,侯麗霞,劉國霞,等.山東省局部地區番茄黃化曲葉病毒的分子鑒定[J].山東農業科學,2010(2):13-15,19.
[15]余文貴,趙統敏,楊瑪麗,等.山東、安徽兩省栽培番茄煙粉虱傳雙生病毒的PCR 檢測及序列分析[J].江蘇農業學報,2009,25(4):747-751.
[16]Doyle J J,Doyle J L.Isolation of plant DNA from fresh tissue[J].Focus,1990,12:13-15.
[17]Wyatt S D,Brown J K.Detection of subgroup Ⅲgeminivirus isolates in leaf extracts by degenerate primers and polymerase chain reaction[J].Phytopathology,1996,86(12):1288-1293.
[18]何自福,虞皓,羅方芳.番茄煙粉虱傳雙生病毒PCR 檢測[J].中國病毒學,2004,19(1):67-69.
[19]Hanley-Bowdoin L,Settlage S B,Orozco B M,et al.Geminiviruses:models for plant DNA replication,transcription,and cell cycle regulation[J].Critical Reviews in Biochemistry and Molecular Biology,2000,35(2):105-140.
[20]張輝.侵染我國番茄雙生病毒種類鑒定及致病性分析[D].杭州:浙江大學,2009:1-123.

