山西短頸劍線蟲(Xiphinema brevicollum)形態與rDNA分子特征
霍世英,徐玉梅,高俊明*,王建明,趙增旗
(1.山西農業大學農學院,太谷 030801;2.新西蘭皇家研究院土地環境研究所,奧克蘭 1072)
劍線蟲屬(XiphinemaCobb,1913)隸屬于矛線目(Dorylaimida),長針科(Longidoridae),劍亞科(Xiphinematinae)。劍線蟲作為一類重要的植物外寄生線蟲,可寄生于植物根部,影響根系長勢,甚至造成根部腫大或壞死等癥狀。美洲劍線蟲組(Xiphinemaamericanumgroup)屬于劍線蟲屬,在我國北京、山東、浙江等多省市都有報道,為我國分布最廣泛的劍線蟲屬內種群,但美洲劍線蟲組內部分種間的差異非常小,甚至交叉重疊,rDNA 序列的相似性很高,其有效種數量存在爭議,如Lamberti等[1]認為有49個有效種,Luc等[2]認為有34 個有效種。1998 年Luc等[2]在排除了地理因素后認為X.brevicollum與X.incogitantum、X.parvum、X.sheri、X.taylori、X.pseudoguirani幾個種之間形態學差別甚微,其形態測量數據存在明顯的重疊,都應歸X.brevicollum的二級同物異名,其形態學偏差屬于種內變異。Luc等[2]進一步指出,X.brevicollum是孤雌生殖的種,其各個群體其實為一個克隆或若干克隆的混合體,再加上其廣泛的地理分布,群體間存在較大的變異是很正常的。在山西境內尚未有X.brevicollum的報道,本文在山西太谷采集的線蟲樣品中,對分離到的劍線蟲進行了形態觀察和測量,并對rDNA-ITS1、rDNA-ITS2和28S序列進行了擴增、測序及系統進化分析。
1 材料與方法
1.1 樣品的采集和線蟲的分離
采集地點:山西省太谷縣山西農業大學校園內,在一株枝葉枯黃的松樹根際距地表5~30cm 深處挖取土壤500g左右放入塑料袋中混勻封口,標明采樣地、采樣時間、寄主植物等,帶回實驗室,4 ℃下保存,用于線蟲分離鑒定。采用淺盤分離法分離線蟲:在塑料筐里均勻鋪兩層紙巾,再用電子秤稱取100g土樣,均勻鋪在塑料筐中的紙巾上面,將塑料筐放在淺盤中,往淺盤中加入400mL 水,放置48h后倒掉塑料筐中的土樣,將淺盤中的線蟲懸浮液倒入600目孔篩,篩掉線蟲懸浮液中多余水分,至篩中剩余懸浮液約30~50mL,轉移至50mL的試管中,靜置3h備用。
1.2 線蟲形態鑒定
參照武揚等的方法[3]。
1.3 線蟲DNA的提取
參照Wu等的方法[4]略作改進。用移液槍吸取10μL ddH2O 放入0.2mL PCR 管中,用挑針挑取單條線蟲放入其中,加入含8μL WLB 液(含125 mmol/L KCl,25 mmol/L Tris-HCl,pH 8.3,3.75 mmol/L MgCl2,2.5mmol/L DTT,1.125%Tween 20)管中,并向管中加入2μL 蛋白酶K(600μg/mL)。混勻后,將管放入-70 ℃冰箱過夜,次日轉入PCR 儀,65 ℃孵育1h、95 ℃10 min。最后經14 000r/min離心1min,即得粗提DNA 的懸浮液。其上清即可直接用于PCR 擴增或者于-20 ℃下保存備用。
1.4 分子檢測
①PCR 反應體系:在0.2mL PCR 管中分別加入10μL mix(2×Taqpolymerase,2×PCR buffer,2×dNTPs),6μL ddH2O,10μmol/L 的上下游引物各1μL,線蟲粗提DNA 2μL。
②ITS1區擴增:以粗提DNA 懸浮液的上清為模板,采用通用的上游引物 V1(5′-TTGATTACGTCCCTGCCCTTT-3′)和下游引物V4(5′-ACGAGCCGAGTGATCCACCG-3′)[5]。擴增程序為95 ℃3min;95℃30s,50℃30s,72℃90s,35個循環;72 ℃5min;4 ℃保溫.
③ITS2區擴增:以粗提DNA 懸浮液的上清為模板,采用通用的上游引物V1,下游引物V2(5′-TTTCACTCGCCGTTACTAAGG-3′)[5]。擴增程序為95℃4min;95℃30s,52℃30s,72℃90s,35 個循環;72 ℃5min;4 ℃保溫。
④28S區擴增:以粗提DNA 懸浮液的上清為模板,采用通用的上游引物D2A(5′-ACAAGTACCGTGAGGGAAAGTTG-3′)[6],下游引物D3B(5′-TCGGAAGGAACCAGCTACTA-3′)。擴增程序為94℃4 min;94℃45s,53℃1min,72℃2min,35 個循環;72℃10min;4℃保溫。
⑤構建貝葉斯系統發育樹:取5μL PCR 反應產物用1%的瓊脂糖凝膠電泳(100V,100mA)分離。電泳后經EB 染色,紫外檢測儀上觀察記錄和拍照。由上海生工生物技術公司進行測序,測序結果經人工校對后與GenBank 數據庫中的已知序列進行BLAST 比較,并從數據庫獲得相關種屬序列,構建貝葉斯系統發育樹。
2 結果與分析
2.1 山西短頸劍線蟲的形態分析
顯微觀察結果見圖1a~h。雌線蟲經熱殺死后呈腹面彎曲的“C”形,體長1.71~2.26mm,兩端漸細。唇區圓形,縊縮明顯,高度為(3.7±0.6)μm(2.3~5.2μm),側器孔為馬鞍狀;齒尖針細長、高度硬化,長度為(87.0±3.3)μm(76.2~105.3 μm);齒針導環為雙環,后環高度骨化,后導環到前端距離為(72.3±2.1)μm(64.4~78.0μm);齒尖針基部呈叉狀,齒托基部呈顯著的凸緣狀,凸緣處體寬為(35.8±2.7)μm(30.5~42.4μm);陰門位于體長中間偏上,子宮內無特殊分化,生殖腺對生、均發育完全,生殖腺較短、前后卵巢長度相等。尾短圓錐形,有輕微指狀突起,尾長略長于肛門處體寬。未見雄蟲。
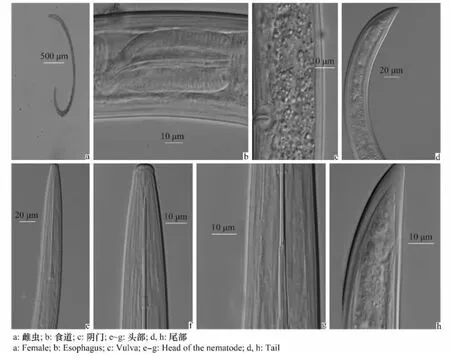
圖1 山西短頸劍線蟲雌蟲的形態特征Fig.1 The morphological characteristic of Xiphinema brevicollumfrom Shanxi Province
雌線蟲的形態測量值見表1,根據Loof等[7]多歧檢索表,從山西太谷縣松樹根際得到的劍線蟲特征代碼為A2-B?-C3-D5/(6)-F2-G1-H2-I4,該蟲被鑒定為X.brevicollum。

表1 山西短頸劍線蟲的形態測量值1)Table 1 The microscopic measurement of Xiphinema brevicollumfrom Shanxi Province
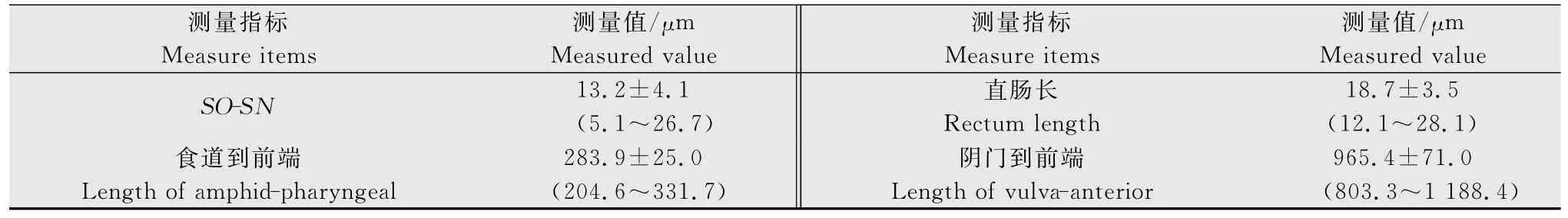
續表1 Table 1 (Continued)
2.2 分子生物學特征
利用MrBayes 3.1.2 軟件對該線蟲的ITS1、ITS2和28SRNA 基因中的D2D3區序列構建貝葉斯系統發育樹進行進化分析。
(1)ITS1 區分子生物學特征:通過GenBank中BLAST比對可知太谷縣松樹根際的Xiphinema分離物ND-46 與AY359856(X.brevicollum)、FM211422(X.brevicollum)、AY359858(X.diffusum)、AY430190(X.brevicollum)和FM211425(X.brevicollum)的相似性在94%以上,在貝葉斯系統發育樹(圖2)上ND-46與FM211422(X.brevicollum)、FM211425(X.brevicollum)、AY359858(X.diffusum)、AY430190(X.brevicollum)在同一分支上,證實了Luc等[2]的觀點,即X.diffusum為X.brevicollum的同物異名,所以根據比對和進化分析可以得出ND-46為X.brevicollum。
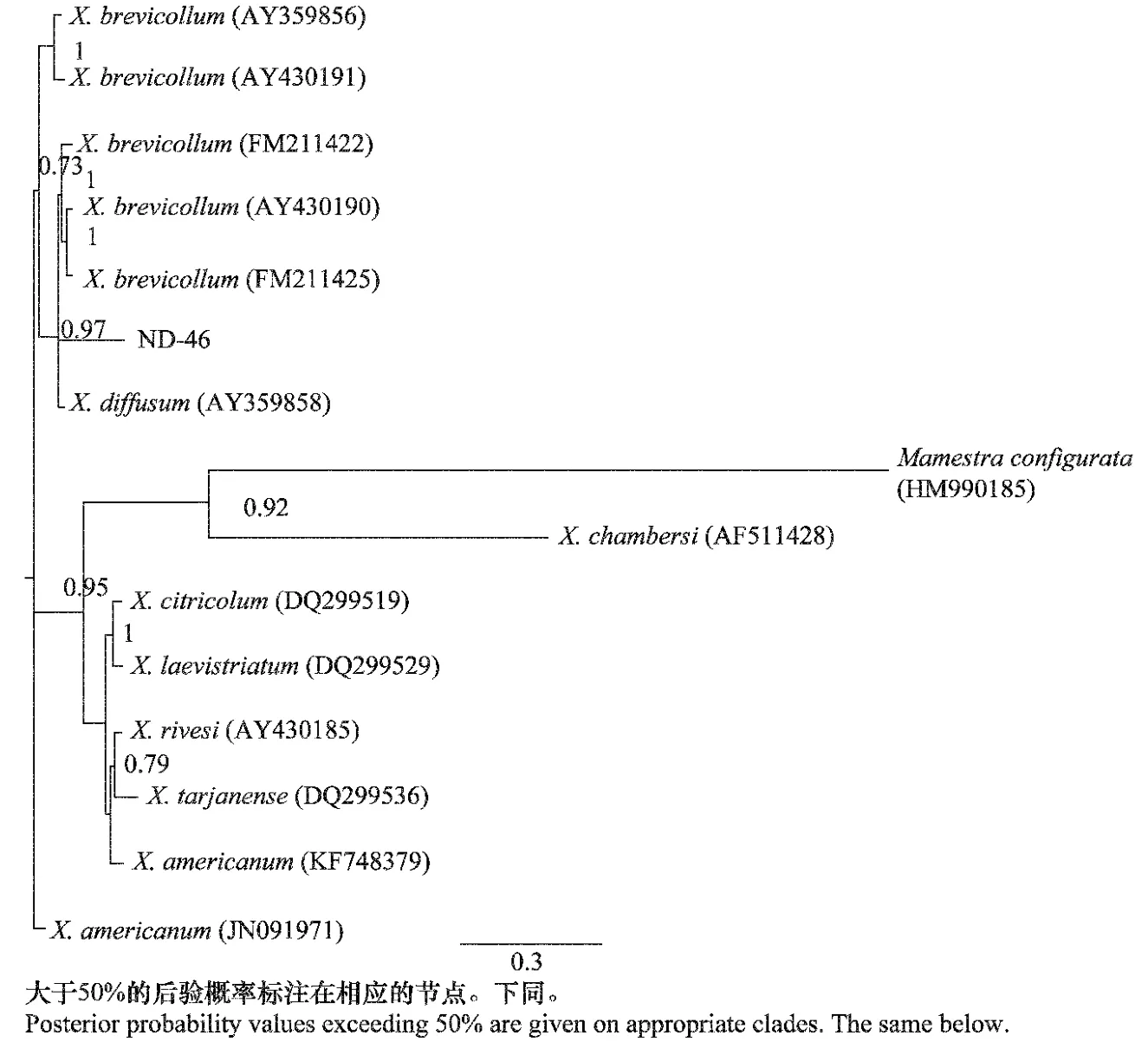
圖2 基于rDNA-ITS1區序列的劍線蟲屬貝葉斯系統發育樹Fig.2 The Bayesian tree based on rDNA-ITS1region of the genus Xiphinema
(2)ITS2 區分子生物學特征:經BLAST 比對可知,太谷縣松樹根際的Xiphinema分離物ND-46與JX218046(X.brevicollum)和FM211420(X.brevicollum)相似性在94%,在貝葉斯系統發育樹(圖3)可以看到ND-46與JX218046(X.brevicollum)親緣關系最近,在同一分支上,因此可以得出ND46為X.brevicollum。
(3)28SRNA 基因中D2D3區分子生物學特征:在BLAST比對發現ND-46與KF430800(X.brevicol-lum),HM163210(X.inaequale),AY601601(X.brevicollum)的相似性在99%,在貝葉斯系統發育樹(圖4)上它們也都在同一支上,親緣關系很近。從比對與進化分析可以進一步得出ND-46為X.brevicollum。
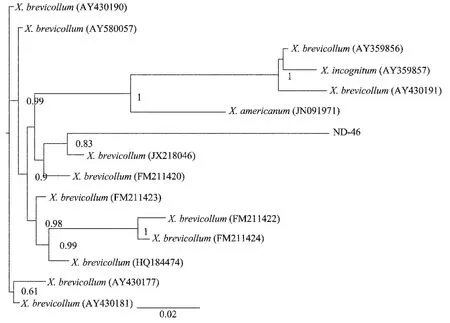
圖3 基于rDNA-ITS2區序列的劍線蟲屬貝葉斯系統發育樹Fig.3 The Bayesian tree based on rDNA-ITS2region of the genus Xiphinema

圖4 基于28SRNA基因D2D3區的劍線蟲屬貝葉斯系統發育樹Fig.4 The Bayesian tree based on D2D3region of 28SRNA gene of the genus Xiphinema
3 討論
劍線蟲屬是線蟲門中種類最多的一個屬,其分類方法繁多,但劍線蟲屬內種的多歧檢索表得到了全世界的普遍接受。基于Loof等[7-11]多歧檢索表,從山西太谷松樹根部得到的劍線蟲特征代碼為A2-B?-C3-D5/(6)-F2-G1-H2-I4,但是據 Lamberti等[12]的統計,在美洲劍線蟲組內已被描述的組內種有49個,其形態特征十分相似,也沒有明顯的種間差異,在劍線蟲屬形態分類多歧檢索表中[6]它們應用相同的鑒定代碼,很難將其依據形態區分。
劍線蟲的鑒定目前普遍采用的方法是rDNARFLP。Vrain等[5,13]應用此方法區分了16個美洲劍線蟲群體rDNA 中ITS 區的特征;Knoetze等[14]和Ni等[15]運用rDNA-RFLP方法分別鑒定了南非和中國臺灣的一些劍線蟲屬群體。隨著劍線蟲屬分子分類研究的不斷豐富,利用某些基因區段特別是rDNA 的分子系統發育分析的研究越來越引起線蟲界的普遍接受[16-18],基于rDNA-ITS、D2D3序列構建的系統發育樹不僅從一定水平上揭示了劍線蟲屬的美洲劍線蟲組Xiphinemaamericanumgroup內種群間的親緣關系及與其他種間關系,也從另外一個角度證明了在山西太谷松樹根際得到的劍線蟲與X.brevicollum親緣關系較近。
基于形態特征與貝葉斯系統發育樹的雙向研究表明:在山西太谷縣松樹根際發現的這一美洲劍線蟲為X.brevicollum。
[1]Lamberti F,Hockland S,Agostinelli A,et al.TheXiphinemaamericanumgroup.Ⅲ.Keys to species identification[J].Nematologia Mediterranea,2004,32(1):53-56.
[2]Luc M,Coomans A,Loof P A A,et al.TheXiphinemaamerianumgroup(Nematoda:Longidoridae).2.Observation onXiphinemabrevicollumLorfello da Costa,1961and comments on the group [J].Fundamental and Applied Nematology,1998,21(5):475-490.
[3]武揚,劉斌,梁定東,等.一種改進的植物線蟲快速固定和脫水方法[J].浙江大學學報(農業與生命科學版),2006,32(2):123-126.
[4]Wu Y,Zheng J,Robbins R T.Molecular characterization of aXiphinemahunaniensepopulation with morphometric data of all four juvenile stages[J].Journal of Nematology,2007,39(1):37-42.
[5]Vrain T C.Restriction fragment length polymorphism separates species of the Xiphinemaamericanumgroup[J].Journal of Nematology,1993,25(3):361-364.
[6]De Ley P,Felix M A,Frisse L M,et al.Molecular and morphological characterisation of two reproductively isolated species with mirror-image anatomy(Nematoda:Cephalobidae)[J].Nematology,1999,1:591-612.
[7]Loof P A A,Luc M.A revised polytomous key for the identification of species of the genusXiphinemaCobb,1913(Nematoda:Longidoridae)with exclusion of theX.amerieanum-group:Supplement1[J].Systematic Parasitology,1993,24:185-189.
[8]Loof P A A,Luc M.A revised polytomous key for the identification of species of the genusXiphinemaCobb,1913(Nematoda:Longidoridae)with exclusion of theX.americanumgroup[J].Systematic Parasitology,1990,16(1):35-66.
[9]Loof P A A,Coomans A,Baujard P.On five species of the genusXiphinemaCobb,1913(Nematoda:Longldoridae)recently described from India[J].Nematology,2001,3:277-283.
[10]Loof P A A,Luc M,Baujard P.A revised polytomous key for the identification of species of the genusXiphinemaCobb,1913(Nematoda:Longldoridae)with exclusion of theX.americanum-group:Supplement 2[J].Systematic Parasitology,1996,33:23-29.
[11]Loof P A A,Luc M,Coomans A.TheXiphinemaamerieanumgroup(Nematota:Dorylaimida).1.Comments upon the key to species published by Lamberti and Carone(1992)[J].Fundamental Applied Nematology,1993,16(4):355-358.
[12]Lamberti F,Molinari S,Moens M,et al.TheXiphinemaamericanumgroup.1.Putative species,their geographical occurrence and distribution,and regional polytomous identification keys for the group[J].Russian Journal of Nematology,2000,8(1):65-84.
[13]Vrain T C,Wakarchuk D A,Levesque A C,et al.Intraspecific rDNA restriction fragment length polymorphism in theXiphinemaamericanumgroup[J].Fundamental and Applied Nematology,1992,15(6):563-573.
[14]Knoetze R,Burger J T,Meyer A J.Discrimination of someXiphinemaspecies from South Africa by rDNA-RFLP analysis[J].African Plant Protection,2000,6(2):25-30.
[15]Ni H F,Cheng Y H,Chen R S,et al.Discrimination ofXiphinemaspecies from Taiwan by rDNA-RFLP analysis[J].Plant Pathology Bulletin,2003,12(4):235-241.
[16]He Yu,Subbotin S A,Rubtsova T V,et al.A molecular phylogenetic approach to Longidoridae(Nematoda:Dorylaimida)[J].Nematology,2005,7:111-124.
[17]Oliveira C M G,Hubschen J,Brown D J F,et al.Phylogenetic relationships amongXiphinemaandXiphidorusnematode species from Brazil inferred from 18SrDNA sequences[J].Journal of Nematology,2004,36(2):153-159.
[18]Ye W M,Szalanski A L,Robbins R J.Phylogenetic relationships and genetic variation inLongidorusandXiphinemaspecies(Nematoda:Longdoridae)using ITS1sequences of nuclear ribosomal DNA[J].Journal of Nematology,2004,36(1):14-19.

