基于分光光度法測定血液中非那西丁與撲熱息痛含量的肝臟儲備功能評估
逯素梅,任瑞,孫濤,馬永梅,馬萬山(山東省千佛山醫院,濟南 250014)
?
基于分光光度法測定血液中非那西丁與撲熱息痛含量的肝臟儲備功能評估
逯素梅,任瑞,孫濤,馬永梅,馬萬山(山東省千佛山醫院,濟南 250014)
摘要:目的建立基于分光光度法測定非那西丁與撲熱息痛含量的肝臟儲備功能評估方法。方法篩選分光光度測定的顯色體系,確定最大吸收波長,分析不同因素對顯色體系的影響,優化非那西丁與撲熱息痛水解的最佳條件,最后對技術體系進行應用性驗證。結果建立了利用分光光度測定樣品中非那西丁和撲熱息痛含量的技術體系,即樣品加入3 mol/L鹽酸水解30 min,加入0.02% 1,2-萘醌-4-磺酸鈉、1%十六烷基三甲基溴化銨及2% NaOH(或3% Na2CO3)(比例為1∶6∶1∶2或3),分別于500 nm和570 nm下測定吸光值,計算各自濃度。該技術測定血漿樣品中非那西丁與撲熱息痛時的分辨率和重復性與高效液相色譜法相當。結論利用分光光度技術測定血液中非那西丁與撲熱息痛含量,二者比值具有評估肝臟儲備功能價值。
關鍵詞:肝臟儲備功能;分光光度技術;非那西丁;撲熱息痛
肝臟儲備功能是肝臟所有儲備肝細胞功能的總和,其在決定是否進行肝切除術及方案選擇上起著不可替代的地位[1],但目前臨床使用的肝臟儲備功能評價技術和指標存在諸多不足。如常用的肝功能生化指標ALT、AST、GGT和LDH,只是表征肝細胞受損,并非肝臟儲備功能的指標[2,3];凝血酶原時間、血漿白蛋白和血漿膽紅素含量能夠反映肝臟的功能,但卻受腎臟排泄功能、胃腸道的消化吸收功能和血紅蛋白的分解代謝等因素影響,造成檢測靈敏度低,特異性差,難以滿足臨床的需要。因此,建立靈敏度高、特異性強的肝臟儲備功能評價體系是當前臨床迫切需要解決的重要課題。其中,利用探針藥物測定肝臟藥物代謝酶細胞色素P450的活性評價肝臟儲備功能備受重視[4]。
細胞色素P450-1A2 (CYP1A2)是CYP酶系的重要家族之一,占整個細胞色素酶P450的15%[5],在人的肝臟呈組成型表達,參與內源性(膽汁酸、膽固醇等)及外源性物質(藥物、毒物)的生物轉化[6,7],是臨床評價肝臟儲備功能的理想靶點。CYP1A2的外源性底物包括咖啡因、非那西丁、茶堿等[8]。研究表明,非那西丁是CYP1A2酶活性的特異性底物[9~11],在肝臟代謝的第一步包括O-脫乙基、N-脫乙酰基和2-羥化反應等過程,其中O-脫乙基化生成撲熱息痛是非那西丁生物轉化的主要步驟。Cui等[12]研究表明,非那西丁O-脫乙基酶在肝臟外組織中的活性極低,非那西丁O-脫乙基反應只有不到5%是在肝臟外進行的,因此非那西丁O-脫乙基作用可作為評價肝臟CYP1A2活性的專屬性和指示性反應。服用探針藥物非那西丁后,測定一定時間內血液中非那西丁與撲熱息痛的比值,用以反映CYP1A2活性及藥物之間的相互作用[13,14],即能準確反映肝臟的生物轉化功能。
1材料與方法
1.1材料人外周血標本采自2012年1月~2014年1月健康成年人新鮮的外周血。試劑包括非那西丁(Sigma公司),撲熱息痛(Sigma公司),對氨基苯酚(阿法埃莎公司),對氨基苯乙醚(阿法埃莎公司),1,2-萘醌-4-磺酸鈉(NQS,日本化成工業株式會社),十六烷基三甲基溴化銨(CTA,國藥集團化學試劑公司),茶堿(國藥集團化學試劑公司),硫化鈉(國藥集團化學試劑公司),高錳酸鉀(國藥集團化學試劑公司),重鉻酸鉀(國藥集團化學試劑公司),甲醇(Merk公司),鹽酸(國產),Na2CO3(國產),NaOH(國藥集團化學試劑公司)。儀器包括Cary100型紫外-可見分光光度計(美國Varian公司),Alliance 2695型高效液相色譜儀(2998UV檢測器)(美國Waters公司),Pico型微量臺式離心機(美國Thermo Fisher Scientific公司),Stratos高速離心機(美國Thermo Fisher Scientific公司),TW12型恒溫水浴槽(德國JULABO公司),XBRIDGE C18色譜柱(美國Waters公司)。
1.2方法
1.2.1顯色體系的選擇
1.2.1.1顯色劑的篩選經查閱文獻和實驗研究表明,非那西丁和撲熱息痛不易與其他化合物反應生成有色產物,而二者的水解脫乙酰基產物對氨基苯乙醚和對氨基苯酚可與多種物質生成有色產物,從而為分光光度法測定非那西丁和撲熱息痛奠定了基礎。在人體內,非那西丁和代謝產物撲熱息痛是混合在一起的,且含量較低。因此,顯色體系應滿足以下條件:①顯色劑在常溫下應穩定,常溫下能迅速與非那西丁和撲熱息痛反應,有色產物穩定。②顯色劑若為一組,則與非那西丁和撲熱息痛反應可產生顏色不同的產物,且二者最大吸收波長差值應盡量大,該種情況下選擇雙波長分光光度技術測定非那西丁和撲熱息痛的含量;顯色劑可為兩組,即測定非那西丁和撲熱息痛的顯色劑不同,這種情況下要求顯色劑應具有專屬性即測定非那西丁(或撲熱息痛)的顯色劑與撲熱息痛(或非那西丁)不反應或不生成能造成干擾的有色產物。③顯色劑不易受其他常規藥物或血清的干擾。④非那西丁和撲熱息痛水解后與顯色劑直接反應或二次處理簡單。
1.2.1.2最大吸收波長配制一定濃度的對氨基苯乙醚和對氨基苯酚的標準溶液,加入顯色劑,待反應穩定后用紫外分光光度計在800~200 nm的范圍內進行掃描,記錄掃描結果,以確定最大吸收波長。
1.2.1.3干擾因素分析配制一定濃度的對氨基苯乙醚和對氨基苯酚的標準溶液,加入干擾因子(如測定對氨基苯乙醚加入對氨基苯酚、血清等),加入顯色劑,待反應穩定后用紫外分光光度計在800~200 nm的范圍內進行掃描,記錄掃描結果,分析各干擾因素的影響。
1.2.2顯色體系的優化根據目標顯色體系,分別從以下幾方面對顯色體系進行優化:①顯色劑各組分添加次序的選擇;②顯色劑用量的優化;③pH值優化;④顯色時間優化;⑤顯色溫度優化。
1.2.3非那西丁與撲熱息痛水解條件的建立使非那西丁與撲熱息痛水解脫乙酰基完全可采取兩種策略即堿水解和酸水解,由于NaOH水解兩種藥物時條件不易控制且不安全,因此本研究采取酸(鹽酸)水解,并對酸的濃度、水解時間進行了探索和優化。
2結果
2.1顯色體系的選擇根據文獻和反復實驗研究表明,能單獨與非那西丁和撲熱息痛的脫乙酰產物對氨基苯乙醚和對氨基苯酚反應生成有色產物的顯色劑很多,但經過預實驗初步確定兩組顯色體系可用于測定同時存在于血液樣品中的兩種物質。其中一種顯色體系為氨基苯乙醚和對氨基苯酚與NQS反應生成黃紅色或紫紅色產物,二者顏色有差別但差別不大,如果加入CTA,則起到增色作用。對氨基苯酚和對氨基苯乙醚與NQS反應產物的最大吸收波長分別為530 nm和465 nm,加入CTA后,最大吸收波長向長波向方向移動,分別變為570 nm和500 nm。因此選擇NQS+CTA作為對氨基苯酚和對氨基苯乙醚的顯色體系。
2.2顯色體系的優化
2.2.1顯色劑濃度和添加次序的優化1 mL待測溶液(含25~500 μg樣品),加入0.02% NQS 4~8 mL,1% CTA 0.5 mL均能得到理想的顏色反應結果,因此選擇6 mL NQS和1 mL CTA,二者加入次序對測定結果無影響。
2.2.2酸堿度及溫度對顯色的影響反應體系的酸堿對測定影響很大[15,16],測定對氨基苯酚(撲熱息痛)時,加入1~4 mL 2% NaOH紫紅色產物穩定,能得到理想結果;測定對氨基苯乙醚(非那西丁)時,有色產物NaOH中不穩定,加入1~6 mL 2% Na2CO3產物穩定,若低于3 mL則不穩定。因此,選擇2 mL 2% NaOH和3 mL 2% Na2CO3用于撲熱息痛和非那西丁的測定。有色產物在5~80 ℃溫度范圍內均較穩定,超過80 ℃,吸光值迅速下降。
2.2.3標準曲線的建立配制系列不同濃度的對氨基苯乙醚和對氨基苯酚,分別依次加入6 mL NQS、1 mL CTA、2 mL 2% NaOH(對氨基苯酚)或3 mL 2% Na2CO3(對氨基苯乙醚),定容至25 mL,于分光光度測定。繪A-C標準曲線。見圖1。回歸方程分別為:A570=0.071 6×(PRL濃度)+0.003 1,A500=0.025 1×(PHN濃度)+0.010 5。

圖1 非那西丁與撲熱息痛A-C標準曲線
2.3非那西丁與撲熱息痛最佳水解條件建立上述方面建立的分光光度法所測定的實際是非那西丁與撲熱息痛的水解脫乙酰基的產物,因此確保樣品中的非那西丁與撲熱息痛完全水解是極關鍵的一步。本項目采取鹽酸水解。首先確定最佳鹽酸濃度,其中水解率=1-測試含量/初始含量,含量均利用建立的HPLC技術測定。非那西丁與撲熱息痛鹽酸水解的最佳濃度均為2~6 mol/L。配濃度均為3 mmol/L的非那西丁和撲熱息痛混合溶液,采用3 mol/L的鹽酸水解,以確定最佳水解時間,其中水解率=1-測試含量/初始含量,含量均利用前面建立的HPLC技術測定。得出非那西丁與撲熱息痛最佳水解時間均為30 min。
2.4應用驗證取健康人血漿,配制不同濃度的非那西丁和撲熱息痛混合溶液,每種濃度溶液分為兩份,一份利用HPLC技術測定含量,另一份利用建立的水解條件水解、加入顯色劑、測定吸光值并利用標準曲線計算含量。在濃度為1~20 μg/mL的濃度范圍內,利用所建立的分光光度技術進行測定,RSD均<10%,當濃度超過5 μg/mL時,RSD<5%,測定更加準確,重復性好。見表1。
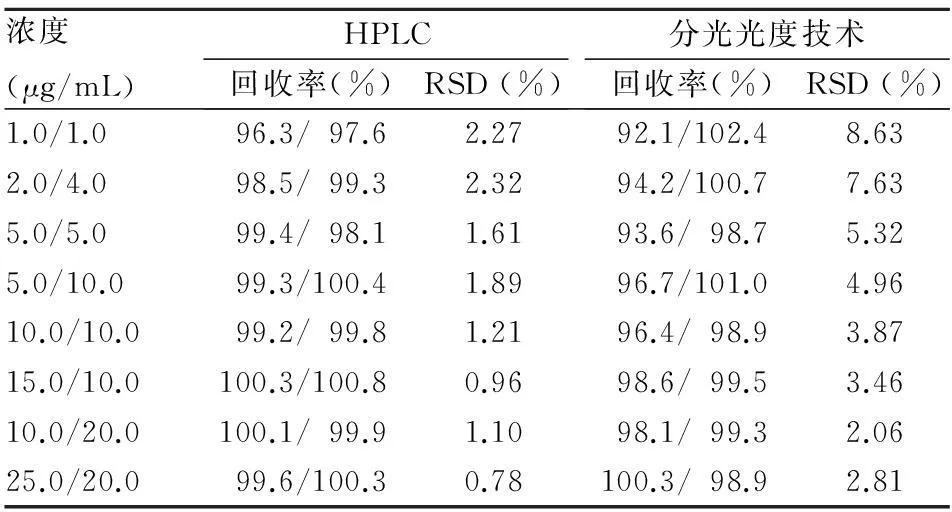
表1 HPLC與分光光度技術測定比較(n=4)
3討論
在評價肝臟儲備功能方面,有許多不同的方法。總的來說,傳統生化指標較易測定,臨床上廣泛應用;定量肝功能試驗及影像學手段,操作較復雜,試劑設備要求較高;臨床肝功能分級綜合幾個生化指標,準確性較高,但有一定局限,尤其是在反映肝臟在承受外來額外負荷時。因此,正確評價肝臟儲備功能,是目前臨床迫切需要解決的重要課題。
探針藥物試驗是通過測定代謝產物含量的變化,評價肝臟的功能狀態,但代謝產物的形成過程,不僅與肝臟本身功能相關,還受生物利用度、蛋白結合率、腎功能等的影響。CYP1A2在肝內特異表達,約占肝臟CYP酶總量的13%[17],是各種因素導致肝臟疾病的共同易損靶點[18],約55%文獻選用非那西丁O-脫乙基化反應研究體外CYP1A2活性[19],其特異底物非那西丁在肝臟經O-脫乙基化生成撲熱息痛,通過測定血液中非那西丁及撲熱息痛含量評估肝臟儲備功能,具有很大優勢,主要包括找到了共同的易損靶點;肝外代謝極少;檢測終產物體現了生物轉化的連續性;受胃腸吸收、腎臟排泄功能的影響小。此外,非那西丁具有對人體影響小,簡便測定等優點[20],且價格低廉,因此,其是臨床實驗的一個理想探針藥物。
血液中的非那西丁和撲熱息痛含量均為微克級,需借助HPLC、液相色譜—串聯質譜法(LC-MS)等現代儀器分析技術才能準確測定,這些經典技術技術具有分辨率高、測定結果準確可靠等優點,但分析儀器價格昂貴、測定成本高、步驟繁鎖,顯然無法滿足臨床肝臟功能大規模檢測的要求。考慮到臨床檢驗的儀器如全自動生化分析儀、酶標儀、分光光度計均基于分光光度技術,建立基于分光光度技術的非那西丁與撲熱息痛的高分辨測定技術,從而為研究開發實用性強的新型肝臟儲備功能檢測試劑盒奠定堅實的基礎。
本研究建立了利用分光光度技術測定血液樣品中微量非那西丁和撲熱息痛的技術體系,即樣品加入3 mol/L鹽酸水解30 min,加入0.02% NQS、1% CTA及2% NaOH(或3% Na2CO3)(比例為1∶6∶1∶2或3),分別于500 nm和570 nm下測定吸光值,計算各自濃度。本研究所建立的技術為開發基于血液中非那西丁和撲熱息痛比值的肝臟儲備功能檢測試劑盒奠定了基礎。通過應用性驗證,本研究所建立的分光光度技術具有分辨率高、測定結果準確可靠等優點,而且克服了分析儀器價格昂貴、測定成本高、步驟繁鎖的不足,可以滿足臨床肝臟儲備功能大規模檢測的要求。
參考文獻:
[1] Manizate F, Hiotis SP, Labow D, et al. Liver functional reserve estimation: state of the art and relevance to local treatments[J]. Oncology, 2010,78(1):131-134.
[2] 梁明龍,張久權,王健.術前肝臟儲備功能評估方法的研究進展[J].中華消化外科雜志,2014,13(4):317-320.
[3] Ge PL, Du SD, Mao YL. Advances in preoperative assessment of liver function[J]. Hepatobiliary Pancreat Dis Int, 2014,13(4):361-370.
[4] 李國昌,陳衛軍,蒲宇紅.細胞色素P450酶系與藥物代謝[J].農墾醫學,2004,26(1):26-29.
[5] 劉哲,王祥瑞.細胞色素酶P4501A2表型分析及其應用價值[J].實用醫學雜志, 2008,24(5):871-872.
[6] 王瀟,劉華,白潔.細胞色素P450調節肝臟藥物代謝的途徑[J].生物技術通報, 2009,(7):39-41.
[7] Rifkind AB. CYP1A in TCDD toxicity and in physiology-with particular reference to CYP dependent arachidonic acid metabolism and other endogenous substrates[J]. Drug Metab Rev, 2006,38(1):291-335.
[8] Qu ZQ, Li XD, Liu HL, et al. Impaired clearance of phenacetin in hepatic cirrhosis and fibrosis[J]. Int J Clin Pharmacol Ther, 2007,45(1):55-62.
[9] 張瑞媚,李允武,金芝貴,等.HPLC法測定非那西丁和對乙酰氨基酚的血濃度[J].北方藥學,2012,9(1):47.
[10]胡云珍,姚彤煒.細胞色素P4501A的研究進展[J].中國藥學雜志,2003,38(4):246-250.
[11] Faber MS, Jetter A, Fuhr U. Assessment of CYP1A2 activity in clinical practice: why, how and when[J]. Basic Clin Pharmacol Toxicol, 2005,97(3):125-134.
[12] Cui ZF, He P, Luo M, et al. Phenacetin O-deethylation in extrahepatic tissues of rats[J]. Eur J Drug Metab Pharmacokinet, 2002,27(2):107-111.
[13] Tanaka E, Kurata N, Yasuhara H. How useful is the "cocktail approach"for evaluating human hepatic drug metabolizing capacity using cytochrome P450 phenotyping probes in vivo[J]. J Clin Pharm Ther, 2003,28(3):157-165.
[14] Dahl ML. Cytochrome P450 phenotyping/genotyping in patients receiving antipsychotics: useful aid to prescribing[J]. Clin Pharmacokinet, 2002,41(7):453-470.
[15] Filik H, Hayvali M, Kilic E. Sequential spectrophotometric determination of paracetamol and p-aminophenol with 2,2′-(1,4-phenylenedivinylene) bis-8-hydroxyquinoline as a novel coupling reagent after microwave assisted hydrolysis[J]. Analytica Chimica Acta, 2004,535(1-2):177-182.
[16] Bandelin FJ, Pankratz RE. Colorimetric Determination of p-Acetophenetidide[J]. Analytical Chemistry, 2002,28(2):218-221.
[17] Urlacher VB, Eiben S. Cytochrome P450 monooxygenases: perspectives for synthetic application[J]. Trends Biotechnol, 2006,24(7):324-330.
[18] 顧而立,賀平,王虹,等.非那西丁代謝試驗與13C-美沙西丁呼氣試驗在正常志愿者中的重復性和相關性[J].肝臟,2012,17(12):849-853.
[19] Yuan R, Madani S, Wei XX, et al. Evaluation of cytochrome P450 probesubstrates commonly used by the pharmaceutical industry to study in vitro drug interactions[J]. Drug Metab Dispos, 2002,30(12):1311-1319.
[20] Huang W, Qu ZQ, Li XD, et al. The effect of transcatheter arterial chemoembolization on CYP1A2 activity in patients with hepatocellular carcinoma[J]. J Clin Pharm Ther, 2008,33(5):489-493.
Assessment of liver reserve function based on determination of phenacetin
and paracetamol by spectrophotometry
LUSu-mei,RENRui,SUNTao,MAYong-mei,MAWan-shan
(ShandongProvincialQianfoshanHospital,Jinan250014,China)
Abstract:ObjectiveTo establish a liver reserve function assessment method based on detection of phenacetin and paracetamol by spectrophotometry. MethodsTo screen the spectrophotometric color system, determine the maximum absorption wavelength, analyze the influence of color system in different factors, optimize optimal conditions that phenacetin and paracetamol hydrolyze, and then verify the application of this technology about the established system. ResultsThe technology system detected phenacetin and paracetamol of blood samples using spectrophotometry was established, in which 3 mol/L hydrochloric acid was added to samples to hydrolyze for 30 min, then added 0.02% 1,2-naphthoquinone-4-sulfonate, 1% sixteen alkyl bromide and 2% sodium hydroxide (or 3% sodium carbonate) (ratio of 1∶6∶1∶2 or 3), and then the absorbance was measured under 500 nm and 570 nm to calculate each concentration. Resolution and repeatability of technology used for determining phenacetin and paracetamol of plasma samples were comparable with HPLC. ConclusionRatio of phenacetin and paracetamol under established spectrophotometric system could assess liver reserve function.
Key words:liver reserve function; spectrophotometry; phenacetin; paracetamol
(收稿日期:2014-11-04)
中圖分類號:R333.4
文獻標志碼:A
文章編號:1002-266X(2015)04-0014-04
doi:10.3969/j.issn.1002-266X.2015.04.005
通信作者簡介:馬萬山(1967-),男,碩士,主任技師,研究方向為臨床醫學檢驗。E-mail: mwsqianyi@163.com
作者簡介:第一逯素梅(1982-),女,博士,主管技師,研究方向為臨床醫學檢驗。E-mail: lsmqianyi@126.com
基金項目:山東省科技攻關項目(2009GG10002005);山東省醫藥衛生科研項目(2007HW116)。

