大鼠GAD65 基因慢病毒載體的構建及其在MSCs 中的表達
趙元淑,鄧 鎮,陳 麗,周玉波,馬 猛,羅亞楠,胡景鑫,雷水生,朱曉琴
GAD65 是腦內GABA(γ-aminobutyric acid,GABA)合成的限速酶。GABA 是哺乳動物腦內重要的抑制性神經遞質[1],在正常機體內GABA 和興奮性神經遞質谷氨酸(glutamic acid,Glu)的量在腦內保持相對平衡,當神經元損傷GAD65 含量降低時腦內GABA 濃度降低可以引起癲癇的發生。目前細胞移植法已經成為癲癇療法的研究熱點,研究表明將GAD65 基因通過細胞移植的方法導入腦內可以有效抑制癲癇的發生[2,3],但是這些研究中使用的種子細胞如神經干細胞、神經前體細胞等由于取材不方便、涉及倫理等問題,限制了其在實驗和臨床中的應用,因此選擇一種理想的種子細胞是細胞移植的根本。骨髓MSCs 在體內外具有很強的增殖能力和多分化潛能[4,5],是一種理想的種子細胞,為了探討GAD65 基因修飾的MSCs 移植對癲癇的作用,本實驗擬通過基因重組技術構建GAD65 的慢病毒載體并感染MSCs,為進一步研究細胞移植后GAD65 基因在腦內的表達及對癲癇的治療效果奠定基礎。
1 材料和方法
1.1 材料和試劑 大腸桿菌DH5α、293 T 細胞、pCDNA3.1-GAD65 質粒由本實驗室保存;LV5-GFP 及包裝質粒由廣州醫科大學藥理實驗室惠贈;NotI、Eco31I、DNA 連接酶購于Fermentas 公司;DNA凝膠回收試劑盒購于天根生化科技有限公司;Lipofectamin2000、Opti-MEM 購于Invitrogen 公司;胎牛血清、低糖DMEM、胰酶購于Gibco;一抗購于Abcam,二抗購于北京中杉金橋。
1.2 方法
1.2.1 LV5-GAD65 慢病毒載體的構建與鑒定PCR 擴增pCDNA3.1-GAD65 中的GAD65 基因片段,根據Genbank 中GAD65(NM_012563.1)的序列設計引物,上下游引物分別加上NotI 和Eco31I 及保護堿基。上游引物5’GATATGCGGCCGCATGGCATCTCCGGGCTCTGGCTTTTGG 3’,下游引物5’CTATCGGTCTCGGATCCTTACAAATCTTGTCCCAGGCGTTC 3’擴增片段為1758 bp。PCR 條件為:95℃3 min;94 ℃30 s;55 ℃30 s;72 ℃30 s;30 個循環72 ℃5 min。利用Agarose 電泳并切膠回收目的片段。酶切、電泳,用DNA 凝膠回收試劑盒回收GAD65 基因片段和載體LV5。用T4 DNA ligase 連接GAD65 基因片段和線性化的載體。小量抽提質粒,送上海英駿生物技術公司測序。
1.2.2 慢病毒的包裝與滴度測定 轉染前1 d,將293 T 細胞接種于15 cm 平皿中,37 ℃5%CO2培養過夜。取1.5 ml Opti-MEM,加入100 μl 的含有穿梭質粒和包裝質粒的(pGag/pol、pRev、pVSVG、LV5-GFP-GAD65)慢病毒;另取1.5 ml Opti-MEM,加入300 μl Lip2000;將上述兩種液體混合,室溫放置20 min。用上述混合液轉染平皿中的細胞,6 h 后吸除轉染液。72 h 收集細胞上清液,離心過濾后分裝,-80 ℃冰箱保存。
將293 T 細胞以3×104濃度接種于96 孔板,各孔加入不同濃度梯度的病毒液100 μl(10-1、10-2、10-3、10-4、10-5),以LV5-GFP 作為對照組,37 ℃5% CO2培養24 h。72 h 后通過熒光顯微鏡計算熒光數,并根據公式TU/μl=(GFP 陽性細胞率×轉染細胞數/100×每孔加入病毒稀釋液體積)×1/稀釋因子計算出病毒液滴度。
1.2.3 慢病毒感染MSCs 轉染前1 d,將對數期生長的MSCs 以5×103接種于96 孔板中,將待轉染細胞分3 組:A 組:LV5-GFP-GAD65 轉染組;B組:空質粒轉染組;C 組:未轉染組。次日,將病毒液以MOI 200 感染細胞,并加入終濃度5 μg/ml 的Polybrene 增加轉染率(B 組以同樣方法轉染空質粒LV5-GFP,C 組不轉染)。24 h 后換液,48 h 觀察轉染細胞熒光表達情況。通過嘌呤霉素篩選得到穩定擴大培養后進行實驗指標檢測。
1.2.4 Western blot 檢測感染后GAD65 蛋白的表達 取病毒感染后2 w 的MSCs,加入裂解液提蛋白,BCA 法測蛋白濃度。取40 μl 蛋白上樣行丙烯酰胺凝膠電泳,將蛋白轉到PVDF 膜上,5%脫脂奶粉封閉1 h,一抗(稀釋至1:2000)4 ℃封閉過夜,加入二抗(稀釋至1:5000)室溫孵育1 h,ECL 曝光顯色。
1.3 統計學處理 采用SPSS13.0 統計軟件對各數據進行分析,統計數據用±s 表示。各組間數據比較采用單因素方差分析(ANOVA),組間兩兩比較采用LSD 檢驗,檢驗水準為α=0.05。
2 結果
2.1 LV5-GFP-GAD65 慢病毒載體的構建與鑒定 構建成功的LV5-GAD65 慢病毒載體經限制性內切酶NotI 和Eco31I 酶切電泳鑒定結果(見圖1)顯示:擴增出大小為1 758 bp 的GAD65 基因片段,和大小為9 337 bp 的LV5 基因片段。測序結果(見圖2)顯示與Genbank 中GAD65(NM_012563.1)的序列完全一致,無讀碼框移。LV5-GAD65 慢病毒載體構建成功。
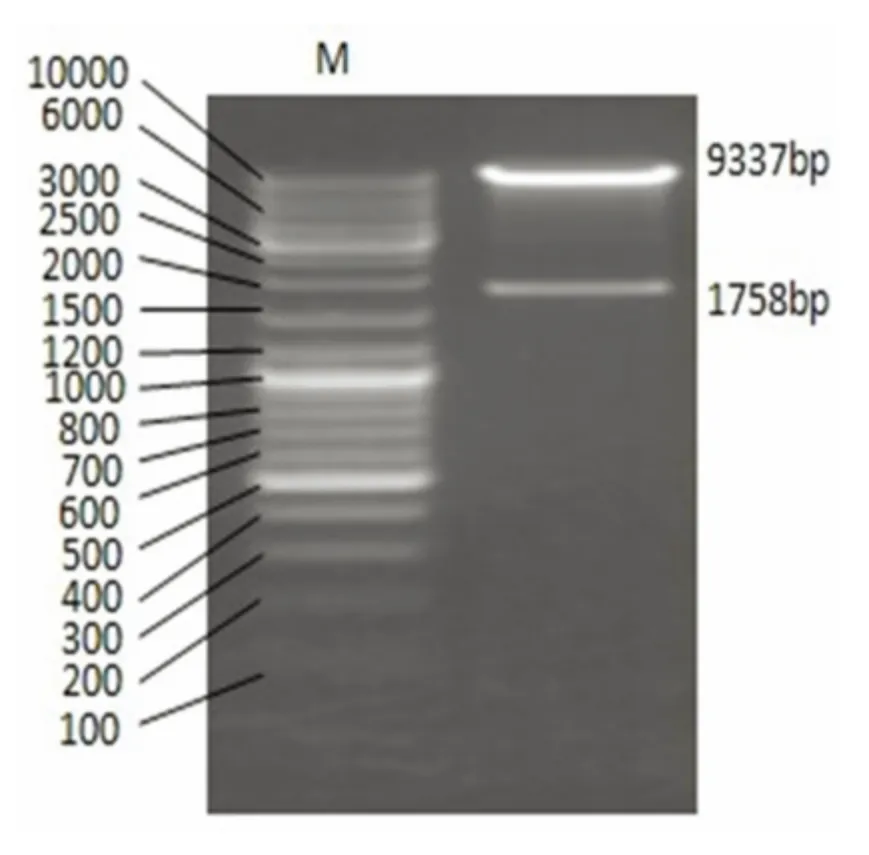
圖1 重組質粒酶切鑒定

圖2 重組質粒LV5-GFP-GAD65 部分測序圖
2.2 慢病毒包裝與滴度測定 慢病毒4 種質粒共轉染293 T 細胞后,72 h 觀察細胞熒光表達。構建的質粒能夠成功感染293 T 細胞。根據病毒滴度計算公式計算出濃縮后LV5-GAD65 慢病毒病毒液滴度為5×107TU/ml,空質粒LV5 的滴度為7×107TU/ml,能夠滿足實驗對病毒液滴度的要求。
2.3 慢病毒感染MSCs 病毒液以MOI 300 感染大鼠MSCs,24 h 換液后熒光不是很明亮,感染72 h后熒光顯微鏡下可以觀察到明亮的綠色熒光,感染率達到90%以上(見圖3)。

圖3 A:LV5-GFP-GAD65 感染MSCs,可見光;B:LV5-GFPGAD65 感染MSCs,熒光
2.4 Western blot 檢測MSCs 中GAD65 蛋白的表達 提取病毒液感染后的各組MSCs 的蛋白,行Western blot 檢測,結果顯示(見圖4):LV5-GFPGAD65 轉染組過表達GAD65 蛋白,而LV5-GFP 空質粒轉染組、未轉染組未檢測到GAD65 蛋白表達。說明包裝濃縮的病毒液感染間充質細胞后,能夠穩定過表達GAD65 蛋白。
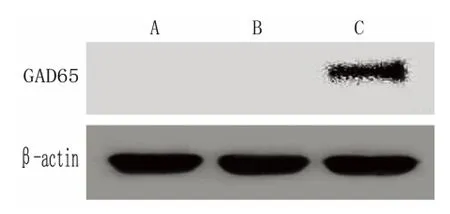
圖4 Western blot 檢測MSCs 中GAD65 的表達
3 討論
顳葉癲癇是目前最難治療的癲癇類型之一,主要表現為海馬硬化,抑制癲癇發作的GABA 能神經元數量大幅度減少,導致腦內神經遞質失衡從而引起癲癇的發生[6~8]。細胞移植作為癲癇的替代療法因其應用安全有效越來越受到重視。骨髓MSCs 是一種來源于骨髓的非造血前體細胞,由于其具有向非間充質細胞譜系如神經細胞、神經膠質細胞、少突膠質細胞等分化的多向分化的能力而成為治療神經損傷的理想種子細胞[9];移植MSCs 可以用于治療脊髓損傷、癲癇等疾病[10,11],但是由于MSCs 在腦內分化成為神經元需要大概3 w 的時間[12,13],而GAD65 基因修飾的MSCs 可以在短時間內產生高濃度的GABA[14],因此移植GAD65 基因修飾的MSCs是治療癲癇的理想選擇。
GAD65 cDNA 全長1758 bp,編碼585 個氨基酸,GAD65 在腦組織內主要位于神經軸突末梢,合成突觸釋放的GABA。本實驗對GAD65 基因進行擴增測序,結果與Genbank 中序列完全一致,無堿基突變和讀碼框移。將DNA 導入真核細胞的方式有兩種:瞬時轉染與穩定轉染:瞬時轉染中,轉染的DNA 不必整合到宿主染色體,轉染的基因會隨著細胞的增殖逐漸丟失;穩定轉染是將轉染的目的基因整合到染色體DNA 中,從而建立克隆的細胞系[15]。研究基因化細胞移植對癲癇的療效則需要GAD65 基因在MSCs 中長期穩定的表達。慢病毒載體是細胞穩定轉染的理想載體。慢病毒載體來源于人類免疫缺陷病毒-1(HIV-1)一種基因轉移載體,因其具有可感染分裂及非分裂細胞、轉移基因片段容量大、目的基因表達時間長、不易引起免疫反應等優點被廣為應用[16~18]。因此,將長為1758 bp 的GAD65 基因穩定轉入MSCs,并建立穩定轉染的細胞系選用慢病毒作為載體是非常合適的。本實驗應用的慢病毒載體是以國際通用的第3 代載體系統為基礎,通過改建構成的四質粒系統,慢病毒載體刪除了全部HIV-1 的編碼基因,應用安全穩定。用包裝產生的高滴度的病毒液感染MSCs,感染效率高,感染率大于90%,通過嘌呤霉素篩選擴大培養后得到穩定表達GAD65基因的細胞株。
本實驗構建了GAD65 慢病毒表達載體,經酶切、測序鑒定,證實慢病毒載體構建成功。包裝產生的病毒液濃度為5×107TU/ml。將病毒液感染大鼠MSCs。Western blot 檢測顯示蛋白表達顯著升高。本實驗成功構建GAD65 慢病毒表達載體,并可以在MSCs 中正確過表達,為進一步研究基因化細胞治療癲癇奠定基礎。
[1]Lindefors N.Dopaminergic regμlation of glutamic acid decarboxylase mRNA expression and GABA release in the striatum:a review[J].Prog Neuropsychopharmacol Biol Psychiatry,1993,17(6):887-903.
[2]Thompson KW,Suchomelova LM.Transplants of cells engineered to produce GABA suppress spontaneous seizures[J].Epilepsia,2004,45(1):4-12.
[3]Thompson KW.Genetically engineered cells with regulatable GABA production can affect afterdischarges and behavioral seizures after transplantation into the dentate gyrus[J].Neuroscience,2005,133(4):1029-1037.
[4]Phinney DG.Building a consensus regarding the nature and origin of mesenchymal stem cells[J].J Cell Biochem Suppl,2002,38:7-12.
[5]Jackson WM,Nesti LJ,Tuan RS.Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells[J].Expert Opin Biol Ther,2010,10(4):505-517.
[6]Wilson CL,Maidment NT,Shomer MH,et al.Comparison of seizure related amino acid release in human epileptic hippocampus versus a chronic,kainate rat model of hippocampal epilepsy[J].Epilepsy Res,1996,26(1):245-254.
[7]Simantov R,Crispino M,Hoe W,et al.Changes in expression of neuronal and glial glutamate transporters in rat hippocampus following kainate-induced seizure activity[J].Brain Res Mol Brain Res,1999,65(1):112-123.
[8]Friedman LK,Pellegrini GDE,Sperber EF,et al.Kainate-induced status epilepticus alters glutamate and GABAA receptor gene expression in adult rat hippocampus:an in situ hybridization study[J].J Neurosci,1994,14(5 Pt 1):2697-2707.
[9]李祿全,余加林,官曉清,等.鼠骨髓間充質干細胞在缺氧缺血性腦病新生鼠腦內的分布及分化[J].第三軍醫大學學報,2005,(4):327-330.
[10]Uccelli A,Prockop DJ.Why should mesenchymal stem cells(MSCs)cure autoimmune diseases[J]?Curr Opin Immunol,2010,22(6):768-774.
[11]Voulgari KA,Fairless R,Karamita M,et al.Mesenchymal stem cells protect CNS neurons against glutamate excitotoxicity by inhibiting glutamate receptor expression and function[J].Exp Neurol,2012,236(1):161-170.
[12]Long Q,Qiu B,Liu W,et al.Functional recovery and neuronal regeneration of a rat model of epilepsy by transplantation of Hes1-down regulated bone marrow stromal cells[J].Neuroscience,2012,212:214-224.
[13]Abdanipour A,Tiraihi T,Mirnajafi ZJ.Improvement of the pilocarpine epilepsy model in rat using bone marrow stromal cell therapy[J].Neurol Res,2011,33(6):625-632.
[14]Castillo CG,Mendoza TS,Aguilar MB,et al.Intranigral transplants of a GABAergic cell line produce long-term alleviation of established motor seizures[J].Behav Brain Res,2008,193(1):17-27.
[15]Sambrook J,Russell WD.分子克隆實驗指南[M].北京:科學出版社,2002.1272.
[16]褚 波,黃雪峰,唐云明.慢病毒載體及其應用進展[J].生物醫學工程學雜志,2008,(1):224-226.
[17]王淑艷,張 愚.慢病毒載體的設計及應用進展[J].中國生物工程雜志,2006,(11):70-75.
[18]楊 馨,胡應和.慢病毒載體介導的RNA 干擾[J].細胞生物學雜志,2006,(4):497-500.

