銀杏內酯和白果內酯對大鼠腦缺血再灌注損傷后VEGF 的表達的影響
劉秀萍,鄧 方
缺血性腦血管病主要是由于血管病變引起血流中斷或減少,導致相應血管供應區缺血缺氧而發生一系列病理生理反應。而促進損傷區域局部血管再生,建立良好的側支循環是缺血后重要的代償機制[1]。血管內皮生長因子(vascular endothelial growth factor,VEGF)于1989 年由Ferara 等在牛垂體濾泡星形膠質細胞體外培養液中分離純化,是胚胎期血管新生和血管形成的關鍵調節物。VEGF 及其受體(vascular endothelial growth factor receptor,VEGFR)系統,在缺血性腦血管病的微循環重建過程中起著至關重要的作用,可能是腦缺血后血管新生調控的中心環節[2]。銀杏內酯(ginkgolides,GK)和白果內酯(bilobalide,BB)是銀杏葉制劑中最為有效的成份,但其對于腦缺血后血管生成方面卻鮮有文獻報道。為深入研究其對急性腦缺血再灌注損傷的作用機制,本研究從血管新生角度,觀察了GK 和BB 對腦缺血的保護作用及對缺血側皮質VEGF 和VEGER-1 表達的影響。
1 材料和方法
1.1 實驗動物 清潔級雄性Wistar 大鼠,體重260~280g,吉林大學實驗動物中心提供,實驗動物生產許可證號:SCXK(吉)2013-0001。
1.2 藥物與試劑 GK(四川成都百裕公司提供,批號:20130801)和白果內酯(四川成都百裕公司提供,批號:NZ130609),兔抗大鼠VEGF 抗體,VEGFR-1 抗體,β-actin,羊抗兔二抗,免疫組化試劑盒(PV-6000,GBI),BCA 蛋白定量試劑盒,濃縮型DAB 試劑盒、ECL 顯影液。
1.3 實驗分組 將實驗動物隨機分為假手術組(Sham 組)、MCAO+鹽水對照組(Saline 組)、MCAO+GK 組(10 mg/kg,GK 組)、MCAO+BB 組(10 mg/kg,BB 組),每組6 只。每組動物于腦缺血再灌注前30 min 腹腔給藥,假手術組和鹽水對照組給予等量生理鹽水。
1.4 大鼠腦缺血再灌注模型的制備 參照Zea Longa 改良線栓法制備大鼠大腦中動脈閉塞模型(middle cerebral artery occlusion,MCAO)。具體方法為:以10%水合氯醛(350 mg/kg)腹腔注射麻醉大鼠,仰臥位固定,碘伏消毒,經頸部正中切口暴露頸動脈三角。手術分離左側頸總動脈、頸外動脈和頸內動脈,結扎頸外動脈和頸總動脈,在頸外動脈近分叉處剪一“V”字形切口,將直徑為0.26 mm、賴氨酸包被的鈍性魚線線栓斜行插入,通過頸內動脈推進到大腦中動脈,插入約18~20 mm 遇有阻力時為止。縫合肌肉和皮膚,術中保持大鼠肛溫在37 ℃±0.5 ℃Sham 組不插線栓,余操作相同。
1.5 神經功能評分、腦梗死體積測定 按Zea Longa 5 分制評分法對大鼠進行評分。評分標準:0分:無神經功能損傷癥狀;1 分:對側前爪不能完全伸展;2 分:向右側轉圈;3 分:向右側傾倒;4 分:不能自發行走,意識喪失。入組標準為:評分為1~3分,且無蛛網膜下腔出血。大鼠腦缺血2 h 再灌注12 h 后,麻醉后迅速取腦,于-20 ℃冰箱中速凍18 min,然后將腦組織放入腦槽中,沿腦組織冠狀切面切成5 片,隨后將腦片放入2%TTC 溶液中,37 ℃避光置水浴箱30 min。再將腦片置于4%多聚甲醛溶液固定4~6 h 后,數碼相機拍照,應用圖像分析軟件計算腦片梗死面積。
1.6 腦組織病理組織學檢查 大鼠腦缺血2 h再灌注12 h 后,用10%水合氯醛麻醉,迅速開胸,用生理鹽水沖洗心臟,然后用4%多聚甲醛灌注固定,斷頭取腦,置于相同灌注液,4 ℃后固定1 w,依次脫水透明浸蠟及包埋,常規HE 染色封片,光鏡下觀察。
1.7 免疫組織化學法檢測VEGF 及VEGFR-1的表達 取大鼠腦組織冰凍切片,嚴格按照免疫組化試劑盒說明書操作,3% H2O2室溫孵育,滴加一抗(兔抗VEGF、VEGFR-1,工作濃度分別均為1∶200)后滴加二抗,經蒸餾水沖洗、蘇木素復染、鹽酸酒精分化、乙醇梯度脫水、二甲苯透明、中性樹膠封片,顯微鏡下觀察。陽性細胞計數:在400 倍光學顯微鏡下分別隨機選取5 個視野,計數免疫反應陽性細胞數后取平均值。
1.8 Western blot 檢測VEGF 及VEGFR-1 的表達 取缺血側大腦皮質進行蛋白提取,BCA 法測定蛋白濃度。蛋白變性后行SDS-PAGE 電泳、轉膜封閉,分別加入一抗(VEGF,1∶1000;VEGFR-1 抗體,1∶1000;β-actin,1∶2000),4 ℃孵育過夜。辣根過氧化物酶標記羊抗兔二抗(1∶2000)室溫孵育,ECL液顯色,凝膠成像系統顯影。采用Image J 圖像分析測定Western blot 條帶灰度值,結果以VEGF 及VEGFR1 與β-actin 灰度值的比值顯示。
2 結果
2.1 GK 和BB 對腦缺血/再灌注大鼠腦梗死范圍及神經功能缺損的影響 TTC 染色結果提示:假手術組腦組織未見梗死灶,Saline 組腦組織梗死面積百分比為(41.09±1.33);與Saline 組相比,GK 組和BB 組腦梗死范圍減小(梗死面積百分比分別為23.8±0.58 和26.97±0.73)(P<0.01),提示GK 和BB 對缺血/再灌注腦損傷有確切的保護作用。在神經功能損傷方面,假手術組無神經系統損害癥狀,Saline 組均出現明顯的神經功能缺陷表現,GK 組和BB組則明顯改善大鼠神經癥狀(P<0.01,P<0.05)。提示GK 和BB 對大鼠神經功能損傷有明顯的改善作用(見表1、圖1)。
2.2 VEGF 及VEGFR-1 蛋白的表達變化VEGF 蛋白含量明顯下降,差異有統計學意義(P<0.01)。在GK 和BB 組,VEGF 蛋白表達較缺血再灌注組顯著增多,差異有統計學意義(P<0.01)。VEGFR-1 蛋白的表達在各組間表達量基本相同,無統計學差異(見圖2)。
2.3 組織形態學表現 組織切片經HE 染色,于400×光鏡下觀察。Sham 組未見明顯病理改變,各種神經細胞層次清晰,細胞數量、形態多樣化,胞核界限清晰,胞質均勻,可清晰見到細胞核。Saline組見大鼠腦缺血中心區大量神經元變性壞死,細胞排列紊亂,形態不規則,可見部分神經元胞質濃縮,胞核固縮、碎裂或溶解。GK 和BB 組與Saline 組相比,梗死區縮小,神經元損傷程度減輕,細胞排列尚規則,殘存的細胞形態相對正常,GK 組殘留的神經元細胞數較BB 組稍多(見圖3)。
2.4 VEGF 及VEGFR-1 陽性細胞的表達變化組織切片經免疫組化染色,于400×光鏡下觀察。Sham 組可見少量VEGF 及VEGFR-1 表達陽性細胞,分布于在脈絡叢及軟膜等處。缺血2 h/再灌注12 h 后,基底節處缺血病灶區可見VEGF 及VEGFR-1 免疫陽性神經細胞數量明顯增加,主要分布在缺血病灶周邊的神經元、膠質細胞、血管內皮細胞等。陽性細胞胞漿內呈明顯棕黃色著色。GK 組和BB 組較Saline 組陽性表達部位相似,陽性表達率較Saline 組顯著增高(見圖4)。
表1 各組再灌注12 h 神經功能評分、腦梗死體積百分比比較(±s,n=6)

表1 各組再灌注12 h 神經功能評分、腦梗死體積百分比比較(±s,n=6)
與假手術組比較#P<0.01;與鹽水對照組比較* P<0.05,**P<0.01
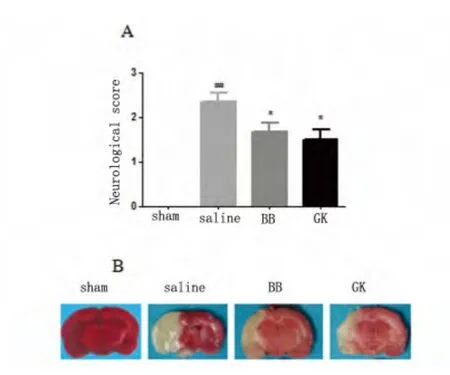
圖1 大鼠腦缺血再灌注12 h 后神經功能評分(A);腦梗死體積(B)
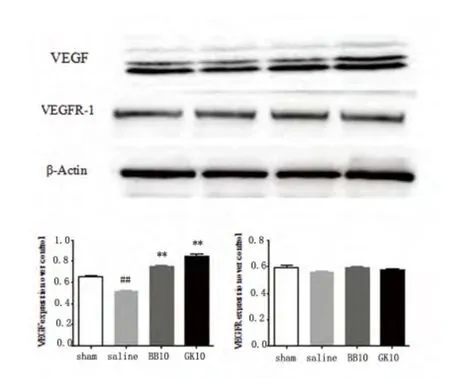
圖2 大鼠再灌注12 h Western blot 示VEGF、VEGFR-1 蛋白水平的表達
3 討論
本研究采用線栓法制備大鼠腦缺血/再灌注模型,從血管新生角度觀察了GK 和BB 的神經保護作用。結果顯示:GK 和BB 能明顯改善缺血/再灌注后大鼠神經功能缺損癥狀,減小腦梗死范圍,減輕組織形態學改變。此前的研究證明,受損的腦組織可出現再塑性,神經元發生的機制均與血管再通有重要的相關性,所以血管生成可以為大腦修復提供新的思路[3,4]。VEGF 是內皮細胞的有絲分裂原,具有促進內皮細胞增殖、加速新生血管形成、提高血管通透性等生物學特性,有類似于血管源性的神經保護和神經營養作用。在腦缺血發生后,VEGF 能誘導新生血管形成,并使新生血管從正常組織向半暗帶及缺血中心區延伸,增加受累腦組織再灌注及供氧量,從而減輕腦缺血損傷。有研究發現,VEGF 參與了局部梗死周邊區的微血管形成作用和血液供應的改善[5]。VEGF 還可間接地促進神經細胞再生并抑制細胞凋亡[6,7]。目前己經證實,缺血及移植損傷能顯著上調神經元及星狀細胞VEGF 的表達。在多種生理和病理情況下以旁分泌的形式作用于血管內皮細胞上的受體,產生不同的生物作用,包括:(1)誘導內皮細胞增殖、分化和遷移,以及體內血管的生成;(2)增加血管通透性;(3)促進血管支持物的生成等[8]。VEGFR-1 主要位于血管內皮細胞上,其胞外部分對VEGF 具有很高的親和力,能以可溶形式存在[9]。VEGF 主要通過VEGFR-1在內皮細胞上發揮作用[9],促進內皮細胞增殖、遷移、微血管管型結構形成及成熟血管生成[10]。
本研究免疫組化及Western blot 結果證明,大鼠缺血再灌注損傷后,缺血側皮質區VEGF 的表達明顯提高,這可能是機體對抗缺血缺氧所致腦組織損害的一種自身保護方式。而GK 和BB 能刺激機體VEGF 分子表達上調,從而增強其誘導血管生成的功能,促進了新生血管的形成和側支循環的重建,進而增加局部腦血流量,提高腦組織對葡萄糖和氧的攝取,加快神經功能缺損的恢復并有效縮小腦梗死的最終體積。免疫組化結果顯示,在GK 組和BB 組中,VEGFR-1 的陽性細胞數較Saline 組明顯增多,表明GK 和BB 在促進VEGF 表達的同時還能通過促進其受體的表達進一步增強缺血區血管生成。然而遺憾的是,Western blot 結果顯示不同組VEGFR-1 的表達量沒有明顯的差異。對這一結果,分析可能有以下幾方面的原因:首先,本研究選取的時間點為缺血2 h/再灌注12 h,可能GK 和BB 促進VEGFR-1的表達上調的作用通過半定量的Western blot 還沒有充分顯現,延長觀察時間可能會發現其上調趨勢;其次,雖然給藥后免疫組化證實了表達VEGFR-1 的陽性細胞數增多,但是單個神經元表達的VEGFR-1的量較小,其蛋白總量變化較小,提高檢測手段的靈敏度可能有助于檢出其變化情況;第三,VEGFR 存在兩種亞型,GK 和BB 可能對VEGFR-1 和VEGFR-2 均有作用,但可能對VEGFR-2 的影響更大,因此選用針對亞型的抗體可能更好地揭示其變化規律,尚需進一步證實。但從以上實驗結果,仍可證實GK 和BB 確實可以通過促進血管生成發揮對腦缺血再灌注損傷的神經保護作用。銀杏葉制劑已廣泛應用于缺血性腦血管病的臨床治療,針對其應用價值和作用機制已進行了很多研究,證明了銀杏內酯和白果內酯具有抗炎、抗凋亡等作用[11,12]。但此前研究所用的銀杏葉制劑多為混合成份,未能分辨其不同成份間的作用差異,機制探討難于深入。本研究選用了單一成份的銀杏內酯和白果內酯進行研究,并比較了兩者的作用差異。從血管新生的角度,本研究證實了兩者可有效促進血管生成,且銀杏內酯組具有更顯著的變化趨勢。在隨后的研究中我們將進一步深入探討。
本研究證實,銀杏內酯和白果內酯可以通過激活血管內皮生長因子上調,進而促進新生血管形成,在腦梗死再灌注損傷中發揮神經保護作用,這可能為腦梗死患者的治療和預防提供新的靶點。
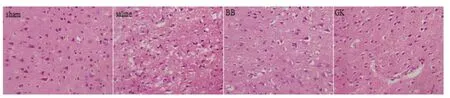
圖3 大鼠腦缺血再灌注12 h 各組大鼠HE 染色(HE×400)
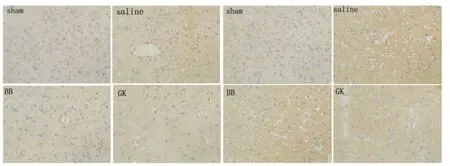
圖4 大鼠缺血再灌注12 h 后免疫細胞化學染色VEGF、VEGFR-1 的表達(×400)
[1]Oshikawa J,Urao N,Kim HW,et al.Extracellular SOD-derived H2O2promotes VEGF signaling in caveolae/lipid rafts and post-ischemic angiogenesis in mice[J].Plos one,2010,5(4):e10189.
[2]何佳,丁鳳菲,劉敏珍,等.VEGF/VEGFR 在腦缺血再灌注損傷中的神經保護作用[J].神經損傷與功能,2013,3(8):177-180.
[3]Chopp M,Li Y,Zhang J.Plasticity and remodeling of brain[J].J Neurol Sci,2008,265(1~2):97-101.
[4]Chopp M,Zhang ZG,Jiang Q.Neurogenesis,angiogenesis and MRI indices of functional recovery from stroke[J].Stroke,2007,38(2):827-831.
[5]Liu F,Ni J,Huang J,et al.VEGF overexpression enhances the accumulation of phospho-S292 MeCP2 in reactive astrocytes in the adult rat striatum following cerebral ischemia[J].Brain Res,2014,14:1683-1687.
[6]Yang J,Yao Y,Chen T,et al.VEGF ameliorates cognitive impairment in in vivo and in vitro ischemia via improving neuronal viability and function[J].Neuromolecular Med,2014,16(2):376-388.
[7]Greenberg DA,Jin K.VEGF and ALS:The luckiest growth factor[J].Trends Mol Med,2004,10(1):1-3.
[8]Goncalves GA,Camargo-Kosugi CM,Bonetti TC,et al.p27kip1 overexpression regulates VEGF expression,cell proliferation and apoptosis in cell culture from eutopic endometrium of women with endometriosis[J].Apoptosis,2014,23:246-248.
[9]Freitas AM,Carmeliet P,Stanimirovic DB,et al.VEGFR-2-mediated increased prolifertion and survival in response to oxygen and glucose deprivation in PlGF knockout astrocytes[J].Neurochem,2008,107(3):756-767.
[10]Chiba Y,Sasayama T,Miyake S,et al.Anti-VEGF receptor antagonist(VGA1155)reduces infarction in rat permanent focal brain ischemia[J].Kobe J Med Sci,2008,54(2):136-146.
[11]Goldie M,Dolan S.Bilobalide,a unique constituent of Ginkgo biloba inhibits inflammatory pain in rats[J].Behav Pharmacol,2013,24:298-306.
[12]WuX,Qian Z,Ke Y,et al.Ginkgolide B preconditioning protects neurons against ischaemia-induced apoptosis[J].J Cell Mol Med,2009,13:4474-4483.

