抗原特異性免疫耐受治療自身免疫疾病的新進展
郭軼先(綜述),夏長青(審校)
(首都醫科大學宣武醫院血液科,北京100053)
抗原特異性免疫耐受治療自身免疫疾病的新進展
郭軼先(綜述),夏長青※(審校)
(首都醫科大學宣武醫院血液科,北京100053)
免疫系統的一個重要功能是能區分自身抗原與外源抗原或者是“有害抗原”與“無害抗原”。自身免疫耐受是指機體內的T、B淋巴細胞不能對自身抗原產生免疫應答,這一過程基于一個復雜的免疫調節網絡,包括中樞免疫耐受和外周免疫耐受。抗原特異性免疫耐受治療是指在自身免疫性疾病選擇性的誘導機體自身免疫耐受,同時保留對病毒、真菌和腫瘤抗原的免疫應答[1]。現對抗原特異性免疫耐受治療自身免得疫疾病的主要方法以及近期在臨床試驗中的進展進行綜述。
1抗原特異性免疫耐受治療的主要方法
1.1針對自身抗原的免疫耐受誘導方法
1.1.1黏膜免疫耐受黏膜免疫耐受是指經口服或經鼻吸入途徑攝入某種外源抗原以誘導機體T 和B淋巴細胞對此種外源抗原產生免疫耐受,而對其他外源抗原仍能維持正常免疫應答的誘導方法[2],黏膜免疫耐受的優點包括抗原特異性、幾乎沒有毒性、便于操作和不良反應少。黏膜免疫耐受在動物模型中可成功地誘導抗原特異性免疫耐受[2],然而,目前為止,黏膜免疫耐受在一些自身免疫性疾病的臨床試驗中未能顯示出類似于動物模型的療效[3-7]。
1.1.2可溶性肽免疫耐受可溶性肽免疫耐受是指重復多次注射較大劑量的可溶性肽可誘導肽特異性T細胞無能或死亡,表現為機體再次接觸抗原肽后抗原肽特異性T細胞不能增殖和分泌白細胞介素2,機體對該可溶性肽產生免疫耐受[8-9]。可溶性肽誘導抗原特異性免疫耐受的另一個機制是可誘導調節T細胞產生,特別是運用低劑量可溶性肽進行免疫[10]。由于可溶性肽本身具有免疫原性,注射可溶性肽有加重疾病或誘發過敏反應的風險[11-12]。此外,在自身免疫性疾病發生過程中存在表位擴展現象。所以在臨床上,單獨應用一種可溶性的肽來誘導免疫耐受效果并不是很理想[13-15]。為了解決這個問題,有研究者使用混合了多個可溶性肽的方式來誘導耐受[16]。
1.1.3變異性肽配體變異性肽配體也稱修飾性肽配體是一種變異抗原,與自然肽配體相比,在與主要組織相容性復合體(major histocompatibility complex,MHC),或T細胞受體(T cell receptor,TCR)結合位置有一個或數個氨基酸被其他氨基酸替換[17]。變異性肽配體作為拮抗劑或半激動劑與自身抗原天然肽配體競爭性結合抗原呈遞細胞(antigen presenting cell,APC)上的MHC或TCR,使T細胞不能完全激活,繼而引起T細胞分化信號改變,T細胞由輔助性T細胞(helper T cell,Th)1/Th17向Th2/Th3方向轉化[18-19]或者誘導調節T細胞生成來發揮特異性免疫調節作用[20]。理論上,變異性肽配體本身不具有免疫原性,與直接應用表位肽誘導免疫耐受相比更為安全。但是在兩個多發性硬化癥(multiple sclerosis,MS)臨床試驗中,其中1個試驗包括142例MS患者,由于9%的患者產生了超敏反應而暫停了[21];另1個試驗包括25例患者也中斷了,因為在3例患者中觀察到疾病的惡化[22]。
1.2針對自身反應性淋巴細胞的免疫耐受誘導方法
1.2.1T細胞疫苗(T cell vaccine,TCV)TCV是指用滅活后的自身反應性T細胞作為疫苗對自身免疫性疾病進行防治[23]。TCV的概念在一定程度上類似于傳染病疫苗接種,只不過TCV要清除的是自身反應性T細胞。TCV靶抗原包括全減毒T細胞(通常是通過照射制備)、TCR或TCR的一部分或者是編碼TCR的DNA。TCV使用安全,耐受性好。更為突出的是,TCV在部分患者中可獲得滿意的治療效果。但是,仍有一些環節需要深入研究[24]。目前,針對多個不同自身抗原制備不同的T細胞克隆還存在一定難度。另外TCV免疫的途徑、使用劑量、免疫的次數、T細胞的活化、滅活、免疫原性增強等與免疫效應有關的指標有待全面考查。
1.2.2DNA疫苗DNA疫苗又稱核酸疫苗或基因疫苗,是編碼免疫原或與免疫原相關的真核表達質粒DNA(有時也可是RNA)[25]。DNA疫苗經一定途徑進入動物體內,被宿主細胞攝取后轉錄和翻譯表達出抗原蛋白,此抗原蛋白能刺激機體產生非特異性和特異性兩種免疫應答反應,從而起到免疫保護作用。DNA疫苗在很多方面優于傳統疫苗[26]。DNA疫苗在體內表達抗原的更接近于正常的真核結構,抗原可與MHC Ⅰ類和Ⅱ類分子一并呈遞并可引起更廣泛的免疫應答,誘導T細胞反應向Th1或Th2方向分化。DNA疫苗可在體內持續表達免疫原從而能誘導長期免疫應答。相對于合成肽段,DNA疫苗的優點是制備方法穩定和造價低,并且儲存和運輸方便。但是,目前DNA疫苗尚缺乏規范的監管,并且理論上還存在一些安全風險,包括插入突變的危險、原癌基因激活或抑癌基因失活、誘導抗體產生抗DNA抗體等。
1.3以抗原呈遞細胞為基礎的免疫耐受誘導方法
1.3.1致耐受樹突狀細胞(dendritic cell,DC)疫苗致耐受DC或半成熟DC是指可高表達MHC-Ⅰ類和MHC-Ⅱ類分子和共刺激分子但是不能分泌炎性因子的DC。致耐受DC可有效地誘導調節T細胞產生而不能誘導Th1/Th17反應。雖然未成熟DC和致耐受DC均可誘導調節T細胞產生,但是致耐受DC誘導調節T細胞產生有更多的優勢。例如,在炎癥環境下,致耐受DC比未成熟DC穩定[27]。致耐受DC還可通過使自身反應T細胞失活或凋亡、誘導T細胞向Th2方向發展來誘導免疫耐受[28]。使用體外誘導的致耐受DC偶聯自身抗原治療自身免疫性疾病,使機體復對該自身抗原的免疫耐受已經成為一個有效的治療手段,并在許多動物模型上得到證實[29]。但是致耐受DC應用到臨床上還存在一系列的問題,包括DC的來源和誘導方案、抗原的選擇、最佳的治療方案等。
1.3.2抗原肽偶聯到1-乙基-3-(3-二甲基氨基丙基)碳酰二亞胺1-乙基-3-(3-二甲基氨基丙基)碳酰二亞胺(1ethyl3(3dimethyllaminopropyl)carbodiie,EDCI)固定的細胞EDCI是一種水溶性碳二亞胺,可用于抗原肽和細胞的偶聯[30]。在缺乏共刺激信號的條件下,經過ECDI固定的抗原肽偶聯凋亡細胞被機體未成熟/致耐受APC細胞處理后呈遞給抗原肽特異性T細胞,誘導抗原肽特異性T細胞對該抗原免疫耐受。免疫耐受的誘導和維持可能與調節性T細胞表達叉頭框蛋白3或分泌抗炎性細胞因子如白細胞介素10/轉化生長因子β增多相關[31]。與可溶性肽相比,這種方法可降低過敏的風險[12]。在最近的研究中,7種髓鞘抗原肽與患者外周白細胞偶聯后應用于MS的治療取得了令人鼓舞的結果[32]。然而,收集和制備足夠數目的細胞是廣泛利用此技術的一個障礙。另外這一治療價格昂貴,且必須在嚴密監控條件下由熟練的操作人員進行,要求嚴格的質量控制,所以限制了該方法不能在更多的醫療機構廣泛開展。
2抗原特異性免疫耐受治療與自身免疫性疾病
2.1MSMS是以中樞神經系統白質脫髓鞘病變為特點的自身免疫性疾病,它是中樞神經系統脫髓鞘疾病中最常見、最主要的疾病。患者以青、中年多見,其臨床特征為發作性視神經、脊髓和腦部的局灶性障礙。因病變累及的部位和髓鞘脫失灶的范圍不同而臨床表現多樣。MS根據病程主要分為4種亞型:復發緩解型,繼發進展型,原發進展型和進展復發型[33]。表1主要介紹了最近開展的MS抗原特異性免疫耐受治療的臨床研究。
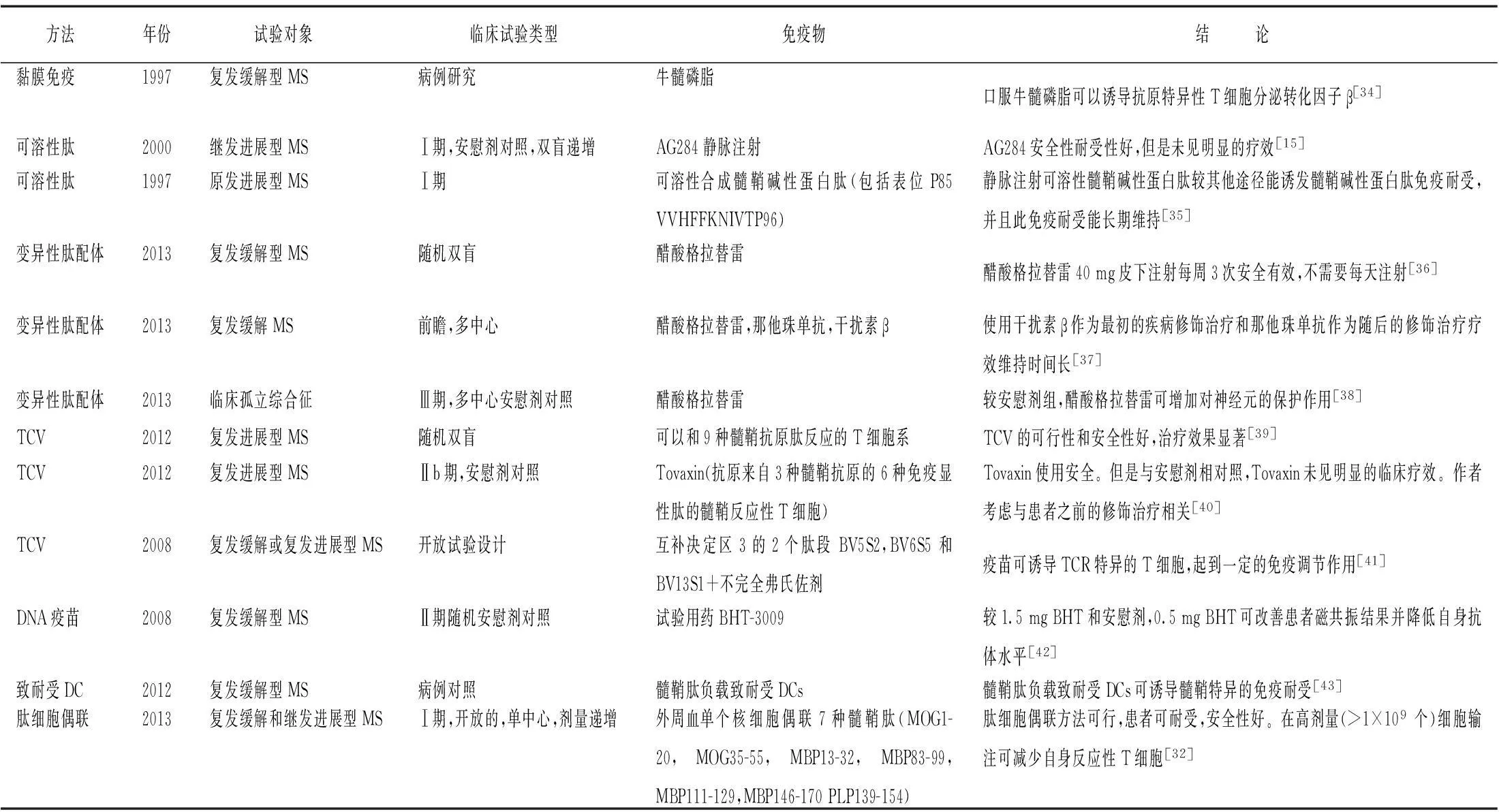
表1 各種抗原特異性免疫耐受方法在MS的臨床研究
MS:多發性硬化癥;TCV:T細胞疫苗;TCR: T細胞受體;DC:樹突狀細胞
2.21型糖尿病1型糖尿病是糖尿病的一種類型,它與2型糖尿病的發病機制完全不同,屬于自體免疫性疾病[44]。1型糖尿病是由于遺傳和環境等外界因素共同作用于遺傳易感性的個體,激活T淋巴細胞介導的自身抗原耐受破壞而導致的一種器官特異性的自身免疫性疾病,從而引起選擇性胰島細胞破壞和功能衰竭,體內胰島素分泌不足進行性加重而導致糖尿病。患者必須注射胰島素治療。表2主要介紹了最近開展的1型糖尿病抗原特異性免疫耐受治療的臨床研究。
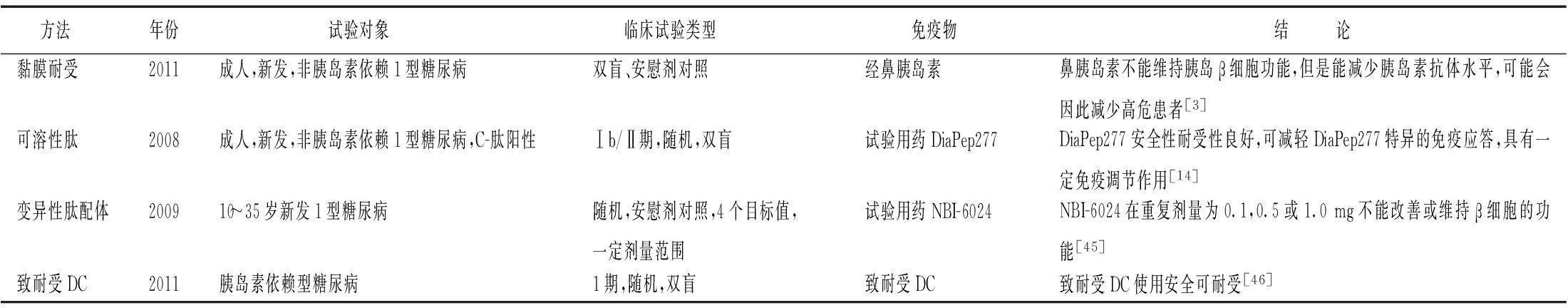
表2 各抗原特異性免疫耐受方法在1型糖尿病的臨床研究
DC:樹突狀細胞
2.3類風濕關節炎(rheumatoid arthritis,RA)RA是一種由自身免疫障礙引致免疫系統攻擊關節的致殘性關節病變。病理特征主要表現為滑膜細胞異常增殖和炎性細胞浸潤,累及周身關節滑膜炎及血管翳形成,嚴重時可侵蝕軟骨與骨導致關節破壞,造成關節變形直至殘廢,并會因關節痛楚及磨損而失去部分活動能力。這種病癥亦會引起關節外的病變,包括皮膚、血管、心臟、肺部及肌肉等。本病具體的病理機制至今未明,尚缺乏有效的治療策略[47]。表3主要介紹了最近開展的RA抗原特異性免疫耐受治療的臨床研究。

表3 各抗原特異性免疫耐受方法在RA的臨床研究
RA:類風濕關節炎;TCV:T細胞疫苗;TCR:T細胞受體
3結語
以抗原為基礎的免疫耐受誘導治療在多種自身免疫性疾病動物模型中成功應用,但是應用到臨床試驗中還存在一定的困難,目前的研究趨勢是使用多種變異自身抗原混合進行免疫耐受治療。以自身反應性T細胞為基礎的免疫耐受治療在自身免疫病的臨床試驗中取得了令人鼓舞的研究結果,但是如何確定并獲得自身反應性T細胞是這一治療的關鍵。DC在維持免疫耐受和免疫應答平衡的重要作用已得到共識,以致耐受DC為基礎的免疫耐受誘導治療已在動物實驗中取得了很好的效果,并且開展了Ⅰ期臨床試驗。抗原偶聯細胞的免疫耐受誘導治療同樣在動物模型中取得了很好的效果,但是轉化到臨床上還存在很多技術挑戰,尚不能大規模開展。
參考文獻
[1]Li L,Boussiotis VA.Physiologic regulation of central and peripheral T cell tolerance:lessons for therapeutic applications[J].J Mol Med (Berl),2006,84(11):887-899.
[2]Ilan Y.Oral tolerance:can we make it work? [J].Hum Immunol,2009,70(10):768-776.
[3]Fourlanos S,Perry C,Gellert SA,etal.Evidence that nasal insulin induces immune tolerance to insulin in adults with autoimmune diabetes[J].Diabetes,2011,60(4):1237-1245.
[4]Landewe RB,Houbiers JG,Van den Bosch F,etal.Intranasal administration of recombinant human cartilage glycoprotein-39 as a treatment for rheumatoid arthritis:a phase II,multicentre,double-blind,randomised,placebo-controlled,parallel-group,dose-finding trial[J].Ann Rheum Dis,2010,69(9):1655-1659.
[5]Zandbelt MM,Houbiers JG,van den Hoogen FH,etal.Intranasal administration of recombinant human cartilage glycoprotein-39.A phase I escalating cohort study in patients with rheumatoid arth-ritis[J].J Rheumatol,2006,33(9):1726-1733.
[6]Harrison LC,Honeyman MC,Steele CE,etal.Pancreatic beta-cell function and immune responses to insulin after administration of intranasal insulin to humans at risk for type 1 diabetes[J].Diabetes Care,2004,27(10):2348-2355.
[7]Hauselmann HJ,Caravatti M,Seifert B,etal.Can collagen type II sustain a methotrexate-induced therapeutic effect in patients with long-standing rheumatoid arthritis? A double-blind,randomized trial[J].Br J Rheumatol,1998,37(10):1110-1117.
[8]Zonneveld-Huijssoon E,Albani S,Prakken BJ,etal.Heat shock protein bystander antigens for peptide immunotherapy in autoimmune disease[J].Clin Exp Immunol,2013,171(1):20-29.
[9]Racke MK,Critchfield JM,Quigley L,etal.Intravenous antigen administration as a therapy for autoimmune demyelinating disease[J].Ann Neurol,1996,39(1):46-56.
[10]Massey EJ,Sundstedt A,Day MJ,etal.Intranasal peptide-induced peripheral tolerance:the role of IL-10 in regulatory T cell function within the context of experimental autoimmune encephalomyelitis[J].Vet Immunol Immunopathol,2002,87(3/4):357-372.
[11]Genain CP,Abel K,Belmar N,etal.Late complications of immune deviation therapy in a nonhuman primate[J].Science,1996,274(5295):2054-2057.
[12]Smith CE,Eagar TN,Strominger JL,etal.Differential induction of IgE-mediated anaphylaxis after soluble vs.cell-bound tolerogenic peptide therapy of autoimmune encephalomyelitis[J].Proc Natl Acad Sci U S A,2005,102(27):9595-9600.
[13]Koffeman EC,Genovese M,Amox D,etal.Epitope-specific immunotherapy of rheumatoid arthritis:clinical responsiveness occurs with immune deviation and relies on the expression of a cluster of molecules associated with T cell tolerance in a double-blind,placebo-controlled,pilot phase Ⅱ trial[J].Arthritis Rheum,2009,60(11):3207-3216.
[14]Huurman VA,van der Meide PE,Duinkerken G,etal.Immunological efficacy of heat shock protein 60 peptide DiaPep277 therapy in clinical type Ⅰ diabetes[J].Clin Exp Immunol,2008,152(3):488-497.
[15]Goodkin DE,Shulman M,Winkelhake J,etal.A phase Ⅰ trial of solubilized DR2:MBP84-102 (AG284) in multiple sclerosis[J].Neurology,2000,54(7):1414-1420.
[16]Dolgin E.The inverse of immunity[J].Nat Med,2010,16(7):740-743.
[17]Bielekova B,Martin R.Antigen-specific immunomodulation via altered peptide ligands[J].J Mol Med (Berl),2001,79(10):552-565.
[18]Singh RA,Zhang JZ.Differential activation of ERK,p38,and JNK required for Th1 and Th2 deviation in myelin-reactive T cells induced by altered peptide ligand[J].J Immunol,2004,173(12):7299-7307.
[19]Uhlin M,Masucci M,Levitsky V.Is the activity of partially agonistic MHC:peptide ligands dependent on the quality of immunological help?[J].Scand J Immunol,2006,64(6):581-587.
[20]Fischer FR,Santambrogio L,Luo Y,etal.Modulation of experimental autoimmune encephalomyelitis:effect of altered peptide ligand on chemokine and chemokine receptor expression[J].J Neuroimmunol,2000,110(1/2):195-208.
[21]Kappos L,Comi G,Panitch H,etal.Induction of a non-encephalitogenic type 2 T helper-cell autoimmune response in multiple sclerosis after administration of an altered peptide ligand in a placebo-controlled,randomized phase II trial.The Altered Peptide Ligand in Relapsing MS Study Group[J].Nat Med,2000,6(10):1176-1182.
[22]Bielekova B,Goodwin B,Richert N,etal.Encephalitogenic potential of the myelin basic protein peptide (amino acids 83-99) in multiple sclerosis:results of a phase II clinical trial with an altered peptide ligand[J].Nat Med,2000,6(10):1167-1175.
[23]Ben-Nun A,Wekerle H,Cohen IR.Vaccination against autoimmune encephalomyelitis with T-lymphocyte line cells reactive against myelin basic protein[J].Nature,1981,292(5818):60-61.
[24]Hellings N,Raus J,Stinissen P.T-cell vaccination in multiple sclerosis:update on clinical application and mode of action[J].Autoimmun Rev,2004,3(4):267-275.
[25]Fissolo N,Montalban X,Comabella M.DNA-based vaccines for multiple sclerosis:current status and future directions[J].Clin Immunol,2012,142(1):76-83.
[26]Saha R,Killian S,Donofrio RS.DNA vaccines:a mini review[J].Recent Pat DNA Gene Seq,2011,5(2):92-96.
[27]Lutz MB.Therapeutic potential of semi-mature dendritic cells for tolerance induction[J].Front Immunol,2012,3:123.
[28]Gross CC,Jonuleit H,Wiendl H.Fulfilling the dream:tolerogenic dendritic cells to treat multiple sclerosis[J].Eur J Immunol,2012,42(3):569-572.
[29]Van Brussel I,Lee WP,Rombouts M,etal.Tolerogenic dendritic cell vaccines to treat autoimmune diseases:can the unattainable dream turn into reality?[J].Autoimmun Rev,2014,13(2):138-150.
[30]Miller SD,Wetzig RP,Claman HN.The induction of cell-mediated immunity and tolerance with protein antigens coupled to syngeneic lymphoid cells[J].J Exp Med,1979,149(3):758-773.
[31]Smith CE,Miller SD.Multi-peptide coupled-cell tolerance ameliorates ongoing relapsing EAE associated with multiple pathogenic autoreactivities[J].J Autoimmun,2006,27(4):218-231.
[32]Lutterotti A,Yousef S,Sputtek A,etal.Antigen-specific tolerance by autologous myelin peptide-coupled cells:a phase 1 trial in multiple sclerosis[J].Sci Transl Med,2013,5(8):175-188r.
[33]Nakahara J,Maeda M,Aiso S,etal.Current concepts in multiple sclerosis:autoimmunity versus oligodendrogliopathy[J].Clin Rev Allergy Immunol,2012,42(1):26-34.
[34]Hafler DA,Kent SC,Pietrusewicz MJ,etal.Oral administration of myelin induces antigen-specific TGF-beta 1 secreting T cells in patients with multiple sclerosis[J].Ann N Y Acad Sci,1997,19(835):120-131.
[35]Warren KG,Catz I,Wucherpfennig KW.Tolerance induction to myelin basic protein by intravenous synthetic peptides containing epitope P85 VVHFFKNIVTP96 in chronic progressive multiple sclerosis[J].J Neurol Sci,1997,152(1):31-38.
[36]Khan O,Rieckmann P,Boyko A,etal.Three times weekly glatiramer acetate in relapsing-remitting multiple sclerosis[J].Ann Neurol,2013,73(6):705-713.
[37]Jokubaitis VG,Spelman T,Lechner-Scott J,etal.The Australian Multiple Sclerosis (MS) immunotherapy study:a prospective,multicentre study of drug utilisation using the MSBase platform[J].PLoS One,2013,8(3):e59694.
[38]Arnold DL,Narayanan S,Antel S.Neuroprotection with glatiramer acetate:evidence from the PreCISe trial[J].J Neurol,2013,260(7):1901-1906.
[39]Karussis D,Shor H,Yachnin J,etal.T cell vaccination benefits relapsing progressive multiple sclerosis patients:a randomized,double-blind clinical trial[J].PLoS One,2012,7(12):e50478.
[40]Fox E,Wynn D,Cohan S,etal.A randomized clinical trial of autologous T-cell therapy in multiple sclerosis:subset analysis and implications for trial design[J].Mult Scler,2012,18(6):843-852.
[41]Vandenbark AA,Culbertson NE,Bartholomew RM,etal.Therapeutic vaccination with a trivalent T-cell receptor (TCR) peptide vaccine restores deficient FoxP3 expression and TCR recognition in subjects with multiple sclerosis[J].Immunology,2008,123(1):66-78.
[42]Garren H,Robinson WH,Krasulova E,etal.Phase 2 trial of a DNA vaccine encoding myelin basic protein for multiple sclerosis[J].Ann Neurol,2008,63(5):611-620.
[43]Raiotach-Regue D,Grau-Lopez L,Naranjo-Gomez M,etal.Stable antigen-specific T-cell hyporesponsiveness induced by tolerogenic dendritic cells from multiple sclerosis patients[J].Eur J Immunol,2012,42(3):771-782.
[44]Eisenbarth GS.Type I diabetes mellitus.A chronic autoimmune disease[J].N Engl J Med,1986,314(21):1360-1368.
[45]Walter M,Philotheou A,Bonnici F,etal.No effect of the altered peptide ligand NBI-6024 on beta-cell residual function and insulin needs in new-onset type 1 diabetes[J].Diabetes Care,2009,32(11):2036-2040.
[46]Giannoukakis N,Phillips B,Finegold D,etal.Phase Ⅰ (safety) study of autologous tolerogenic dendritic cells in type 1 diabetic patients[J].Diabetes Care,2011,34(9):2026-2032.
[47]Macfarlane GJ,El-Metwally A,De Silva V,etal.Evidence for the efficacy of complementary and alternative medicines in the management of rheumatoid arthritis:a systematic review[J].Rheumatology(Oxford),2011,50(9):1672-1683.
[48]Ivanova IP,Seledtsov VI,Seledtsov DV,etal.Characterization of immunogenic properties of polyclonal T cell vaccine intended for the treatment of rheumatoid arthritis[J].Bull Exp Biol Med,2007,144(4):630-634.
[49]Moreland LW,Morgan EE,Adamson TR,etal.T cell receptor peptide vaccination in rheumatoid arthritis:a placebo-controlled trial using a combination of Vbeta3,Vbeta14,and Vbeta17 peptides[J].Arthritis Rheum,1998,41(11):1919-1929.
摘要:自身免疫性疾病是機體對自身抗原的免疫耐受機制破壞,導致一個或多個器官的免疫性損傷。目前,大多數自身免疫性疾病的治療策略仍是長期使用免疫抑制藥物,其主要問題是缺乏免疫抑制的特異性,長期使用可抑制正常免疫效應細胞的功能,導致嚴重的甚至危及患者生命的不良反應,因此,臨床上需要特異性的、低毒性和更加長效的治療手段以治療自身免疫性疾病。
關鍵詞:自身免疫性疾病;免疫耐受;抗原特異;樹突狀細胞
Progress in the Treatment of Antigen Specific Immune Tolerance for Autoimmune DiseasesGUOYi-xian,XIAChang-qing.(DepartmentofHematology,CapitalMedicalUniversityXuanwuHospital,Beijing100053,China)
Abstract:Autoimmune diseases can cause immune damages of one or more organs as a result of breaking the balance of body′s immune tolerance to auto-antigen.At present,the strategy of most autoimmune diseases treatment is still based on long-term use of immunosuppressive drugs which lack of antigen-specificity and inhibit the normal function of the immune effector cells and cause severe and sometimes life-threatening side effects.Therefore,antigen-specific lower toxic and longer effective treatments are needed for autoimmune diseases in clinical.
Key words:Autoimmune diseases; Immune tolerance; Antigen specific; Dendritic cells
收稿日期:2014-09-29修回日期:2015-01-12編輯:相丹峰
doi:10.3969/j.issn.1006-2084.2015.16.010
中圖分類號:R593.2
文獻標識碼:A
文章編號:1006-2084(2015)16-2906-04

