嗜酸乳桿菌生產共軛亞油酸的發酵條件研究
湯玉清,徐 毅,潘麗爽,汪惠麗
(合肥工業大學生物與食品工程學院,安徽合肥 230009)
?
嗜酸乳桿菌生產共軛亞油酸的發酵條件研究
湯玉清,徐 毅*,潘麗爽,汪惠麗
(合肥工業大學生物與食品工程學院,安徽合肥 230009)
[目的]為提高微生物法發酵合成共軛亞油酸(CLA)的產量,優化嗜酸乳桿菌生產共軛亞油酸的發酵條件。[方法]試驗以亞油酸為底物,利用嗜酸乳桿菌合成共軛亞油酸,選取對CLA的生成量影響顯著的幾個因素:底物濃度、接種量、pH、發酵時間、發酵溫度進行單因素試驗,并在此基礎上進行正交試驗優化發酵條件。 [結果]單因素試驗得到的最優發酵條件為底物濃度1.0 mg/ml、接種量4%、初始pH 5.5、發酵時間48 h、發酵溫度37 ℃。正交試驗發現,底物濃度、發酵時間、發酵溫度顯著影響CLA的合成產量。最終得到的最優發酵條件為底物濃度為1.5 mg/ml、接種量2%、初始pH 5.5、發酵時間36 h、發酵溫度33 ℃。用氣質聯用法對產物進行定性分析,證明產物是c-9,t-11 CLA。此時,CLA的產量為91.54 μg/ml。[結論]試驗優化了共軛亞油酸的發酵條件,為更有效率地利用嗜酸乳桿菌生產共軛亞油酸提供了理論依據。
共軛亞油酸;嗜酸乳酸桿菌;發酵條件
共軛亞油酸(CLA)是亞油酸的同分異構體,是普遍存在于動物和人體內的天然活性營養物質[1]。作為一種營養物質,CLA從抗癌、減肥到防止動脈硬化、防治糖尿病等方面,都有廣泛的應用,具有廣闊的應用前景[2-7]。目前,CLA的合成方法主要有化學合成法、酶催化合成法、微生物合成法,目前合成CLA的最常用的方法是堿性異構化的化學方法,但化學合成的CLA的各種不同的異構體混雜在一起,這導致后期CLA的分離純化變得尤其復雜和困難,為工業化生產帶來很多不便。與之相比,CLA的微生物合成法由于亞油酸異構酶具有專一性,將亞油酸專一地轉化成CLA(c-9,t-11),便于分離純化。特別是乳酸菌,菌種易于獲得且不容易被雜菌污染,易于培養,產CLA的能力與其他菌種相比相對較高,而且乳酸菌還是人體益生菌。相比于微生物合成法,酶催化合成法需要更高的生產成本。從分離工藝難易程度和經濟學效應兩方面比較,用乳酸菌合成共軛亞油酸具有更好的發展前景[8-12]。
筆者以嗜酸乳桿菌為試驗菌種,以亞油酸為反應底物,采用MRS液體培養基培養菌種,分別探究底物濃度、接種量、初始pH、培養時間和培養溫度對CLA產量的影響。根據單因素結果采用正交試驗,通過方差分析法,得到了最優發酵培養條件。發酵液中的CLA經有機溶劑萃取后,用氣質聯用法進行定性分析,確定產物成分為c-9,t-11。
1 材料與方法
1.1 材料
1.1.1菌種與培養基。選擇嗜酸乳桿菌為試驗菌種,菌種由山東大學提供,試驗之前先對菌種進行活化。
MRS培養基(W/V):葡萄糖2%,檸檬酸三銨0.2%,硫酸鎂0.02%,硫酸錳0.005%,蛋白胨1.0%,乙酸鈉0.5%,磷酸氫二鉀0.2%,酵母粉0.5%,牛肉膏1.0%,吐溫-80 0.1%(V/V)。亞油酸乳化后,再過濾除菌,根據需要加入培養基。
1.1.2主要試劑。蛋白胨、牛肉膏、葡萄糖、亞油酸等,國藥集團化學試劑有限公司;酵母浸粉,北京奧博星生物技術有限公司;濃硫酸,無錫市展望化工試劑有限公司。
1.1.3主要儀器。TU-1901型紫外分光光度計,北京普析通用儀器有限公司;氣質聯用儀,江蘇萬科科教儀器有限公司;旋轉蒸發儀,上海亞榮生化儀器廠;超凈工作臺,蘇州凈化設備有限公司;冷凍離心機,上海天美生化儀器設備工程有限公司;恒溫培養箱,上海制成分析儀器制造有限公司。
1.2 方法
1.2.1發酵液中CLA生成量的測定。該試驗以最終發酵產物中CLA的產量為評價指標,采用紫外檢測法測定CLA的含量[13]。用正己烷將CLA純品稀釋成不同的濃度,然后以正己烷為空白對照,測定不同濃度CLA在波長233 nm處的吸光值,并繪制成標準曲線(圖1),得到線性回歸方程為y=0.127 9x+0.025 6,R2=0.999 7。
發酵結束之后,將發酵液倒入50 ml的離心管中,在5 000 r/min的條件下離心5 min。離心后將上清液倒入250 ml的分液漏斗中,加入25 ml的正己烷萃取,之后靜置分層,下層丟棄,上層用蒸餾水水洗2次,將水層棄去后用無水硫酸鈉將上層干燥。之后將上清液取出定容到25 ml。隨后從中吸取1 ml,并用正己烷定容到15 ml,以正己烷為參比,測定其在波長233 nm處的紫外吸光值。
1.2.2單因素試驗。
1.2.2.1底物濃度對CLA產量的影響。接種量為2%,培養溫度37 ℃,發酵24 h,初始pH為6.8,底物濃度分別為0、0.5、1.0、1.5、2.0 mg/ml,其他條件均相同,考察底物濃度對CLA產量的影響。每組試驗進行3次重復,結果取其平均值,選取較為適宜的底物濃度。
1.2.2.2接種量對CLA產量的影響。底物濃度采用“1.2.2.1”得出的最佳底物濃度,接種量分別為0%、2%、4%、6%、8%,培養溫度37 ℃,發酵24 h,初始pH為6.8,其他條件均相同,考察接種量對CLA產量的影響。每組試驗進行3次重復,結果取其平均值,選取較為適宜的接種量。
1.2.2.3初始pH對CLA產量的影響。底物濃度采用“1.2.2.1”得出的最佳底物濃度,接種量采用“1.2.2.2”得出的最佳接種量,培養溫度37 ℃,發酵24 h,初始pH分別為5.0、5.5、6.0、6.5、7.0,其他條件均相同,考察初始pH對CLA產量的影響。每組試驗進行3次重復,結果取其平均值,選取較為適宜的初始pH。
1.2.2.4培養時間對CLA產量的影響。底物濃度采用“1.2.2.1”得出的最佳底物濃度,接種量采用“1.2.2.2”得出的最佳接種量,培養溫度37 ℃,初始pH采用“1.2.2.3”得出的最佳初始pH,發酵時間分別為12、24、36、48、60 h,其他條件均相同,考察培養時間對CLA產量的影響。每組試驗進行3次重復,結果取其平均值,選取較為適宜的培養時間。
1.2.2.5培養溫度對CLA產量的影響。底物濃度采用“1.2.2.1”得出的最佳底物濃度,接種量采用“1.2.2.2”得出的最佳接種量,初始pH采用“1.2.2.3”得出的最佳初始pH,發酵時間采用“1.2.2.4”得出的最佳發酵時間,培養溫度分別為25、29、33、37、41 ℃,其他條件均相同,考察培養溫度對CLA產量的影響。每組試驗進行3次重復,結果取其平均值,選取較為適宜的培養溫度。
1.2.3正交試驗。根據單因素試驗的結果,選擇合適的正交表進行正交試驗,每組試驗進行3次重復,并對正交試驗的結果進行方差分析,得出最優發酵條件[14]。
1.2.4氣質聯用法定性分析。在最佳培養條件下發酵合成CLA,將發酵液與200 ml的氯仿甲醇(2∶1)溶液混合,均質5 min,再用冷凍離心機在4 ℃,5 000 r/min條件下離心5 min,棄去上層,下層用無水硫酸鈉干燥,之后將干燥好的溶液轉移到旋轉蒸發儀中蒸發,在30 ℃條件下蒸去大多數溶劑,剩余部分轉移到離心管中用氮氣將剩余溶劑吹走。向剩余的物質中加入1 ml 1 mol/L的硫酸甲醇溶液,并在60 ℃條件下水浴30 min,水浴結束后自然冷卻。然后加入1 ml的正己烷,振蕩30 s,用冷凍離心機在4 ℃、5 000 r/min條件下離心5 min,用GC-MS進行定性分析,亞油酸標品經相同處理后作對照。選用CP-Sil88(100 m×0.25 mm×0.25 μm)強極性色譜柱,升溫程序:色譜柱的初溫140 ℃,在此溫度下維持5 min,然后再以7 ℃/min的速度將溫度上升至175 ℃,在此溫度下維持5 min,再以5 ℃/min的速度將溫度上升至200 ℃,最后再以0.3 ℃/min的速度將溫度上升至210 ℃,維持15 min。載氣為氦氣,進樣口的溫度為220 ℃,流速為1.0 ml/min,進樣量為1.0 μl,分流比為30∶1,檢測器的溫度為220 ℃。選用EI離子源,其溫度為220 ℃,連接口的溫度為250 ℃,掃描質量數的范圍設為100~350。
2 結果與分析
2.1 單因素試驗結果
2.1.1底物濃度對CLA產量的影響。根據“1.2.2.1”的試驗條件,進行底物濃度對CLA產量的影響試驗。由圖2可知,底物濃度在0~1.0 mg/ml范圍內,CLA的生成量呈上升趨勢,并且在底物濃度為1.0 mg/ml的時候達到最高值。但當底物濃度大于1.0 mg/ml時,CLA的生成量反而減少。這可能是因為亞油酸對細胞有毒害作用,它的濃度過高會抑制細胞和酶的活性,從而導致CLA的生成量降低。綜合考慮,底物濃度控制在1.0 mg/ml左右比較合適。
2.1.2接種量對CLA產量的影響。根據“1.2.2.2”的試驗條件,進行接種量對CLA產量影響的試驗,試驗結果如圖 3所示。接種量在0~4%范圍內,CLA的生成量呈上升趨勢,并且在接種量為4%的時候達到最高值。但當接種量大于4%時,CLA的生成量反而減少。這可能是因為接種量過多時培養液中的營養物質相對不足,微生物活性不高,從而導致CLA的生成量降低。綜合考慮,接種量應控制在4%左右比較合適。
2.1.3初始pH對CLA產量的影響。根據“1.2.2.3”的試驗條件,進行初始pH對CLA產量影響的試驗。紫外檢測結果如圖4所示,初始pH在5.0~5.5范圍內,CLA的生成量呈上升趨勢,并且在初始pH為5.5的時候達到最高值。但當初始pH大于5.5時,CLA的生成量反而減少。這可能是因為每種微生物都有適合自己生長的最適pH,培養液pH過高或過低都會影響微生物的活性,從而導致CLA的生成量降低。綜合考慮,初始pH應控制在5.5左右比較合適。
2.1.4培養時間對CLA產量的影響。根據“1.2.2.4”的試驗條件,進行培養時間對CLA產量影響的試驗。結果如表5所示,培養時間在12~48 h范圍內,CLA的生成量呈上升趨勢,并且在培養時間為48 h的時候達到最高值。但當培養時間大于48 h時,CLA的生成量反而減少。這可能是因為一方面,隨時間的延長微生物生長進入衰退期,活性降低,產CLA的能力下降;另一方面,隨時間的延長,部分已生成的CLA可能逐漸發生硬脂化,從而導致CLA的生成量降低。綜合考慮,培養時間應控制在48 h左右比較合適。
2.1.5培養溫度對CLA產量的影響。根據試驗“1.2.2.5”的試驗條件,進行培養溫度對CLA產量影響的試驗。結果如圖6所示,培養溫度在25~37 ℃范圍內,CLA的生成量呈上升趨勢,并且在培養溫度為37 ℃的時候達到最高值。但當培養溫度大于37 ℃時,CLA的生成量反而減少。這可能是因為亞油酸受到亞油酸異構酶的催化從而轉化生成為CLA,而每種酶都有最適溫度,環境的溫度太高或太低都會影響酶活,從而導致CLA的生成量降低。綜合考慮,培養溫度為37 ℃左右時有利于CLA的合成。
2.2 正交試驗結果根據單因素試驗結果結合相關文獻資料,選取對CLA的生成量影響顯著的4個因素:底物濃度、接種量、培養時間、培養溫度進行正交試驗,各因素水平如表1所示,選擇L9(34)正交表進行正交試驗,試驗方案及試驗結果如表2所示。
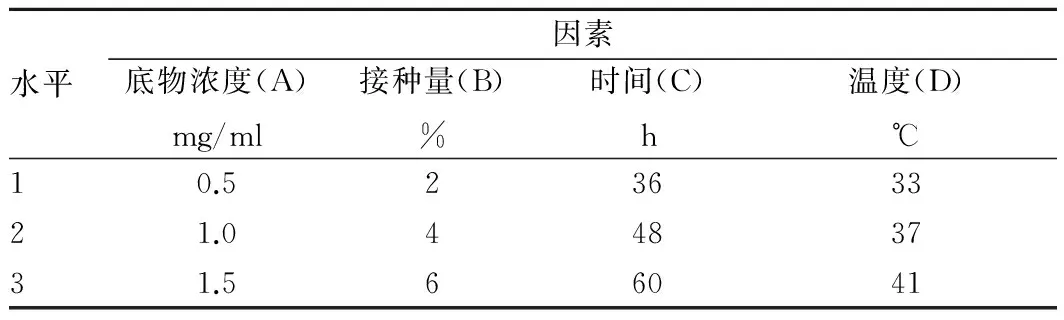
表1 正交試驗因素水平設計
由表2可以直接看出,CLA生成量最高的一組各因素組合條件為A3B1C3D2,即底物濃度1.5 mg/ml,接種量2%,發酵時間60 h,發酵溫度37 ℃。根據表2中各因素K值的大小,得到的最佳組合條件為A3B1C1D1,即底物濃度1.5 mg/ml,接種量2%,發酵時間36 h,發酵溫度33 ℃。對正交試驗結果進行方差分析,結果得出FA=17.6***,FB=3.3,FC=3.7*,FD=4.9*;其中F0.001(2,18)=10.39,F0.01(2,18)=6.01,F0.05(2,18)=3.55。

表2 正交試驗結果
由方差分析結果可知,各因素的主次順序由主到次為A、D、C、B。由于直接分析最好的組合條件和計算分析最好的組合條件在C(時間)和D(溫度)的取值上不一致,因此將這2種組合條件進行驗證性試驗,并綜合考慮經濟效應和適用性等因素,從而確定最佳組合條件,其方案及結果如表3所示。
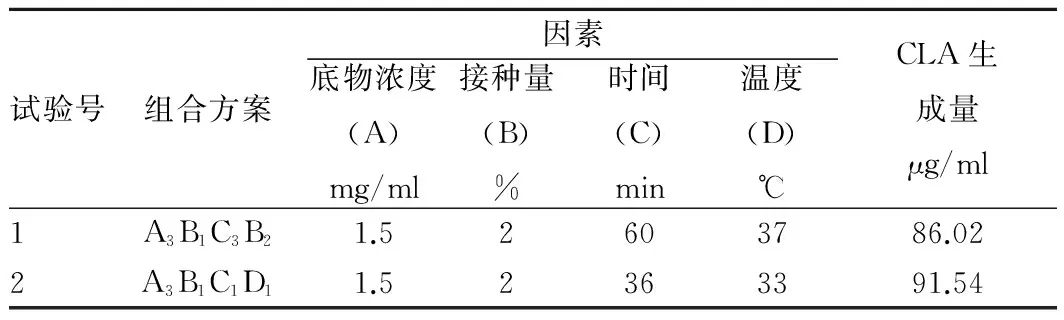
表3 驗證性試驗結果
結果表明,A3B1C1D1為最優組合條件,在此條件下,CLA的生成量經計算為91.54 μg/ml。最終得到的最優發酵條件為底物濃度為1.5 mg/ml,接種量2%,初始pH為5.5,培養時間36 h,培養溫度33 ℃。
2.3 氣質聯用定性分析結果根據試驗“1.2.4”的試驗條件,用氣質聯用法對產物進行定性分析,結果如圖7所示。由圖7可以看出,與亞麻酸標品色譜圖(圖7a)相比,產物色譜圖(圖7b)中生成了一種新的物質,這種物質的化學結構經質譜分析結構如圖8所示,為c-9,t-11CLA,得出亞油酸在試驗所給條件下,轉化生成了c-9,t-11CLA。
3 結論
以最終發酵產物中CLA的產量為評價指標,通過單因素和正交試驗優化了嗜酸乳桿菌合成共軛亞油酸的工藝條件。單因素試驗確定了較優發酵條件分別為底物濃度1.0 mg/ml、接種量 4%、初始pH 5.5、培養時間48 h和培養溫度37 ℃。根據單因素試驗結果結合相關文獻資料,采用正交試驗進一步研究了底物濃度、接種量、培養時間、培養溫度對CLA的產量的影響,最終得到的最優發酵條件為底物濃度為1.5 mg/ml、接種量2%、初始pH為5.5、培養時間36 h和培養溫度33 ℃。并用氣質聯用法對發酵產物成分進行了分
析,證明產物是c-9,t-11CLA,此時,CLA的產量為91.54 μg/ml。
[1] 馬子川.生活中的化學[M].北京:北京師范大學出版社,2011:40.
[2] WHIGHAM L D,WATRAS A C,SCHOELLER A D A.Efficacy of conjugated linoleic acid for reducing fat mass:a meta-analysis in humans 1,2[J].Am J Clin Nutr,2007,85(5):1203-1211.
[3] IP CL,SF C,JA S,et al.Mammary cancer prevention by conjugated dienoic derivative of linoleic acid[J].Cancer Res,1991,51(22):6118-6124.
[4] KENNEDY A1,MARTINEZ K,SCHMIDT S,et al.Antiobesity mechanisms of action of conjugated linoleic acid[J].J Nutr Biochem,2010,21(3):171-179.
[5] PARIZA MW,PARK Y,ME C.The biologically active isomers of conjugated linoleic acid[J].Prog Lipid Res,2001,40(4):283-298.
[6] LEE KNL,KRITCHEVSKY D,MW P.Conjugated linoleic acid and atherosclerosis in rabbits[J].Atherosclerosis,1994,108(1):19-25.
[7] HOUSEKNECHT KL,JP V H,SY M,et al.Dietary conjugated linoleic acid normalizes impaired glucose tolerance in the Zucker diabetic fatty fa/fa rat[J].Biochem Biophys Res Commun,1998,247(3):911.
[8] 谷利偉,趙金蘭.共軛亞油酸研究進展[J].糧油食品科技,2001,9(2):28-29.
[9] 梁世中.生物制藥理論與實踐[M].北京:化學工業出版社,2005:285-286.
[10] 萬永虎,賈東晨,謝志丹,等.共軛亞油酸的合成[J].中國釀造,2013,32(4):5-11.
[11] 郭諍,張根旺,孫彥.共軛亞油酸制備方法的研究進展[J].化學通報,2003,66(9):592-597.
[12] 王麗敏,呂加平,王強.微生物生產共軛亞油酸的研究進展[J].中國乳品工業,2005,33(11):38-41.
[13] 周凌華,張灝,鄭小平,等.共軛亞油酸紫外檢測方法的研究[J].乳業科學與技術,2007(5):267-270.
[14] 潘麗軍,陳錦權.試驗設計與數據處理[M].南京:東南大學出版社,2007:322-328.
[15] 合肥工業大學數學教研室.概率論與數理統計[M].合肥:合肥工業大學出版社,2004:301-310.
Study on the Fermentation Conditions of Producing Conjugated Linoleic Acid byLactobacillusacidophilus
TANG Yu-qing, XU Yi*, PAN Li-shuang et al
(College of Biological and Food Engineering, Hefei University of Technology, Hefei, Anhui 230009)
[Objective] To improve the synthesis of conjugated linoleic acid (CLA), optimize the fermentation conditions of producing conjugated linoleic acid byLactobacillusacidophilus. [Method] With linoleic acid as substrate, four factors (substrate concentration, inoculation quantity, fermentation time, fermentation temperature) were selected to carry out single factor test, which significantly impacted the generation of CLA, on the basis of this, orthogonal test was conducted to optimize fermentation conditions. [Result] Single factor experiment reflected that the optimal fermentation conditions were the substrate concentration 1.0 mg/ml, inoculation quantity 4%, initial pH 5.5, fermentation time 48 h, fermentation temperature 37 ℃. The orthogonal test found that the substrate concentration, fermentation time and fermentation temperature had significant influence on the production of CLA. Finally, the optimal fermentation conditions were obtained: the substrate concentration 1.5 mg/ml, inoculation amount 2%, initial pH 5.5, incubation time 36 h, incubation temperature 33 ℃. GC-MS was used to conduct qualitative analysis of the product. It turned out that the product was c-9, t-11 CLA. At this point, the production of CLA was 91.54 μg/ml. [Conclusion] In summary, the fermentation conditions pertaining to the synthesis of CLA was optimized in this study, facilitating the more efficient use of this CLA biosynthetic processes.
Conjugated linoleic acid;Lactobacillusacidophilus; Fermentation condition
國家自然科學基金青年基金項目(31401671)。
湯玉清(1987- ),男,安徽六安人,碩士研究生,研究方向:食品營養與神經毒理。*通訊作者,講師,博士,從事微生物與食品方面的研究。
2014-12-29
S 188+.4
A
0517-6611(2015)06-272-04

