光照強度對長春花生活史形成和光合作用的影響
高揚,王永勖,樊梓鸞,王振宇,唐中華
(1.吉林市林業科學研究院,吉林吉林132013;2.東北林業大學林學院,哈爾濱150040;3.哈爾濱工業大學食品科學與工程學院,哈爾濱150090;4.東北林業大學,哈爾濱150040)
光照強度對長春花生活史形成和光合作用的影響
高揚1,王永勖1,樊梓鸞2,王振宇3,唐中華4
(1.吉林市林業科學研究院,吉林吉林132013;2.東北林業大學林學院,哈爾濱150040;3.哈爾濱工業大學食品科學與工程學院,哈爾濱150090;4.東北林業大學,哈爾濱150040)
長春花是重要的藥用植物,廣泛栽植于熱帶和亞熱帶地區,其次生代謝產物文多靈、長春堿,長春質堿等可治療多種癌癥。如果可以通過調節光照來達到不同的生產目的,將對生產實踐具有重要意義。實驗分3個強度光照培養長春花,分別為100 μmol/m2·s、500μmol/m2·s和900μmol/m2·s,運用主成分分析法(PCA),對營養生長、有性生長和無性繁殖3類15種性狀進行統計,結果表明:不同光照強度對長春花生活史型的調控作用十分明顯,其生活史型隨著光照強度的減弱,由VS轉變為VC,體現了植物能量的內部循環。光合數據結果表明,嫩葉主要利用強光,老葉主要利用弱光,使植物充分利用不同生境下的光照,以保證生存。
長春花;生活史型;主成分分析
植物生活史又稱植物生活周期,是指植物在一生中所經歷的以細胞分裂、細胞增殖、細胞分化為特征,最終產生與親代基本相同的子代的生殖、生長和發育的循環過程。一個典型的植物生活史包括植物的營養生長、有性生殖和無性生殖3個基本階段,其保障是能量的供應與分配,其實質是子代從親代獲得一套完整包含子代生長發育所需的全部遺傳新的DNA,由此實現植物延續后代的基本目的[1]。
長春花[Catharanthusroseus(L.)G. Don],屬于夾竹桃科(Apocynaceae)長春花屬(CatharanthusG. Don)。直立多年生草本或亞灌木狀。其次生代謝產物長春堿、長春新堿、文多靈有抗癌作用。本實驗研究光照對長春花生活史型的影響,期望對生產實踐起到指導作用。
1 材料與方法
以溫室內培育70天的長春花為實驗材料,在平均光照強度分別為100μmol/m2·s、500μmol/m2·s和900μmol/m2·s(光照時間6:00~19:00,溫度為28℃(晝)/20℃(夜),濕度60%),人工氣候箱中培養四周后,對長春花植株進行生活史性狀參數測定。
光合數據由LI-6400測定,光補償點(LCP, μmol photons/m2·s)、光飽和點(LSP, μmol photons /m2·s)、最大凈光合速率等重要參數由下面公式得出:
Pn=P1×(1-e-P2×(PPFD-P3))
其中,P1為光飽和時的光合速率,即最大凈光合速率;P2為常數;Pn是實際測定的光合速率;PPFD是指光量子同量密度(photosynthetic photon flux density, μmol/m2·s);P3是光補償點;e為自然對數。光飽和點按凈光合速率為最大凈光合速率的90%時的光合有效輻射求得。
2 結果與分析
2.1 數據的標準化處理
對數據首先進行標準化處理,消除量綱,按營養生長、有性生長和無性生長將長春花形態性狀分為3類,分別測定如植株高度、基徑、節間長等15個主要數量指標,結果見表1。
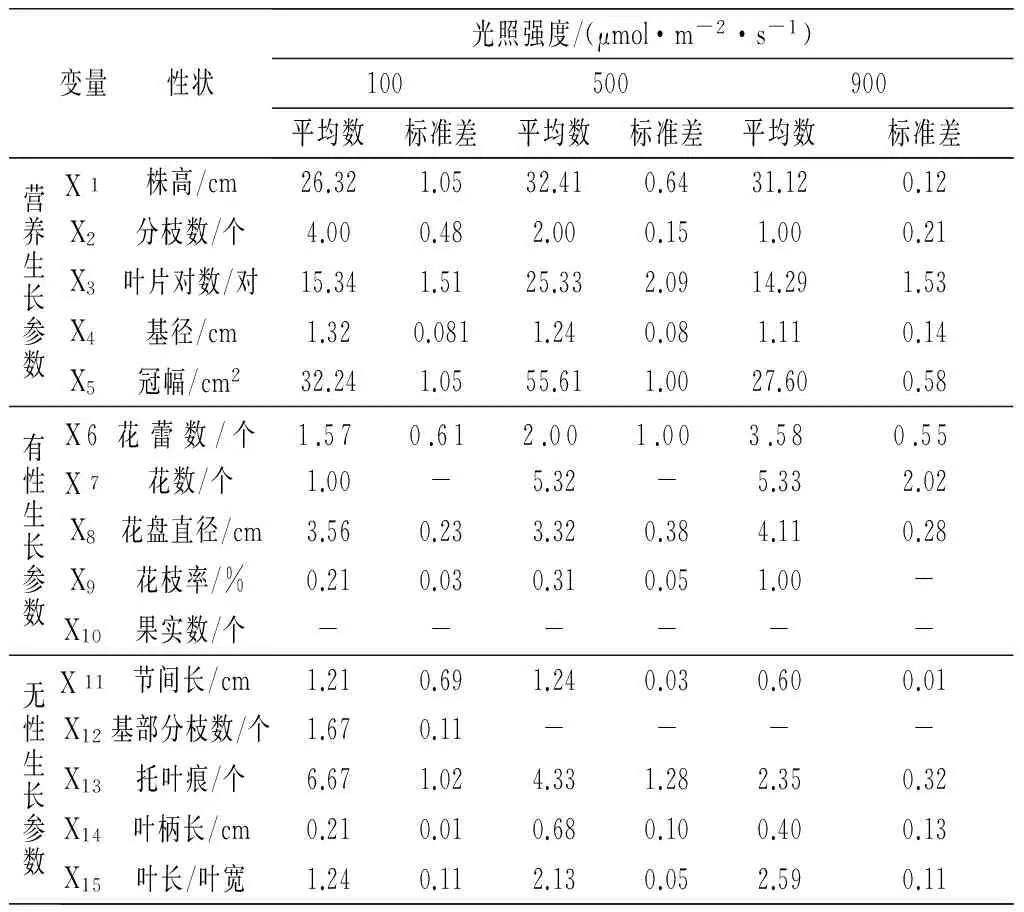
表1 不同光照強度對長春花生活史型形成的影響
2.2 生活史主成分提取和分析
應用SPSS12.0按照主成分提取與分析的方法,對其營養生長、有性繁殖和無性繁殖性狀進行主成分分析,第一主成分特征值均大于1,主分量得分系數見表2。
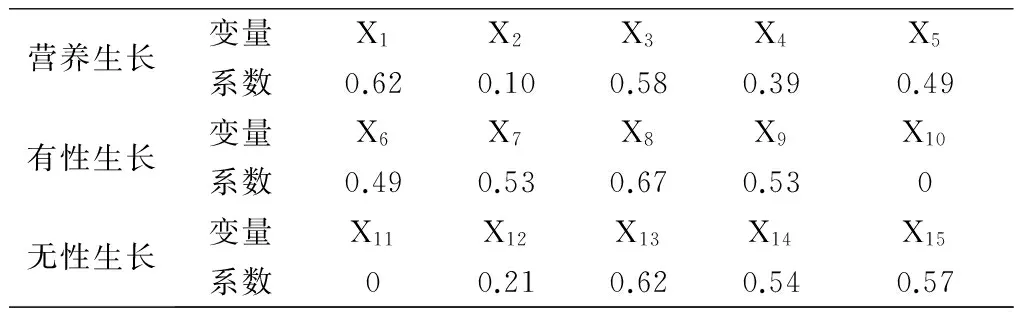
表2 長春花在不同生活史性狀上主成分向量系數矩陣
根據主分量得分系數,分別計算出不同類型長春花在營養生長、有性生殖和無性生殖的主成分得分,結果見表3。主成分結果見圖1。
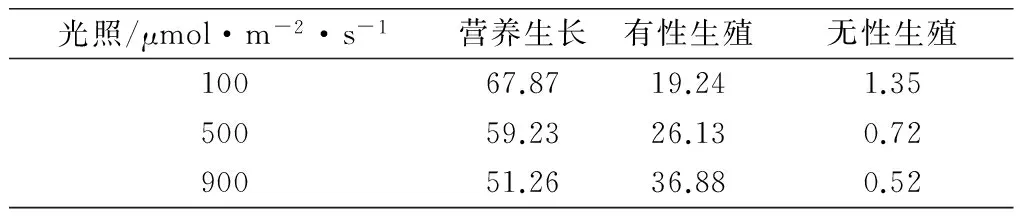
表3 不同類型長春花在不同生活史階段的主成分結果
經過主分量歸一化結果,得到100μmol/m2·s V0.6787S0.1924C0.0135,500μmol/m2·s V0.5923S0.2613C0.0072,900μmol/m2·s V0.5126S0.3688C0.0052。可以看出,光照強度改變后長春花植株內有性生殖和無性生殖的比例有了較為明顯的增加。光照強度減弱后長春花內部能量分配格局起了變化,從原來以營養生長的VS生活史型向VC生活史型過渡。
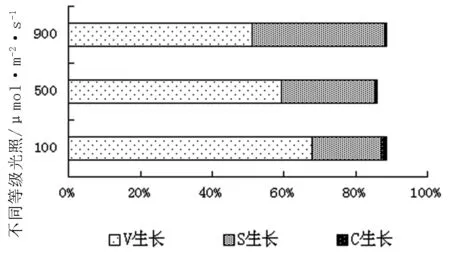
圖1 長春花不同光照條件下主分量綜合得分
2.3 不同光照對長春花的光合與呼吸作用
2.3.1 不同齡級葉片的光響應曲線。葉齡不同對外界光響應敏感程度具有顯著的差異。本實驗測定了100、500、900μmol/m2·s光照條件下,長春花嫩葉和老葉的光響應曲線(圖2)。
由圖2可以看出,嫩葉光合作用與光照強度呈正相關,光補償點和光飽和點均較高。提高光照強度能顯著提高長春花未成熟葉片的光合水平。而老葉的光合作用與光照強度呈負相關,光補償點和飽和點接近,可能由于其電子傳遞鏈的老化和較低的羧化效率而趨向于利用低光照。這可能是植物適應不同光照強度的一種生理機制。
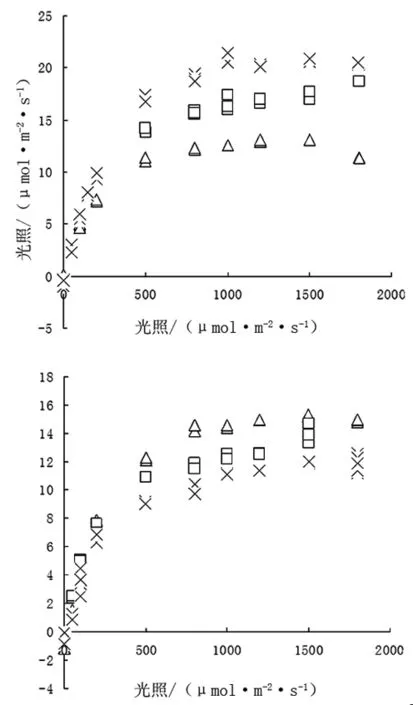
圖2 幼嫩和成熟葉片在不同光照條件下的光響應曲線
2.3.2 光合作用相關數據及氣孔顯微結構。不同光照下長春花最大凈光合速率、呼吸和氣孔導度數據如圖3。
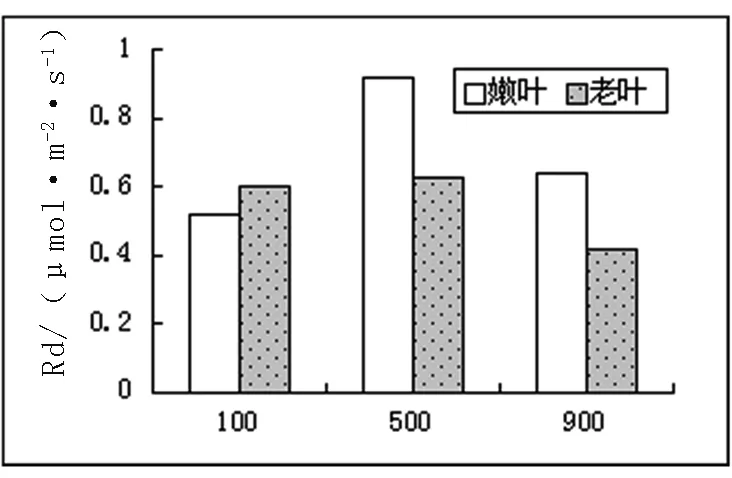
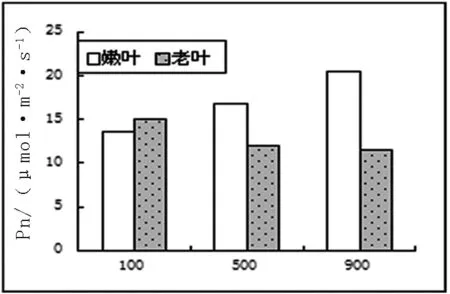
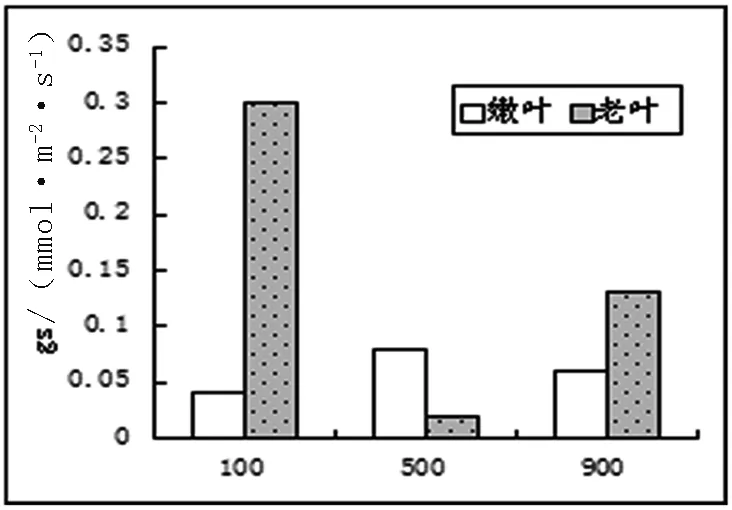
圖3 不同光照下長春花光合、呼吸、氣孔導度圖
從圖3中可以看出,最大凈光合速率中,嫩葉速率與光照強度成正比,而老葉則成反比。這和以前的研究成果,不同發育階段的葉片能吸收和利用不同光質和光強,所以衰老葉片也被稱為陰生葉,主要利用弱光,而幼嫩葉片主要利用強光。這樣有助于植物充分適應不同生境下光照條件[2]相一致。呼吸試驗中嫩葉在500μmol/m2·s條件下,達到最大,其氣孔導度也達到最大。老葉的呼吸作用隨光照強度增強而降低,氣孔導度在弱光下最大,進一步說明衰老葉片適應低光照的能力較強。
3 討論
用主成分分析法計算出3個光照條件下長春花生活史型分別為100μmol/m2·s V0.6787S0.1924C0.0135,500μmol/m2·s V0.5923S0.2613C0.0072,900μmol/m2·s V0.5126S0.3688C0.0052,可以看出,光照強度對長春花生活史型的調控作用十分明顯。低光照下,長春花主要將能量集中在營養生長和無性生長,保證植株的存活。同時減弱光照強度可誘導積累生物堿,從而增加植物組織中生物堿的含量[3-4]。隨著光照強度的增加,植物葉片保衛細胞膨壓下降氣孔關閉[5-6],植物所需的二氧化碳無法滿足,致使光合作用下降或停止[7-8],而可溶性糖開始積累,可溶性糖,包括蔗糖、葡萄糖和果糖,在葉片中大量積累可能與提高保水能力、增加抗性有關,同時還能作為能量供應物質和信號分子促進有性繁殖[9]。而實驗結果S型比例上升驗證了這個結論。
這對生產實踐有一定的指導作用,如果想得到更多的種子可以適當的增強光照,從代謝產物的角度來講,低光照是一種脅迫,有利于長春花體內的次生代謝產物文多靈、長春堿、長春質堿等抗癌成分的積累;如果想增加其含量,可考慮適當減弱光照強度。
[1]祖元剛,王文杰,楊逢建,等.植物生活史型多樣性及其動態研究[J],生態學報,2002,22(11):1811-1818.
[2]閻秀峰,王洋,尚辛亥,等,光強和光質對野外栽培高山紅景天生物量和紅景天甙含量的影響[J].生態學報,2004,24(4):647-679.
[3]Haegele B F,Rowell R M.Genetic and environ mental based variability in secondary metabolite leaf content of Adenostyles alliariae and A.alpina(Asteraceae).Atest of there source avail ability hypothesis[J].Oikos,1999,85(2):234-246.
[4]SalmoreAK,HunterMD.Environmental and genotypic influence sonisoquino line alkaloid contentin Sanguinaria canadensis[J]. Journal of Chemical Ecology,2001,27(9):1729-1747.
[5]Wong S C, Cowan I R, Farquhar G D. Stomatal conductance correlates with photosynthetic capacity. Nature, 1979, 282(5737): 424-426.
[6]Parida K A, Jha B. Salt tolerance mechanisms in mangroves: a review. Trees-Structure and Function, 2010, 24(2): 199-217.
[7]Gama P B S, Inanaga S, Tanaka K, Nakazawa R. Physiological response of common bean (PhaseolusvulgarisL. ) seedlings to salinity stress.African Journal of Biotechnology, 2007, 6(2): 79-88.
[8]MullerB, Pantin F, G nard M, Turc O, Freixes S, Piques M, Gibon Y. Water deficits uncouple growth from photosynthesis, increase C content,and modify the relationships between C and growth in sink organs. Journal of Experimental Botany, 2011, 62(6): 1715-1729.
[9]Masaaki O and Kryoshi O. Effects of sugar on Vegetative Development and Floral Transition in Arabidopsis. Plant Physiol ,2001,127:252-261.
Effect of Different Light Intensity on Life Cycle forms and Photosynthesis ofCatharanthusroseus
Gao Yang1*, Wang Yongxu1, Fan Ziluan2, Wang Zhenyu3, Tang Zhonghua4
(1.Research Institute of Forestry Science Jilin City, Jilin 132013;2.School of Forestry, Northeast Forestry University,Harbin 150040; 3.School of Food Science and Engineering,Harbin Institute of Technology,Harbin 150090;4.Northeast Forestry University; Harbin 150040)
Catharanthusroseuscan be used as medicine,Its secondary metabolites such as vindoline, vinblastine can be used to cure various cancers. It would be important for production if we can be by adjusting the illumination to achive diffrent purposes of production. The experiment was divided into three intensity of light cultureCatharanthusroseus, respectively 100μmol/m2·s,500μmol/m2·s and 900μmol/m2·s,the results show that the control effects of different light intensity on the life history ofCatharanthusroseustype is obvious, its life cycle forms with the reduction of light intensity, changes from VS for the VC, embodies the plant energy internal circulation.The photosynthetic data results show that young leaves use of bright light, old leaves use of weak light, make full use of light plants under different habitats in order to ensure survival.
Catharanthusroseus; Life cycle forms; PCA
2015-01-20
國家自然科學基金項目(31170510)
高揚(1981-),女,碩士,工程師,從事森林培育方面的研究工作,E-mail: hjgly36@126.com。
Q948.1;Q945.11
A
DOI.:10.13268/j.cnki.fbsic.2015.03.001

