腫瘤壞死因子受體相關因子參與炎癥免疫調節的研究進展
李 影,陳鏡宇,張玲玲,魏 偉
(安徽醫科大學臨床藥理研究所,抗免疫藥物教育部重點實驗室,安徽合肥 230032)
腫瘤壞死因子受體相關因子參與炎癥免疫調節的研究進展
李 影,陳鏡宇,張玲玲,魏 偉
(安徽醫科大學臨床藥理研究所,抗免疫藥物教育部重點實驗室,安徽合肥 230032)
中國圖書分類號:R-05;R364.5;R392.11;R977.6
摘要:腫瘤壞死因子受體相關因子(tumor necrosis factor re-ceptor-associated factors,TRAF)是一類重要的具有多功能的細胞內信號轉導因子。TRAF參與多種受體家族的信號轉導,包括腫瘤壞死因子受體家族(tumor necrosis factor recep-tor,TNFR)和Toll樣-IL-1受體(Toll-like receptors-interleu-kin-1 receptors,TLR-IL-1R)家族等,在固有免疫和獲得性免疫中發揮重要作用。受體活化時,TRAF直接或間接募集下游受體的胞內結構域,參與信號轉導,最終激活NF-κB和干擾素調節因子(interferon regulatory factor,IRF)等活化轉錄因子信號通路,從而誘導免疫和炎癥反應,參與炎癥免疫性疾病的發生發展。
關鍵詞:TRAF;信號轉導;TNFR;NF-κB;免疫;炎癥;疾病
網絡出版時間:2015-8-10 14:37 網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150810.1437.006.html
腫瘤壞死因子受體相關因子(tumor necrosis factor recep-tor-associated factors,TRAF)是一類具有多功能的細胞內信號接頭分子。這類分子在細胞內與下游分子相互作用,最終引起NF-κB活化誘導免疫與炎癥反應。對于TRAF家族,目
前已發現人和鼠的TRAF分子各有7種(TRAF1-7),這些TRAF分子不僅有類似的結構特征,而且作為信號轉導通路上游的接頭分子在細胞內信號通路中起關鍵作用。本文將闡述TRAF蛋白在調控經典NF-κB途徑與非經典NF-κB途徑中的異同,TRAF蛋白調節Ⅰ型干擾素路徑及其在炎癥免疫性疾病中的作用。
1 TRAF家族成員功能結構域
目前,在哺乳動物中發現TRAFs家族成員共有7個(TRAF1-7),它們主要參與TNF受體家族信號通路[1]。大多數TRAFs成員都包含一個N-末端指環狀結構域(1-86AA)和數量不等的鋅指,而C-末端TRAF結構域(358-501AA)由卷曲螺旋TRAF-N(N-terminal coiled-coil region,TRAF-N)結構域和保守的TRAF-C(C-terminal β-sandwich,TRAF-C)結構域組成。在7種TRAFs家族中,TRAF1結構最特殊,它不含TRAF結構N-末端的指環結構域和鋅指結構[2]。研究表明,TRAF1在鼻咽癌的癌組織中表達高于癌旁組織,并且在霍奇金淋巴瘤中也高表達。TRAF2結構域包含2個亞結構域,即TRAF-N結構域和TRAF-C結構域[3]。TRAF-C的C末端序列與TNF-R2和腫瘤壞死因子受體相關死亡域蛋白(TNF receptor associated death domain pro-tein,TRADD)相互作用,而TRAF-C的N末端與受體相互作用蛋白(receptor inter-acting protein,RIP)相互作用。TRAF2主要激活2個獨立的信號轉導途徑:NF-κB誘導激酶(NF-κB inducing kinase,NIK)途徑和c-Jun氨基端激酶(c-Jun N-terminal kinases,JNK)途徑[4]。TRAF3是TRAF家族中功能最為多樣化的成員之一。最近研究表明,TRAF3不僅能夠負向調節NF-κB和MAPK信號通路,還能夠正向調節Ⅰ型干擾素的產生[5]。TRAF4除具有TRAF家族成員共有的結構特征外,還具有自己獨特的特征,如TRAF4是TRAF家族成員中唯一可以核定位的蛋白,在胚胎發育過程和乳腺癌中高表達[6]。TRAF5表達較廣泛,高表達于肺,中度表達于脾、胸腺、腎,在乳腺等其它組織中水平很低。研究表明,TRAF5在缺血性腦梗死和炎癥性腸疾病中發揮重要作用[7]。TRAF6是多功能的細胞內信號轉導分子,具有受體結合特異性,是TRAF家族中唯一可以與白介素-1受體(in-terleukin-1 receptor,IL-1R)相關激酶、核因子κB受體激動劑(receptor activator of nuclear factor-κB,RANK)、CD40直接結合的信號分子,在RANK介導的破骨細胞激活途徑中起重要作用[8]。TRAF7于2004年被發現,有長型和短型兩種形式,長型是通常所說的TRAF7,編碼670個氨基酸的蛋白。短型被定名為TRAF7s,較長型缺少第1~66號氨基酸[9]。目前TRAF7相關的研究還不是很多。
除了TRAF7外,所有TRAFs在C-末端都有高度保守的模序,稱為TRAF結構域。TRAF結構域的長度約為200個氨基酸,并劃分為TRAF-N和TRAF-C兩部分[10]。TRAFs的三聚化,需要完整的TRAF結構域。晶體結構分析發現,在蘑菇形三聚體中,TRAF-C像蘑菇上的帽子,TRAF-N的α螺旋為莖。一個腫瘤壞死因子受體2(tumor necrosis factor re-ceptor 2,TNFR2)分子僅與TRAF2分子三聚體中一個TRAF-C區的淺表部位結合,而不與三聚體中另外兩個單體接觸。TRAFs這種三聚體化學結構為信號由細胞外經TN-FR向細胞內傳遞奠定了重要的結構基礎。所有哺乳動物的TRAF分子的N端,除了TRAF1以外都含有1個指環結構域和5~7個鋅指結構域[11]。指環狀結構被認為可介導DNA-蛋白質和蛋白質-蛋白質間的相互作用,近來又發現指環狀結構參與TRAFs的蛋白酶體依賴的降解過程[12]。
TRAFs作為銜接蛋白,一方面通過與受體胞內段的TRAF同源結構域接受外界刺激信號,另一方面又可通過其TRAF同源結構域募集胞質內其它含有TRAF的蛋白分子,或通過其N-端指環/鋅指結構與其它蛋白質分子或DNA結合,形成復合物向下游傳遞信號。
2 調控NF-κB途徑
2.1TRAF參與TNFRs超家族誘導經典的NF-κB途徑
TNFR1和TNFR2是TNF兩個受體,屬于TRAF家族成員,在細胞增殖、分化、凋亡、免疫調節和炎癥反應等生理和病理過程中發揮關鍵作用。TNFR1在人體所有組織中表達,是介導TNF信號轉導的主要受體;TNFR2主要是存在于免疫細胞,參與免疫細胞的免疫調節和炎癥過程。TNF-α通過其特異性受體而募集TRADD、細胞凋亡蛋白抑制劑1/2(cellular inhibitor of apoptosis protein,cIAP1/2)、TRAF2/5和RIP1等組成的復合物到TNFR1上,接頭蛋白RIP1被泛素化酶cIAP 和TRAF泛素化,通過轉化生長因子激活激酶1(transforming growth factor-p-activated kinase 1,TAK1)激活IKK激酶。RIP1通過多聚泛素鏈和轉化生長因子活化蛋白激酶1結合蛋白(transforming growth factor-activated kinase 1-binding pro-tein 2/3,TAB2/TAB3)之間的結合來募集TAK1激酶復合物,而RIP1募集IKK復合物是通過多聚泛素鏈和IKKγ之間的結合[13]。活化的IKK復合物,在Ser32和Ser36上磷酸化IκBα,通過Lys19上SKP1,Cdc53/Cullin1和F-box蛋白β轉導含有重復序列的蛋白(βTRCP)SCFIκB的E3泛素連接酶復合物導致IκBα多泛素化。多聚泛素化的IκBα通過26S蛋白酶體降解后,釋放RelA和形成RelA/p50異源二聚體進入細胞核,從而誘導基因表達。
研究表明,cIAP1和cIAP2可以催化RIP1的泛素化和TNF介導的IKK活化。TRAF2和cIAP1/2之間的相互作用對TNF-α誘導的RIP1多泛素化和NF-κB活化起促進作用[14],這表明TRAF2,雖然不是直接的RIP1 E3連接酶,但在RIP泛素化的過程中起關鍵作用。TRAF2和TRAF5可能在TNF-α誘導的典型的NF-κB活化中并非必不可少,因為在TRAF2-/-成纖維細胞中,NF-κB的活化僅部分降低[15];而缺失TRAF2和TRAF5的細胞基本上沒有TNF依賴性激酶活性。
2.2TRAF參與調控非經典的NF-κB途徑 在哺乳動物中,NF-κB家族包括RelA、RelB、p50/NF-κB1、p52/NF-κB2 和c-Rel。由p52/RelB基因形成的異二聚體介導的非經典NF-κB途徑,在次級淋巴組織發育和適應性免疫應答中尤為重要。TRAF3蛋白可以與NIK相互作用,該作用觸發了NIK蛋白的泛素化-蛋白酶體降解途徑。NIK在非經典NF-κB途徑中起關鍵作用。TRAF3蛋白水平降低,能夠促進NIK蛋白在細胞內積聚,而NIK能夠通過與IKKα發生相互
作用,并且直接磷酸化IKKα,使之二聚化,誘導無活性NF-κB前體蛋白p100活化為有活性p52,激活非經典NF-κB通路(Fig 1)。研究發現,在人多發性骨髓瘤(multiple myelo-ma,MM)細胞中存在NIK蛋白積累和非經典NF-κB途徑活化,以及TRAF2、TRAF3、cIAP1和cIAP2基因缺失和(或)突變,提示TRAF2、TRAF3、cIAP1和cIAP2都負性調控非經典NF-κB信號通路[16]。在休眠細胞中,NIK與TRAF2/TRAF3以及cIAP1/cIAP2形成一個復合體,并且該復合體促進NIK發生K48位泛素化降解,當通路被激活,NIK發生蓄積,并磷酸化下游的IKKα,后者促進無活性NF-κB前體蛋白p100被蛋白酶體剪切,成為有活性p52。p52與RelB形成異二聚體并入核,啟動下游靶基因轉錄。從抑制的NIK/TRAF/cIAP復合物中釋放NIK,導致NIK在B細胞中積累[17]。在多發性骨髓瘤病人細胞系中,都存在NF-κB通路相關基因表達異常,并且多數有NIK蛋白蓄積,進而造成NF-κB通路持續活化,從而促進骨髓瘤細胞增殖、抑制骨髓瘤細胞凋亡促進新生血管形成、最終導致溶骨病變。
另外,NIK基因缺失可使致死表型的TRAF2-/-和TRAF3-/-小鼠獲救,即缺失的NF-κB2基因也可使致死表型的TRAF3-/-小鼠獲救。而缺失的NF-κB1基因不能使致死表型的TRAF3-/-小鼠獲救,這表明NIK是持續活化非經典NF-κB途徑的關鍵分子。與TRAF3-/-小鼠比較,TRAF3-/-NF-κB2+/-小鼠只能存活幾天,而TRAF3-/-NIK+/-小鼠出生后可存活幾個月[18]。這可能是由于在TRAF3-/-NIK+/-小鼠中NIK水平不足從而誘導非經典NF-κB信號通路。
3 TRAF參與調控Ⅰ型干擾素的產生
Ⅰ型干擾素(interferons,IFNs)在控制病毒感染起到了至關重要的作用。最近在哺乳動物細胞中發現兩大信號通路負責干擾素的產生。一個是由另一個TRAF家族成員Toll樣受體(toll-like receptors,TLRs)誘導的,尤其是TLR7和TLR9,可在漿細胞樣樹突狀細胞(plasmacytoid dendritic cells,pDC)的核內中識別病毒核酸[19]。另一種是由RIG-I樣受體(RIG-I like receptors,RLRs)誘導,包括視黃酸,可誘導基因-I(retinoic acid-induced gene I,RIG-I)和黑色素瘤分化相關基因5(mela- noma differentiation associated gene 5,MDA5),其可在許多其他類型的細胞中識別細胞質病毒RNA。
在pDC中,TLR7和TLR9從病毒中分別識別單鏈RNA和非甲基化DNA,并且通過MyD88觸發下游信號,而TLR3在常規樹突狀細胞和巨噬細胞中識別雙鏈RNA并通過Toll /IL-1受體結構域接頭分子(Toll/IL-1 receptor domain contai-ning adaptor inducing IFN-β,TRIF)激活下游信號。MyD88與白介素-1受體相關激酶1(interleukin-1 receptor-associated kinase 1;IRAK-1)、IRAK4和干擾素調節因子-7(interferon regulatory factor-7,IRF7)形成一個復合物,直接激活IRF7。IRAK1和IKKα已被認為是潛在的IRF7激酶。磷酸的IRF7進入細胞核誘導I型干擾素表達(Fig 2)。IRF7的激活需要泛素結合酶13(ubiquitin conjugating enzyme 13,UBC13)和TRAF6完整的指環結構域,這表明多泛素化在活化IRF家族的轉錄因子上也是非常重要的。TRIF與TRAF3和TRAF6共同誘導TBK1和IKKε活化,從而使IRF3和IRF7磷酸化[20]。IRF3/7通過TBK1/IKKε磷酸化,誘導形成IRF同二聚體和/或異二聚體,然后易位到細胞核并結合到IFN-敏感反應元件(interferon stimulate response elements,ISREs),導致I型干擾素和IFN誘導性基因表達。MyD88依賴性和TRIF依賴性抗病毒途徑都需要TRAF3,因為TRAF3-/-骨髓誘導的巨噬細胞和TRAF3-/-pDC不能在TLR3和TLR4配體刺激后產生Ⅰ型干擾素。
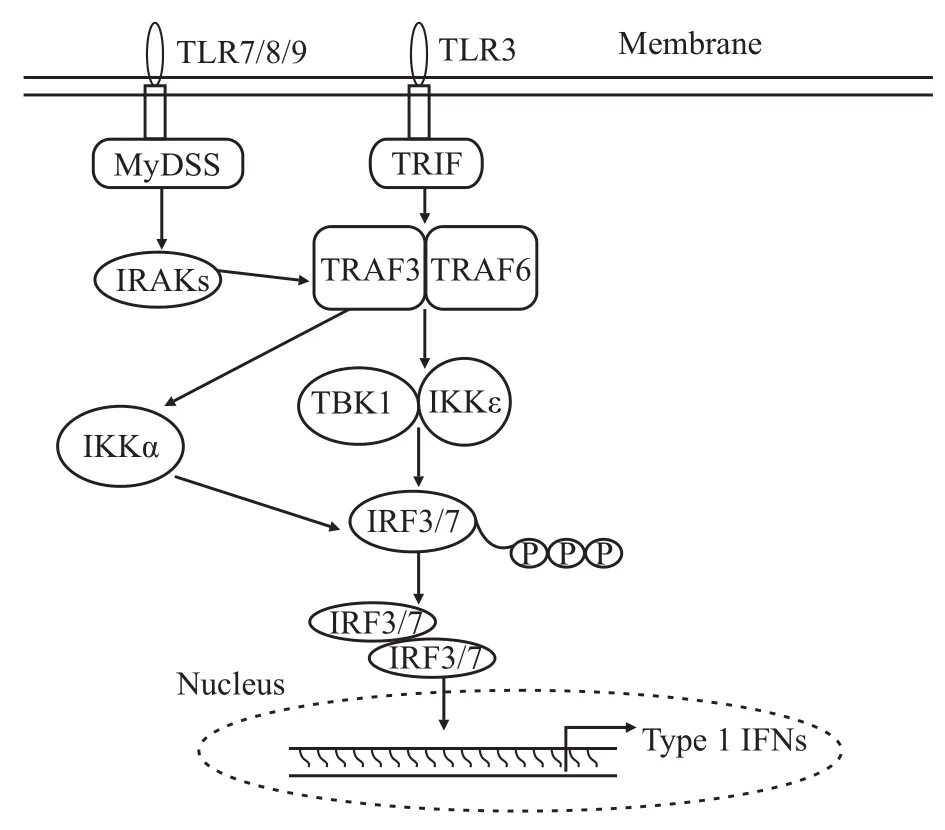
Fig 2 TRAF mediated type 1 interferon production pathway
一旦檢測到細胞質中的病毒RNA,RIG-I和MDA5募集胱冬肽酶結構域(caspase recruitment domain,CARD)配體去誘導IFN-β(也被稱為線粒體抗病毒信號)、IFN-β啟動子刺激-1(interferon beta promoter stimulator1,IPS-1)或病毒誘導的信號適配器。該信號復合物再與TRAF3一起激活TBK1/IKKε,進一步磷酸化和激活IRF3/7。IFN-β和TRAF3之間的相互作用對于Y440A/Q442A突變體IFN的產生非常關鍵[21]。此外,TRAF3基因敲除細胞顯示病毒誘導的IFN-α產生明顯減少,說明TRAF3在RLR介導的干擾素生產起關鍵作用。
4 TRAF在免疫細胞中的作用
TRAF2、3、5和6對B細胞的生存、發展和活化起重要作
用。在缺少TRAF2或TRAF3的條件下,由于p52的激活,不依賴BAFF的B細胞生存期表現明顯的延長。在BAFF-R-/-小鼠中的B細胞成熟過程中,B細胞不表達TARF2、TARF3和cIAP1/2。因此,B細胞的生存、成熟通常由BAFF結合BAFF-R后,BAFF-R與TARF2、TARF3或cIAP1/2解離,從而激活下游非經典NF-κB途徑[22]。B細胞缺失TARF2、TARF3或cIAP1/2,對CD40信號表現出不同的影響。TRAF3-/-B細胞在CD40信號轉導中可加速JNK、ERK 和p38的磷酸化。然而,TRAF2-/-B細胞則減少和減慢CD40的信號轉導[23]。在TRAF2-/-和cIAP1-/-cIAP2-/-小鼠的B細胞中,用綿羊紅血細胞免疫后可明顯降低生發中心的形成。
除了TARF4以外,TRAF的其他亞型在調節T細胞免疫中發揮關鍵的作用。TRAF1-/-T細胞在T細胞受體信號中表現為T細胞增殖和促進Th2細胞因子(IL-4、IL-5、IL-13)的產生。TRAF1-/-T細胞的增殖是由于激活p52通路。在TRAF2-/-或TRAF3-/-T細胞中,盡管它們激活p52,但既不可使T細胞生存期延長也不可使T細胞增殖。例如,在TRAF2-/-小鼠中,TRAF2-NIK-p52信號可導致自身免疫炎癥反應失調。TRAF3-/-T細胞小鼠可增加調節性T細胞產生。在TRAF5-/-T細胞中,CD27介導的共刺激信號減少。在TRAF6-/-小鼠的胸腺中,調節性T細胞的形成表現出嚴重缺陷[24]。TRAF6-/-T細胞會導致多器官炎癥疾病發生。TRAF6-/-T細胞在應對調節性T細胞的抑制作用,通過PI3K-Akt途徑表現出超活化作用。TRAF6-/-CD4 T細胞通過增加TGF-β誘導的Smad2/3活化和下調IL-12來調節Th17的分化。活化的TRAF6-/-CD8 T細胞在應對生長因子缺失時,表現出磷酸腺苷(adenosine monophosphate,AMP)激酶活化的缺陷,導致感染后記憶性CD8 T細胞形成嚴重缺陷。
樹突狀細胞(dendritic cells,DCs)是體內最強大的專職抗原呈遞細胞,具有免疫原性和耐受性雙重作用。DCs通過呈遞抗原活化T細胞、產生炎癥細胞因子和趨化因子,參與類風濕關節炎(rheumatoid arthritis,RA)病理過程。TRAF1、2、3、4和6參與調節DCs功能,其中TRAF1和2具有協同作用。TRAF3-/-DCs在TLR7和TLR9信號通路中可增加IL-12產生但減少IL-10和I型干擾素的產生[25]。TRAF6是DCs成熟和活化所需。在CD40L反應中,TRAF6-/-DCs不能上調MHCII和CD86的表達及炎性細胞因子的產生。
5 TRAF在炎癥免疫疾病及腫瘤中的作用
在RA發生發展中,大量炎癥相關細胞,如DCs入侵到關節滑膜組織。而且,滑膜細胞本身也大量增殖并侵入到關節軟骨。這些細胞大量分泌促炎癥細胞因子和基質金屬蛋白酶,介導關節滑膜炎癥的加劇,并最終導致對滑膜、軟骨和骨組織的侵蝕與破壞,其中NF-κB發揮重要作用,尤其在滑膜細胞增殖和炎性細胞浸潤中起主導作用。滑膜組織中過表達的TNF-α可以上調滑膜細胞中TRAF2的表達量和激活NF-κB信號通路,進而介導滑膜細胞增殖。有研究發現,TRAFs介導NF-κB信號通路在RA的形成和進展中起關鍵作用。在RA病理過程中,TRAFs參與介導了NF-κB的經典途徑。NF-κB的活化是通過結合TNFR1引起下游級聯反應的。TNFR1參與的信號是TNF-α通過三聚體和TRADD、TRAF2、RIP和cIAP1/2形成的受體復合物介導參與的[26]。在B細胞中,敲除TRAF1和TRAF2后,在CD40的刺激下,兩者表現出協同激活NF-κB活性。然而TRAF1在RA中的作用,在不同的組織中表現出不同的作用。
系統性紅斑狼瘡(systemic lupus erythematosus,SLE)是一種典型的自身免疫病,以T、B淋巴細胞異常活化,產生致病性自身抗體為特征,其中B淋巴細胞功能改變具有重要意義。CD40是TNFR家族成員中的代表性受體,并在抗原特異性獲得性免疫反應中發揮重要作用[27]。淋巴細胞中NF-κB和AP-1通路的活化是SLE的重要發病機制之一。CD40能與TRAF1,2,3,6直接結合形成復合體,在介導NF-κB和AP-1信號活化中起重要作用。其中TRAF6介導CD40下游的NF-κB活化作用強,且TRAF6-缺陷的脾細胞CD40介導的NF-κB信號通路不能活化[28]。對于B細胞中的AP-1信號通路,TRAF6可選擇性地介導JNK磷酸化,再促進C-Fos和C-Jun向核內轉移,啟動炎癥相關基因的轉錄;而TRAF2可選擇性活化細胞外信號調節激酶(extracellular signal-regulated ki-nase,ERK)和p38,并誘導C-Fos向細胞核內轉移[29]。由此可知,TRAF家族在SLE的發生發展中起重要作用。
有研究報道稱,在人類腫瘤中TRAF4和TRAF6過表達和基因擴增,如在乳腺癌和肺癌中TRAF4過表達。TRAF4蛋白過度表達僅限于癌癥細胞和亞細胞定位一致的細胞質中。TRAF4蛋白過度表達的機制是TRAF4基因拷貝數增加。肺癌和骨肉瘤細胞中表現為TRAF6過表達和基因擴增。然而,下調TRAF6可抑制NF-κB活化、細胞生存和增殖以及腫瘤形成和入侵[30]。這些研究結果表明,在人類肺癌和骨肉瘤細胞中TRAF6過表達可促進腫瘤形成和侵襲。
6 結語與展望
總之,TRAFs是一種重要的具有多功能的細胞內信號轉導因子。在受體活化時,TRAFs直接或間接募集受體的胞內結構域,通過調控經典和非經典的NF-κB信號通路,不僅在維持免疫系統平衡,而且在自身免疫病的病理機制調控中起著十分重要作用。盡管對TRAFs的研究已經取得了巨大的進展,但是TRAFs的活性和表達水平的調節機制呈現出復雜的網絡體系。例如,TRAF6的K63多泛素化是怎樣介導TAK1和IKK的活化?盡管NIK穩定性是通過TRAF2、TRAF3、cIAP1和cIAP2調控,且是通過非經典的NF-κB信號,但需要進一步探索cIAP1/2是如何以TRAF2/3為靶點連接受體來降解蛋白質。設計特異性控制TRAFs的下游信號傳導途徑的治療策略具有重要意義,如cIAP1/2藥理抑制劑目前用于癌癥臨床試驗的不同階段及其他TARFs介導的疾病中。因此,深入探討TRAFs家族成員的結構功能及在炎癥免疫調節中的作用,對進一步揭示炎癥免疫性疾病的病理機制,制定靶向TRAFs的治療藥物具有重要的意義。
參考文獻:
[1] Chen B B,Coon T A,Glasser J R,et al.A combinatorial F box protein directed pathway controls TRAF adaptor stability to regulate inflammation[J].Nature Immunol,2013,14(5):470-9.
[2] Zotti T,Vito P,Stilo R.The seventh ring:exploring TRAF7
functions[J].J Cellular Physiol,2012,227:1280-4.
[3] Song Z,Jin R,Yu S Y,et al.CD40 is essential in the upregula-tion of TRAF proteins and NF-κB-dependent proinflammatory gene expression after arterial injury[J].PLoS One,2011,6(8):e23239.
[4] Cabal-Hierro L,Rodríguez M,Artime N,et al.TRAF-mediated modulation of NF-κB and JNK activation by TNFR2[J].Cell Sig-nal,2014,26(12):2658-66.
[5] Muro I,Fang G,Gardella K A,et al.The TRAF3 adaptor protein drives proliferation of anaplastic large cell lymphoma cells by regu-lating multiple signaling pathways[J].Cell Cycle,2014,13 (12):1918-27.
[6] Yoon J H,Cho Y J,Park H H.Structure of the TRAF4 TRAF do-main with a coiled-coil domain and its implications for the TRAF4 signaling pathway[J].Acta Cryst,2014,70(Pt 1):2-10.
[7] Buchta C M,Bishop G A.TRAF5 negatively regulates TLR signa-ling in B lymphocytes[J].J Immunol,2014,192(1):145-50.
[8] Liu H,Tamashiro S,Baritaki S,et al.TRAF6 activation in multi-ple myeloma:a potential therapeutic target[J].Clin Lymphoma Myeloma Leuk,2012,12(3):155-63.
[9] Fu D,Zhang Y,Xiao S,et al.The first homolog of a TRAF7 (TNF receptor-associated factor 7)gene in a mollusk,Crassostrea hongkongensis[J].Fish Shellfish Immunol,2011,31(6):1208 -10.
[10]Liu J,Yan J,Jiang S,et al.Site-specific ubiquitination is re-quired for relieving the transcription factor Miz1-mediated suppres-sion on TNF-α-induced JNK activation and inflammation[J].Proc Natl Acad Sci USA,2012,109(1):191-6.
[11]Hcker H,Tseng P H,Karin M.Expanding TRAF function:TRAF3 as a tri-faced immune regulator[J].Nat Rev Immunol,2011,11(7):457-68.
[12]Chapard C,Hohl D,Huber M.The role of the TRAF-interacting protein in proliferation and differentiation[J].Exp Dermatol,2012,21(5):321-6.
[13]Bartuzi P,Hofker M H,van de Sluis B.Tuning NF-κB activity:a touch of COMMD proteins[J].Biochim Biophys Acta,2013,1832 (12):2315-21.
[14]Rosebeck S,Rehman A O,Apel I J,et al.The API2-MALT1 fu-sion exploits TNFR pathway-associated RIP1 ubiquitination to pro-mote oncogenic NF-κB signaling[J].Oncogene,2014,33(19):2520-30.
[15]Schnetzke U,Fischer M,Spies-Weisshart B,et al.The E3 ubiq-uitin ligase TRAF2 can contribute to TNF-α resistance in FLT3-ITD-positive AML cells[J].Leuk Res,2013,37(11):1557-64.
[16]Zaravinos A,Kanellou P,Lambrou G I,et al.Gene set enrich-ment analysis of the NF-κB/Snail/YY1/RKIP circuitry in multiple myeloma[J].Tumour Biol,2014,35(5):4987-95.
[17]Kim S W,Schifano M,Oleksyn D,et al.Protein kinase C-associ- ated kinase regulates NF-κB activation through inducing IKK acti-vation[J].Int J Oncol,2014,45(4):1707-14.
[18]Bista P,Zeng W,Ryan S,et al.TRAF3 controls activation of the canonical and alternative NF-κB by the lymphotoxin beta receptor [J].J Biol Chem,2010,285(17):12971-8.
[19]Kopecka J,Rozkova D,Sediva A.Plasmacytoid DCs,exposed to TSLP in synergy with TLR ligands,acquire significant potential to-wards Th2 polarization[J].Med Sci Monit Basic Res,2013,19:291-9.
[20]Li H,Jin M,Lv T,et al.Mechanism of focal cerebral ischemic tolerance in rats with ischemic preconditioning involves MyD88-and TRIF-dependent pathways[J].Exp Ther Med,2013,6(6):1375-9.
[21]Kim S S,Lee K G,Chin C S,et al.DOK3 is required for IFN-β production by enabling TRAF3/TBK1 complex formation and IRF3 activation[J].J Immunol,2014,193(2):840-8.
[22]Moore C R,Liu Y,Shao C S,et al.Specific deletion of TRAF3 in B lymphocytes leads to B lymphoma development in mice[J].Leukemia,2012,26(5):1122-7.
[23]Pérez-Chacón G,Llobet D,Pardo C,et al.TNFR-associated fac-tor 2 deficiency in B lymphocytes predisposes to chronic lympho-cytic leukemia/small lymphocytic lymphoma in mice[J].J Immu-nol,2012,189(2):1053-61.
[24]Shimo Y,Yanai H,Ohshima D,et al.TRAF6 directs commit-ment to regulatory T cells in thymocytes[J].Genes Cells,2011,16:437-47.
[25]付靜靜,張玲玲,魏 偉.樹突細胞在類風濕性關節炎病理機制中的免疫原性和耐受性雙重作用[J].中國藥理學通報,2012,28(9):1185-8.
[25]Fu J J,Zhang L L,Wei W.Dual role of dendritic cells in the pathological mechanism of rheumatoid arthritis:immunogenicity and tolerogenicity[J].Chin Pharmacol Bull,2012,28(9):1185 -8.
[26]Kankaanranta H,Ilmarinen P,Zhang X,et al.Tumour necrosis factor-α regulates human eosinophil apoptosis via ligation of TNF-receptor 1 and balance between NF-κB and AP-1[J].PLoS One,2014,9(2):e90298.
[27]Cen H,Zhou M,Leng R X,et al.Genetic interaction between genes involved in NF-κB signaling pathway in systemic lupus ery-thematosus[J].Mol Immunol,2013,56(4):643-8.
◇論著◇
[28]Rowland S L,Tremblay M M,Ellison J M,et al.A novel mecha-nism for TNFR-associated factor 6-dependent CD40 signaling[J].J Immunol,2007,179(7):4645-53.
[29]Grotsch B,Brachs S,Lang C,et al.The AP-1 transcription factor Fra1 inhibitors follicular B cell differentiation into plasma cells [J].J Exp Med,2014,211(11):2199-202.
[30]Zhong L,Cao F,You Q.Effect of TRAF6 on the biological behav-ior of human lung adenocarcinoma cell[J].Tumour Biol,2013,34(1):231-9.
Research advance of tumor necrosis factor receptor-associated factors in inflammatory immune regulation
LI Ying,CHEN Jing-yu,ZHANG Ling-ling,WEI Wei
(Institute of Clinical Pharmacology,Anhui Medical University,Key Laboratory of Anti-inflammatory and Immune Medicine,Anhui Medical University,Ministry of Education,Hefei 230032,China)
Abstract:The tumor necrosis factor receptor(TNF-R)-associatedfactor(TRAF)is an important of multifunctional intracellular
signal transduction factors.TRAFs involve in signal transduction of many receptor families,including TNF receptor family(TN-FR),Toll-like receptors interleukin-1 receptors(TLR-IL-1R)family and so on.TRAFs play important roles in innate immunity and acquired immunity.TRAFs could directly or indirectly re-cruit the intracellular domains of receptors in the condition of ac-tivated receptor,which leads to the activation of transcription factors,such as NF-κB and interferon-regulatory factor(IRF),through signaling pathway.And TRAFs ultimately induce im-mune and inflammatory responses and involve in the development of inflammatory autoimmune diseases.
Key words:TRAF;signal transduction;TNFR;NF-κB;immuni-ty;inflammation;diseases
作者簡介:李 影(1989-),女,碩士生,研究方向:抗炎免疫藥理學,E-mail:liying09ahmu@163.com;張玲玲(1972-),女,博士,教授,碩士生導師,研究方向:抗炎免疫藥理學,通訊作者,E-mail:llzhang@ahmu.edu.cn;魏 偉(1960-),男,博士,教授,博士生導師,研究方向:抗炎免疫藥理學,通訊作者,E-mail:wwei@ahmu.edu.cn
基金項目:國家自然科學基金資助項目(No 81173075,31100640,81330081,81473223);中國博士后科學基金資助項目(No 2013M540509)
收稿日期:2015-04-10,修回日期:2015-05-16
文獻標志碼:A
文章編號:1001-1978(2015)09-1206-06
doi:10.3969/j.issn.1001-1978.2015.09.006