礦質養分輸入對森林生物固氮的影響
鄭棉海,陳 浩,朱曉敏,毛慶功,莫江明
1中國科學院華南植物園,中國科學院退化生態系統植被恢復與管理重點實驗室,廣州 510650 2中國科學院大學,北京 100039
礦質養分輸入對森林生物固氮的影響
鄭棉海1,2,陳 浩1,2,朱曉敏1,2,毛慶功1,2,莫江明1,*
1中國科學院華南植物園,中國科學院退化生態系統植被恢復與管理重點實驗室,廣州 510650 2中國科學院大學,北京 100039
生物固氮是森林生態系統重要的氮素來源,并且在全球氮循環中占有重要的地位。近代以來,因人類活動加劇而導致氮沉降的增加以及其它礦質養分元素(如磷、鉬、鐵等)輸入的改變已成為影響森林生態系統生物固氮的重要因素之一,并引起了學術界的普遍關注。綜述了國內外關于森林生物固氮對礦質養分輸入的響應及機理。主要內容包括:(1)森林生物固氮的概念及主要的測定方法;(2)礦質養分輸入對森林生物固氮的影響。整體上講,氮素輸入抑制了森林生物固氮,磷和其他營養元素輸入則表現為促進作用。氮和磷、磷和微量元素同時添加均提高了森林的固氮量;(3)礦質養分改變森林生物固氮的機理。包括生物作用機制(如改變地表層固氮菌的數量或群落豐度、改變結瘤植物的根瘤生物量和附生植物的豐度或蓋度)和環境作用機制(如引起土壤酸化、改變碳源物質的含量);(4)探討了礦質養分輸入對森林生物固氮影響研究中所存在的問題,并對未來該領域的研究提出建議。
礦質養分輸入;生物固氮;氮沉降;森林;固氮酶活性
生物固氮是森林生態系統重要的氮素來源。據估計,陸地生態系統每年通過生物固定的有效氮大約為110Tg,遠遠高于閃電固氮(3Tg N/a)[1-2]。這意味著每年有超過97%的“新”氮素是通過生物固氮進入陸地生態系統中[3]。值得注意的是,森林是固氮微生物分布最為廣泛的生態系統,如在土壤、凋落物、植物葉片、苔蘚、地衣和豆科植物的根瘤等均可以發現固氮菌的存在。地球上森林的覆蓋面積占整個陸地面積30%[4],并且固氮量達到了陸地生態系統固氮總量的近一半[5]。通過生物固定的有效氮不僅可以提高森林的生產力,還會進一步影響生態系統的結構和功能。因此,了解森林生物固氮的影響因素將有助于我們更好地認識生物固氮對森林氮循環的影響。
一般認為環境因子(如溫度、水分和光照等)的變化和礦質養分的輸入均會影響生物固氮。其中礦質養分的輸入,尤其是人類活動引起的氮沉降增加已成為普遍關注的焦點[3,6]。近30年來,隨著工業的發展和人口增加,化石燃料的過度使用已經悄然改變了全球氮循環的格局。據統計,目前全球多數地區的氮沉降速率已經超過10kg N hm-2a-1,遠遠高于生態系統的自然氮沉降(<0.5kg N hm-2a-1)[6]。許多研究發現,長期氮沉降可能通過增加森林土壤有效氮的含量而減弱固氮菌的競爭優勢,或者通過改變固氮附生植物和結瘤植物的氮素獲取方式,從而減少對固氮菌的能量分配,進一步降低森林的固氮量[7-8]。
此外,長期氮沉降可能導致生態系統養分失衡,進而使固氮菌的生長受到其他礦質養分(如磷、鉬、鐵、鈷等)的限制。磷元素參與微生物(包括固氮菌)細胞膜的合成、酶的活化以及信號的轉導[9],同時也是固氮菌能源物質ATP的主要成分[10],因此其含量的高低直接關系到固氮菌的生長和繁殖。但土壤磷起源于巖石風化,在沒有外來磷素輸入的情況下,會逐漸被生物吸收消耗或形成可溶性的有機磷而流失[11]。長期氮沉降也會通過加劇土壤磷的限制[12]進一步抑制森林的固氮能力。另外,其他營養元素的限制,尤其是構成固氮酶蛋白的重要微量元素(如鉬、鐵、鈷等)的缺乏,也可能會影響固氮酶蛋白的生物合成及相關功能的表達,進而制約生物固氮的過程[13-15]。
我國作為全球氮沉降最嚴重的三大地區之一(歐洲、北美和中國),氮沉降以每年0.41kg/hm2的速率增加,且在2000年的記錄就達到了21.1kg N hm-2a-1[6,16]。大量的干、濕沉降勢必會威脅到我國森林的固氮能力,并通過加劇其他礦質養分的失衡進一步干擾森林生物固氮的進行。但是,目前我國關于生物固氮的研究主要集中在農業方面,而在森林方面的報道僅有5篇,且內容主要集中在兩個方面:前者只是對森林中某種結瘤植物的固氮能力進行初步報道[17-18],缺乏對森林生物固氮的系統研究及影響因素的探索;后者主要關注環境因子(如溫度、濕度等)對森林附生植物[19]或結瘤植物[20-21]固氮的影響,卻忽視了礦質養分在森林固氮中的重要性。因此,本文綜述國內外關于礦質養分輸入對森林生物固氮影響的研究現狀,同時歸納和總結相應的機理,以期人們更好地認識森林生物固氮在全球氮循環中的重要性,進而為國內開展森林生物固氮的相關研究提供理論基礎和參考。
1 森林生物固氮的概念及研究方法
1.1 森林生物固氮的概念
生物固氮現象最早發現于豆科作物中,隨后主要被用于提高糧食的產量。到了1894年,林業上也開始進行豆科樹種和其他結瘤固氮樹種的選育,并利用植物固氮的“施肥”作用來提高森林的生產力[22]。按照目前普遍的定義,生物固氮是指固氮微生物將大氣中的分子態氮固定下來,進一步轉化為可以被其他生物有效利用的化合態氮的過程[23]。在森林生態系統中,固氮微生物廣泛分布于不同的組織層次,如地表層的土壤和凋落物、豆科植物的根瘤及冠層的附生植物等。根據固氮方式的差異,森林生物固氮主要為共生固氮和自由固氮兩種形式。由于固氮微生物與植物之間存在復雜的關系,所以關于生物固氮的分類并沒有很明確的標準[24]。目前普遍把具有根瘤結構的固氮植物歸入共生固氮的范疇,除此之外的其他固氮形式,如土壤、凋落物、植物葉片以及附生植物(苔蘚和地衣)等固氮菌進行的固氮統稱為自由固氮[5,24]。
1.2 生物固氮的研究方法
衡量森林生物固氮的主要指標為固氮酶活性,通過固氮酶活性可以進一步計算森林的固氮量。隨著對生物固氮的深入研究,目前已有多種方法可以有效測定固氮酶活性。如,乙炔還原法、15N同位素稀釋法、15N自然豐度法、總氮差值法、酰脲估算法等[25-26]。在森林固氮的研究中,以采用15N同位素稀釋法和乙炔還原法較多,因此以下主要對這兩種方法進行介紹。
15N同位素稀釋法主要用于固氮植物的研究。使用該方法首先需要選取生長條件相近的非固氮植物作為參照植物。在相同條件下施加含有15N同位素的氮肥,同時保證沒有其他外源氮素的干擾。隨著實驗的進行,參照植物從土壤中吸收含15N的氮素,而固氮植物不僅吸收土壤中的15N,還通過固氮作用吸收來自大氣的14N。因為14N的“稀釋”作用,經過一段時間后固氮植物體內15N /14N比例低于參照植物。通過兩種植物的15N原子百分比差值以及參照植物體內的總N含量,即可計算出固氮植物的固氮量。但因為該方法需要選取參照植物,而參照植物選取的適當與否直接關系到結果的精確性,再加上15N同位素價格昂貴,所以該方法使用并不多。相比之下,乙炔還原法具有操作簡單,價格便宜等優點[27]。
早在20世紀60年代,Hardy等[27]通過室內和野外實驗發現固氮酶不僅可以固定空氣中的氮氣,還具有將乙炔(C2H2)還原為乙烯(C2H4)的能力。因此,利用固氮酶還原乙炔的能力,測定單位時間內乙炔減少量或者乙烯生成量即可得知固氮酶的活性。目前,在森林生物固氮的研究中普遍采用該方法,具體操作如下:將待測樣品置于密閉性良好的培養瓶中,用氣密注射器抽出10%的空氣,同時注入相應體積的高純度乙炔。在室內恒溫條件或者野外環境下培養數小時后,用注射器抽出部分氣體并收集于真空采氣管中。48h內用氣相色譜儀測定待測氣體中C2H4生成量,然后計算得到固氮酶活性(nmol C2H4g-1h-1)。理想條件下,固氮酶每還原3mol C2H2與固定1mol N2等價,所以部分研究直接采用理想比例3∶1(C2H2∶N2)換算成生物固氮量(kg N hm-2a-1)[28-29]。但由于不同森林的環境條件及固氮菌種類存在差異,導致轉換比例也有所不同。因此,目前多數研究結合15N同位素方法對轉換值進行校準,從而得到實際的固氮量[30-31]。Anderson等[32]對乙炔還原法和15N同位素吸收法進行比較,認為只有通過15N同位素技術進行校準才能精確地估算森林的固氮量。
2 礦質養分輸入對森林生物固氮的影響
2.1 氮素輸入對森林生物固氮的影響
目前,關于氮素輸入影響森林固氮的研究主要集中在“富”氮的熱帶森林(表1)。多數施肥試驗表明,長期或短期施加氮肥均會降低固氮菌的競爭優勢(如降低固氮酶的活性),從而減少森林的固氮量。例如,Barron等[15]在巴拿馬熱帶成熟林的研究發現,長達7a的氮肥添加(125kg N hm-2a-1)使土壤固氮酶活性降低了75%。Crews等[33]在熱帶3個鐵心木成熟林中的研究也發現,施加氮肥(100kg N hm-2a-1)降低了凋落物固氮酶活性,并且在年齡最老的成熟林中的抑制作用達到極顯著水平。在波多黎各熱帶森林中,Cusack等[34]對森林不同組織層次的生物固氮進行研究,發現短期施加氮肥(50kg N hm-2a-1)同時降低了土壤、凋落物、附生植物葉片和苔蘚的固氮酶活性。在溫帶森林的研究也有類似的結論,如在瑞典一個火燒后355a的溫帶成熟林中,短期內施加不同水平的氮肥(0.56kg N hm-2周-1或 3.18kg N hm-2周-1)分別使苔蘚(Pleuroziumschreberi)固氮量降低為2.8μmol m-2d-1和3.0μmol m-2d-1,且作用均達到極顯著水平(P<0.001)[30]。但也有少數研究結果表示施加氮肥對生物固氮的影響不大[13,35]。
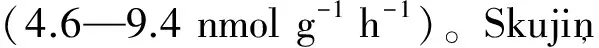
2.2 磷素輸入對森林生物固氮的影響
關于磷素對生物固氮起重要作用的認識主要來源于熱帶森林的研究。因為熱帶森林多數表現為磷素限制[44],因此研究磷素輸入對熱帶森林生物固氮的影響具有重要的意義。目前,許多研究認為磷素輸入促進了固氮細菌的生長,進而提高熱帶森林的固氮酶活性或固氮量(表1)。例如,Barron等[15]在巴拿馬熱帶成熟林的研究發現,7a的磷肥添加(50kg P hm-2a-1)使土壤固氮酶活性增加了約2倍(P<0.007)。在熱帶合歡成熟林中,Binkley等[45]利用乙炔還原法和15N同位素稀釋法均證實了施加磷肥(5g/盆 CaHPO4)顯著增加結瘤植物(Facaltariamoluccana)的固氮量。在哥斯達黎加熱帶成熟林,Reed等在2010年[46]和2013年[23]先后報道了不同磷肥試驗(長期施肥150kg P hm-2a-1和單次施肥844μg P g-1)的結果:施加磷肥的凋落物固氮酶活性分別是對照的3倍和2倍。Grove和Malajczuk[28]在澳大利亞一個紅桉樹林進行3年的磷肥試驗也發現,施加低濃度(30kg P hm-2a-1)和高濃度(200kg P hm-2a-1)磷肥使林下層豆科植物的根瘤固氮量分別增加了59%和99%。此外,在熱帶其他成熟林[33,35,47]和次生林[48]的研究中也都得出了類似的結論。除了熱帶地區,少數溫帶地區的研究同樣發現磷素輸入可以提高森林的固氮量。如在克拉馬斯溫帶森林,Yelenik等[31]發現2a施加磷肥(150kg P hm-2a-1)不同程度地提高了土壤和凋落物層的固氮量。在瑞典一個赤松和云杉混合成熟林(355a)中,短期施加磷肥(0.42kg P hm-2周-1)也會輕微提高苔蘚(Pleuroziumschreberi)的固氮量[30]。
盡管大多數研究結果均表明施加磷肥可以提高森林的生物固氮,但仍有少部分研究認為添加磷肥對生物固氮的影響不大。如在熱帶地區,Vitousek和Hobbie[13]通過對鐵心木成熟林進行長期(>10a)的磷肥添加試驗,發現來自對照樣方的凋落物置于施加磷肥的樣方中其固氮酶活性并沒有增加,這與Silvester[49]研究結論一致。在溫帶地區,也有相關報道認為施加磷肥不一定會提高結瘤植物[31]或者苔蘚[50]的固氮量。
2.3 其他礦質養分輸入對森林生物固氮的影響
除氮素和磷素以外,有研究表明其他礦質養分(尤其是微量營養元素)的輸入也會影響森林的生物固氮,并且多數表現為促進作用(表1)。礦質養分(除N和P外)輸入促進森林固氮的現象在熱帶地區和溫帶地區均可以發現。在熱帶地區,如Barron等[15]對巴拿馬一個成熟林進行營養元素(包括Mo, S, Cu, B, Fe, Mn, Zn, Ca, Mg等)添加處理,發現長期施肥(25kg hm-2a-1)的土壤固氮酶活性大約是對照的2倍(P<0.013)。Vitousek[47]在美國一個鐵心木(Metrosiderospolymorpha)成熟林的研究證明,施加混合營養元素(除N、P外的所有營養元素)同時提高了根瘤和凋落物的固氮酶活性。通過對3個不同土壤年齡的熱帶森林進行研究,Crews等[33]也發現施加營養元素均增加了3個森林的凋落物固氮酶活性,其中在土壤年齡最小(300a)和年齡最大(4100000a)的森林中促進作用均達到極顯著水平(P<0.001)。在溫帶森林的研究也有類似的結論,如Silvester[49]也發現添加微量營養元素可以促進凋落物固氮,其中施肥處理的固氮酶活性(15.2nmol C2H4g-1h-1)顯著高于對照(4.1nmol C2H4g-1h-1)。此外,也有少數研究得出添加微量營養元素對森林固氮影響不顯著的結論[13,23,50]。
在影響生物固氮的眾多微量營養元素中,鉬(Mo)成為關注的焦點。微量元素鉬和鐵共同參與合成固氮酶蛋白中的鉬固氮酶(也稱鉬鐵蛋白)[10,14]。而鉬固氮酶幾乎存在于所有的固氮細菌中,且參與生物固氮的過程[51]。在熱帶和溫帶森林的研究均表明,添加鉬元素促進了土壤或凋落物的固氮酶活性。在熱帶森林,如Barron等[15]發現鉬肥添加提高了土壤固氮酶活性,并且高濃度(504μg Mo/kg)比低濃度(42μg Mo/kg)的促進作用更加明顯;而長達7a的鉬添加試驗進一步證明,施加鉬肥(0.01kg hm-2a-1)的土壤固氮酶活性比對照增加了4倍。同樣在巴拿馬熱帶森林,Wurzburger等[14]對6個具有不同磷含量的森林進行研究,發現在磷飽和的森林中施加鉬肥(667mg Mo/kg)可以使土壤的固氮酶活性增加3倍。Vitousek[47]也認為,添加營養元素引起凋落物固氮酶活性的增加很可能與鉬元素有關。鉬元素輸入對溫帶森林固氮的影響研究甚少,目前僅有Silvester[49]進行過相關的報道,即鉬添加處理使黃杉成熟林的凋落物固氮酶活性增加2—3倍。
2.4 氮、磷及其他礦質養分的交互作用
總體上講,單獨施加氮肥會抑制森林生物固氮,施加磷肥則起到促進作用。氮肥和磷肥同時施加對森林固氮的影響僅在熱帶地區進行過報道,且氮素和磷素之間可能不存在交互作用。例如,在巴拿馬科羅拉多島的一個露天溫室中,Batterman等[52]進行了不同梯度氮肥(0, 30, 60g N m-2a-1)和磷肥(0, 20, 40g P m-2a-1)的析因設計試驗,結果發現單獨施加氮肥或者磷肥對印加(Ingapunctata)的根瘤固氮分別起到抑制(P<0.001)和促進作用(P<0.001),而氮肥和磷肥同時施加雖然也促進了印加的根瘤固氮,但其交互作用并不顯著。Binkley等[45]在夏威夷熱帶森林中的研究也發現,同時施加氮肥和磷肥(5g/盆 NH4NO3+ 5g/盆 CaHPO4)對豆科樹種(Facaltariamoluccana)的根瘤固氮沒有交互作用,但卻提高了根瘤固氮酶活性和單位植株的根瘤固氮量。此外,Reed等[35]在哥斯達黎加熱帶森林中的研究也得到類似的結論,即同時施加氮肥和磷肥(150kg N hm-2a-1+ 150kg P hm-2a-1)也會提高凋落物和土壤的固氮酶活性。這表明磷素對生物固氮的促進作用可能比氮素的抑制作用更加強烈。

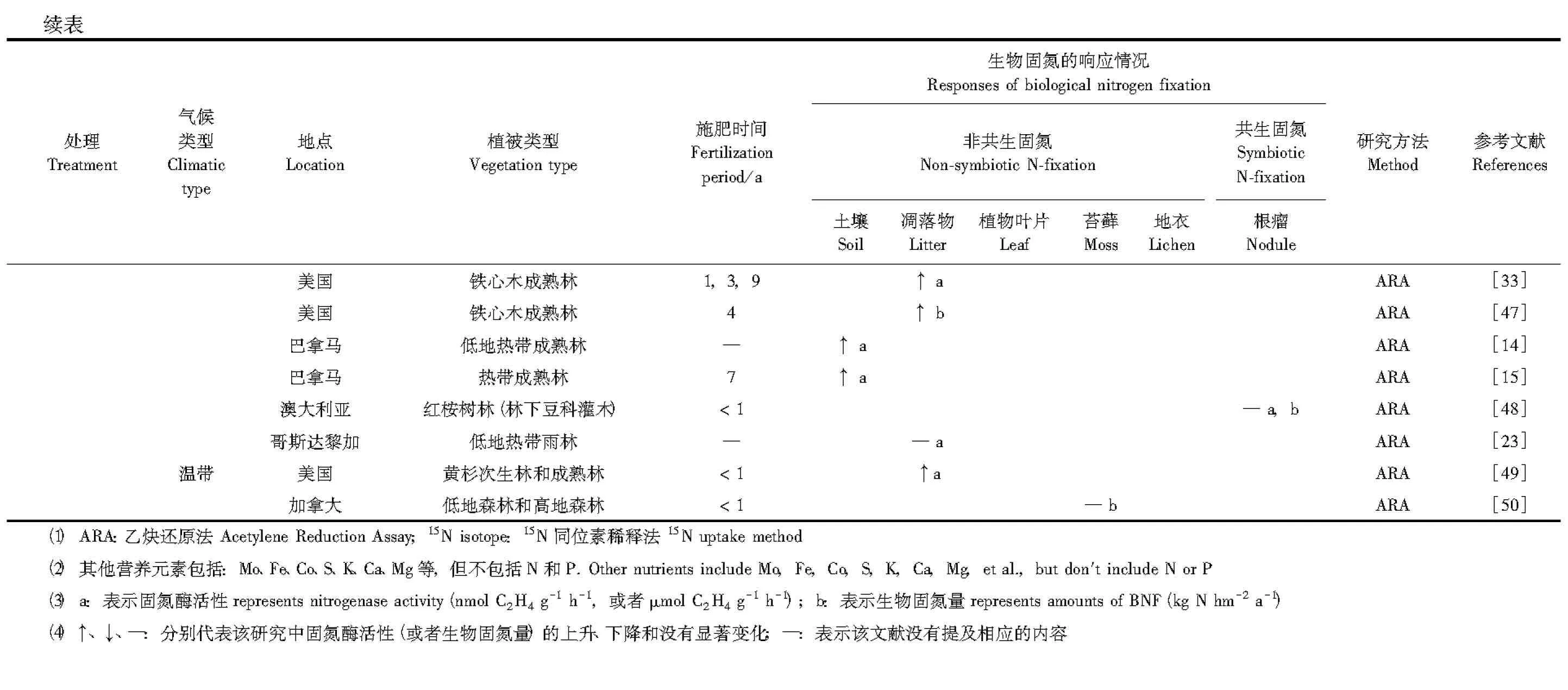
相比之下,磷和其他礦質養分同時添加對熱帶森林固氮的影響表現出交互作用。如,在美國熱帶森林中,Vitousek和Hobbie[13]通過凋落物分解試驗發現,來自對照樣方的凋落物置于單獨施加磷肥或T肥(T肥: 除N、P外的所有營養元素)的樣方中,其固氮酶活性沒有發生顯著變化;但置于同時施加磷肥和T肥的樣方后固氮酶活性顯著增加,并且磷和T的交互作用達到極顯著水平(P<0.001)。Silvester[49]通過室內實驗分析也發現,相比對照(1.0—1.6nmol C2H4g-1h-1),單獨施加磷肥對凋落物固氮酶活性沒有影響(1.1—1.2nmol C2H4g-1h-1),施加除氮以外的所有營養元素(包括磷等)卻可以顯著提高固氮酶活性(4.6—5.1nmol C2H4g-1h-1)。Wurzburger等[14]在巴拿馬兩個磷受限的熱帶森林(Zetek和Rio Paja)進行了鉬和磷的添加試驗,結果也表明同時添加鉬(667mg Mo/kg)和磷(283mg P/kg)會使土壤固氮酶活性增加1.5—4倍,并且鉬和磷的交互作用達到顯著水平。此外,Vitousek[47]和Reed等[23]通過研究也先后得到類似的結論,這說明熱帶森林生物固氮可能同時受到磷素和其他礦質養分的限制。而溫帶森林目前僅有Markham[50]進行過相關報道,即磷和微量營養元素同時添加對兩種苔蘚(Sphagnumcapillifolium和Pleuroziumschreberi)固氮的影響均不存在交互作用。
3 礦質養分輸入影響森林生物固氮的機理
綜合目前國內外的研究,礦質養分(主要為氮素和磷素)輸入影響森林生物固氮的機理可以分成生物作用機制和環境作用機制兩個部分。
3.1 生物作用機制
森林的不同組織層次均有固氮菌的分布,然而它們對礦質養分輸入的響應機制卻存在差異。因此,本文將從森林地表的土壤及凋落物層、結瘤植物和冠層附生植物3個不同層次闡述礦質養分輸入對森林固氮的影響機制。
3.1.1 改變地表層固氮菌的數量或群落豐度
自由固氮菌主要分布于森林的土壤和凋落物層,所以其數量或群落豐度很容易受到土壤氮、磷等養分的影響。
長期的氮素輸入可能通過減少固氮菌的數量或者群落豐度,進而降低森林的固氮量。目前普遍認為,固氮菌在氮素限制的森林中具備較強的競爭優勢,所以固氮酶活性比較高[33]。然而,長期的氮素輸入不斷提高了土壤的氮素含量和生物總量[54],并加劇微生物之間的競爭。此時繼續通過耗能方式進行固氮將不利于固氮菌的生存[10],因此固氮菌的數量逐漸減少。如在Harvard森林,Compton等[55]研究認為長期施加氮肥增加了松林土壤固氮基因(nifH)擴增的困難性。這意味著施加氮肥可能減少了土壤固氮菌的數量,進而抑制固氮基因的表達。Kolb和Martin[56]通過研究也發現,施加氮肥降低了土壤根際固氮菌與總細菌的比例,同時也顯著降低了固氮酶的活性。此外,長期的氮素輸入可能不利于對高氮環境耐受性較弱的固氮菌生存,從而降低了固氮菌的群落豐度。如,Piceno和Lovell[57]通過氮肥添加試驗研究土壤固氮基因的變化,結果發現長期施加氮肥使土壤中原本具有的優勢固氮基因消失,同時也降低了土壤的生物固氮量。在長期的增溫和施加氮肥控制試驗中,Berthrong等[58]發現施加氮肥降低了松林土壤固氮基因的豐度和多樣性。Freedman等[59]同樣發現氮沉降降低了北方闊葉林土壤固氮基因的豐度。這表明氮素的輸入通過減少固氮菌的群落豐度,進而抑制森林的生物固氮。
相反,磷素的輸入可能促進固氮菌的生長并增加其群落的豐度,群落豐度的增加可以提高森林的固氮總量。如在哥斯達黎加熱帶雨林,Reed等[46]發現長期施加磷肥(150kg P hm-2a-1)使凋落物產生新的固氮基因。這表明磷素的輸入導致新的固氮菌(如喜磷固氮菌等)出現。此外,Reed等[46]研究還證明了磷肥添加可以顯著地提高凋落物固氮基因的豐度和固氮量,且固氮基因的豐度與固氮量之間存在顯著的正相關關系(P=0.025,r2=0.35)。
3.1.2 改變結瘤植物的根瘤生物量
根瘤固氮是結瘤植物最主要的氮素來源[8],因此根瘤的生長很大程度上受到結瘤植物的調控。礦質養分的輸入可能會引起土壤養分的失衡,進而改變結瘤植物對氮素的需求,導致根瘤的生物量和固氮量發生變化。
長期的氮素輸入可能會減少結瘤植物對根瘤的生物量分配,從而降低根瘤的固氮量。對于結瘤植物而言,通過根瘤固氮方式獲取氮素需要消耗能量[10]。當大量氮素進入土壤時,固氮植物會減少對根瘤的生物量分配,部分轉向耗能較少的獲取方式,即土壤有效氮素的吸收[8,31]。雖然有研究表明,在土壤氮含量豐富的情況下,單位根瘤的固氮酶活性并沒有發生顯著變化,但是植物總的根瘤固氮量卻降低了[60]。這說明在共生固氮系統中,外來氮素的輸入可能是通過減少根瘤的生物量來降低植物的固氮總量。例如,Ekblad和Huss-Danell[61]通過溫室實驗分析,發現添加氮素使榿木(Alnusincana)的根瘤生物量和固氮量同時降低。Barron等[37]采用時間序列的方法也發現類似的結論,即成熟林(有效氮含量高)的印加樹根瘤生物量和固氮量均低于次生林,這表明土壤有效氮的增加會抑制根瘤的生長和固氮。
磷素的輸入可能增加了結瘤植物對氮素的需求,因此結瘤植物通過增加根瘤的生物量(如根瘤的數量、干重和密度等)來提高根瘤的固氮總量。例如,Yang[62]通過磷添加試驗發現,添加磷素(0.1—1.0μmol/L KH2PO4)促進了木麻黃(Casuarinacunninghamiana)及其根瘤的生長。通過溫室實驗的研究,Hingston等[48]發現不同濃度的磷添加(4mg P/kg土或10mg P/kg土)雖然都降低了兩種結瘤植物(Acaciapulchella和Kennediaprostrate)的根瘤固氮酶活性,但均提高了單位植株的根瘤數量、干重和固氮量。Grove和Malajczuk[28]的研究也表明,不同的施肥量(30kg P hm-2a-1或200kg P hm-2a-1)分別使豆科植物(Bossiaealaidlawiana)的根瘤固氮量提高了59%和99%,并認為固氮量的增加主要是因為施加磷肥顯著增加了根瘤的密度。因此,磷是限制結瘤植物生長及固氮的主要原因[60]。
3.1.3 改變附生植物的豐度或蓋度
冠層附生植物(苔蘚和地衣)的營養元素主要來源于大氣環境[63],或者間接通過寄主植物葉片和樹皮的淋溶析出獲得[64]。所以,短期的林下層施肥對附生植物沒有直接影響,但長期的礦質養分輸入可能通過改變寄主植物的營養狀況,進一步影響附生植物的生長和固氮。

相比之下,長期的磷素輸入反而促進了附生植物的生長并提高其豐度或者蓋度,進而增加森林的固氮量。如,在夏威夷熱帶雨林,Benner等[68]進行了長達14a的磷肥(100kg P hm-2a-1)添加試驗,發現施加磷肥顯著提高了固氮地衣(Pseudocyphellariacrocata)的豐度和固氮酶活性;通過進一步的研究發現,長期施加磷肥使地衣的固氮量增加了將近30倍,并認為這是由于地衣的豐度增加所導致的[53]。Gordon等[67]發現8a施加磷肥(5kg P hm-2a-1)使苔蘚(Dicranumscoparium和Polytrichumjuniperinum)的蓋度增加13%—16%,并且在植物功能群中的比例也增加了1倍。附生植物蓋度的增加很可能與寄主植物磷含量的提高有關。如,Benner[69]在夏威夷森林的研究中發現,固氮地衣蓋度較高的寄主喬木,其葉片和樹皮的磷含量也相對較高(P<0.001)。這暗示了磷的輸入可能通過提高寄主植物磷的含量,進而增加附生植物的蓋度。附生植物蓋度的增加也會提高森林的固氮總量。
3.2 環境作用機制
3.2.1 引起土壤酸化

長期的氮素輸入除了降低土壤pH,還會導致土壤中的大量交換性陽離子(K+, Ca2+, Mg2+等)流失,同時增加了土壤可交換性Al3+的濃度[76]。大量Al3+累積引起的鋁毒效應也會進一步抑制豆科植物的生長和根瘤固氮的進行[77]。例如,Wood等[78]研究發現,當pH<5.0時,根瘤菌的生長和根瘤的形成都會受到抑制,而在酸性條件下同時進行添加鋁處理則使兩者在pH<6.0就開始受到抑制。Igual等[79]也發現添加鋁處理(>440μmol/L Al)會降低木麻黃(Casuarinacunninghamiana)的根瘤干重,并且在高鋁處理下(880μmol/L Al)的固氮效率降低為原來的一半。
此外,氮素輸入引起土壤酸性的增加還可能影響土壤Mo的含量。一般在酸性條件下土壤Mo含量很低[15,49],而微量元素Mo限制生物固氮的結論在許多研究中[14-15,49]也已經得到證明。
3.2.2 改變碳源物質的含量
多數固氮微生物在生長和固氮過程均需要從環境中獲取有效的碳源,因此碳源物質的含量也是影響森林地表層(土壤和凋落物)生物固氮的重要因素。在森林生態系統中,礦質養分(如氮素)的輸入主要通過影響凋落物的分解,進而改變有效碳源物質的含量[80]。
長期的氮素輸入減少了凋落物中纖維素和半纖維素的含量,同時導致木質素累積,進而減少了可被固氮微生物有效利用的碳源。目前已有多數研究證明,當外源氮素進入土壤時,微生物會提高纖維素水解酶(如β-1,4-葡萄糖苷酶和纖維素二糖水解酶等)的活性,并降低木質素氧化酶(如多酚氧化酶和過氧化物酶等)的活性,導致纖維素、半纖維素等可被利用的碳源物質越來越少[81-82]。有效碳源的減少不僅影響了固氮微生物的生理代謝,還會阻礙其生物固氮的過程。
雖然沒有證據表明碳源物質的減少會直接抑制森林地表層的生物固氮,但目前已有許多研究認為土壤或凋落物的固氮酶活性與有機碳含量之間存在正相關性。例如,在哥斯達黎加熱帶森林中,Reed等[35]發現土壤和凋落物固氮量在夏季最高,認為這可能是夏季濕度較高的情況下,凋落物層的可溶性有機碳增加,從而提供給固氮菌豐富的有效碳源。Wurzburger等[14]通過研究土壤剖面不同深度的固氮酶活性,發現有機質含量豐富并且含氮量較低(也即有最高的C/N)的土壤表層固氮酶活性最高。在夏威夷熱帶森林,Vitousek[42]的研究也發現凋落物的自由固氮酶活性與其獲取的能量(碳源)有關。Pérez等[83]在溫帶成熟林中的研究也表明,若凋落物含有較高的C/N,相應的固氮酶活性也比較高。
4 問題與展望
4.1 空間尺度的局限性
從現有的研究來看,多數森林固氮的研究對象只是局限于某些固氮能力較強的植物,而這種局部性的研究并不能代表整個森林或者區域的固氮情況[3]。其次,在森林的不同組織層次均有固氮植物或者固氮微生物分布,但多數研究的對象只是局限于森林中某個類群,比如苔蘚、地衣、豆科固氮植物,或者局限于某個組織層次,如土壤層、凋落物層,而缺乏對整個森林的系統估算。目前,國外如Cusack等[34]對森林生物固氮進行過比較系統的報道,而國內還未在該領域進行系統的研究。從全球尺度上講,目前有關陸地生態系統生物固氮的報道主要集中在歐洲和北美等少數地區,在豆科植物廣泛分布的亞洲、非洲和南美洲等地區的研究卻相當缺乏[5]。中國固氮植物資源豐富,因此加強和開展國內森林共生固氮和自由固氮的研究將有助于我們認識全球變化(如氮沉降等)對我國森林氮循環的影響。
4.2 時間尺度的局限性
森林生物固氮會呈現一定的日變化或者季節變化,因此某個時間點的采樣結果并無法代表森林的實際固氮量[29]。其次,短時間尺度的研究也可能會誤導我們對森林固氮的認識。比如短期添加營養元素對某些附生植物的影響可能不明顯,但長期施肥通過間接方式改變了附生植物的固氮速率[68,84]。所以,目前多數短期施肥的控制性試驗的研究(特別是溫室實驗)無法完全反映森林的真實固氮。在美國、瑞典、智利等部分區域采用空間代替時間的方法研究大時間尺度下的森林固氮差異,然而這樣的研究方法在其他地區(如亞洲地區)的應用卻非常少。我國具備從熱帶至寒帶不同氣候條件的森林生態系統,隨著中國生態系統研究網絡(CERN)的建立和逐步完善,該網絡體系將有助于我們實現不同區域或年齡段森林生物固氮的合作研究,更好地理解森林生物固氮的機理。
4.3 研究方法的局限性
關于固氮酶活性的測定方法有很多種,但是不同的方法各有其優缺點。例如,15N同位素稀釋法雖然可以比較精確地測定固氮酶活性,但該方法主要運用在固氮植物的研究,對土壤或者凋落物等自由固氮并不適用。乙炔還原法雖然操作簡單,但其測定值只能反映固氮酶在理想條件下的最高活性,因此可能會高估森林實際的固氮量[85]。其次,在森林固氮量的換算中,部分研究直接采用理想比例(3∶1)進行計算無法反映實際的固氮情況。此外,方法上的不統一,如不同的培養時間、培養條件(溫室或野外)、轉換比例(理想比例或實際比例)等,也會使不同森林固氮量之間缺乏可比性。因此,加強我國生物固氮相關測定方法的研究并與國際上的新方法接軌,可以更為精確地估算不同森林類型的生物固氮量。
4.4 研究的深度不足
國內外對森林固氮的研究仍然停留在固氮酶活性的分析。引起固氮酶活性變化的更深層次機理還不清楚,尤其在固氮菌群落結構和功能方面的研究甚少。目前,國際上已有部分研究利用分子生物學的方法,證明了養分添加影響森林固氮菌群落的豐度[55,58-59],但在國內仍未見到相關的報道。其次,養分的輸入究竟是影響了森林中哪些類群的固氮菌生長,以及哪些固氮菌對森林固氮量的貢獻最大等都還沒有得到有效的鑒定。隨著我國分子生物學的發展,基于PCR技術的RFLP、t-RFLP、DGGE和基因探針雜交等方法將有助于我們對固氮菌的群落結構進行深入分析。因此,利用分子技術研究森林生物固氮將是研究的重點。
[1] Gruber N, Galloway J N.An Earth-system perspective of the global nitrogen cycle.Nature, 2008, 451(7176): 293-296.
[2] Galloway J N, Schlesinger W H, Levy H, Michaels A, Schnoor J L.Nitrogen fixation: Anthropogenic enhancement-environmental response.Global Biogeochemical Cycles, 1995, 9(2): 235-252.
[3] Galloway J N, Dentener F J, Capone D G, Boyer E W, Howarth R W, Seitzinger S P, Asner G P, Cleveland C C, Green P A, Holland E A, Karl D M, Michaels A F, Porter J H, Townsend A R, V?osmarty C J.Nitrogen cycles: past, present, and future.Biogeochemistry, 2004, 70(2): 153-226.
[4] Food and Agricultural Organization of the United Nations.Global Forest Resources Assessment 2010: Main Report.Rome: Food and Agricultural Organization of the United Nations, 2010.
[5] Cleveland C C, Townsend A R, Schimel D S, Fisher H, Howarth R W, Hedin L O, Perakis S S, Latty E F, Von Fischer J C, Elseroad A, Wasson M F.Global patterns of terrestrial biological nitrogen (N2) fixation in natural ecosystems.Global Biogeochemical Cycles, 1999, 13(2): 623-645.
[6] Galloway J N, Townsend A R, Erisman J W, Bekunda M, Cai Z C, Freney J R, Martinelli L A, Seitzinger S P, Sutton M A.Transformation of the nitrogen cycle: recent trends, questions, and potential solutions.Science, 2008, 320(5878): 889-892.
[7] Forsum ?, Dahlman L, N?sholm T, Nordin A.Nitrogen utilization by Hylocomium splendens in a boreal forest fertilization experiment.Functional Ecology, 2006, 20(3): 421-426.
[8] Markham J H, Zekveld C.Nitrogen fixation makes biomass allocation to roots independent of soil nitrogen supply.Canadian Journal of Botany, 2007, 85(9): 787-793.
[9] Vance C P, Graham P H, Allan D L.Biological nitrogen fixation: phosphorus-a critical future need // Pedrosa F O, Hungria M, Yates G, Newton W E.Nitrogen Fixation: From Molecules to Crop Productivity.Netherlands: Springer, 2002: 509-514.
[10] Alberty R A.Thermodynamics of the mechanism of the nitrogenase reaction.Biophysical Chemistry, 2005, 114(2-3): 115-120.
[11] Hedin L O, Vitousek P M, Matson P A.Nutrient losses over four million years of tropical forest development.Ecology, 2003, 84(9): 2231-2255.
[12] Braun S, Thomas V F D, Quiring R, Flückiger W.Does nitrogen deposition increase forest production? The role of phosphorus.Environmental Pollution, 2010, 158(6): 2043-2052.
[13] Vitousek P M, Hobbie S.Heterotrophic nitrogen fixation in decomposing litter: patterns and regulation.Ecology, 2000, 81(9): 2366-2376.
[14] Wurzburger N, Bellenger J P, Kraepiel A M, Hedin L O.Molybdenum and phosphorus interact to constrain asymbiotic nitrogen fixation in tropical forests.PloS ONE, 2012, 7(3): e33710.
[15] Barron A R, Wurzburger N, Bellenger J P, Wright S J, Kraepiel A M L, Hedin L O.Molybdenum limitation of asymbiotic nitrogen fixation in tropical forest soils.Nature Geoscience, 2009, 2(1): 42-45.
[16] Liu X J, Zhang Y, Han W X, Tang A H, Shen J L, Cui Z L, Vitousek P, Erisman J W, Goulding K, Christie P, Fangmeier A, Zhang F S.Enhanced nitrogen deposition over China.Nature, 2013, 494(7438): 459-462.
[17] 丁明懋, 蚊偉民, 廖蘭玉.大葉相思(Acaciaauriculaeformis)和馬占相思(Acaciamangium)固氮量的研究.生態學報, 1991, 11(3): 289-290.
[18] 姚允寅, 陳明, 馬昌磷, 王志東, 侯景琴, 張麗紅, 駱永云.利用15N天然豐度法評估森林生態系統植物的固氮能力.中國核科技報告, 1990: 814-822.
[19] Han B, Zou X, Kong J, Sha L, Gong H, Yu Z, Cao T.Nitrogen fixation of epiphytic plants enwrapping trees in Ailao Mountain cloud forests, Yunnan, China.Protoplasma, 2010, 247(1-2): 103-110.
[20] 丁明懋, 蟻偉民, 廖蘭玉, 傅聲雷, 余作岳.生態條件對馬占相思結瘤固氮的影響.熱帶亞熱帶植物學報, 1994, 2(2): 15-21.
[21] 鄧廷秀, 劉國凡.榿木人工林結瘤固氮的時空變化及其對后續植物的效應(Ⅱ).山地學報, 1996, 14(S1): 30-35.
[22] Son Y.Non-symbiotic nitrogen fixation in forest ecosystems.Ecological Research, 2001, 16(2): 183-196.
[23] Reed S C, Cleveland C C, Townsend A R.Relationships among phosphorus, molybdenum and free-living nitrogen fixation in tropical rain forests: results from observational and experimental analyses.Biogeochemistry, 2013, 114(1-3): 135-147.
[24] Reed S C, Cleveland C C, Townsend A R.Functional ecology of free-living nitrogen fixation: a contemporary perspective.Annual Review of Ecology Evolution and Systematics, 2011, 42: 489-512.
[25] Herridge D F, Peoples M B, Boddey R M.Global inputs of biological nitrogen fixation in agricultural systems.Plant and Soil, 2008, 311(1-2): 1-18.
[26] Boddey R M, Peoples M B, Palmer B, Dart P J.Use of the15N natural abundance technique to quantify biological nitrogen fixation by woody perennials.Nutrient Cycling in Agroecosystems, 2000, 57(3): 235-270.
[27] Hardy R W F, Holsten R D, Jackson E K, Burns R C.The acetylene-ethylene assay for N2fixation: laboratory and field evaluation.Plant Physiology, 1968, 43(8): 1185-1207.
[28] Grove T S, Malajczuk N.Nodule production and nitrogen fixation (acetylene reduction) by an understorey legume (Bossiaealaidlawiana) in Eucalyptus forest.Journal of Ecology, 1992, 80(2): 303-314.
[29] Reed S C, Cleveland C C, Townsend A R.Tree species control rates of free-living nitrogen fixation in a tropical rain forest.Ecology, 2008, 89(10): 2924-2934.
[30] Zackrisson O, DeLuca T H, Nilsson M C, Sellstedt A, Berglund L M.Nitrogen fixation increases with successional age in boreal forests.Ecology, 2004, 85(12): 3327-3334.
[31] Yelenik S, Perakis S, Hibbs D.Regional constraints to biological nitrogen fixation in post-fire forest communities.Ecology, 2013, 94(3): 739-750.
[32] Anderson M D, Ruess R W, Uliassi D, Mitchell J S.Estimating N2fixation in two species ofAlnusin interior Alaska using acetylene reduction and15N2uptake.Ecoscience, 2004, 11(1): 102-112.
[33] Crews T E, Farrington H, Vitousek P M.Changes in asymbiotic, heterotrophic nitrogen fixation on leaf litter ofMetrosiderospolymorphawith long-term ecosystem development in Hawaii.Ecosystems, 2000, 3(4): 386-395.
[34] Cusack D F, Silver W, McDowell W H.Biological Nitrogen Fixation in Two Tropical Forests: Ecosystem-Level Patterns and Effects of Nitrogen Fertilization.Ecosystems, 2009, 12(8): 1299-1315.
[35] Reed S C, Cleveland C C, Townsend A R.Controls over leaf litter and soil nitrogen fixation in two lowland tropical rain forests.Biotropica, 2007, 39(5): 585-592.
[36] Skujin,? J, Tann C C, B?rjesson I.Dinitrogen fixation in a montane forest sere determined by15N2assimilation andinsituacetylene-reduction methods.Soil Biology and Biochemistry, 1987, 19(4): 465-471.
[37] Barron A R, Purves D W, Hedin L O.Facultative nitrogen fixation by canopy legumes in a lowland tropical forest.Oecologia, 2011, 165(2): 511-520.
[38] DeLuca T H, Zackrisson O, Gentili F, Sellstedt A, Nilsson M-C.Ecosystem controls on nitrogen fixation in boreal feather moss communities.Oecologia, 2007, 152(1): 121-130.
[39] Hope S M, Li C Y.Respiration, nitrogen fixation, and mineralizable nitrogen spatial and temporal patterns within two Oregon Douglas-fir stands.Canadian Journal of Forest Research, 1997, 27(4): 501-509.
[40] Dawson J O.Dinitrogen fixation in forest ecosystems.Canadian Journal of Microbiology, 1983, 29(8): 979-992.
[41] Matzek V, Vitousek P.Nitrogen fixation in bryophytes, lichens, and decaying wood along a soil-age gradient in Hawaiian montane rain forest.Biotropica, 2003, 35(1): 12-19.
[42] Vitousek P M.Potential nitrogen fixation during primary succession in Hawaii Volcanoes National Park.Biotropica, 1994, 26(3): 234-240.
[43] Lagerstr?m A, Nilsson M C, Zackrisson O, Wardle D A.Ecosystem input of nitrogen through biological fixation in feather mosses during ecosystem retrogression.Functional Ecology, 2007, 21(6): 1027-1033.
[44] Vitousek P M, Porder S, Houlton B Z, Chadwick O A.Terrestrial phosphorus limitation: mechanisms, implications, and nitrogen-phosphorus interactions.Ecological Applications, 2010, 20(1): 5-15.
[45] Binkley D, Senock R, Cromack K.Phosphorus limitation on nitrogen fixation byFacaltariaseedlings.Forest Ecology and Management, 2003, 186(1-3): 171-176.
[46] Reed S C, Townsend A R, Cleveland C C, Nemergut D R.Microbial community shifts influence patterns in tropical forest nitrogen fixation.Oecologia, 2010, 164(2): 521-531.
[47] Vitousek P M.Nutrient limitation to nitrogen fixation in young volcanic sites.Ecosystems, 1999, 2(6): 505-510.
[48] Hingston F, Malajczuk N, Grove T.Acetylene reduction (N2-fixation) by jarrah forest legumes following fire and phosphate application.Journal of Applied Ecology, 1982, 19(2): 631-645.
[49] Silvester W B.Molybdenum limitation of asymbiotic nitrogen fixation in forests of Pacific Northwest America.Soil Biology and Biochemistry, 1989, 21(2): 283-289.
[50] Markham J H.Variation in moss-associated nitrogen fixation in boreal forest stands.Oecologia, 2009, 161(2): 353-359.
[51] Rubio L M, Ludden P W.Biosynthesis of the iron-molybdenum cofactor of nitrogenase.Annual Review of Microbiology, 2008, 62: 93-111.
[52] Batterman S A, Wurzburger N, Hedin L O.Nitrogen and phosphorus interact to control tropical symbiotic N2fixation: a test in Inga punctata.Journal of Ecology, 2013, 101(6): 1400-1408.
[53] Benner J W, Vitousek P M.Cyanolichens: a link between the phosphorus and nitrogen cycles in a Hawaiian montane forest.Journal of Tropical Ecology, 2012, 28(1): 73-81.
[54] Cusack D F, Silver W L, Torn M S, Burton S D, Firestone M K.Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests.Ecology, 2011, 92(3): 621-632.
[55] Compton J E, Watrud L S, Porteous L A, DeGrood S.Response of soil microbial biomass and community composition to chronic nitrogen additions at Harvard forest.Forest Ecology and Management, 2004, 196(1): 143-158.
[56] Kolb W, Martin P.Influence of nitrogen on the number of N2-fixing and total bacteria in the rhizosphere.Soil Biology and Biochemistry, 1988, 20(2): 221-225.
[57] Piceno Y M, Lovell C R.Stability in natural bacterial communities: I.Nutrient addition effects on rhizosphere diazotroph assemblage composition.Microbial Ecology, 2000, 39(1): 32-40.
[58] Berthrong S T, Yeager C M, Gallegos-Graves L, Steven B, Eichorst S A, Jackson R B, Kuske C R.Nitrogen fertilization has a stronger effect on soil nitrogen-fixing bacterial communities than elevated atmospheric CO2.Applied and Environmental Microbiology, 2014, 80(10): 3103-3112.
[59] Freedman Z, Eisenlord S D, Zak D R, Xue K, He Z, Zhou J Z.Towards a molecular understanding of N cycling in northern hardwood forests under future rates of N deposition.Soil Biology and Biochemistry, 2013, 66: 130-138.
[60] Pearson H L, Vitousek P M.Stand dynamics, nitrogen accumulation, and symbiotic nitrogen fixation in regenerating stands ofAcaciakoa.Ecological Applications, 2001, 11(5): 1381-1394.
[61] Ekblad A, Huss-Danell K.Nitrogen fixation by Alnus incana and nitrogen transfer fromA.incanatoPinussylvestrisinfluenced by macronutrients and ectomycorrhiza.New Phytologist, 1995, 131(4): 453-459.
[62] Yang Y.The effect of phosphorus on nodule formation and function in theCasuarina-Frankiasymbiosis.Plant and Soil, 1995, 176(1): 161-169.
[63] Clark K L, Nadkarni N M, Gholz H L.Retention of Inorganic Nitrogen by Epiphytic Bryophytes in a Tropical Montane Forest.Biotropica, 2005, 37(3): 328-336.
[64] Goward T, Arsenault A.Cyanolichen distribution in young unmanaged forests: a dripzone effect? The Bryologist, 2000, 103(1): 28-37.
[65] Van Der Heijden E, Verbeek S K, Kuiper P J C.Elevated atmospheric CO2and increased nitrogen deposition: effects on C and N metabolism and growth of the peat mossSphagnumrecurvumP.Beauv.var.mucronatum(Russ.) Warnst.Global Change Biology, 2000, 6(2): 201-212.
[66] R?nnqvist M.Long-term effects of nitrogen deposition on epiphytic lichens.Ume?: Ume? Universitet, 2013.
[67] Gordon C, Wynn J M, Woodin S J.Impacts of increased nitrogen supply on high Arctic heath: the importance of bryophytes and phosphorus availability.New Phytologist, 2001, 149(3): 461-471.
[68] Benner J W, Conroy S, Lunch C K, Toyoda N, Vitousek P M.Phosphorus fertilization increases the abundance and nitrogenase activity of the cyanolichenPseudocyphellariacrocatain Hawaiian montane forests.Biotropica, 2007, 39(3): 400-405.
[69] Benner J W.Epiphytes preferentially colonize high-phosphorus host trees in unfertilized Hawaiian montane forests.The Bryologist, 2011, 114(2): 335-345.
[70] Soltani N, Khavari-Nejad R A, Yazdi M T, Shokravi S, Fernández-Valiente E.Variation of nitrogenase activity, photosynthesis and pigmentation of the cyanobacteriumFischerellaambiguastrain FS18under different irradiance and pH values.World Journal of Microbiology and Biotechnology, 2006, 22(6): 571-576.
[71] Gauslaa Y.The Lobarion, an epiphytic community of ancient forests threatened by acid rain.The Lichenologist, 1995, 27(1): 59-76.
[72] Tsygankov A S, Serebryakova L T, Sveshnikov D A, Rao K K, Gogotov I, Hall D O.Hydrogen photoproduction by three different nitrogenases in whole cells of Anabaena variabilis and the dependence on pH.International Journal of Hydrogen Energy, 1997, 22(9): 859-867.
[73] Jeng D Y, Morris J A, Mortenson L E.The effect of reductant in inorganic phosphate release from adenosine 5′-triphosphate by purified nitrogenase ofClostridiumpasteurianum.Journal of Biological Chemistry, 1970, 245(11): 2809-2813.
[74] Yamanaka T, Hirai K, Aizawa S, Yoshinaga S, Takahashi M.Nitrogen-fixing activity in decomposing litter of three tree species at a watershed in eastern Japan.Journal of Forest Research, 2011, 16(1): 1-7.
[75] Zahran H H.Rhizobium-legume symbiosis and nitrogen fixation under severe conditions and in an arid climate.Microbiology and Molecular Biology Reviews, 1999, 63(4): 968-989.
[76] Lu X K, Mo J M, Gundersern P, Zhu W X, Zhou G Y, Li D J, Zhang X.Effect of simulated N deposition on soil exchangeable cations in three forest types of subtropical China.Pedosphere, 2009, 19(2): 189-198.
[77] Ledgard S F, Steele K W.Biological nitrogen fixation in mixed legume/grass pastures.Plant and Soil, 1992, 141(1-2): 137-153.
[78] Wood M, Cooper J E, Holding A J.Aluminium toxicity and nodulation ofTrifoliumrepens.Plant and Soil, 1984, 78(3): 381-391.
[79] Igual J M, Rodriguez-Barrueco C, Cervantes E.The effects of aluminium on nodulation and symbiotic nitrogen fixation inCasuarinacunninghamianaMiq.Plant and soil, 1997, 190(1): 41-46.
[80] Mo J M, Brown S, Xue J H, Fang Y T, Li Z A.Response of litter decomposition to simulated N deposition in disturbed, rehabilitated and mature forests in subtropical China.Plant and Soil, 2006, 282(1-2): 135-151.
[81] Carreiro M M, Sinsabaugh R L, Repert D A, Parkhurst D F.Microbial enzyme shifts explain litter decay responses to simulated nitrogen deposition.Ecology, 2000, 81(9): 2359-2365.
[82] Waldrop M P, Zak D R, Sinsabaugh R L, Gallo M, Lauber C.Nitrogen deposition modifies soil carbon storage through changes in microbial enzymatic activity.Ecological Applications, 2004, 14(4): 1172-1177.
[83] Pérez C A, Carmona M R, Armesto J J.Non-symbiotic nitrogen fixation during leaf litter decomposition in an old-growth temperate rain forest of Chiloé Island, southern Chile: Effects of single versus mixed species litter.Austral Ecology, 2010, 35(2): 148-156.
[84] Benner J W, Vitousek P M.Development of a diverse epiphyte community in response to phosphorus fertilization.Ecology Letters, 2007, 10(7): 628-636.
[85] Welsh D T.Nitrogen fixation in seagrass meadows: regulation, plant-bacteria interactions and significance to primary productivity.Ecology Letters, 2000, 3(1): 58-71.
Effects of the addition of mineral nutrients on biological nitrogen fixation in forest ecosystems
ZHENG Mianhai1,2, CHEN Hao1,2, ZHU Xiaomin1,2, MAO Qinggong1,2, MO Jiangming1,*
1KeyLaboratoryofVegetationRestorationandManagementofDegradedEcosystems,SouthChinaBotanicalGarden,ChineseAcademyofSciences,Guangzhou510650,China2UniversityofChineseAcademyofSciences,Beijing100039,China
Biological nitrogen fixation (BNF) in forest ecosystems plays a very important role in global nitrogen (N) cycling, because forest ecosystems cover 30% of the global land area and represent nearly half of the N fixation that occurs in terrestrial ecosystems.Additionally, these ecosystems harbor abundant N-fixation microbes, including both symbiotic and free-living N-fixation bacteria.It is generally believed that environmental conditions (e.g.temperature, moisture, and light intensity) and nutrient availability are the most important factors regulating BNF in ecosystems.Among these factors, the effects of nutrient availability have recently received increasing attention.In the last several decades, anthropogenic activities have greatly modified the global biogeochemical cycles of N and other mineral nutrients.For example, the quantity of global N deposition increased from 41Tg N /a in 1950to 103Tg N /a in 2000.Long-term N deposition may exert direct effects on forest BNF by reducing the competitive advantage of free-living N-fixation bacteria or by reducing the energy allocated to symbiotic N-fixation bacteria.N deposition may also lead to imbalances in mineral nutrient proportions that play vital roles in the growth of N-fixation bacteria.Phosphorus (P), for example, is thought to be a major component of microbial cell membranes and also to be directly related to the formation of adenosine triphosphate (ATP), which is very important for nitrogenase function.In addition, many rock-derived nutrients (e.g.Ca, K, Mo, and Fe) are depleted and their availability becomes poor during forest succession.Deficiency of these mineral nutrients may consequently influence forest BNF by limiting the growth of N-fixation bacteria.In recent decades, mineral nutrient addition experiments (in the lab orinsitu) have been widely used in Europe and North America to investigate how nutrient availability influences forest BNF.However, little information on how forest BNF responds to nutrient addition is available from China, although N deposition is projected to increase with the rapid growth of the Chinese economy in the future.In this paper, we review the impacts and underlying mechanisms of mineral nutrient addition on forest BNF, based on the available literature.The objectives were to enhance our understanding of how mineral nutrient addition regulates forest BNF and to provide scientific data for sustainable forest management.This review focuses on the following four aspects: (1) The concept of forest BNF and the principal measuring methods;(2) The effects of mineral nutrient addition on forest BNF, including the N fixation by free-living organisms occurring in the upper soil, the lichens and mosses growing on the litter layer, and symbiotic N fixation via relationships with root nodule plants (e.g., legumes).In general, N addition decreases forest BNF, whereas addition of P or other nutrients has a positive impact.In addition, the combined addition of N and P, or P and other mineral nutrients, increases forest BNF;(3) The mechanisms underlying forest BNF can be divided into biotic (e.g., variance in the abundance or richness of N-fixing bacteria, the cover or richness of epiphytes, and the biomass of root nodule plants) and abiotic mechanisms (e.g., soil acidification and changes in the available carbon content);(4) The limitations of the current research and our suggestions for further research on forest BNF.
mineral nutrient addition;biological nitrogen fixation;nitrogen deposition;forest;nitrogenase activity
國家自然科學基金(41273143);國家重點基礎研究發展計劃973項目(2011CB403204)
2014-04-24; < class="emphasis_bold">網絡出版日期:
日期:2015-05-20
10.5846/stxb201404240810
*通訊作者Corresponding author.E-mail: mojm@scib.ac.cn
鄭棉海,陳浩,朱曉敏,毛慶功,莫江明.礦質養分輸入對森林生物固氮的影響.生態學報,2015,35(24):7941-7954.
Zheng M H, Chen H, Zhu X M, Mao Q G, Mo J M.Effects of the addition of mineral nutrients on biological nitrogen fixation in forest ecosystems.Acta Ecologica Sinica,2015,35(24):7941-7954.

