IL-17在系統性硬皮病患者中的表達及與結締組織生長因子的相關性
劉孟莊,王 娟,阿克木江·阿西木
(1. 新疆維吾爾自治區人民醫院,新疆 烏魯木齊 830001;2解放軍第23醫院,新疆 烏魯木齊 830000)
IL-17在系統性硬皮病患者中的表達及與結締組織生長因子的相關性
劉孟莊1,王 娟1,阿克木江·阿西木2
(1. 新疆維吾爾自治區人民醫院,新疆 烏魯木齊 830001;2解放軍第23醫院,新疆 烏魯木齊 830000)
目的 探討白細胞介素-17(IL-17)在系統性硬皮病(SSc)患者中的表達水平,及其與結締組織生長因子(CTGF)的相關性。方法 選擇68例SSc患者和同期整形外科收治的30例非SSc患者,采用酶聯免疫吸附試驗(ELISA)法檢測血漿IL-17水平,采用免疫組化SABC法檢測皮膚CTGF含量。比較各組IL-17和CTGF表達水平的差異,及二者的相關性。結果 與對照組比較,SSc患者IL-17、CTGF蛋白表達水平較對照組顯著升高,且活動組IL-17、CTGF蛋白表達水平顯著高于非活動組(P<0.05);彌漫型SSc組IL-17、CTGF蛋白表達水平較局限型SSc組明顯增高(P<0.05);SSc患者IL-17、CTGF蛋白與改良Rodman總皮膚厚度評分(MRSS)均呈線性正相關(r=0.712,0.738,P<0.05);血漿IL-17與皮損組織CTGF蛋白亦呈線性正相關(r=0.680,P<0.05)。結論 IL-17在SSc患者外周血中表達增高,與CTGF具有較好相關性,共同參與了SSc的發病過程,阻斷Th17細胞活化、分泌IL-17,有望為SSc的治療提供新的靶點。
系統性硬皮病;白細胞介素-17;結締組織生長因子
系統性硬皮病(SSc)又稱硬化癥,是一種自身免疫性彌漫性結締組織疾病,發病高峰年齡是30~50歲,以手、足皮膚發硬為突出表現,嚴重者可出現全身皮膚僵硬和內臟器官纖維化[1]。研究認為,免疫性疾病患者組織和外周血中的Th17/Treg細胞體系處于失衡狀態,而由Th17分泌的白細胞介素-17(IL-17)對固有免疫及獲得性免疫炎癥均有促進作用[2]。目前,結締組織生長因子(CTGF)對SSc的作用已得到證實[3],但其與IL-17的相關性,是否共同作用于SSc的發病,國內尚未見報道。本研究通過聯合檢測SSc患者IL-17和CTGF的表達水平,并分析其相關性,旨在為SSc的發病機制研究提供新的思路。
1 臨床資料
1.1一般資料 選擇2009年1月—2013年12月新疆維吾爾自治區人民醫院皮膚科收治的SSc患者共68例,均符合1980年美國風濕協會制訂的SSc分類標準[4],并經組織病理檢查確診。其中男25例,女43例;年齡34~67(46.1±5.7)歲;病程3~105(39.4±8.6)個月;按照Valentini評分標準:活動組(≥3分)29例,非活動組(<3分)39例;改良Rodnan總皮膚厚度評分(MRSS)為4.4~7.3(6.1±0.7)分;彌漫型SSc 37例,局限型SSc 31例。同時選擇我院整形外科收治的非SSc患者30例,其中男13例,女17例;年齡33~69(45.8±6.1)歲。本研究經我院倫理學委員會審核通過,所有研究對象均簽署知情同意書。2組性別、年齡比較差異無統計學意義(P>0.05),具有可比性。
1.2 標本采集及檢測
1.2.1 IL-17 所有研究對象均于清晨抽取空腹靜脈血2 mL,置于EDTA抗凝管中,充分混勻,3 000 r/min離心10 min,留取上層血漿。采用酶聯免疫吸附試驗(ELISA)法檢測血漿IL-17水平,試劑盒購自深圳晶美生物工程有限公司,所有操作嚴格按照試劑盒說明書進行。
1.2.2 CTGF 破損標本取自前臂伸側或脛前部皮損患處,未經任何藥物治療。對照標本取自整形外科手術切除的正常皮膚組織。將標本組織通過10%甲醛固定、石蠟包埋,4 μm厚連續切片后進行免疫組化SABC法染色。每例標本組織均取相連的3張切片,常規脫蠟、水化、0.01 mol/L枸櫞酸鹽緩沖液(pH 6.0)作抗原熱修復。兔抗人CTGF免疫組化單克隆抗體購自美國Santa Cruz生物技術公司,S-P免疫組化試劑盒均購自福州邁新生物技術開發公司,均采用試劑盒已知陽性組織作為陽性對照,以PBS代替一抗體作為陰性對照。
1.3 CTGF蛋白表達定量方法 采用Nikon Eclipss E600型全自動圖像分析儀及Image-proplus圖像分析軟件進行定量分析,每張切片選取四周及中央5個區域(10×40倍),均取該區域陽性反應最多的視野。測陽性反應面積比(陽性面積/組織面積×100%),即吸光度值(A),再取平均值。
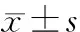
2 結 果
2.1SSc患者疾病活動度與IL-17、CTGF表達的關系 與對照組比較,SSc患者IL-17、CTGF蛋白表達水平均顯著升高,且活動組IL-17、CTGF蛋白表達水平顯著高于非活動組(P<0.05)。見表1。
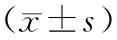
表1 SSc患者疾病活動度與IL-17、CTGF表達的關系
注:①與對照組比較,P<0.05;②與非活動組比較,P<0.05。
2.2 不同亞型的SSc患者IL-17、CTGF表達比較 與對照組比較,彌漫型和局限型SSc患者IL-17、CTGF蛋白表達水平均顯著升高(P<0.05),且彌漫型SSc組IL-17、CTGF蛋白表達水平明顯高于局限型SSc組(P<0.05)。見表2。
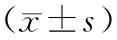
表2 不同亞型SSc患者IL-17、CTGF表達比較
注:①與對照組比較,P<0.05;②與非活動組比較,P<0.05。
2.3SSc患者IL-17、CTGF蛋白表達水平與MRSS的相關性分析 經Pearson相關性分析顯示,SSc患者IL-17、CTGF蛋白與MRSS均呈線性正相關(r=0.712,0.738,P<0.05);血漿IL-17與皮損組織CTGF蛋白亦呈線性正相關(r=0.680,P<0.05)。
3 討 論
SSc的發病機制復雜,目前尚不十分清楚,臨床上缺乏有效的藥物,但免疫功能紊亂作為發病的重要原因已達成共識[5]。大量文獻證實CTGF作為轉化生長因子β(TGF-β)的下游效應因子,具有極強的致纖維化作用,在多種肺、肝等器官的纖維化疾病中高表達。近年來,研究發現SSc組織纖維化與CD4+T細胞的活化密切相關[6],且血漿IL-17水平和TGF-β在不同亞型的SSc患者體內選擇性增高,但關于IL-17與CTGF之間的相互關系,以及二者在SSc發病機制中的作用尚未見相關報道。
IL-17作為新近發現的一種致炎細胞因子,是由不同于Th1、Th2的CD4+T細胞亞群所分泌,該亞群細胞被命名為Th17細胞[7]。本組研究顯示,與對照組比較,SSc患者IL-17、CTGF蛋白表達水平較對照組有不同程度顯著升高,且活動組IL-17、CTGF蛋白表達水平顯著高于非活動組(P<0.05),推測IL-17在SSc發病機制中起一定的作用,一方面IL-17可誘導其他炎癥細胞的活化、聚集,促進炎癥反應;另一方面IL-17還可促進成纖維細胞的增生,影響機體纖維化的形成。同時彌漫型SSc組IL-17、CTGF蛋白表達水平較局限型SSc組明顯增高(P<0.05),說明IL-17水平與病情嚴重程度相關,高水平IL-17提示病情較重,預后較差。
皮膚增厚是SSc纖維化進展的重要表現,MRSS是目前最常用的臨床評價標準。相關性分析發現,SSc患者IL-17、CTGF蛋白與MRSS均呈線性正相關,進一步說明IL-17與CTGF在SSc參與了SSc致病的整個過程,而并非只在炎癥反應階段發揮作用。有學者研究認為,在SSc疾病的后期,隨著炎癥反應逐漸被抑制,干擾素-γ(IFN-γ)、IL-4等因子水平不斷降低,對Th17細胞的抑制作用也隨之減弱,從而促進IL-17對成纖維細胞的活化,加速纖維化的進展[8-9]。此外,血漿IL-17與皮損組織CTGF蛋白亦呈線性正相關,說明存在較好的相關性和協同性,但二者在SSc發病中的相互作用機制尚需進一步研究證實。
綜上所述,IL-17在SSc患者外周血中表達增高,與CTGF具有較好相關性,共同參與了SSc的發病過程,且可作為SSc病情嚴重程度的判斷指標之一。阻斷Th17細胞活化、分泌IL-17有望為SSc的治療提供新的靶點。
[1]SteenVD,MedsgerTA.Changesincausesofdeathinsystemicsclerosis,1972-2002[J].AnnRheumDis,2007,66(7):940-944
[2]MurataM,FRjimotoM,MatsushitaT,etal.Clinicalassociationofscriminterleukin-17levelsinsystemicsclerosis:issystemicseleresisTh17disease?[J].JDermatolSci,2008,50(5):240-242
[3]GranelB,ArgiroL,HachullaE,etal.AssociationbetweenaCTGFgenepolymorphismandsystemicsclerosisinaFrenchpopulation[J].TheJournalofRheumatology,2010,37(2):351-358
[4]MasiAT.Preliminarycriteriafortheclassificationofsystemicsclerosis(scleroderma)[J].Arthritis&Rheumatism,1980,23(5):581-590
[5]VongaJ,AbrahamD.Systemicsclerosis:aprototyplcmuhisystemfibroticdisorder[J].JClinInvest,2007,117(3):557-567
[6]IshikawaH,TakedaK,OkamotoA,etal.Inductionofautoimmunityinableomyein-inducedmurinemodelofexperimentalsystemicscleresis:animportantroleforCD4+Tcells[J].JInvestDermatol,2009,129(7):1688-1695
[7]KoshyPJ,HendersonN,LoganC,etal.Interleukin17inducescartilagecollagenbreakdown:novelsynergisticeffectsincombinationwithproinflammatorycytokines[J].AnnRheumDis,2008,61(8):704-713
[8]SimonianPL,RoarkCL,WehrmannF,etal.Th17-polarizedimmuneresponseinamufinemodelofhypersensitivitypneumonitisandlungfibrosis[J].JImmunol,2009,182(1):657-665
[9]AntigaE,QuaglinoP,BellandiS,etal.RegulatoryTcellsintheskinlesionsandbloodofpatientswithsystemicsclerosisandmorphoea[J].BrJDermatol,2010,162(5):1056-1063
10.3969/j.issn.1008-8849.2015.24.032
R593.25
B
1008-8849(2015)24-2703-02
2014-06-15

