油樟幼苗對馬尾松林窗面積的光合響應特征
劉 輝, 宋會興,,*, 楊萬勤, 張 健
1 四川農業大學 風景園林學院, 成都 611130 2 四川農業大學 生態林業研究所, 成都 611130
油樟幼苗對馬尾松林窗面積的光合響應特征
劉 輝1, 宋會興1,2,*, 楊萬勤2, 張 健2
1 四川農業大學 風景園林學院, 成都 611130 2 四川農業大學 生態林業研究所, 成都 611130
為了解馬尾松人工林窗對伴生樹種的影響,為馬尾松人工純林的團塊狀混交提供科學依據,研究了10 m×10 m(T1)、15 m×15 m(T2)、20 m×20 m(T3)、25 m×25 m(T4)、30 m×30 m(T5)、35 m×35 m(T6)和40 m×40 m(T7)馬尾松人工林窗中油樟(Cinnamomumlongepaniculatum)幼苗葉片形態和光合生理特征的變化,探討馬尾松林窗斑塊對混生樹種生長的影響。結果表明:1)林窗面積低于20 m×20 m時,油樟幼苗葉片最大凈光合速率顯著低于曠地對照;2)葉片比葉重隨著林窗面積的增大顯著升高;林窗內油樟幼苗葉氮含量在小林窗中(10 m×10 m)顯著低于曠地對照,但在大林窗中(如20 m×20 m)顯著高于對照;林窗內幼苗葉磷含量則與曠地無顯著性差異;3)葉氮在光合組分中的總分配系數隨著林窗面積的增加而增大,其中葉氮在羧化組分中的分配系數升高尤為明顯,而捕光組分的分配系數在林窗面積10 m×10 m—20 m×20 m范圍內隨林窗面積的增加而顯著降低。可見,當馬尾松林窗面積低于20 m×20 m時,林窗環境會顯著影響油樟幼苗的光合能力,油樟幼苗可以通過調節比葉面積、葉氮含量以及葉氮在光合組分中的分配等形態、生理適應特征來適應林窗環境的變化。
油樟; 人工林窗; 葉氮分配; 光合能力; 馬尾松
林窗是森林群落中常見的干擾現象之一[1]。林窗的形成改變了林地的光熱水肥等環境條件,增加森林生態系統的環境異質性和微生境的多樣性,從而成為森林生態系統長期維持和循環更新的重要驅動力[2- 3]。近年來,為提高低效人工林的經營與管理水平,科研人員模擬天然林中林窗在森林更新中的作用,逐步開展了人工純林的團塊狀改造實踐[4- 5]。然而,存在的問題是:究竟多大的林窗“斑塊”最有利于混交樹種的生長?這需要研究林窗梯度對混交樹種生長特征的影響。
馬尾松(Pinusmassoniana)是我國尤其是長江流域及其以南地區重要的造林先鋒樹種和主要用材林樹種[6- 7]。單一樹種形成的大面積馬尾松純林存在生物多樣性貧乏、土壤酸化與供肥能力不足、病蟲害發生風險高、林分生產力低下等林業生態問題[8- 9]。在馬尾松純林的團塊狀改造過程中,我們研究了不同大小林窗對混交樹種油樟幼苗光合生理特征的影響,以期為低效馬尾松人工林的改造提供一定的科學依據。
1 材料與方法
1.1 研究區概況
研究地點位于四川省宜賓市高縣來復鎮毛顛坳林區(104°32′—104°34′E,28°34′—28°36′N,海拔412—567 m),該區屬亞熱帶濕潤季風氣候,年降水量1500 mm左右,年均氣溫18.1 ℃,最高氣溫36.8 ℃,最低氣溫7.8 ℃,土壤類型為山地黃壤,土壤基本理化性質見表1。地帶性植被類型為亞熱帶常綠闊葉林。現有林地分別是1972年和1997年人工造林后形成的馬尾松人工純林,行間距2.5 m×2.5 m,郁閉度0.6—0.8。林下植被蓋度約30%,主要灌木有青岡(Quercusserrata)、鐵仔(Myrsineafricana)、梨葉懸鉤子(Rubuspirifolius)、野桐(Mallotusjaponicus)、展毛野牡丹(Melastomanormale)等;主要草本有商陸(Pokeberryroot)、蕨(Pteridiumaquilinum)、芒(Miscanthussinensis)、芒萁(Dicranopterisdichotoma)、皺葉狗尾草(Setariaplicata)等[10]。

表1 研究樣地土壤基本理化性質(均值±標準差)Table 1 Basic indicators of soil physical and chemical properties(mean ± SD)
1.2 研究材料
油樟(Cinnamomumlongepaniculatum(Gamble)N. Chao ex H. W. Li)系樟科樟屬常綠喬木,是中國特有樹種,主要分布在四川宜賓,在湖北、湖南、陜西、云南、江西、廣西、廣東等地均有分布。油樟具有生長速度快、萌蘗強,葉片多,病蟲少,樹形美觀等特點,是當地造林和四旁綠化的重要鄉土樹種。
1.3 樣地設置及處理
試驗于2011年冬季選取年齡相同(1997年造林,平均株高9.3 m)、環境條件(坡向、坡度等)一致的馬尾松純林樣地,隨機設置10 m×10 m(T1)、15 m×15 m(T2)、20 m×20 m(T3)、25 m×25 m(T4)、30 m×30 m(T5)、35 m×35 m(T6)和40 m×40 m(T7)的人工采伐林窗各4個,每兩林窗間距10 m以上。2012年春季按照2.5 m×2.5 m的造林密度在各梯度林窗中栽植2年生油樟幼苗,常規管理:栽植時每株施加尿素20 g,夏末幼樹周圍除草撫育1次。以相鄰環境條件一致的全伐曠地為對照處理(CK)。
1.4 研究方法
2013年4月初,對各林窗油樟幼苗生長狀況進行調查。選擇林窗中央位置油樟幼苗中上部向光生長的當年生健康成熟葉片1片進行相關參數測定,作為該林窗特征值。
1.4.1 油樟幼苗葉片光合參數的測定
采用LI- 6400便攜式光合儀測定植株葉片光響應曲線及CO2響應曲線。測定時為晴朗天氣的9:00—12:00。其中光響應測定條件控制在:空氣流速為500 μmol/s,溫度設置為(25±1)℃,相對濕度為(60±5)%,CO2濃度為380 μmol/mol。在測定不同光合有效輻射(PAR)梯度下的凈光合速率(Pn)時,每個PAR梯度平衡180 s。依據Farquhar[11]的方法擬合Pn-PAR曲線求得接近飽和光強;CO2響應曲線的測定控制條件與光響應曲線一致,以接近飽和光強為測定光強,CO2濃度梯度從400、300、200、150、100、50、20、0 μmol/mol,然后再按400、600、800、1000、1200 μmol/mol遞增,按照各點測得的Pn與胞間二氧化碳濃度(Ci)值繪制Pn-Ci曲線求得飽和光強下葉片最大凈光合速率(Pmax)。最大羧化速率(Vcmax)與暗呼吸速率(Rd)計算方法參照Farquhar和Sharkey的方法[12],最大電子傳遞速率(Jmax)參照Tenhunen的方法計算[13]。試驗于2013年4月中旬完成。
1.4.2 油樟幼苗葉片比葉重、光合色素、葉氮及磷含量的測定
完成光合參數測定后,取同一葉片測定葉面積后80 ℃烘干至恒重,稱重并計算比葉重(LMA),比葉面積(SLA)為LMA的倒數;光合色素含量采用浸提法[14];用凱氏定氮法測定葉片總氮含量(N)[15- 16];磷含量(P)用鉬銻抗比色法測定[17]。
1.4.3 油樟幼苗葉氮在光合機構中的分配系數
葉氮在羧化系統(主要是Rubisco)中的分配系數PC按照如下公式計算[18]:
PC=Vcmax/(6.25×Vcr×NA)
葉氮在生物力能學組份(光合電子傳遞和光合磷酸化載體蛋白組份)中的分配系數PB按照如下公式計算[19]:
PB=Jmax/(8.06×Jmc×NA)
葉氮在捕光色素蛋白復合體(PSⅠ、PSⅡ、LHCⅡ)中的分配系數PL按如下公式計算[20]:
PL=Cc/(NM×CB)
葉氮在光合機制中的分配系數PT按公式PT=PC+PB+PL計算。
式中,NA是葉片單位面積的N含量(g/m2);Cc為葉綠素濃度(mmol/g);NM是葉片單位質量的N含量(mg/g);CB是結合在捕光色素蛋白復合體中的葉綠素,為5.79 mmol/gN;Vcr是Rubisco比活,即單位Rubisco蛋白的固定活性;Jmc為單位細胞色素f(Cyt f)的最大電子傳遞速率;Vcr與Jmc的測定參見Ninnemets和Tenhunen[21]。
1.5 數據處理
采用單因素方差檢驗(One-way ANOVA)比較不同林窗梯度環境之間油樟幼苗光合參數、葉氮含量、光合氮分配等特征參數。T-檢驗方法測試其差異顯著性。所有分析統計應用SPSS17.0及EXCEL2003進行數據處理。
2 結果與分析
2.1 林窗中油樟幼苗的最大凈光合速率Pmax和比葉重特征
從T1林窗到T5林窗,隨著林窗面積的增大,油樟幼苗最大凈光合速率呈明顯的升高趨勢。與對照曠地環境中的油樟幼苗相比,僅有T1、T2林窗中的幼苗最大凈光合速率顯著低于對照,T3及更大林窗中的油樟幼苗最大凈光合速率與對照沒有顯著性差異(圖1)。
在最小林窗T1中,油樟幼苗具有最低的比葉重LMA,LMA值隨著林窗面積的增大顯著升高,曠地內的油樟幼苗具最大的LMA值,并顯著高于T6及更小林窗中的LMA值(圖1)。
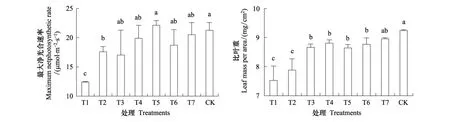
圖1 不同林窗中油樟幼苗葉片的比葉重與最大凈光合速率(均值±標準差)
2.2 不同林窗中油樟幼苗葉片氮、磷含量特征
無論是以單位質量表示的葉氮含量還是以單位面積表示的葉氮含量均表現出相同的變化趨勢。從林窗T1到林窗T3,氮含量隨林窗增大顯著增加;但從林窗T3到林窗T7以及曠地對照,幼苗葉片氮含量呈下降趨勢,其中T3與T4林窗中顯著高于對照(圖2)。
與葉氮含量變化不同,盡管從林窗T1到林窗T3油樟幼苗葉片磷含量呈升高的趨勢,但并沒有達到顯著性水平。與對照相比,各林窗內油樟幼苗葉片磷含量無顯著性變化(圖2)。

圖2 不同林窗中油樟幼苗葉片氮、磷含量
2.3 不同林窗中油樟幼苗光合氮分配特征
油樟幼苗葉片在光合機制中的氮分配系數PT隨著林窗面積的增大而增加,曠地內的幼苗葉片光合氮分配系數顯著高于所有林窗內油樟幼苗(圖3)。葉氮在羧化系統中的分配系數PC表現出與PT基本一致的變化趨勢,與PT不同的是最小林窗T1中幼苗PC顯著低于林窗T3、T4和T5(圖3)。
與PC、PT的變化趨勢一致,隨著林窗面積的增大,油樟幼苗在葉片光合機制生物力能學組份中的分配系數PB表現為上升的趨勢,與PC、PT的變化趨勢不同的是,盡管曠地內植株的PB值顯著高于林窗內植株,但不同林窗之間PB值并無顯著性差異(圖3);葉氮在捕光色素中的分配系數PL在林窗中的動態則表現出了與PT、PC和PB值完全不同變化趨勢,從T1林窗到T3林窗PL值隨著林窗面積的增大顯著降低,而T3林窗到T7林窗一直到曠地,PL值無顯著性差異(圖3D)。

圖3 不同林窗中油樟幼苗葉片光合氮分配特征
2.4 油樟幼苗光合能力與比葉面積、氮含量及光合氮分配之間的關系
Pearson相關性分析表明,林窗內油樟幼苗葉片光合潛力與NA、NM、PB、磷含量、PC呈極顯著的正相關關系(P≤0.01),與葉氮光合總氮分配系數PT呈顯著性正相關關系(P≤0.05),與比葉面積、PL呈極顯著的負相關關系(P≤0.01)(表2)。
3 討論
林窗形成后,林窗內的光照、溫度和水分等環境因子均發生變化,使得物質和能量環境明顯不同于林地、林外曠地環境[22]。林窗中環境因子的變化規律與格局因林窗大小的變化而不同[23];林窗內小氣候的變化會直接影響喬木幼苗生長[24]。本研究中,10 m×10 m(T1)林窗中油樟幼苗最大凈光合速率最低。隨著林窗面積的增大,油樟幼苗葉片最大凈光合速率增加。在林窗面積增加至20 m×20 m(T3)時,林窗內幼苗最大凈光合速率與曠地沒有顯著性差異。
植物葉片的最大凈光合速率與植物葉片結構特征、化學計量特征密切關聯。葉片比葉重LMA和氮、磷含量能在一定程度上代表植物對環境資源的利用方式和能力[25]。LMA是葉片厚度與密度的乘積,能夠在一定程度上反映植物對資源獲取和利用的制衡關系[26- 27],是植物碳獲取策略的關鍵葉特征之一[28]。弱光環境中,植物葉片細胞內儲藏物質減少,葉肉細胞變大、細胞壁次生結構弱化[29- 30],葉片同化組織對輸導組織和結構組織的相對比例升高[31],導致林窗內植物葉片可能具有更高的氮含量,并認為這是植物葉片對弱光環境的形態生理適應特征,本文研究與多數結果相一致[32- 33],在面積大于15 m×15 m(T2)的林窗內的油樟幼苗葉片氮含量通常高于曠地對照。但在較小林窗(10 m×10 m,T1)中油樟幼苗葉氮含量顯著低于曠地對照。在對常綠
表2 馬尾松林窗中油樟幼苗葉片光合生理參數之間的相關性分析
Table 2 Correlation analysis of photosynthetic characteristics in seedlings ofC.longepaniculatumunder forest gap in the masson pine plantation

Pmax: 最大光合速率Maximum net photosynthetic rate; SLA: 比葉面積Specific leaf area; NA: 單位面積氮含量Specific leaf area; NM:單位質量氮含量mass-based leaf nitrogen concentration; P磷含量:Mass-based leaf phosphorus concentration; PC:分配到羧化作用上的氮partition into Rubisco apparatus; PB:分配到生物能量上的氮partition into bioenergetic apparatus; PL:分配到捕光成分氮partition into the light harvesting apparatus; PT:分配到光合機制的氮Total partition in the photosynthetic apparatus; * P≤0.05;** P≤0.01
樹種Rhododendronponticum與Ilexaquifolium[34]、煥鏞木(Woonyoungiaseptentrionalis)[35]的研究中也發現類似現象。這可能是油樟幼苗在極端環境中維持體內化學元素相對穩定有關系。在光資源嚴重不足的環境內植物生長緩慢,葉片內限制磷含量的核糖體(特別是rRNA)對磷的需求降低[36],葉磷含量隨之降低。在本研究中,葉磷含量并沒有因林窗面積的變化而發生顯著性變化,這可能與弱光環境下成熟葉片生命活動周期延長有關[25,32]。
葉氮在不同光合組份中的分配情況更能反映環境變化條件下的植物種群適應對策[37- 38]。葉氮在捕光組分和能量轉化組分(包括電子傳遞、腺嘌呤核苷三磷酸合成和CO2同化組分)中的分配取決于生長光強和氮的利用[20]。本文的研究結果表明,當林窗面積大于20 m×20 m(T3)時,高光強促進了油樟幼苗葉氮在羧化系統PC和生物力能學組分PB中的投資與利用,這與油樟葉片在面積大于20 m×20 m(T3)林窗時具有較高的最大凈光合速率相一致。在較小林窗內(低于20 m×20 m),油樟葉氮在捕光組分的分配系數PL顯著升高,以增加結合在光系統Ⅰ、光系統Ⅱ和捕光葉綠素a/b蛋白復合體的數量。然而,PL的增加是以減少葉氮在羧化組分和電子傳遞體中的分配為代價的,與小林窗內油樟幼苗葉片具較低的最大凈光合速率相吻合。
以上分析表明,當面積低于20 m×20 m時,馬尾松林窗顯著影響了油樟幼苗葉片的光合能力。油樟幼苗可以通過調節比葉面積、葉氮含量以及葉氮在光合組分中的分配系數等形態、生理適應特征來適應林窗環境的變化。
[1] Runkle J R. Synchrony of regeneration, gaps, and latitudinal differences in tree species diversity. Ecology, 1989, 70(3): 546- 547.
[2] 臧潤國, 王伯蓀, 劉靜艷. 南亞熱帶常綠闊葉林不同大小和發育階段林隙的樹種多樣性研究. 應用生態學報, 2000, 11(4): 485- 488.
[3] Sherman R E, Fahey T J, Battles J J. Small-scale disturbance and regeneration dynamics in a neotropical mangrove forest. Journal of Ecology, 2000, 88(1): 165- 178.
[4] Ashton P M S, Gamage S, Gunatilleke I A U N, Gunatilleke C V S. Restoration of a Sri Lankan rainforest: using Caribbean pinePinuscaribaeaas a nurse for establishing late-successional tree species. Journal of Applied Ecology, 1997, 34(4): 915- 925.
[5] Duncan R S, Chapman C A. Consequences of plantation harvest during tropical forest restoration in Uganda. Forest Ecology and Management, 2003, 173(1/3): 235- 250.
[6] 楊會俠, 汪思龍, 范冰, 張偉東, 韋翠娥. 馬尾松人工林發育過程中的養分動態. 應用生態學報, 2010, 21(8): 1907- 1914.
[7] 楊會俠, 汪思龍, 范冰, 張偉東. 不同林齡馬尾松人工林年凋落量與養分歸還動態. 生態學雜志, 2010, 29(12): 2334- 2340.
[8] 包維楷, 張鐿鋰, 王乾, 擺萬奇, 鄭度. 大渡河上游林區森林資源退化及其恢復與重建. 山地學報, 2002, 20(2): 194- 198.
[9] 王乾, 吳寧, 羅鵬, 易紹良, 包維楷, 石福孫. 青藏高原東緣亞高山針葉林和采伐跡地中蘚類生長速率及其影響因子. 植物生態學報, 2007, 31(3): 464- 469.
[10] 譚波, 吳福忠, 楊萬勤, 張健, 徐振鋒, 劉洋, 茍小林. 不同林齡馬尾松人工林土壤節肢動物群落結構. 應用生態學報, 2013, 24(4): 1118- 1124.
[11] Farquhar G D, Ehleringer J R, Hubick K T. Carbon isotope discrimination and photosynthesis. Annual Review of Plant Physiology and Plant Molecular Biology, 1989, 40(1): 503- 537.
[12] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33(1): 317- 345.
[13] Tenhunen J D, Yocum C S, Gates D M. Development of a photosynthesis model with an emphasis on ecological applications. Oecologia, 1976, 26(2): 89- 100.
[14] 黃帆, 郭正元, 徐珍. 測定浮萍葉綠素含量的方法研究. 實驗技術與管理, 2007, 24(5): 29- 31.
[15] 呂偉仙, 葛瀅, 吳建之, 常杰. 植物中硝態氮、氨態氮、總氮測定方法的比較研究. 光譜學與光譜分析, 2004, 24(2): 204- 206.
[16] 雷澤湘, 徐德蘭, 謝貽發, 劉正文. 太湖水生植物氮磷與湖水和沉積物氮磷含量的關系. 植物生態學報, 2008, 32(2): 402- 407.
[17] 李會娟. 2種植物磷含量的檢測方法比較研究. 現代農業科技, 2012, (11): 16- 17.
[18] Friend A D. PGEN: an integrated model of leaf photosynthesis, transpiration, and conductance. Ecological Modelling, 1995, 77(2/3): 233- 255.
[19] Evans J R. Photosynthesis-the dependence on nitrogen partitioning //Causes and Consequences of Variation in Growth Rate and Productivity of Higher Plants. The Hague: SPB Academic Publishing, 1989: 158- 174.
[20] Hikosaka K, Terashima I. A model of the acclimation of photosynthesis in the leaves of C3plants to sun and shade with respect to nitrogen use. Plant, Cell & Environment, 1995, 18(6): 605- 618.
[21] Niinemets ü, Tenhunen J D. A model separating leaf structural and physiological effects on carbon gain along light gradients for the shade-tolerant speciesAcersaccharum. Plant, Cell & Environment, 1997, 20(7): 845- 866.
[22] 譚輝, 朱教君, 康宏樟, 胡理樂. 林窗干擾研究. 生態學雜志, 2007, 26(4): 587- 594.
[23] Ritter E, Dalsgaard L, Einhorn K S. Light, temperature and soil moisture regimes following gap formation in a semi-natural beech-dominated forest in Denmark. Forest Ecology and Management, 2005, 206(1/3): 15- 33.
[24] Powers M D, Pregitzer K S, Palik B J, Webster C R. Water relations of pine seedlings in contrasting overstory environments. Forest Ecology and Management, 2009, 258(7): 1442- 1448.
[25] Niinemets ü. Global-scale climatic controls of leaf dry mass per area, density, and thickness in trees and shrubs. Ecology, 2001, 82(2): 453- 469.
[26] Wilson T D. Models in information behaviour research. Journal of Documentation, 1999, 55(3): 249- 270.
[27] Long W X, Zang R G, Schamp B S, Ding Y. Within- and among-species variation in specific leaf area drive community assembly in a tropical cloud forest. Oecologia, 2011, 167(4): 1103- 1113.
[28] Wright I J, Westoby M, Reich P B. Convergence towards higher leaf mass per area in dry and nutrient-poor habitats has different consequences for leaf life span. Journal of Ecology, 2002, 90(3): 534- 543.
[29] Niinemets ü. Components of leaf dry mass per area-thickness and density-alter leaf photosynthetic capacity in reverse directions in woody plants. New Phytologist, 1999, 144(1): 35- 47.
[30] Yamashita N, Koike N, Ishida A. Leaf ontogenetic dependence of light acclimation in invasive and native subtropical trees of different successional status. Plant, Cell & Environment, 2002, 25(10): 1341- 1356.
[31] Feng Y L, Auge H, Ebeling S K. InvasiveBuddlejadavidiiallocates more nitrogen to its photosynthetic machinery than five native woody species. Oecologia, 2007, 153(3): 501- 510.
[32] 胡啟鵬, 郭志華, 李春燕, 馬履一. 不同光環境下亞熱帶常綠闊葉樹種和落葉闊葉樹種幼苗的葉形態和光合生理特征. 生態學報, 2008, 28(7): 3262- 3270.
[33] 王玉平, 陶建平, 劉晉仙, 何澤. 不同光環境下6種常綠闊葉林樹種苗期的葉片功能性狀. 林業科學, 2012, 48(11): 23- 29.
[34] Niinemets ü, Valladares F, Ceulemans R. Leaf-level phenotypic variability and plasticity of invasiveRhododendronponticumand non-invasiveIlexaquifoliumco-occurring at two contrasting European sites. Plant, Cell & Environment, 2003, 26(6): 941- 956.
[35] 孫谷疇, 趙平, 曾小平, 彭少麟. 不同光強下煥鏞木和觀光木的光合參數變化. 植物生態學報, 2002, 26(3): 355- 362.
[36] 程濱, 趙永軍, 張文廣, 安樹青. 生態化學計量學研究進展. 生態學報, 2010, 30(6): 1628- 1637.
[37] 張亞杰, 馮玉龍. 不同光強下生長的兩種榕樹葉片光合能力與比葉重、氮含量及分配的關系. 植物生理與分子生物學學報, 2004, 30(3): 269- 276.
[38] 張亞杰, 馮玉龍. 喜光榕樹和耐蔭榕樹光適應機制的差異. 植物生理與分子生物學學報, 2004, 30(3): 297- 304.
Responses of photosynthetic traits inCinnamomumlongepaniculatumseedlings to forest gap size in a Masson pine plantation
LIU Hui1, SONG Huixing1,2,*, YANG Wanqin2, ZHANG Jian2
1SchoolofLandscapeArchitecture,SichuanAgriculturalUniversity,Chengdu611130,China2InstituteofEcologicalForestry,SichuanAgriculturalUniversity,Chengdu611130,China
Forest gaps are one of the most common phenomena in forest communities that provide a variety of microhabitats. The formation of forest gaps can change the environmental microsite conditions of forested land such as affecting the availability of light, heat, water and influencing soil fertility. Gaps can increase environmental heterogeneity and the diversity of microhabitats present in forested ecosystems, thus becoming an important driving force for the long-term maintenance of forest ecosystems while aiding in cycling and regeneration. For the past few years, with the goal of improving the operational efficiency and management of plantations, researchers have simulated the function of gaps in natural forest during forest regeneration, and have gradually developed a mass transformation practice of artificial pure forest. However, the question remains; what size of forest gap patches is most conducive to the growth of mixed species forests? Additional work is needed to study the impact of forest gap gradients on the growth characteristics of mixed species forests.Pinusmassonianais an important afforestation pioneer species and the main fiber-producing species in China, especially in the Yangtze River basin and in southern China. The planting of large areas of single-species Masson pine forest has created many problems related to forest ecology, such as reduced biodiversity, soil acidification and poor soil fertility, along with an increased risk of forest diseases and insect pests, low forest productivity and so on. This study was designed to help land managers understand the impacts of forest gaps in Masson pine plantations on associated tree species in light of the extensive use of such plantations. The goal was to provide a scientific basis for the use of various sized gaps in Masson pine plantations and to analyze the effects of gaps on other forest species. The effects of gaps on mixed species seedlings were studied by comparing the changes of leaf morphology and photosynthetic physiological characteristics of an important indigenous broad-leaved tree species,Cinnamomumlongepaniculatum, in forest gaps of different sizes. The main results follow. First, when the size of forest gaps was less than 20 m × 20 m, the maximum net photosynthetic rate of the leaves ofC.longepaniculatumseedlings was significantly lower than that in open land. Second, with an increase of forest gap size, leaf mass per unit area increased significantly. Compared with the control, although the leaf nitrogen content ofC.longepaniculatumseedlings decreased significantly in small forest gaps (e.g., 10 m × 10 m), it increased significantly in large gaps (e.g., 20 m × 20 m). Nevertheless, no significant difference was observed in the phosphorus content of leaves of seedlings grown in either forest gaps or in open land. Third, with an increase in forest gap size, total partition coefficients of leaf nitrogen in the photosynthetic apparatus increased, especially the partition coefficients of leaf nitrogen in carboxylation components. Nevertheless, the coefficient of leaf nitrogen partitioning into the light harvesting apparatus decreased significantly with an increase in the size of forest gaps (10 m × 10 m—20 m × 20 m). The results demonstrated that if the gap size is less than 20 m × 20 m forest gaps have marked effects on the photosynthetic capacity ofC.longepaniculatumseedlings. Seedlings may adapt to changes in the forest gap environment by adjusting a number of morphological and physiological characteristics, e.g., specific leaf area, leaf nitrogen content and the distribution of leaf nitrogen in the photosynthetic apparatus.
Cinnamomumlongepaniculatum; forest gap; partition for leaf nitrogen; photosynthetic capability;Pinusmassoniana
國家科技部“十二五”科技支撐計劃項目(2011BAC09B05); 中國博士后基金項目(2013M531976)
2013- 09- 22;
2014- 07- 02
10.5846/stxb201309222326
*通訊作者Corresponding author.E-mail: Huixingsong@aliyun.com
劉輝, 宋會興, 楊萬勤, 張健.油樟幼苗對馬尾松林窗面積的光合響應特征.生態學報,2015,35(12):4089- 4096.
Liu H, Song H X, Yang W Q, Zhang J.Responses of photosynthetic traits inCinnamomumlongepaniculatumseedlings to forest gap size in a Masson pine plantation.Acta Ecologica Sinica,2015,35(12):4089- 4096.

