燕麥β-葡聚糖與沙蒿膠多糖對菌群人源化小鼠生理及腸道微生物調節比較研究
張 靜,胡新中*,李俊俊,鄭建梅,陳杏云,唐凌云
(1.西北農林科技大學食品科學與工程學院,陜西 楊凌 712100;2.陜西師范大學食品工程與營養科學學院,陜西 西安 710062)
沙蒿(Artemisia sphaerocephala Krasch.,ASP)是一種廣泛生長于中國陜西、寧夏、甘肅、新疆和內蒙古等干旱半干旱省區的野生植物[1]。沙蒿作為中草藥還具有消炎散腫、寬胸利氣及殺蟲之療效,亦可用于醫治腮腺炎、扁桃腺炎、疥瘡紅腫、腸梗阻和腹脹等癥[2-3],作為食品添加劑,自古以來就被產區農牧民作為面制食品增筋劑、減肥食品和降血糖食品廣泛食用[4-5]。沙蒿膠多糖來自沙蒿籽外皮層,是一種熱穩定性好、黏度大、吸水性好,在pH 5~8范圍內穩定的植物多糖[6],被廣泛用作增稠劑、穩定劑、保水劑和成膜劑[7],分別由主鏈為木聚糖連接而成的高分子質量組分[8]和主鏈為(1→4)-β-D-吡喃甘露糖和吡喃葡萄糖組成的低分子質量組分構成[9],研究還發現ASP可顯著降低Ⅱ型糖尿病大鼠空腹血糖值,提高Ⅱ型糖尿病大鼠的胰島素敏感性[5]、血清和肝組織超氧化物歧化酶(superoxide dismutase,SOD)的活性[10],并且攝食劑量達到200 mg/kg時可以顯著降低四氧嘧啶誘發的糖尿病小鼠血糖水平[11]。目前對沙蒿膠多糖的研究比較匱乏,且多集中在提取分離和生物活性方面。其對菌群人源化(human flora-associated,HFA)小鼠生理指標以及腸道的作用尚未見報道。
與沙蒿膠多糖相比,國內外對燕麥β-葡聚糖的研究已經相當多。燕麥β-葡聚糖是一種水溶性的非淀粉多糖,存在于胚乳和糊粉層細胞壁中,在籽粒的亞糊粉層中大量富集,燕麥麩中含量為6.6%~11.3%,在種胚中含量極少,在去皮的燕麥粉中含量為3.0%~5.4%,因此常從燕麥麩皮中提取[12-13]。燕麥β-葡聚糖是由β-(1→3)糖苷鍵和β-(1→4)糖苷鍵連接β-D-吡喃葡萄糖單位而形成的一種高分子無分支線性黏多糖[14]。大量的動物實驗表明,燕麥β-葡聚糖具有預防和治療糖尿病、緩解糖尿病并發癥、調節血糖水平、降低血壓[15-17]、降低膽固醇水平[18]、調節機體免疫功能和抗疲勞功能[19]。研究還發現燕麥β-葡聚糖具有益生元的作用,不僅能夠改善腸道環境、調節腸道系統中微生物群落組成、改善消化系統,還可以使腸道蠕動增加,縮短糞便通過大腸的時間,減少有毒物質與腸壁的接觸時間,從而預防和減少腸癌的發生[20-22]。
本實驗中利用HFA小鼠,能比較真實地反映人體腸道環境,不僅有效避免了人體實驗的倫理問題,而且已經證實該模型在腸道菌群研究方面是可行的[23-24]。燕麥β-葡聚糖和沙蒿膠多糖是否能改善HFA小鼠的生長以及糖脂指標還不清楚。本實驗擬利用添加沙蒿膠多糖和燕麥β-葡聚糖的飼料飼喂HFA小鼠8 周,探究這兩種植物多糖對HFA小鼠生理及腸道微生物結構的影響以及差異。
1 材料與方法
1.1 動物、材料與試劑
無菌KM小鼠,由第三軍醫大學基礎部實驗動物學教研室提供。
動物飼料均由第三軍醫大學新橋醫院實驗動物中心提供;燕麥β-葡聚糖和沙蒿膠多糖為本實驗室提取純化,純度分別為81.9%和86.5%,分子質量分別為152、325.8 kD。
苯酚-氯仿-異戊醇(25∶24∶1,V/V)、RNase、去離子甲酰胺、尿素、聚合酶鏈式反應(polymerase chain reaction,PCR)引物 生工生物工程(上海)股份有限公司;N,N,N’,N’-四甲基乙二胺 美國Promega公司;2×Power Taq PCR Master Mix、Goldview 北京Bioteke公司;瓊脂糖 天根生化科技有限公司;DNA Markers日本TaKaRa公司;其他試劑均為國產分析純。
1.2 儀器與設備
無菌隔離器 蘇州市馮氏實驗動物設備有限公司;OneTouch血糖儀 美國強生公司;HR-15B熱量計 長沙長興高教儀器設備公司;HHS-85型電熱恒溫水浴鍋 上海天平儀器廠;MiniBeadBeater-16磁珠研磨儀 美國BioSpec公司;GelDOC2000凝膠成像系統、PTC-200 PCR儀、1170-4486水平電泳儀、170-9081突變檢測系統 美國Bio-Rad公司;D24 UV超純水儀 美國Millipore公司;NanoDrop?Spectrophotometer核酸定量儀 美國NanoDrop公司。
1.3 方法
1.3.1 動物分組與處理
收集1 位健康志愿者(女,25 歲,3個月內未服用過抗生素,同期內未患腹瀉及其他腸道疾病,自我感覺健康,為非素食主義者,典型中國飲食)清晨第一次排出的新鮮糞便,在厭氧無菌條件下稱質量,以1∶9(m/V)加入Wilkins-Chalgren厭氧肉湯(Oxoid)稀釋,振蕩混勻后獲得糞便懸液。給30 只無菌KM小鼠(3 周齡,雌雄各半)灌胃接種糞便懸液0.4 mL,3 周后能獲得菌群結構穩定的HFA小鼠模型[25]。HFA小鼠飼育于溫度20~23℃、相對濕度40%~70%的無菌隔離器中,接受12 h光照/12 h黑暗處理。飼料和墊料均經過60Co-γ 50 kGy射線輻照滅菌(第三軍醫大學輻照中心),飲水、鼠籠和飲水瓶等經過高溫高壓滅菌后傳進無菌隔離器。
將30 只HFA小鼠(6 周齡)按體質量隨機分為3 組,每組10 只,雌雄各半:普通組(CT組)、燕麥β-葡聚糖組(CT+OG組)、沙蒿膠多糖組(CT+ASP組),分別飼喂基礎飼料(熱量值15.97 kJ/g)、基礎飼料+5%燕麥β-葡聚糖(在基礎飼料中添加質量分數5%燕麥β-葡聚糖,熱量值15.68 kJ/g),基礎飼料+5%沙蒿膠多糖(在基礎飼料中添加質量分數5%沙蒿膠多糖,熱量值16.51 kJ/g),自由攝食飲水,飼喂8 周。在飼喂結束前2 d,將HFA小鼠過夜禁食12 h進行口服葡萄糖耐量實驗(oral glucose tolerance test,OGTT)。以逼迫法采集小鼠新鮮糞便樣品,于-80℃條件下保存備用。飼喂結束后,將HFA小鼠眼眶取血后處死,快速解剖取出肝臟組織、脂肪組織稱質量并用10%福爾馬林溶液固定后送至第三軍醫大學西南醫院病理科進行蘇木精-伊紅(hematoxylin-eosin,HE)染色,血清生化指標均由第三軍醫大學西南醫院檢驗科檢測。
1.3.2 糞便細菌總DNA提取
取50 mg糞便樣品置于2 mL螺口管中,加入700 μL的裂解緩沖液(500 mmol/L NaCl、50 mmol/L Tris-HCl(pH 8.0)、50 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、4%十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)),250 μL苯酚-氯仿-異戊醇和0.2 g鋯珠(0.5 mm)混勻,并將研磨管放入Mini-BeadBeater-16研磨儀中以最大轉速研磨2 min,12 000 r/min、4℃離心5 min后,向上清液中加入250 μL 10 mol/L乙酸銨,離心后取上清液用苯酚-氯仿-異戊醇抽提2次和氯仿提取2次后,加入異丙醇于-20℃條件下放置30 min后離心棄去上清液,70%乙醇洗滌沉淀2次,自然風干后,加入50 μL無菌ddH2O溶解DNA沉淀,加入2 μL RNase(10 mg/mL)37℃孵育15 min。取2 μL DNA溶液于核酸定量儀中測定DNA純度及含量。
1.3.3 PCR擴增反應
本實驗中PCR擴增體系均為25 μL:1 μL 100 ng/μL DNA模板、12.5 μL 2×Power Taq PCR Master Mix,上下游引物(10 μmol/L)各0.5 μL,加無菌ddH2O至25 μL。本實驗所用16S rDNA基因PCR擴增引物序列為上游引物:5’-GC clamp-AACGCGAAGAACCTTAC-3’,下游引物:5’-CGGTGTGTACAAGACCC-3’,其中GC clamp序列為CGCCCGGGGCGCGCCCCGGGCGGGGCGGGG GCACGGGGGG,目的基因大小為489 bp[26]。V6~V8可變區16S rDNA基因PCR擴增采用Touch-down PCR程序為:94℃預變性5 min;94℃變性30 s,62℃退火30 s,72℃延伸1 min,之后每一個循環退火溫度下降0.5℃,共循環20次;94℃變性30 s,53℃退火30 s,72℃延伸8 min,10個循環;72℃ 終端延伸8 min,4℃結束。
1.3.4 變性梯度凝膠電泳(denaturing gradient gel electrophoresis,DGGE)、染色以及凝膠回收、測序
參照Muyzer等[27]的方法,對16S rDNA基因的擴增產物進行DGGE分析。DGGE使用質量分數6%或8%聚丙烯酰胺凝膠,將100%變性梯度定義為包含體積分數40%甲酰胺和7 mol/L尿素的體系,電泳采用DCodeTMUniversal Mutation Detection System,電泳緩沖液為1×Tris-acetate-EDTA(TAE,pH 8.0)。首先在220 V電壓下預電泳5 min,隨后在85 V的固定電壓下電泳16 h。電泳結束后,進行銀染、拍照。將DGGE凝膠上的特定條帶切割下來并將其搗碎,加入 40 μL 1×PCR Buffer,4℃過夜[25]。然后取上清液作為PCR模板重新進行擴增,取5 μL PCR產物進行1%瓊脂糖凝膠電泳,陽性結果取10 μL用于DGGE檢測,將在DGGE圖譜上為單一條帶的PCR產物進行測序處理。測序由生工生物工程(上海)股份有限公司測序部完成,序列的同源性在GenBank公共數據庫進行BLAST分析。
1.3.5 采用Quantity One軟件對DGGE圖譜進行數字化處理和多樣性分析
豐富度指數S為每個泳帶的條帶總數。
多樣性Shannon-Wiener指數H按照公式(1)計算。

式中:Pi為第i條條帶占該泳道所有條帶吸光度的比例。
均勻度指數E按照公式(2)計算。

1.4 統計學分析
2 結果與分析
2.1 多糖對HFA小鼠血清生化指標的影響

表1 普通組和多糖組HFA小鼠血清生化指標Table1 The contents of GLU, TG, Tch, HDL-C and LDL-C in serum of mice in CT, CT + OG and CT + ASP groups
普通組和多糖組HFA小鼠血清空腹血糖(glucose,GLU)、甘油三酯(triglyceride,TG)、總膽固醇(total cholesterol,Tch)、高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL-C)及低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C)的含量如表1所示,CT+OG組和CT+ASP組HFA小鼠血清GLU水平均低于CT組,但差異不顯著(P>0.05);CT+OG組Tch含量與CT組無差異,但CT+ASP組卻顯著高于CT組和CT+OG組(P<0.05);各組TG含量高低順序依次為CT+ASP組>CT組>CT+OG組,其中CT+OG組顯著低于其他兩組;CT+ASP組HDL-C含量顯著高于其他組(P<0.05),CT+OG組與CT組間無差異;CT+OG組LDL-C含量高于CT組和CT+ASP組,但無顯著差異(P>0.05)。
2.2 組織切片染色結果
2.2.1 肝臟HE染色結果
如圖1所示,CT組和CT+OG組HFA小鼠肝組織結構完整,肝細胞呈多邊形、排列整齊,肝小葉輪廓清晰,肝細胞條索圍繞中央靜脈呈放射狀排列,細胞質豐富,核膜清晰;CT+ASP組與CT組和CT+OG組相比,細胞核體積增大,細胞排列更加緊密。
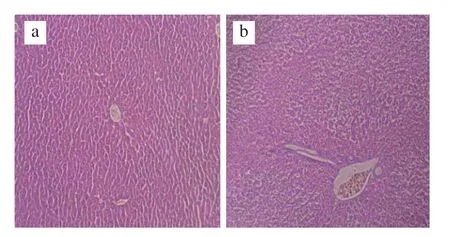

圖1 HFA小鼠肝臟組織HE染色結果(HE,×100)Fig.1 Histological observation of liver tissue (HE, ×100)
2.2.2 脂肪HE染色結果
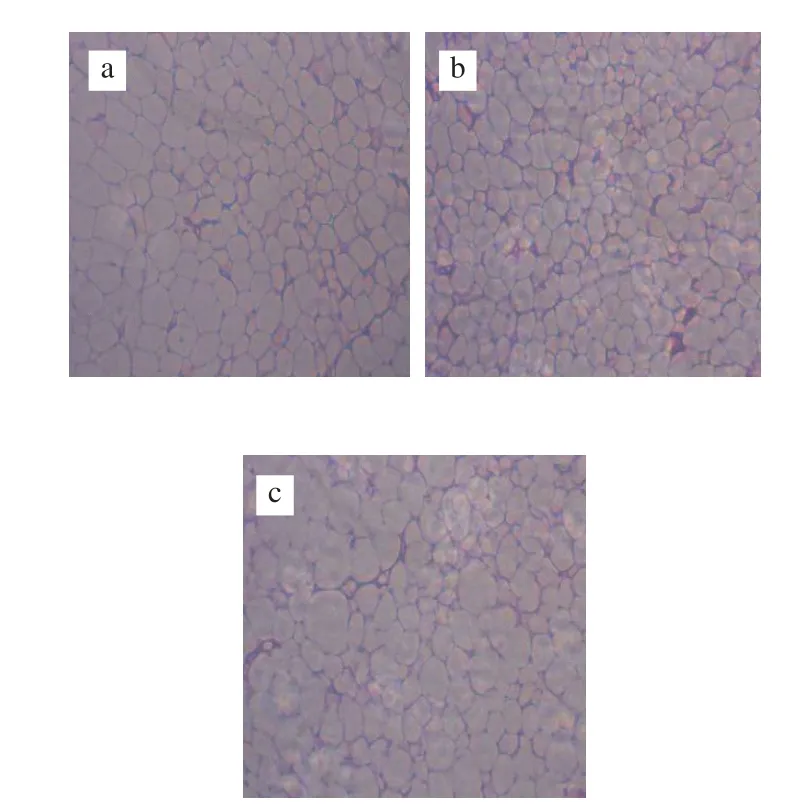
圖2 HFA小鼠脂肪組織HE染色結果(HE,×200)Fig.2 Histological observation of adipose tissue (HE, ×200)
如圖2所示,CT+ASP組HFA小鼠脂肪細胞較CT組和CT+OG組明顯變得肥大,而CT+OG組脂肪細胞較CT組明顯變小,表明沙蒿膠多糖會明顯促進脂肪細胞的肥大,而燕麥β-葡聚糖可在一定程度上抑制脂肪細胞的肥大。
2.2.3 多糖對HFA小鼠腸道菌群的影響
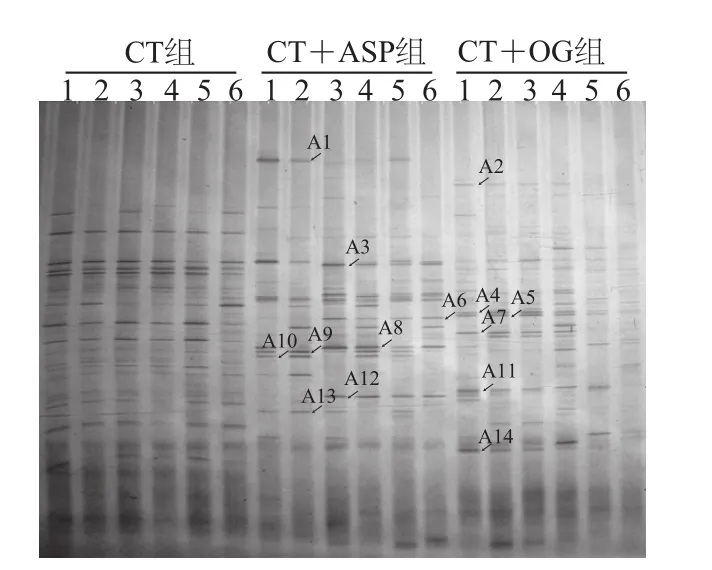
圖3 HFA小鼠16S rDNA V6~V8區DGGE指紋圖譜Fig.3 DGGE fingerprint atlas of 16S rDNA V6–V8 regions of HFA mouse model
從每組小鼠中選取合格的6 只,進行16S rDNA V6~V8區DGGE指紋圖譜分析。如圖3所示,A1、A6、A8、A9、A10、A12、A13號條帶在CT+ASP組中信號變強,測序結果表明A6、A8、A9、A10、A12、A13號條帶可能分別為Clostridium citroniae、Clostridium saccharolyticum、Ruminococcus lactaris、Acinetobacter gyllenbergii、Acinetobacter calcoaceticus、Clostridium jejuense,相似性分別為92%、96%、94%、91%、96%、91%(表2),提示說明沙蒿膠多糖刺激這幾種菌群的繁殖;A2、A4、A5、A7、A8、A9、A11、A13、A14號條帶在CT+OG組中信號變強,測序結果表明A4、A5、A7、A8、A9、A11、A13、A14號條帶可能分別為Acinetobacter gyllenbergii、Turicibacter sanguinis、Acinetobacter calcoaceticus、Clostridium saccharolyticum、Ruminococcus lactaris、Clostridium citroniae、Clostridium jejuense、Acinetobacter gyllenbergii,相似性分別為98%、90%、86%、96%、94%、94%、91%、98%(表2),說明飲食添加燕麥β-葡聚糖會刺激這幾種菌群的增殖;A3號條帶在CT+ASP組變弱,在CT+OG組中強度變得更弱,說明添加多糖飲食會導致該菌群數量減少,且燕麥β-葡聚糖的作用更明顯,測序結果表明A3號條帶可能為Acinetobacter calcoaceticus,相似性為98%。

表2 DGGE圖譜中優勢條帶的種屬鑒定結果Table2 Closest species associated with bands in DGGE profile
從UPGMA相似性聚類分析圖上可以看出DGGE結果主要聚為三大簇(圖4A)。各組能單獨聚在一起,表明各組之間菌群結構有差異。由主成分分析圖(圖4B)也能看出各組組內基本能聚成一類,其中燕麥β-葡聚糖組和沙蒿膠多糖組相距較近,表明該兩組菌群結構更為相近。
由圖4B可知,CT組、CT+OG組和CT+ASP組數據基本聚集為三部分,表明組內相似性較高。而CT+OG組與CT+ASP組又能聚集到一起,說明組間相似性較高。這與UPGMA相似性聚類分析結果一致。

圖4 DGGE結果的UPGMA相似性聚類分析(A)和主成分分析(B)Fig.4 UPGMA cluster analysis for similarity coefficients (A) and principal component analysis (B) of DGGE

圖5 微生物多樣性指數分析Fig.5 Diversity indices calculated from the V6–V8 DGGE banding profile
如圖5所示,對V6~V8區DGGE圖譜進行多樣性分析,沙蒿膠多糖組Shannon-Wiener指數H、均勻度指數E、豐富度指數S均高于普通組和燕麥β-葡聚糖組,但無統計學差異(P>0.05)。說明沙蒿膠多糖能增加微生物多樣性、增加HFA小鼠腸道微生物種類以及總菌分配均一性,而燕麥β-葡聚糖能增加腸道微生物種類,但對微生物多樣性以及總菌分配多樣性基本無影響。
3 結論與討論
本實驗分別用含燕麥β-葡聚糖與沙蒿膠多糖飼料飼喂HFA小鼠8 周后,HFA小鼠的血清生化指標、肝臟組織、脂肪組織以及腸道菌群結構都發生了不同的變化,這說明兩種多糖對HFA小鼠的生理以及腸道微生物有調節作用,并且二者的作用存在差異。
燕麥β-葡聚糖和沙蒿膠多糖這兩種多糖對于降低血清空腹血糖(GLU)含量的作用基本一致,但在對甘油三酯(TG)、總膽固醇(Tch)、高密度脂蛋白膽固醇(HDL-C)及低密度脂蛋白膽固醇(LDL-C)的作用上卻完全相反。燕麥β-葡聚糖在降低TG、Tch和LDL-C含量方面表現更突出(P<0.05)。甘油三酯是被貯藏起來的熱量源,是脂肪成分,而總膽固醇是指血液中所有脂蛋白所含膽固醇的總和,膽固醇和甘油三酯升高都會導致高脂血癥。高密度脂蛋白膽固醇是抗動脈粥樣硬化的膽固醇,它可減少患冠狀動脈性心臟病的危險。低密度脂蛋白膽固醇水平升高會增加患冠狀動脈性心臟病的危險,對健康不利。盡管選用模型不同,本實驗中燕麥β-葡聚糖對于血液生化指標的影響與許多報道基本一致,具有降低血糖、膽固醇和體脂等生理功能[17,28-30],從而減少心血管疾病、糖尿病的危險。沙蒿膠多糖對血清生化指標的影響卻與許多報道不同,相關研究證明沙蒿膠多糖可緩解Ⅱ型糖尿病大鼠高血糖、高血壓和胰島素抵抗癥狀,提高血清和肝組織SOD活性[12],并且一定攝食劑量可以顯著降低四氧嘧啶誘發的糖尿病小鼠血糖水平[11],最近還有很多專利聲稱沙蒿膠多糖不僅對Ⅰ型糖尿病大鼠具有降血脂、抗氧化功效,還對肥胖小鼠有降血脂的功能[6]。且中國古代醫書記載沙蒿籽粒可用來醫治糖尿病[31],這可能與所選的動物模型不同有關。血液生化指標是反映人體健康的重要指標,血液生化指標紊亂會引起心腦血管方面的疾病。甘油三酯升高會導致冠心病和動脈粥樣硬化的發生,總膽固醇含量的升高預示著心腦血管疾病發生機率大大提高[29],這提示沙蒿膠多糖有誘發疾病的危險。前人對于β-葡聚糖的保健功能以及作用機理猜想很多,而且也有很多實例證明[15,32]β-葡聚糖具有降低餐后血脂水平、降低胰島負擔、降低脂類成分吸收等功能,通常認為這與其抗營養性能和能在腸內形成高黏度環境有關[33-34],但是沙蒿膠多糖的黏度特性并沒有使其具有相應的功能,這說明腸道對于沙蒿膠多糖的吸收率高,但是黏性多糖對于血液生化指標的影響途徑是復雜多樣的,仍需進一步探究。
從肝臟組織形態學也可看出,多糖飲食對HFA小鼠的肝組織結構沒有明顯作用,但從脂肪組織形態學觀察可看出,沙蒿膠多糖飲食明顯增加了脂肪組織的肥大程度,而燕麥β-葡聚糖卻可明顯避免脂肪細胞肥大,這說明燕麥β-葡聚糖有保肝護肝和減肥作用,而沙蒿膠多糖會引起脂肪沉積和脂肪細胞肥大。
近年來,越來越多的學者關注到腸道菌群對人類健康的重要性。人類與微生物共同進化了數百萬年,在此過程中人體腸道形成大量正常菌群,這些菌群在腸道中通過特定的方式形成與宿主相互作用的生理性統一體,發揮營養、免疫、代謝等一系列生理作用[35]。人類的某些疾病是微生物失衡造成的,而不是由于某種致病微生物的存在,如過敏性疾病、肥胖、炎癥性腸病等疾病等[36]。對于Ⅰ型糖尿病小鼠模型,腸道微生物群與先天免疫系統的交互會降低患糖尿病的傾向[37]。與無自身免疫個體相比,高遺傳糖尿病風險的孩子會表現出不同的腸道微生物群組成,隨著時間的推移多樣性會下降,并且橢圓形擬桿菌相對豐度升高[38]。肥胖已成為一個主要的健康問題,已有研究表明肥胖與西方式飲食和微生物群密切相關[39]。研究發現導致動物模型肥胖的原因是占主導地位腸道菌群中擬桿菌門的減少和厚壁菌門的增加[40]。然而針對人類雙胞胎而言,肥胖個體擬桿菌門下降,但放線菌增加,而不是在于厚壁菌門[41]。究其原因可能是這些菌群豐度的相對改變會增加機體從食物中獲取能量的能力,產生低級炎癥。肥胖動物模型的誘導通常是通過一些宿主遺傳和環境因素的變化來實現微生物群組成的變化。肝臟由于其獨特的解剖結構,與腸道也有著密切聯系,它是結腸和小腸靜脈70%血流通過門靜脈流入的第一個腸外器官,所以易受來自血流中腸腔細菌產物的影響。正常情況下,少量移位細菌產物抵達肝臟,但因肝臟免疫系統的“肝耐受”功能,可避免有害反應。但是如果肝臟處于疾病狀態,那么這種耐受會被打破而降低肝功能、激活炎性反應并且因腸源性因素而進一步加劇了病理進程[42]。近年來,隨著對腸道菌群的逐步重視以及相應技術的發展,通過移植外源腸道微生物群恢復微生物群落健康已經被證明可以作為對某些疾病治療的有效手段[43]。研究如何通過飲食調控腸道菌群、保障宿主機體健康成為熱點科學研究問題之一。本實驗通過兩種多糖飼喂HFA小鼠發現燕麥β-葡聚糖和沙蒿膠多糖均使腸道菌群結構發生了明顯的變化,不僅改變HFA小鼠腸道的菌群組成,還會增加其腸道微生物的多樣性,而且CT+ASP組效果比CT+OG組明顯(P>0.05)。申瑞玲等[34,44-45]研究已證實,燕麥β-葡聚糖能夠起到調節腸道菌群的作用,如促進雙歧桿菌和乳酸桿菌的增殖,抑制大腸桿菌的繁殖等,可以作為益生元。但在HFA小鼠模型腸道菌群中這種效果不明顯,這可能與模型不同和所提取的多糖分子質量的差異有關。但對于沙蒿膠多糖對腸道菌群的影響鮮有報道,需要進一步探究。上述HFA小鼠的血清、肝臟、脂肪等指標的變化與腸道菌群變化是否有關也需要更深入地研究探討。
造成燕麥β-葡聚糖與沙蒿膠多糖對菌群人源化小鼠生理及腸道微生物調節方面的差異究其原因可能有:1)多糖組成、糖苷鍵種類不同導致多糖聚合度不同、結構不同,從而導致其溶解性、流變學特性乃至生理特性不同。結構是其生理功能的基礎,溶解性是其發揮生物學活性的首要條件,黏度不僅在一定程度上與其溶解度呈正相關,還是臨床上藥效發揮的關鍵控制因素之一,如果黏度過高,則不利于多糖藥物的擴散與吸收。Guo Qingbin等[46]認為提取的沙蒿膠多糖是一種由高分子質量沙蒿膠多糖(60P)、低分子質量沙蒿膠多糖(60S)以及游離蛋白質等組分組成的雜多糖,其中中性糖和糖醛酸質量分數分別為66.9%、15.8%。60P含有55.4%中性糖和25.8%糖醛酸,其中包括80.5%木糖、10.9%阿拉伯糖、5%葡萄糖、2.3%半乳糖和1.2%鼠李糖,其主鏈由木聚糖連接而成[8,47]。60S含有87.1%中性糖和10.4%糖醛酸,由38.3%葡萄糖、28.1%甘露糖、24.2%半乳糖和9.4%阿拉伯糖等單糖組成,主鏈由(1→4)-β-D-吡喃甘露糖和吡喃葡萄糖組成,且為不被人體消化的β型[9]。燕麥β-葡聚糖為由燕麥β-葡聚糖、蛋白質、脂肪等組成的混合物,燕麥β-葡聚糖是由β-(1→3)糖苷鍵和β-(1→4)糖苷鍵連接β-D-吡喃葡萄糖單位而形成的一種高分子無分支線性黏多糖[48-49],且糖苷鍵比例約為3∶7[14]。2)分子質量不同。燕麥β-葡聚糖和沙蒿膠多糖重均分子質量分別為152 kD和325.8 kD。分子的大小是多糖具備生物活性的必要條件,多糖分子質量越大、分子體積越大,越不利于多糖跨越多重細胞膜障礙進入生物體內發揮生物學活性。而分子質量大小不僅影響溶解度還影響黏度。可見分子質量對于生物活性的影響是至關重要的。3)多糖空間結構存在差異,造成其功能不同。雖然研究者已經清楚燕麥β-葡聚糖和沙蒿膠多糖的一級結構,但關于分子鏈形態、空間構象、以及聚集結構都還不了解。4)多糖中含有的雜質不同。提取的植物粗多糖多含有蛋白質、脂肪以及其他雜質。而這些雜質在多糖發揮生物活性過程中的作用如何尚不清楚,這就需要進一步提取純化得到更純的多糖。
本實驗利用HFA小鼠模型,比較燕麥β-葡聚糖與沙蒿膠多糖對菌群人源化小鼠生理及腸道微生物調節的異同,發現二者的作用效果不盡相同:在降低HFA小鼠血清空腹血糖、總膽固醇、甘油三酯含量,脂肪細胞大小方面,分子質量小的燕麥β-葡聚糖功效明顯優于分子質量大的沙蒿膠多糖;但在增加HFA模型小鼠腸道微生物多樣性方面,分子質量大的沙蒿膠多糖顯著優于分子質量小的燕麥β-葡聚糖。
[1]中國植物志編委會.中國植物志(第67卷)[M].北京: 科學出版社,1991: 189-280.
[2]全國中草藥匯編編寫小組.全國中草藥匯編(上冊)[M].北京:人民衛生出版社, 1983: 815.
[3]江蘇新醫學院.中藥大詞典(下冊)[M].上海: 上海人民出版社,1977: 2358.
[4]張繼, 高義霞, 武光朋, 等.沙蒿多糖的提取, 純化工藝研究[J].食品科學, 2007, 28(5): 125-127.
[5]XING Xiaohui, ZHANG Zhengmao, HU Xinzhong, et al.Antidiabetic effects of Artemisia sphaerocephala Krasch.gum, a novel food additive in China, on streptozotocin-induced type 2 diabetic rats[J].Journal of Ethnopharmacology, 2009, 125(3): 410-416.
[6]HU Xinzhong, XING Xiaohui.Medical properties of Shahao in China[J].Ethnomedicine: Source & Mechanism, 2009, 27: 221-240.
[7]BAI S, YONG T, YUN X.Survey and prospect of the studies on the extraction of oil and glue from Artemisia[J].Packaging and Food Machine, 2000, 3: 17-23.
[8]GUO Qingbin, CUI S W, WANG Qi, et al.Structure characterization of high molecular weight heteropolysaccharide isolated from Artemisia sphaerocephala Krasch.seed[J].Carbohydrate Polymers, 2011, 86(2):742-746.
[9]GUO Qingbin, CUI S W, WANG Qi, et al.Structural characterization of a low-molecular-weight heteropolysaccharide (glucomannan)isolated from Artemisia sphaerocephala Krasch.[J].Carbohydrate Research, 2012, 350: 31-39.
[10]HU Xinzhong, XING Xiaohui, ZHANG Zhengmao, et al.Antioxidant effects of Artemis sphaerocephala Krasch.gum, on streptozotocin-induced type 2 diabetic rats[J].Food Hydrocolloids, 2011, 25(2): 207-213.
[11]ZHANG Ji, HUANG Yulong, HOU Tiande, et al.Hypoglycaemic effect of Artemisia sphaerocephala Krasch.seed polysaccharide in alloxan-induced diabetic rats[J].Swiss Medical Weekly, 2006,136(33/34): 529-532.
[12]胡新中, 魏益民, 任長忠.燕麥品質與加工[M].北京: 科學出版社,2009: 16-17.
[13]FRY S C.Polysaccharide-modifying enzymes in the plant cell wall[J].Annual Review of Plant Biology, 1995, 46(1): 497-520.
[14]張暉, 蔡秋聲.谷物β-葡聚糖研究進展[J].糧食與油脂, 2010(5): 3-7.
[15]汪海波, 劉大川, 汪海嬰, 等.燕麥β-葡聚糖對糖尿病大鼠的血糖及糖代謝功能的影響研究[J].食品科學, 2005, 26(8): 387-391.
[16]TAPPY L, GüGOLZ E, WüRSCH P.Effects of breakfast cereals containing various amounts of β-glucan fibers on plasma glucose and insulin responses in NIDDM subjects[J].Diabetes Care, 1996, 19(8):831-834.
[17]BRENNAN C S, CLEARY L J.The potential use of cereal (1→3,1→4)-β-D-glucans as functional food ingredients[J].Journal of Cereal Science, 2005, 42(1): 1-13.
[18]ANDON M B, ANDERSON J W.State of the art reviews: the oatmeal-cholesterol connection: 10 years later[J].American Journal of Lifestyle Medicine, 2008, 2(1): 51-57.
[19]徐超, 胡新中, 羅勤貴, 等.燕麥對小鼠抗疲勞作用的研究[J].中國糧油學報, 2009, 24(9): 36-39.
[20]M?LKKI Y, VIRTANEN E.Gastrointestinal effects of oat bran and oat gum: a review[J].LWT-Food Science and Technology, 2001,34(6): 337-347.
[21]BYRNE B M, DANKERT J.Volatile fatty acids and aerobic flora in the gastrointestinal tract of mice under various conditions[J].Infection and Immunity, 1979, 23(3): 559-563.
[22]SHEN Ruiling, DANG Xueya, DONG Jilin, et al.Effects of oat β-glucan and barley β-glucan on fecal characteristics, intestinal microflora, and intestinal bacterial metabolites in rats[J].Journal of Agricultural and Food Chemistry, 2012, 60(45): 11301-11308.
[23]曾本華, 唐歡, 李文霞, 等.肥胖患者HFA小鼠模型的建立[J].中國微生態學雜志, 2012, 24(4): 289-291.
[24]李瑞, 廖振林, 方祥, 等.抗性淀粉對HFA小鼠腸道菌群的影響[J].中國微生態學雜志, 2013, 25(7): 762-765.
[25]HIRAYAMA K.Ex-germfree mice harboring intestinal microbiota derived from other animal species as an experimental model for ecology and metabolism of intestinal bacteria[J].Experimental Animals, 1999, 48(4): 219-227.
[26]NüBEL U, ENGELEN B, FELSKE A, et al.Sequence heterogeneities of genes encoding 16S rRNAs in Paenibacillus polymyxa detected by temperature gradient gel electrophoresis[J].Journal of Bacteriology,1996, 178(19): 5636-5643.
[27]MUYZER G, de WAAL E C, UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993, 59(3): 695-700.
[28]裴素萍, 蔡東聯, 朱昱, 等.燕麥β-葡聚糖治療大鼠高脂血癥[J].第二軍醫大學學報, 2006, 27(5): 510-513.
[29]申瑞玲, 王志瑞, 董吉林, 等.燕麥β-葡聚糖對高脂血癥大鼠空腹和餐后脂代謝的影響[J].食品科學, 2009, 30(1): 258-260.
[30]張培培, 樊明濤, 胡新中, 等.燕麥全粉和燕麥β-葡聚糖對大鼠生長和血液生化指標的影響[J].中國糧油學報, 2010, 25(9): 27-31.
[31]ZHAO C X, HUANG Z S.Preliminary study of the drought-resistance structure of main xerophytic plants in Tenggeli Desert[J].Journal of Integrative Plant Biology, 1981, 4: 281.
[32]WANG Dongfeng, WANG Changhong, ZHAO Guiwen, et al.Composition, characteristic and activity of rare earth elementbound polysaccharide from tea[J].Bioscience, Biotechnology, and Biochemistry, 2001, 65(9): 1987-1992.
[33]王鳳梅, 樊明壽, 鄭克寬.燕麥β-葡聚糖的保健作用及影響其積累的因素[J].麥類作物學報, 2005, 25(2): 116-118.
[34]申瑞玲, 王章存, 姚惠源.燕麥β-葡聚糖對小鼠腸道菌群的影響[J].食品科學, 2005, 26(2): 208-212.
[35]SEKIROV I, RUSSELL S L, ANTUNES L C M, et al.Gut microbiota in health and disease[J].Physiological Reviews, 2010, 90(3): 859-904.
[36]CLEMENTE J C, URSELL L K, PARFREY L W, et al.The impact of the gut microbiota on human health: an integrative view[J].Cell, 2012,148(6): 1258-1270.
[37]WEN Li, LEY R E, VOLCHKOV P Y, et al.Innate immunity and intestinal microbiota in the development of type 1 diabetes[J].Nature,2008, 455: 1109-1113.
[38]GIONGO A, GANO K A, CRABB D B, et al.Toward defining the autoimmune microbiome for type 1 diabetes[J].The ISME Journal,2010, 5(1): 82-91.
[39]LEY R E.Obesity and the human microbiome[J].Current Opinion in Gastroenterology, 2010, 26(1): 5-11.
[40]LEY R E, B?CKHED F, TURNBAUGH P, et al.Obesity alters gut microbial ecology[J].Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(31): 11070-11075.
[41]TURNBAUGH P J, HAMADY M, YATSUNENKO T, et al.A core gut microbiome in obese and lean twins[J].Nature, 2008, 457: 480-484.
[42]吳文明, 李帆, 楊云生.腸道菌群與肝病關系的研究進展[J].中華消化雜志, 2013, 33(7): 500-502.
[43]BAKKEN J S.Fecal bacteriotherapy for recurrent Clostridium difficile infection[J].Anaerobe, 2009, 15(6): 285-289.
[44]申瑞玲, 王章存, 董吉林, 等.燕麥β-葡聚糖對小鼠結腸菌群及其功能的影響[J].營養學報, 2006, 28(5): 430-433.
[45]申瑞玲, 董吉林, 姚惠源.燕麥β-葡聚糖體內外發酵的研究[J].中國糧油學報, 2006, 21(3): 97-101.
[46]GUO Qingbin, CUI S W, WANG Qi, et al.Extraction, fractionation and physicochemical characterization of water-soluble polysaccharides from Artemisia sphaerocephala Krasch seed[J].Carbohydrate Polymers, 2011, 86(2): 831-836.
[47]GUO Qingbin, WANG Qi, CUI S W, et al.Conformational properties of high molecular weight heteropolysaccharide isolated from seeds of Artemisia sphaerocephala Krasch[J].Food Hydrocolloids, 2013,32(1): 155-161.
[48]LAZARIDOU A, BILIADERIS C G, IZYDORCZYK M S.Molecular size effects on rheological properties of oat β-glucans in solution and gels[J].Food Hydrocolloids, 2003, 17(5): 693-712.
[49]JOHANSSON L, TUOMAINEN P, ANTTILA H, et al.Effect of processing on the extractability of oat β-glucan[J].Food Chemistry,2007, 105(4): 1439-1445.

