排風(fēng)藤內(nèi)生真菌PFT-2 發(fā)酵產(chǎn)物抗氧化活性研究
楊 揚(yáng),蘇香萍*,李則君,汪鋆植,2,鄒 坤,2
1三峽大學(xué)生物與制藥學(xué)院;2 三峽大學(xué)天然產(chǎn)物研究與利用湖北省重點(diǎn)實(shí)驗(yàn)室,宜昌 443002
植物內(nèi)生菌(entophytic fungal)是指那些在其生活史的一定階段或全部階段生活于健康植物各種組織和器官內(nèi)部或細(xì)胞間隙的真菌或細(xì)菌[1]。許多研究[2-4]表明,植物內(nèi)生菌能產(chǎn)生多種全新的活性物質(zhì),作為生物防治資源、外源基因的載體和新藥的來(lái)源,在農(nóng)業(yè)、醫(yī)藥、食品衛(wèi)生領(lǐng)域有著巨大的應(yīng)用潛力。
排風(fēng)藤(Solanum cathayanum)為茄科植物千年不爛心的干燥全草,為植物白英的全草[5]。夏秋采收,曬干,生用,亦用鮮品。生長(zhǎng)于海拔200~1400 m 處山坡陰濕處及灌木叢中,主產(chǎn)于三峽地區(qū)的巴東、長(zhǎng)陽(yáng)、秭歸、興山以及神農(nóng)架,全國(guó)大部分地區(qū)均有分布[6]。排風(fēng)藤其性微寒,味苦,具有清熱利濕、解毒消腫之功效,且富含生物堿、黃酮、萜類(lèi)和甾體等化合物[7],具有抗炎、保肝護(hù)肝和抗氧化活性[8,9]。
文獻(xiàn)[10]從排風(fēng)藤中分離得到18 株菌株,其中兩株菌株的代謝產(chǎn)物的抗菌活性較強(qiáng)。目前國(guó)內(nèi)外對(duì)排風(fēng)藤的研究主要集中在排風(fēng)藤藥材提取物的成分和活性[8,9],而未見(jiàn)排風(fēng)藤內(nèi)生真菌代謝產(chǎn)物生物活性的研究報(bào)道。本文對(duì)排風(fēng)藤內(nèi)生真菌PFT-2進(jìn)行發(fā)酵擴(kuò)大培養(yǎng),并對(duì)各提取物做抗氧化活性的研究,為排風(fēng)藤內(nèi)生真菌的這一微生物資源的研究開(kāi)發(fā)提供理論依據(jù)。
1 材料與儀器
1.1 出發(fā)菌株
排風(fēng)藤內(nèi)生真菌PFT-2 (Rhizoctonia.sp.PFT02),本實(shí)驗(yàn)室提供并培養(yǎng)。
1.2 實(shí)驗(yàn)試劑
二苯代苦味肼基自由基(DPPH·),Sigma 公司;石油醚、氯仿、正丁醇、乙酸乙酯、丙酮、甲醇、Vc、無(wú)水乙醇、鐵氰化鉀、三氯化鐵、磷酸二氫鈉、磷酸氫二鈉、三氯乙酸均為國(guó)產(chǎn)分析純?cè)噭?/p>
1.3 實(shí)驗(yàn)儀器
UV-3100 型紫外可見(jiàn)分光光度計(jì),上海美普達(dá)儀器有限公司;立式壓力蒸汽滅菌鍋,上海博迅實(shí)業(yè)有限公司醫(yī)療設(shè)備廠;GSP-9270MBE 隔水式恒溫培養(yǎng)箱,上海博迅實(shí)業(yè)有限公司醫(yī)療設(shè)備廠;EYELA旋轉(zhuǎn)蒸發(fā)儀旋轉(zhuǎn)蒸發(fā)器;超凈工作臺(tái),上海博迅實(shí)業(yè)有限公司醫(yī)療設(shè)備廠。
2 實(shí)驗(yàn)方法
2.1 培養(yǎng)基
PDA 液體發(fā)酵培養(yǎng)基的制備:稱(chēng)取2000 g 馬鈴薯,洗凈去皮切碎,加水煮沸0.5 h,紗布過(guò)濾,定容至10 L,再加蔗糖200 g,充分溶解,分裝于三角瓶,200 mL/500 mL 瓶,121 ℃,滅菌30 min。
2.2 種子液制備
將本實(shí)驗(yàn)室分離保藏的菌株排風(fēng)藤PFT-2 菌株接種到PDA 斜面培養(yǎng)基中活化,28 ℃恒溫培養(yǎng)箱培養(yǎng)7 d,觀察菌株生長(zhǎng)狀態(tài),是否和母斜面相同。將活化好的PFT-2 菌株接種到PDA 液體發(fā)酵培養(yǎng)基中,28 ℃恒溫?fù)u床培養(yǎng)3 d 左右,記錄觀察發(fā)酵液特征,如正常可接入發(fā)酵培養(yǎng)基擴(kuò)大培養(yǎng)。
2.3 發(fā)酵培養(yǎng)
將上述種子液按照5%的接種量接種到8 L 的PDA 液體發(fā)酵培養(yǎng)基中,即40 瓶200 mL/500 mL裝的錐形瓶,28 ℃恒溫?fù)u床培養(yǎng)14 d,觀察發(fā)酵液狀態(tài),菌絲體形態(tài)大小、顏色及密度不再變化為準(zhǔn)。
2.4 代謝產(chǎn)物分離提取和樣品制備
發(fā)酵液萃取:將發(fā)酵液用4 層紗布過(guò)濾,發(fā)酵濾液用等體積的乙酸乙酯萃取,萃取發(fā)酵液三次,直至顏色為無(wú)色。合并萃取液,置于圓底燒瓶中,旋轉(zhuǎn)蒸發(fā)去除溶劑,得發(fā)酵液乙酸乙酯萃取物。
菌絲體提取:發(fā)酵液過(guò)濾后菌絲體,先60 ℃烘干,再研磨成粉,稱(chēng)取各菌株菌絲100 mL,用800 mL甲醇超聲萃取3 次,每次30 min 冷浸抽提,合并提取物旋蒸濃縮得到菌絲體甲醇總提物。取適量菌絲體甲醇總提物用蒸餾水混懸后,依次用石油醚、氯仿、乙酸乙酯、正丁醇,丙酮、甲醇提取得到菌絲體甲醇總提物各部位,即石油醚部位、氯仿部位、乙酸乙酯部位、正丁醇部位、丙酮提取物、甲醇提取物、水層剩余物和水不溶物,將所有提取物冷藏于冰箱中,備抗氧化活性測(cè)定之用。
2.5 抗氧化活性測(cè)定
2.5.1 DPPH·清除能力[11,12]
向試管中依次加入1.0 mL 0.15 mmol/L DPPH·溶液和1.0 mL 甲醇,總體積為2.0 mL,混勻20 min后,測(cè)定吸光度(A 為517 nm),記為A0;加入1.0 mLDPPH·溶液和1.0 mL 待測(cè)試樣溶液,測(cè)定值記為Ai;加入1.0 mL 甲醇和1.0 mL 待測(cè)試樣溶液,測(cè)定值記為Aj,按下式計(jì)算DPPH·清除率。

樣品清除DPPH·能力采用IC50值表示。并以維生素C(Vc)作抗氧化活性對(duì)照實(shí)驗(yàn)。
2.5.2 Fe3+還原力的測(cè)定[13]
準(zhǔn)確稱(chēng)取樣品100 mg,溶劑溶解并定容至10 mL,配制成質(zhì)量濃度為10 mg/mL 樣品溶液,稀釋成不同質(zhì)量濃度,取2.5 mL 各濃度的樣品溶液,加入2.5 mL 0.2 mol/L 磷酸緩沖液及2.5 mL 1%鐵氰化鉀,50 ℃水浴反應(yīng)20 min 后,急速冷卻,加入2.5 mL 10%三氯乙酸溶液混勻,0.2 μm 水相濾膜過(guò)濾,取上清液5 mL,加入5 mL 0.02%三氯化鐵溶液混勻,10 min 后于700 nm 波長(zhǎng)處測(cè)定吸光度A。吸光度越大則還原能力越大,以VC作為陽(yáng)性對(duì)照。
3 結(jié)果與討論
3.1 發(fā)酵液的培養(yǎng)狀態(tài)
PFT-2 內(nèi)生真菌接種發(fā)酵培養(yǎng)到第5 d 時(shí),菌絲球的顏色由乳白色逐漸變?yōu)辄S色,其大小均勻,發(fā)酵液無(wú)色澄清;PFT-2 內(nèi)生真菌發(fā)酵培養(yǎng)到第12 d 時(shí),菌絲球變?yōu)槟G色,并且大部分菌絲球變得松散呈絮狀,發(fā)酵液仍為澄清無(wú)色,此狀態(tài)持續(xù)到第14 d發(fā)酵結(jié)束。
3.2 發(fā)酵液乙酸乙酯萃取物和菌絲體甲醇總提物抗氧化活性結(jié)果
DPPH·是一類(lèi)較為穩(wěn)定的芳香類(lèi)自由基,天然抗氧化物質(zhì)對(duì)DPPH·的清除能力被認(rèn)為是抗氧化物質(zhì)清除自由基的總能力,因此DPPH·法被廣泛用于各種物質(zhì)體外抗氧化活性的研究中。另外Fe3+還原能力的測(cè)定,可檢驗(yàn)提取物是否為良好的電子供應(yīng)體,提取物通過(guò)提供電子使Fe3+還原為Fe2+,根據(jù)體系吸光度的大小可以反應(yīng)出提取物的還原力強(qiáng)弱,吸光度越大,還原力越強(qiáng),說(shuō)明其抗氧化活性就越強(qiáng)。

表1 各樣品對(duì)DPPH·的清除率Table 1 Scavenging rates of samples against DPPH· %
由表1 可知,乙酸乙酯萃取PFT-2 內(nèi)生真菌的濾液,甲醇浸泡粗提的PFT-2 內(nèi)生真菌的菌絲體,兩個(gè)樣品都對(duì)DPPH·均有一定的清除活性,并且在一定質(zhì)量濃度范圍內(nèi),清除DPPH·的能力均隨著樣品物質(zhì)量濃度的增大而增強(qiáng),而在實(shí)驗(yàn)的質(zhì)量濃度范圍內(nèi),菌絲體甲醇總提物在各質(zhì)量濃度條件下清除DPPH·的能力明顯強(qiáng)于發(fā)酵液乙酸乙酯萃取物,則選擇菌絲體甲醇總提物做進(jìn)一步的抗氧化活性研究。
3.3 菌絲體甲醇總提物的不同極性部位的抗氧化活性
由圖1 可知,在一定質(zhì)量濃度范圍內(nèi),菌絲體甲醇總提物的各極性部位對(duì)DPPH·的清除作用呈隨濃度增大而增加趨勢(shì),但當(dāng)達(dá)到一定濃度后樣品對(duì)DPPH·的清除率隨濃度增大,變化趨于平緩,同時(shí)各種提取物對(duì)DPPH·的清除效果與提取劑的極性也有一定關(guān)系,清除效果較好的物質(zhì)主要集中在甲醇、正丁醇、丙酮等極性較大的溶劑中。在實(shí)驗(yàn)的質(zhì)量濃度范圍內(nèi),不同有機(jī)溶劑的萃取物在各質(zhì)量濃度條件下清除DPPH·的能力為:VC>菌絲體甲醇提取物>菌絲體正丁醇部位>菌絲體甲醇總提物>菌絲體乙酸乙酯部位>菌絲體丙酮提取物>水層剩余物>菌絲體氯仿部位>菌絲體石油醚部位,故PFT-2 內(nèi)生真菌次級(jí)代謝產(chǎn)物中抗氧化活性成分主要分布在甲醇提取物,當(dāng)質(zhì)量濃度達(dá)到5.000 mg/mL 時(shí),其清除率達(dá)到83.3%。活性最差的在石油醚部位,當(dāng)質(zhì)量濃度達(dá)到5.000 mg/mL 時(shí),其清除率僅為38.1%。
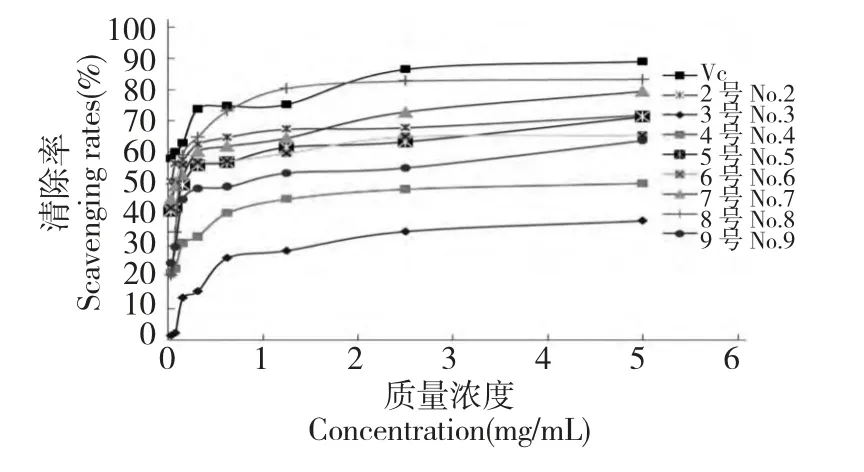
圖1 菌絲體甲醇總提物的不同極性部位對(duì)DPPH·的清除率Fig.1 DPPH· scavenging rates of different polar fractions of the total methanol extract from mycelium
3.4 菌絲體甲醇總提物各部位樣品對(duì)DPPH·清除活性IC50值的影響
由表2 可見(jiàn),萃取物或提取物對(duì)DPPH·清除活性IC50值順序?yàn)?甲醇提取物<VC<丙酮提取物<正丁醇部位<甲醇總提物<乙酸乙酯部位<水層剩余物<氯仿部位<石油醚部位。IC50越小說(shuō)明對(duì)DPPH·的清除效果越好,在各種提取物中,甲醇提取物的活性最強(qiáng)。IC50值最大的為石油醚提取物4.510 mg/mL。

表2 菌絲體甲醇總提物的不同極性部位對(duì)DPPH·清除活性的IC50值Table 2 IC50values of different polar fractions of the total methanol extract from mycelium in DPPH· assay

圖2 菌絲體甲醇總提物的不同極性部位對(duì)Fe3+還原力曲線Fig.2 Fe3+ reducing power curves of different polar fractions of the total methanol extract from mycelium
3.5 菌絲體甲醇總提物的不同極性部位對(duì)Fe3+還原力測(cè)定
由圖2 可看出,PFT-2 內(nèi)生真菌次級(jí)代謝產(chǎn)物的提取物對(duì)Fe3+具有較強(qiáng)的還原能力,其還原能力強(qiáng)弱為:甲醇提取物>丙酮提取物>正丁醇部位>甲醇總提物>VC>乙酸乙酯部位>水層剩余物>氯仿部位>石油醚部位。其中乙酸乙酯部位、水層剩余物、氯仿部位表現(xiàn)出與VC相當(dāng)?shù)倪€原能力,甲醇部位、丙酮提取物、正丁醇部位、甲醇總提物明顯強(qiáng)于VC;石油醚部位還原能力弱于VC。
4 結(jié)論
在DPPH·的清除實(shí)驗(yàn)中,從清除率及IC50來(lái)看,排風(fēng)藤PFT-2 內(nèi)生真菌的次級(jí)代謝產(chǎn)物中抗氧化物質(zhì)應(yīng)該主要是一些強(qiáng)極性物質(zhì),這些物質(zhì)容易被甲醇、正丁醇、丙酮等極性溶劑提取獲得,而氯仿、石油醚等溶劑提取所得的弱極性物質(zhì)活性很低或者不具活性。
在Fe3+還原力的測(cè)定實(shí)驗(yàn)中,排風(fēng)藤PFT-2 內(nèi)生真菌的次級(jí)代謝產(chǎn)物的提取物的還原力強(qiáng)弱順序?yàn)?甲醇提取物>丙酮提取物>正丁醇部位>甲醇總提物>VC>乙酸乙酯部位>水層剩余物>氯仿部位>石油醚部位,與DPPH·的清除實(shí)驗(yàn)所得結(jié)果基本一致。
DPPH·法和Fe3+還原力測(cè)定結(jié)果表明,排風(fēng)藤PFT-2 內(nèi)生真菌的次級(jí)代謝產(chǎn)物具有較強(qiáng)的清除DPPH·能力。排風(fēng)藤PFT-2 內(nèi)生真菌可大規(guī)模固體培養(yǎng),且培養(yǎng)基價(jià)格低廉,培養(yǎng)條件容易控制,其次生代謝產(chǎn)物有望開(kāi)發(fā)為天然抗氧化劑,并有可能開(kāi)發(fā)為活性抗氧化單體的天然來(lái)源。
1 Petrini O.Fungal endophytes of tree leaves.In:Microbial Ecology of Leaves (Eds Andrews JH,,Hirano SS).New York:Spring-Verlag,1991:179-197.
2 Kulnar D,Siva S,Cheung H,et al.In vitro studies of endophytic fungi from Triptreygium wilfordii with anti-proliferative activity on human peripheral blood mononuclear cells.J Ethnopharmacol,2004,94:295-300.
3 Wagellaar MM,Clardy J.Dicerandrols,new antibiotic and cytotoxic dimers produced by the fungus Phomopsis longicolla isolated from an endangered mint.Nat Prod Res,2001,64:1006-1009.
4 Sessitsch A,Reiter B,Berg G.Endophytic bacterial communities of field-grown potato plants and their plant-growth promoting and antagonistic abilities.Canadian J Microbiol,2004,50:239-249.
5 Zuo XM(左小明),Deng ZS(鄧張雙),Guo ZY(郭志勇),et al.Isolation and identification of chemical constituents of Solanum cathayanum.J Huazhong Norm Univ,Nat Sci(華中師范大學(xué)學(xué)報(bào),自科版),2012,3:322-323.
6 Fu SX(傅書(shū)遐).Flora of Hubei (湖北植物志).Wuhan:Hubei Science and Technology Press,2002.517-518.
7 Xie MX(謝明霞),Zhou Y(周媛),Zou K(鄒坤).Chemical constituents of Solanum cathayanum.J Chin Med Mater (中藥材),2008,31:1332-1334.
8 Xie MX(謝明霞),Wang JZ(汪鋆植),Zhou Y(周媛),et al.Protective effect of Solanum cathayanum extracts and compounds on acute liver injury.Pharm Clin Chin Mater Med(中藥藥理與臨床),2009,25(3):51-53.
9 Huang SL(黃少蘭),Dong WJ(董文娟),Xue YH(薛艷紅),et al.Protective effect of Solanum cathayanum alkaloid on H2O2induced SH-damage in SY5Y cells.Jiangsu J Tradit Chin Med(江蘇中醫(yī)藥),2011,9:90-93.
10 Su XP(蘇香萍),Hu GH(胡格華),Wu J(吳軍),et al.Isolation and antimicrobial activities of endophytic fungi in Solanum cathayanum.Lishizhen Med Mater Med Res(時(shí)珍國(guó)醫(yī)國(guó)藥),2012,6:337-339.
11 Guo XL(郭夏麗),Luo LP(羅麗萍),Leng TT(冷婷婷),etal.Chemical compositions and antioxidant activities of seven honeys from different floral sources.Nat Prod Res Dev(天然產(chǎn)物研究與開(kāi)發(fā)),2010,22:665-670.
12 Nie SP(聶少平),Xie MY(謝明勇),Luo Z(羅珍).Studies on antioxidant activity of tea polysaccharide.Nat Prod Res Dev(天然產(chǎn)物研究與開(kāi)發(fā)),2005,17:549-552.
13 Deng J(鄧靖),Mo ZC(莫正昌),Ji GQ(汲廣全),et al.Antioxidant activity of extract from Balanophora spicata Hayata in vitro.Food Scince(食品科學(xué)),2010,31(5):23-25.

