解淀粉芽孢桿菌BI2產抑菌物質的新型種衣劑的研制
王亞軍,李 昆,王德培,2
(1.天津科技大學生物工程學院,天津 300457;2.工業發酵微生物教育部重點實驗室,天津 300457)
目前對種子進行包衣處理是使種子免受黃曲霉等有害菌侵害的有效手段.迄今為止廣泛使用的種衣劑大部分是化學農藥類種衣劑,該種衣劑在防治有害菌的同時會有環境污染、病害菌抗藥性增加、種子本身殘留農藥成分等負面影響.生物種衣劑是利用拮抗微生物的代謝產物或拮抗微生物本身加工制成的種子包衣劑,它是將拮抗微生物或拮抗物質、成膜劑、助劑經特定工藝加工制成的,可直接包裹在種子表面,形成具有一定通透性的膜結構[1-2].生物種衣劑因其生物防治功能和零污染成為具有較好發展前景的一類種衣劑[3].解淀粉芽孢桿菌BI2是本實驗室從秸稈飼料中分離出的一株拮抗菌,其所產的兩種次級代謝產物對黃曲霉具有較強的抑制作用,其中抑菌物質A(已鑒定是表面活性素)對黃曲霉菌絲生長有顯著抑制作用,抑菌物質B(待鑒定)對黃曲霉孢子萌發具有較強抑制作用[4].另外,其抑菌物質對玉米小斑病菌、小麥紋枯病菌、水稻紋枯病菌等20 多種重要的植物病原性菌也具有較強的抑制作用[5].本研究探索BI2除菌發酵液凍干粉與研發出的成膜劑混合后作為一種新型種衣劑的可行性.
1 材料與方法
1.1 材料
解淀粉芽孢桿菌BI2(Bacillus amyloliquefaciens BI2)由本實驗室自秸稈飼料中分離得到,中國微生物菌種保藏管理委員會普通微生物中心保藏,保藏號:CGMCC No.3413;黃曲霉(Aspergillus flavus)由天津科技大學生化工程研究室保存;花生種子購自天津市康佳益農農作物種植專業合作社;羧甲基纖維素鈉(CMC-Na)、海藻酸鈉、殼聚糖購自上海紫一試劑廠;聚乙烯醇(PVA)、乙酸、次氯酸鈉購自天津市化學試劑廠;兩性霉素B 和制霉菌素購自上海生工生物工程有限公司.
1.2 方法
1.2.1 成膜劑配方的篩選
分別配制質量分數 1.5%,的羧甲基纖維素鈉(CMC-Na)溶液、1.5%,海藻酸鈉溶液、1.5%,殼聚糖溶液、4%,聚乙烯醇(PVA)溶液.同時配制復合型成膜劑溶液,選擇4%,聚乙烯醇與1.5%,羧甲基纖維素鈉分別以體積比3∶1、4∶1、5∶1、6∶1 的比例混合.根據其成膜性、透水性、水溶性和溶脹性等指標[6],篩選出最佳成膜劑.每個處理組3 個重復.
(1)成膜性測定:將等體積(1,mL)的各成膜劑溶液于干凈載玻片上流動成膜,置于30,℃下晾干.成膜性等級:Ⅰ級:能夠均勻成膜,載玻片在水中浸泡30,min 后,膜能從載玻片上完整刮下,表示成膜性好;Ⅱ級:能夠均勻成膜,載玻片在水中浸泡30,min后,膜不能從載玻片上完整刮下,表示成膜性中等;Ⅲ級:不能均勻成膜,表示成膜性差.
(2)透水性測定:將等體積(1,mL)的各成膜劑溶液涂布于圓形濾紙的表面并干燥.取干凈的培養皿蓋稱質量,將已干燥的濾紙折疊并放在培養皿蓋上,有成膜劑的一面朝下,吸取10,mL 蒸餾水放在濾紙片內,3,h 后稱取培養皿蓋的質量,計算涂抹不同成膜劑的濾紙片滲下水的質量.
(3)溶脹性測定:將等體積(1,mL)的各成膜劑溶液于干凈載玻片上流動成膜,干燥后取下稱質量,然后浸入水中,6,h 后取出并用濾紙吸去表面的水,再次稱質量,按照式(1)計算溶脹率,其中m 為膜濕質量;m0表示膜干質量.
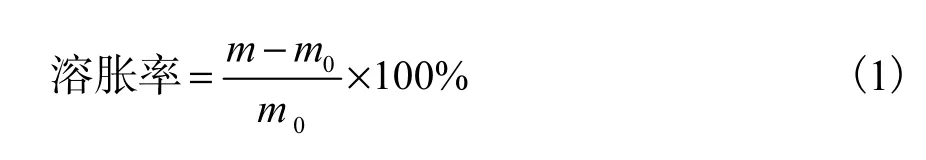
(4)水溶性測定:將等體積(1,mL)的各成膜劑溶液于干凈載玻片上流動成膜,干燥后浸入水中,20,h后計算載玻片上膜溶解的面積,并計算溶解面積的百分比.
1.2.2 成膜劑溶液的配制及除菌發酵液凍干粉的特性
發酵液經加熱離心除菌后連續過 30,000、10,000、5,000 超濾膜后再過400~600 納濾膜,均取透過液,經冷凍干燥得到凍干粉.成膜劑按最佳配方進行配制,實驗組加入不同質量的凍干粉,制成含抑菌物質的種子包衣后,包衣種子,對照組不加抑菌物質.每個處理組3 個重復.
(1)發酵液凍干粉的pH 穩定性:將發酵液凍干粉溶于水,使其質量濃度為100,mg/mL,pH 分別用HCl 和NaOH 調至5、6、8、10、12,處理12,h 后調回原pH 8.5,牛津杯法[7]測定各組的抑菌活性.未經處理的發酵液為對照,置于30,℃培養36,h,用十字交叉法測量抑菌圈直徑.
(2)發酵液凍干粉的熱穩定性:將發酵液凍干粉溶于水,使其質量濃度為100,mg/mL,分別在50、60、70、80、90、100,℃處理 30,min,121,℃處理20,min,牛津杯法測定各組的抑菌活性.未經處理的發酵液為對照,置于30,℃培養36,h,用十字交叉法測量抑菌圈直徑.
1.2.3 除菌發酵液凍干粉的最小抑菌質量濃度
除菌發酵液凍干粉的最小抑菌濃度采用96 孔板法[8]測定.用生理鹽水將PDA 斜面上的黃曲霉孢子洗下.在孔中加入4×106,mL-1的孢子懸液100,μL,然后在孔中分別加入不同質量濃度的除菌發酵液凍干粉溶液各 100,μL,使其終質量濃度為 0.38~19.15,mg/mL;陰性對照為100,μL 無菌水,陽性對照為50,μg/mL 兩性霉素B,每個處理組設3 個平行.將96 孔板置于30,℃培養48,h 后,用酶標儀測定孔板透光率,孔板透光率沒有變化且孔中無可見黃曲霉孢子萌發的濃度視為最小抑菌質量濃度.
1.2.4 種子包衣方法
稱取形狀規則、飽滿的花生種子15,g,用1%,次氯酸鈉消毒,并用無菌水洗滌晾干置于250,mL 三角瓶中,吸取成膜劑溶液3,mL,注入三角瓶中并不斷搖動,用玻璃棒攪拌種子防止種子粘連,放置30,min,使其在種子表面固化成膜[9].
1.2.5 包衣種子萌發試驗
將包衣后花生種子在40,℃左右的溫水中浸泡2~4,h,取出后放入干凈培養皿中,用6 層紗布蓋好,置于25,℃培養,使其萌發,每天噴淋等量溫水2 次,保持花生種子濕潤,每個處理3 個重復,每個重復50粒種子.以同濃度成膜劑包衣的種子和未包衣種子為對照.發芽勢和發芽率按照式(2)、(3)計算.

1.2.6 種子包衣的抗黃曲霉效果
按照1.2.4 方法,在各個三角瓶中分別加入含有不同含量抑菌物質的成膜劑溶液3,mL,使除菌發酵液凍干粉的質量分數分別為1、2、3、4、5,mg/mL,10,mg/mL 的制霉菌素與成膜劑混合后涂布的種子為陽性對照,未加抑菌物質包衣后種子和未包衣種子為空白對照,再分別在各個三角瓶中加入2×104,mL-1黃曲霉孢子200,μL,后向各三角瓶中噴灑10,mL PDA 液體培養基,充分搖動三角瓶使黃曲霉孢子分散均勻,30,℃培養,觀察黃曲霉生長情況[10].
1.2.7 數據統計分析
采用SPSS 19.0 中的方差分析程序(ANOVA)分析各實驗部分的差異,在圖中以不同字母表示不同處理組之間具有顯著差異(P<0.05).
2 結果與分析
2.1 最佳成膜劑的篩選
實驗表明羧甲基纖維素鈉(CMC-Na)和海藻酸鈉成膜性較差;聚乙烯醇(PVA)溶脹性較差;殼聚糖具有較好的成膜性、耐水性,但透水性、溶脹性較差.將聚乙烯醇與羧甲基纖維素鈉以一定比例混合后,其溶脹性提高,因此本研究將聚乙烯醇與羧甲基纖維素鈉以不同比例混合,與其他待試成膜劑一起測定其各種性能指標.成膜劑的配方:A 為4%,PVA 溶液,B 為1.5%,殼聚糖溶液,C、D、E、F 分別為4%,PVA 與1.5%,CMC-Na 以體積比3∶1、4∶1、5∶1、6∶1 的混合溶液.在圖中以不同字母表示不同處理組之間具有顯著差異(P<0.05).
圖1 為成膜劑的透水性測定結果.從圖1 中可以看出,配方E 和配方F 的透水性相差不大,但透水性比其他各組效果明顯提高.
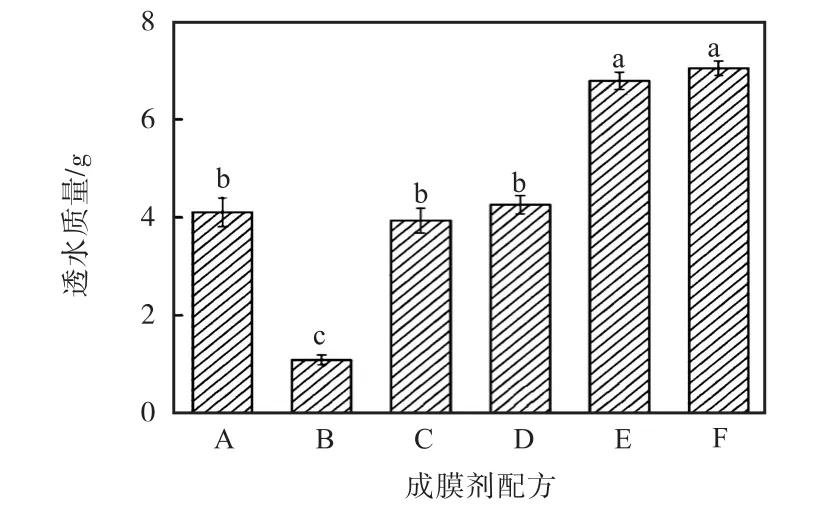
圖1 成膜劑的透水性測定結果Fig.1 Water permeability of the film former
圖2 為成膜劑的溶脹性測定結果.從圖2 中可以看出:配方A 和配方B 的溶脹率不大,其中配方B的溶脹率最低,為70.82%,.復合型成膜劑的溶脹率均較高,其中配方 C、D、E 的溶脹率分別為188.08%,、180.22%,和175.91%,.
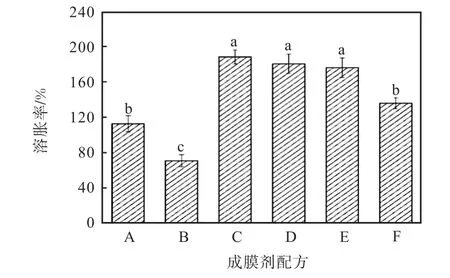
圖2 成膜劑的溶脹率測定結果Fig.2 Swelling ratio of the film former
圖3 為成膜劑的水溶性測定結果.從圖3 中可以看出:配方A 和配方B 的耐水性非常好.復合型成膜劑配方C 和配方D 的耐水性較差;配方E 和配方F 的耐水性較好.
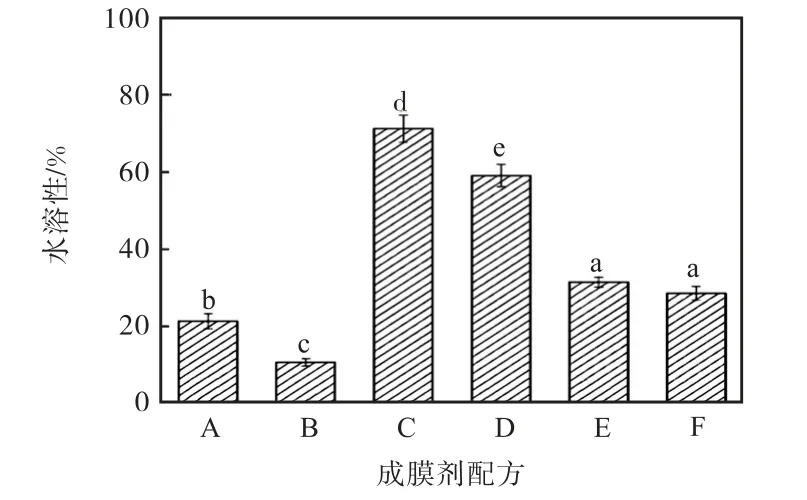
圖3 成膜劑的水溶性測定結果Fig.3 Water solubility of the film former
從成膜劑的成膜性、透水性、溶脹性和溶水性綜合考慮,配方E(4%,聚乙烯醇與1.5%,羧甲基纖維素鈉以體積比5∶1 混合配制成的成膜劑)綜合性能優于其他成膜劑配方,因此選擇其作為種子包衣的最佳成膜劑配方.
2.2 除菌發酵液凍干粉的特性
除菌發酵液凍干粉的pH 穩定性和熱穩定性如圖4 和圖5 所示.從圖4 中可以看出除菌發酵液凍干粉在酸性條件下不穩定,在pH 為6~12 條件下比較穩定.
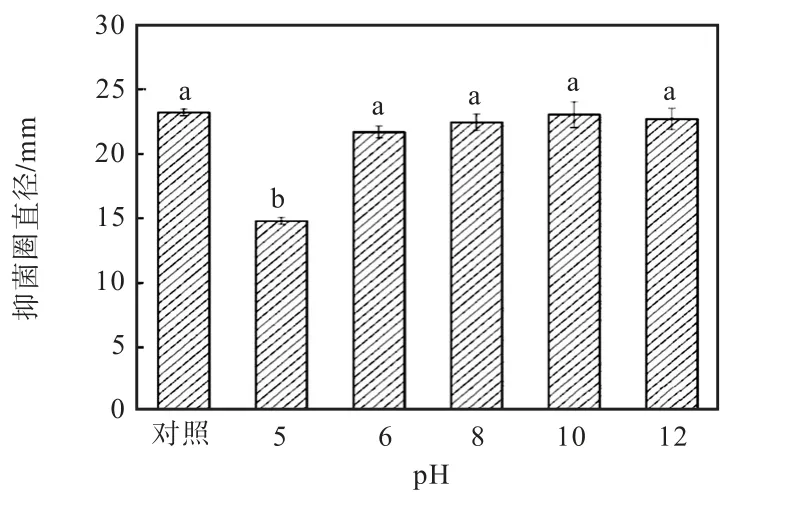
圖4 發酵液凍干粉的pH穩定性Fig.4 The pH stability of the lyophilized powder of the fermentated broth
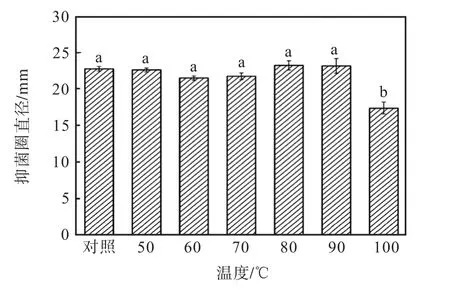
圖5 發酵液凍干粉的熱穩定性Fig.5 The thermal stability of the lyophilized powder of the fermentated broth
從圖5 中可以看出除菌發酵液凍干粉在50~90,℃處理30,min,抑菌活性保持不變;在100,℃處理30,min,抑菌活性下降24.4%,;說明其具有較強的熱穩定性.
2.3 除菌發酵液凍干粉最小抑菌濃度
發酵液凍干粉最小抑菌濃度實驗結果如圖6 所示.當發酵液凍干粉質量濃度低于1.92,mg/mL 時,透光率下降,可看到黃曲霉的生長,且隨著除菌發酵液凍干粉濃度的降低,黃曲霉的生長逐漸旺盛;當除菌發酵液凍干粉質量濃度高于1.92,mg/mL 時,無黃曲霉孢子萌發.因此,除菌發酵液凍干粉對黃曲霉的最小抑菌質量濃度為1.92,mg/mL.

圖6 發酵液凍干粉的最小抑菌濃度Fig.6 MIC of the lyophilized powder of the fermentated broth
2.4 包衣對種子萌發的影響
不同處理方法對種子萌發的影響見表1.從表1可以看出,經種子包衣后,花生種子在發芽勢和發芽率指標方面,與對照組間無顯著差異,說明經此成膜劑包衣后不會影響種子的發芽勢和發芽率.
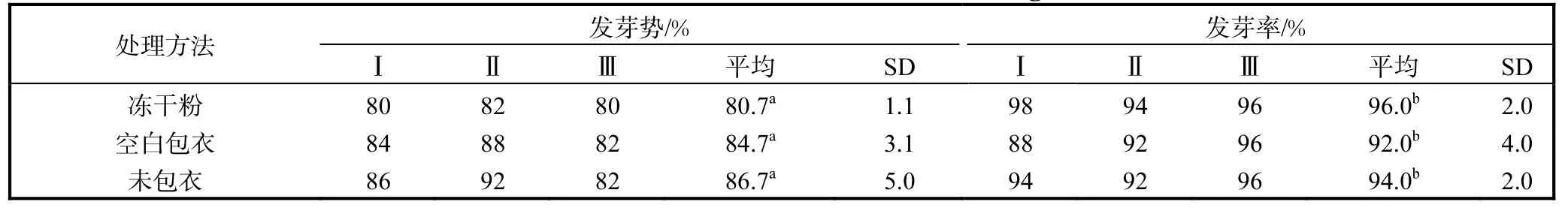
表1 不同處理方法對種子萌發的影響Tab.1 The effect of the different treatment on seed germination
2.5 種子包衣的抗黃曲霉效果
種子包衣的抗黃曲霉效果如圖7 所示.從圖7中可見:黃曲霉在沒有任何抑菌物質存在時生長旺盛(圖7,G、H);在有較低質量濃度抑菌物質存在時,黃曲霉生長受到一定抑制;隨著除菌發酵液凍干粉在成膜劑溶液中質量濃度的增加,黃曲霉的生長量逐漸減少,當除菌發酵液凍干粉質量濃度達到4,mg/mL(圖7,D)時,沒有黃曲霉生長,與制霉菌素溶液包衣種子的抑菌效果相近.
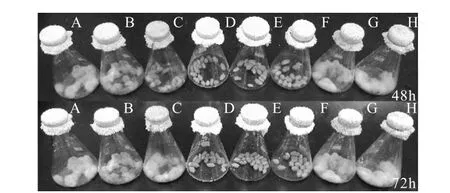
圖7 種子包衣抑制黃曲霉的效果Fig.7 The inhibitory effect of seed coating on Aspergillus flavus
3 討論
芽孢桿菌BI2是一株廣譜拮抗菌株,能夠抑制20多種植物病原菌[12],本研究期望利用芽孢桿菌BI2發酵液中具有高效抑菌能力的抑菌物質,旨在開發一種新型環保生物種衣劑,實現防止種子霉變的目的.與化學農藥種衣劑相比,微生物種衣劑尤其是在其次級代謝產物作為有效成分時,對包衣后的成膜性等要求很高[13].經過成膜劑配方的配制實驗,最終選擇4%,聚乙烯醇與1.5%,羧甲基纖維素鈉以體積比5∶1 混合配制成的成膜劑作為種子包衣的最佳成膜劑配方,以此比例混合配制成的成膜劑,綜合性能優于其他成膜劑配方,并且對包衣后花生種子的發芽勢和發芽率沒有顯著影響.含有抑菌物質的發酵液凍干粉pH 穩定性、熱穩定性均較好,可適用于種子包衣中.在抑制黃曲霉孢子萌發方面,抑制黃曲霉孢子萌發的最小質量濃度為1.92,mg/mL.在抑制花生種子表面的黃曲霉時,隨著發酵液凍干粉質量濃度的增加,黃曲霉的生長量逐漸減少,成膜劑中最小發酵液凍干粉的含量只有4,mg/mL.目前用芽孢桿菌菌劑包衣種子防治植物病害菌方面的報道仍較少,一種新型環保生物種衣劑需要考慮多方面的因素,比如殺菌效能、對人體的危害性、殘留量等.吳繼星等[14]以蘇云金芽孢桿菌(B.thuringiensis)為活性成分研制出一種生物種衣劑,不僅能防治大豆孢囊線蟲病且能促進大豆生長.李春等[15]利用根瘤菌、固氮菌等有益微生物作為活性成分,研制出一種能防治棉花苗期病害、促進棉花生長及增強棉花在鹽脅迫下生長能力的多功能生物種衣劑.本研究中芽孢桿菌種衣劑的活性成分自菌體發酵產生,與化學農藥類種衣劑相比具有易于生產、成本低、環保無毒等優點.本研究研制的新型種衣劑為菌株和生防制劑的進一步研究和發展提供了優良的資源,有望在種子及生防領域得到應用.
[1]Ziani K,Ursúa B,Maté J I.Application of bioactive coatings based on chitosan for artichoke seed protection[J].Crop Protection,2010,29(8):853-859.
[2]Hirano S,Yamamoto T,Hayashi M,et al.Chitinase activity in seeds coated with chitosan derivatives[J].Agricultural and Biological Chemistry,1990,54(10):2719-2720.
[3]張琦,徐寧彤,曲琪環.生物復合型種衣劑對香谷苗期生理指標的影響[J].安徽農業科學,2010,38(30):16746-16747,16750.
[4]王德培,李可樂,王亞軍,等.解淀粉芽孢桿菌BI2抗真菌活性物質的分離純化及特性分析[J].食品工業科技,2013(11):78-81.
[5]孟慧.芽孢桿菌BI2的鑒定及其抑制黃曲霉特性的研究[D].天津:天津科技大學,2011.
[6]楊樺.種衣劑在林木種子上應用及殼聚糖作為種衣劑抗性添加劑的研究[D].雅安:四川農業大學,2008.
[7]劉冬梅,李理,楊曉泉,等.用牛津杯法測定益生菌的抑菌活力[J].食品研究與開發,2006,27(3):110-111.
[8]胡小平,喆萬,李若瑜.應用CLSI M38-A2 方案測定須癬毛癬菌對抗真菌藥物敏感性[J].中國真菌學雜志,2011,6(3):149-153.
[9]董麗萍,浦恩堂,吳毅歆,等.解淀粉芽孢桿菌B9601-Y2 復方油菜種衣劑的研制[J].云南大學學報:自然科學版,2013,35(4):558-564.
[10]Zhang Ting,Shi Zhiqi,Hu Liangbin,et al.Antifungal compounds from Bacillus subtilis B-FS06 inhibiting the growth of Aspergillus flavus[J].World Journal of Microbiology and Biotechnology,2008,24(6):783-788.
[11]肖琴.新型環保型棉花種衣劑的研制與應用研究[D].武漢:武漢理工大學,2008.
[12]王德培,孟慧,管敘龍,等.解淀粉芽孢桿菌BI2的鑒定及其對黃曲霉的抑制作用[J].天津科技大學學報,2010,25(6):5-9.
[13]姚麗霞,武占省,李春.一種復合型成膜劑的成膜性能測定及其對生防菌抑菌活性的影響[J].農藥學學報,2009,11(3):381-387.
[14]吳繼星,陳在佴,曹春霞,等.蘇云金桿菌懸浮種衣劑:中國,1849890A[P].2006-04-06.
[15]李春,姚麗霞,陶晶,等.一種多功能生物種衣劑及制備方法:中國,101444227A[P].2009-01-09.

