經典及改進的CUPRAC 法在多組分抗氧化劑活性研究中的應用
李 輝,王曉飛,焦海勝
1蘭州大學藥學院,蘭州 730000;2 蘭州大學第二醫院藥學部,蘭州 730030
20 世紀80 年代以后,隨著分子生物學和醫學的發展,人們對生物體中包含的大量自由基反應及其對人體產生的危害有了越來越多的認識。機體內的抗氧化防御系統一旦失衡,就會產生氧化損傷,進而導致細胞活力下降、機體衰老、血管病變、細胞癌變、糖尿病及并發癥等80 余種疾病[1-3]。減少機體氧化損傷的最有效方法是補充抗氧化劑。為了測定抗氧化劑活性,建立了多種方法。根據反應機制的不同可將這些方法分為兩種,即基于質子轉移(TRAP 法和ORAC 法)和基于電子轉移(DPPH 法、ABTS 法和FRAP 法)的方法[4,5]。TRAP 法以不穩定的氧化電極作為反應終點指示劑,由于各抗氧化劑的反應終點不同,因此各個實驗室缺乏可比性。ORAC 法選用的熒光探針為β-藻紅蛋白,不同批次的熒光探針差別很大[6],此外,檢測對溫度、氧化劑、熒光標記物和樣品濃度較為敏感[7],重復性較差。DPPH 法所用的DPPH·試劑溶于親脂性溶劑,其只可以用于檢測親脂性抗氧化劑的抗氧化活性[8],且其在溶液中對光、空氣中的氧及pH 值敏感,不能很好的反映抗氧化物質的活性[7]。ABTS法所選用的ABTS·+雖然既溶于親水性溶劑又溶于親脂性溶劑,但由于其是以氮為中心的自由基,空間位阻較大,與抗氧化活性物質酚類聚合物反應的速率較慢[9]。FRAP 法測定環境pH3.6,其所處的環境與體液不同,此外由于FRAP 屬于電子轉移(SET)反應,其不能測定氫轉移(HET)的起作用的物質,尤其是巰基和蛋白,如谷胱甘肽[10]。由于這些方法存在的缺點,需要聯合采用多種方法反映多組分混合物的總抗氧化活性[11]。為了克服以上缺點,Apark R 等建立了CUPRAC 方法用于測定多組分混合物的抗氧化活性。通過改進本方法,可用于同時測定親脂性和親水性抗氧化劑活性、檢測維生素C 和黃酮類化合物混合物中維生素C 含量、篩選多組分中抗氧化劑等。本文綜述了經典及改進的CUPRAC 法在多組分抗氧化劑活性研究中的應用,同時探討了其優點和不足。
1 經典的CUPRAC 法
經典的CUPRAC 法由土耳其伊斯坦布爾大學Apark R 課題組首次建立[12],所選用的試劑為CuCl2-新亞銅靈(Nc)試劑。其反應原理如圖1 所示。

圖1 CUPRAC 法反應原理Fig.1 Reaction principle of CUPRAC method
在CuCl2溶液中依次加入NH4Ac 緩沖溶液(pH7.0)、Nc 溶液,生成Cu2+-Nc,顯淡藍色。加入抗氧化劑后其與Cu2+-Nc 反應生成Cu+-Nc 和H+,其中Cu+-Nc 顯黃色在450 nm 處有最大吸收,H+被NH4Ac 緩沖溶液中和[13]。Cu2+-Nc/Cu+-Nc 的氧化還原電位(0.7V)比Cu2+/Cu+的氧化還原電位(0.16V)高,因此多酚類抗氧化劑與Cu2+-Nc/Cu+-Nc 的反應比與Cu2+/Cu+的快[13]。
Apark R 等指出經典的CUPRAC 法測定抗氧化劑時,測定條件(混合時間、混合溫度、溶媒pH)對檢測結果影響較大[12,14]。研究表明,當室溫下混合30 min 時,一些與Cu2+-Nc 反應較快的抗氧化劑(如維生素C、沒食子酸和槲皮素),采用CUPRAC法測定的抗氧化活性與實際較一致;而50 ℃混合20 min 時,一些與Cu2+-Nc 反應較慢的抗氧化劑(如柚皮苷、柚皮素、尿酸和膽紅素),采用CUPRAC法測定的抗氧化活性與實際較一致;黃酮苷類抗氧化劑,水解后采用CUPRAC 法測定的抗氧化活性與實際較一致[12,14]。此外,Celik SE 等還研究了溶劑對CUPRAC 法檢測結果的影響[15],研究結果表明,不論何種抗氧化劑(親脂性和親水性)的抗氧化活性均可采用CUPRAC 法在極性和非極性溶劑中進行測定,采用CUPRAC 法測定的抗氧化活性隨著溶劑的溶解性、介電常數及類型的變化而變化,但在乙醇/水溶液中其隨溶劑的溶解性、介電常數的變化較小。同時,Apark R 等指出在采用CUPRAC 法測定多組分抗氧化劑時,需要采用氮氣排除溶液中的氧氣,以免其中的氧氣影響檢測結果;由于CuCl2-Nc試劑與抗氧化單體的反應速度比氧氣快,因此在測定抗氧化單體時則不需要排除溶液中的氧氣[13]。
經典的CUPRAC 法在多組分抗氧化活性測定中的應用見表1。
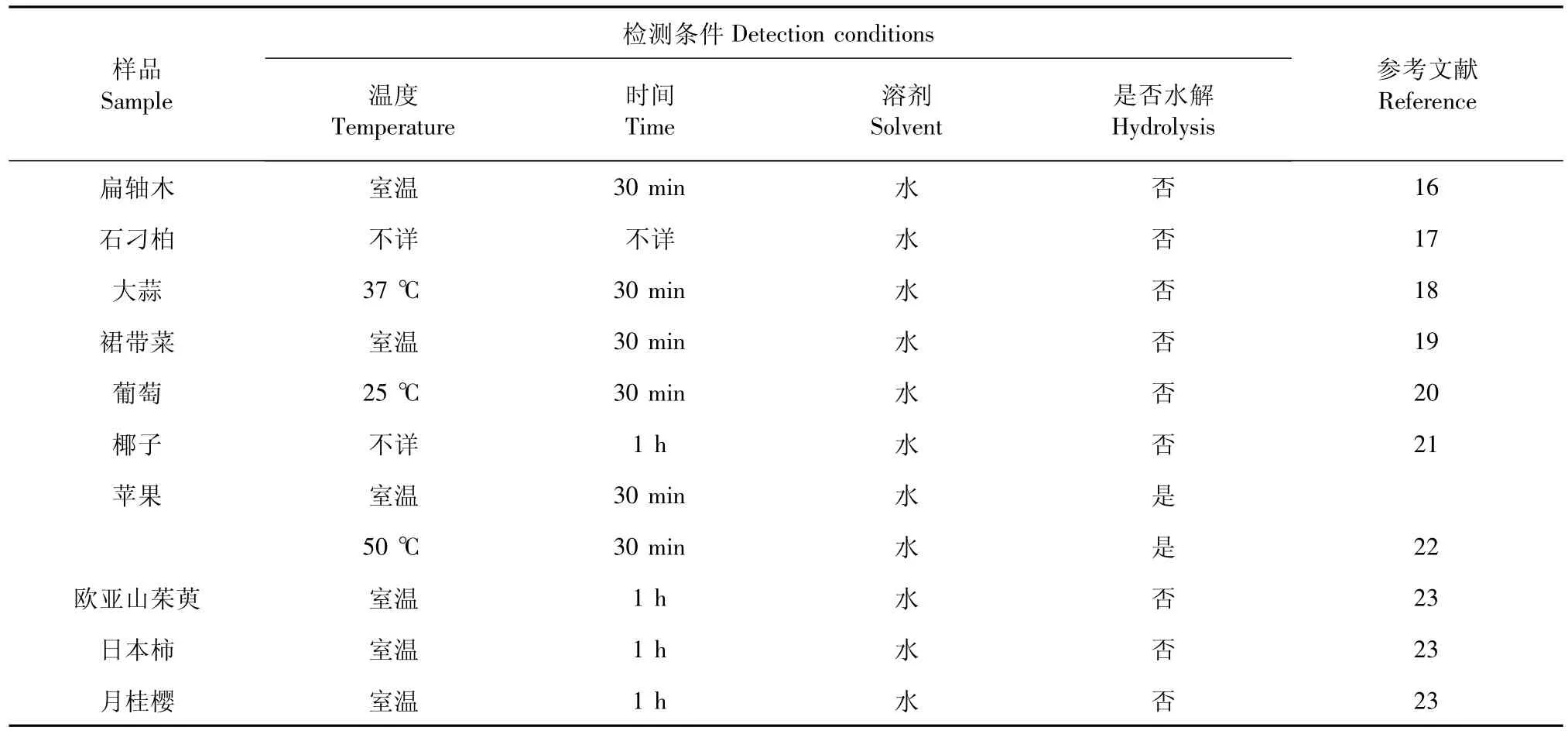
表1 經典的CUPRAC 法在多組分抗氧化活性測定中的應用Table 1 The application of main CUPRAC method in determination of antioxidant activity of multicomponent
2 改進的CUPRAC 法
2.1 同時測定親脂性和親水性抗氧化劑活性的CUPRAC 法
采用CUPRAC 法的測定抗氧化活性隨著溶劑的溶解性、介電常數及類型的變化而變化,由于不同抗氧化劑(親脂性和親水性)在溶劑中的溶解性不同,因此很難采用CUPRAC 法在同一溶劑中同時測定親脂性和親水性抗氧化劑的抗氧化活性。為了克服以上缺點,?zyürek M[24]等對CUPRAC 法進行了改進,改進的措施包括采用溶有甲基-β-環糊精的丙酮-水(1∶9,v/v)溶液溶解樣品,由于有甲基-β-環糊精呈筒狀結構,其兩端與外部為親水性,而筒的內部為疏水性,其借 范德華力將一些大小和形狀合適的親脂性抗氧化劑包含于筒狀結構中,增加親脂性抗氧化劑在丙酮-水(1∶9,v/v)溶液的溶解性。此外,他們還對甲基-β-環糊精在丙酮-水(1∶9,v/v)溶液中的濃度進行了優化,研究結果表明,當甲基-β-環糊精在丙酮-水(1∶9,v/v)溶液中的濃度為2%時測定結果最好。
2.2 用于檢測維生素C 和黃酮類化合物混合物中維生素C 含量的CUPRAC 法
采用CUPRAC 法的測定抗氧化活性時,多種抗氧化劑均能與Cu2+-Nc 反應,生成Cu+-Nc,在450 nm 處有最大吸收。因此,在測定抗氧化劑維生素C的含量時,其他抗氧化劑(如黃酮類化合物)會產生干擾。為了測定抗氧化劑維生素C 的含量,?zyürek M[25]等對CUPRAC 法進行了改進以便排除黃酮類化合物的干擾。改進的措施包括在待測樣品中加入LaCl3溶液,然后采用乙酸乙酯萃取,由于La3+與黃酮類化合物反應,生成La3+-黃酮類化合物復合物,該復合物溶于水,采用乙酸乙酯萃取后,維生素C可富集與有機相中。此外?zyürek M[25]等還研究了排除蘆丁干擾的方法。蘆丁由于其具有3-O-蕓香糖基團,不能與LaCl3反應,因此再加入LaCl3溶液之前,須對待測樣品進行水解。
2.3 用于篩選多組分中抗氧化劑的CUPRAC 法
經典的CUPRAC 法只能測定多組分抗氧化劑的抗氧化活性,不能篩選多組分中的抗氧化劑。為了篩選多組分成分中的抗氧化劑,Celik SE[26]等建立了在線HPLC-柱后CUPRAC 法用于篩選多組分中的抗氧化劑。其篩選系統結構如圖2 所示。

圖2 在線HPLC-柱后CUPRAC 法技術篩選多組分中抗氧化劑系統結構[26]Fig.2 Flow chart of screening the antioxidant compounds from multicomponent by HPLC-CUPRAC assays [26]
在該方法中,天然產物經HPLC 分離,流出物在柱后進入活性檢測單元與Cu2+-Nc 作用后,利用作用前后在517 nm 處吸光度的變化,即作用后在色譜圖中形成倒峰,進行抗氧化劑的篩選。此外,Celik SE[26]等還對Cu2+-Nc 的濃度及流速進行了優化,研究結果表明,在篩選維生素E 時,Cu2+-Nc 的濃度為3.33 mmol/L Cu2+/2.5 mmol/L Nc/333 mmol/L NH4Ac、Cu2+-Nc 的流速為0.5 mL/min 時,篩選靈敏度最高。
2.4 用于測定抗氧化劑羥自由基清除活性的CUPRAC 法
羥自由基與某些疾病及衰老有著密切的關系,為了測定水溶性抗氧化劑羥自由基清除活性,Bektaso?lu B[27]對CUPRAC 法進行了改進。在改進的CUPRAC 法中,羥自由基由Fe2+-EDTA 與過氧化氫反應生成,以2,4-二甲氧基苯甲酸、3,5-二甲氧基苯甲酸或p-氨基苯甲酸為探針物質,當加入抗氧化劑時,抗氧化劑與探針物質競爭性的與羥自由基反應,反應2 h 后,加入HCl 終止反應,其中由探針物質與羥自由基反應生成的羥基化探針物質由乙酸乙酯富集于有機相,其可以與Cu2+-Nc 反應,生成Cu+-Nc,在450 nm 處有吸收。通過測定A0/A 可以反應水溶性抗氧化劑羥自由基清除活性,其中A0為未加入抗氧化劑時的吸光度;A 為加入抗氧化劑的吸光度。
另一種測定氧化劑羥自由基清除活性的CUPRAC 法 由?zyürek M[28]等 建 立。該 方 法 與Bektaso?lu B 建立的方法相比較,其采用水楊酸作為探針物質,加入抗氧化劑時,抗氧化劑與探針物質競爭性的與羥自由基反應,反應10 min 后,加入過氧化氫酶與過量的過氧化氫反應,以減少過氧化氫產生的干擾。
2.5 用于測定抗氧化劑黃嘌呤氧化酶抑制活性的CUPRAC 法
?zyürek M[29]等對CUPRAC 法進行了改進用于測定多酚及黃酮類化合物黃嘌呤氧化酶抑制活性。在改進的方法中黃嘌呤在黃嘌呤氧化酶的催化下于37 ℃反應30 min,生成尿酸與過氧化氫,尿酸與過氧化氫均能與Cu2+-Nc 反應,生成Cu+-Nc,在450 nm 處有吸收。當加入抗氧化劑時,抗氧化劑由于具有黃嘌呤氧化酶抑制活性,抑制了生成尿酸與過氧化氫的生成,進而抑制了450 nm 處的吸收。因而1-A0/A 可以表示抗氧化劑的黃嘌呤氧化酶抑制活性。其中A0為未加入抗氧化劑時的吸光度;A 為加入抗氧化劑的吸光度。此外,?zyürek[29]等還對溶液pH及反應時間進行了優化,研究結果表明,當溶液pH值在6-9,反應時間為30 min 時,測定結果最好。
2.6 用于測定抗氧化劑過氧化氫清除活性的CUPRAC 法
?zyürek M[30]等對CUPRAC 法進行了改進用于測定多酚及黃酮類化合物過氧化氫清除活性。在改進的方法中過氧化氫可與Cu2+-Nc 反應,生成Cu+-Nc,在450 nm 處有吸收;當加入抗氧化劑時,在氯化銅的催化下,過氧化氫首先與抗氧化劑反應。因此通過測定以下三種溶液與Cu2+-Nc 反應的吸光度值:a) H2O2+CuCl2;b) H2O2+CuCl2+抗氧化劑;c) H2O2+CuCl2+抗氧化劑+過氧化氫酶,以[A0-(A1-A2)]/A0表示抗氧化劑的過氧化氫清除活性,其中A0為溶液a 與Cu2+-Nc 反應的吸光度值;A1為溶液b 與Cu2+-Nc 反應的吸光度值;A2為溶液c 與Cu2+-Nc 反應的吸光度值。此外?zyürek M[30]等還優化了溶液a、b、c 混合時間,研究表明,混合30 min后,其與Cu2+-Nc 反應的吸光度值趨于穩定。
2.7 用于測定含巰基蛋白抗氧化活性的CUPRAC法
?eki? SE[31]等對CUPRAC 法進行了改進用于測定含巰基蛋白的抗氧化活性。該方法與經典的CUPRAC 法比較,由于NH4Ac 緩沖溶液可使蛋白沉淀,其采用了尿素緩沖溶液取代NH4Ac 緩沖溶液。
2.8 用于測定多組分抗氧化活性的基于CUPRAC法的光學感應器
為了將CUPRAC 法制作成便于攜帶的檢測試劑盒,Benner M[32]等發明了基于CUPRAC 法的光學感應器。該感應器的制作方法如下:首先將聚四氟乙烯離子交換薄膜浸泡于2 mL 的1.0 ×10-2mol/LCuCl2-Nc+2 mL 的7.5 ×10-3mol/L Nc +2 mL 的1.0 mol/L NH4A+2.2 mL 的H2O 中,搖動30 min,取出聚四氟乙烯薄膜,即得基于CUPRAC 法的光學感應器。該感應器測定多組分抗氧化活性的過程如下:將該感應器置于所測多組分的乙醇溶液中搖動30 min 以生成Cu+-Nc,然后將光學感應器置于盛有水的比色皿中,以防止感應器附著于比色皿壁上,于450 nm 處檢測。
3 結論
由于抗氧化反應的復雜性和多樣性,目前測定物質抗氧化活性的方法雖然很多,但還沒有統一的標準的測定方法和和測定參數,相信隨著CUPRAC法的引進,CUPRAC 法與其他抗氧化活性測定方法的聯合應用能更加準確的反映多組分抗氧化劑的活性。
此外,經典和改進CUPRAC 法多用于抗氧化活性的測定,其在多組分物質中抗氧化劑篩選方面的研究較少。目前文獻報道的有以Cu2+-Nc 為活性檢測試劑的HPLC-柱后生物活性檢測在線聯用技術,由于該方法需要對HPLC 儀器進行改裝,該裝置目前尚未商品化。相信以的Cu2+-Nc 為顯影試劑的TLC 自顯影技術將會應用于多組分物質中抗氧化劑的篩選。
1 Valko M,et al.Free radical and antioxidants in normal physiological functions and human disease.Int.J Biochem.Cell Biol,2007,39:44-84.
2 Ames BN,Gold LS.Endogenous mutagens and the causes of aging and cancer.Mutat Res,1991,250 (1-2):3-16.
3 Mayne ST.Antioxidant nutrients and chronic disease:use of biomarkers of exposure and oxidative stress status in epidemiologic research.J Nutri,2003,133:933-940.
4 Huang D,et al.The chemistry behind antioxidant capacity assays.J Agric Food Chem,2005,53:1841-1856.
5 Prior RL,et al.Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements.J Agric Food Chem,2005,53:4290-4302.
6 Ou B,et al.Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe.J Agric Food Chem,2001,49:4619-4626.
7 Schaich KM.Critical considerations in ORAC,TRAP,ABTS/TEAC and DPPH assay of antiradical action.Plenary Lecture,International Workshop on Antioxidant Measurement Assay Methods,Istanbul University,Istanbul.Turkey.
8 Ozcelik B,et al.Effects of light,oxygen,and pH on the absorbance of 2,2-Diphenyl-1-picrylhydrayl.J Food Sci,2003,68:487-490.
9 Lee JH,et al.Electron donation mechanisms of beta-carotene as a free radical scavenger.J Food Sci,2003,68:861-865.
10 Apark R,et al.Comparative evaluation of various total antioxidant capacity assays applied to phenolic compounds with the CUPRAC assay.Molecules,2007,12:1496-1547.
11 Prior RL,et al.Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements.J Agric Food Chem,2005,53:4290-4302.
12 Apark R,et al.Noval total antioxidant capacity index for dietary polyphenols and Vitamins C and E,using their cupric ion reducing capability in the presence of Neocuproine:CUPRAC method.J Agric Food Chem,2004,5:7970-7981.
13 Apark R,et al.Mechanism of antioxidant capacity assay and the CUPRAC (cupric ion reducing antioxidant capacity) assay.Microchim Acta,2008,160:413-419.
14 Apark R,et al.Total antioxidant capacity assay of human serum using copper (Ⅱ)-neocuproine as chromogenic oxidant:The CUPRAC method.Free Radic Res,2005,39:949-961.
15 ?elik SE,et al.Solvent effects on the antioxidant capacity of lipophilic and hydrophilic antioxidants measured by CUPRAC,ABTS/persulphate and FRAP method.Talanta,2010,81:1300-1309.
16 Sonia A,Adarsh PV.Preliminary phytochemical screening and in vitro antioxidant activities of Parkinsonia aculeate Linn.Biomed Res Int,DOI:10.1155/2014/756184.
17 Lee JW,et al.Bioactive compounds,antioxidant and binding activities and spear yield of Asparagus officinalis L.Plant Foods Hum Nutri,2014,69:175-181.
18 Chen S,et al.Evaluation of garlic cultivars for polyphenolic content and antioxidant properties.PLoS One,2013,8:e79730.
19 Fung A,et al.Fucoxanthin content and antioxidant properties of Undaria pinnatifida.Food Chem,2013,136:1055-1062.
20 González-Centeno MR,et al.Proanthocyanidin composition and antioxidant potential of the stem winemaking byproducts from 10 different grape varieties (Vitis vinifera L.).J Agric Food Chem,2012,60:11850-11858.
21 Oliveira MB,et al.Cocos nucifera Linn.(Palmae) husk fiber ethanolic extract:antioxidant capacity and electrochemical in-vestigation.Comb Chem High Throughput Screen,2013,16:121-129.
22 Karaman S,et al.Comparison of antioxidant capacity and phenolic composition of peel and flesh of some apple varieties.J Sci Food Agric,2013,93:867-875.
23 Celep E,et al.A comparative study on the in vitro antioxidant potentials of three edible fruits:cornelian cherry,Japanese persimmon and cherry laurel.Food Chem Toxicol,2012,50:3329-3335.
24 ?zyürek M,et al.Simultaneous total antioxidant capacity assay of lipophilic and hydrophilic antioxidants in the same actone-water solution containing 2% methyl-β-cyclodextrin using the cupric reducing antioxidant capacity (CUPRAC)method.Anal Chim Acta,2008,630:28-39.
25 ?zyürek M,et al.Spectrophotometric determination of ascorbic acid by the modified CUPRAC method with extractive separation of flavonoids-La (III) complexs.Anal Chim Acta,2007,588:88-95.
26 ?elik SE,et al.Determination of antioxidants by a noval online HPLC-cupric reducing antioxidant capacity (CUPRAC)assay with post-column detection.Anal Chim Acta,2010,674:79-88.
27 Bektaso?lu B,et al.Novel hydroxyl radical scavenging antioxidant activity assay for water-soluble antioxidants using modified CUPRAC method.Biochem Biophys Res Commun,2006,345:1194-1200.
28 ?zyürek M,et al.Hydroxyl radial scavenging assay of phenolics and flavonoids with a modified cupric reducing antioxidant capacity (CUPRAC) method using catalase for hydrogen peroxide degradation.Anal Chim Acta,2008,616:196-206.
29 ?zyürek M,et al.Measurement of xanthine oxidase inhibition activity of phenolics and flavonoids with a modified cupric reducing antioxidant capacity (CUPRAC) method.Anal Chim Acta,2009,636:42-50.
30 ?zyürek M,et al.A noval hydrogen peroxide scavenging assay of phenolica and flavonoids using cupric reducing antioxidant capacity (CUPRAC) methodology.J Food Comp Anal,2010,23:689-698.
31 ?eki? SD,et al.Modified cupric reducing antioxidant capacity (CUPRAC) assay for measuring the antioxidant capacities of thiol-containing proteins in admixture with polyphenols.Talanta,2009,79:344-351.
32 Benner M,et al.Development of low-coat optical sensor for cupric reducing antioxidant capacity measurement of food extracts.Anal Chem,2010,82:4252-4258.
- 天然產物研究與開發的其它文章
- 內生真菌Berkleasmium sp.寡糖對盾葉薯蕷培養細胞和幼苗防御相關酶活性的影響

