頂空固相微萃取分析金黃色葡萄球菌揮發性代謝產物的條件優化
(西南民族大學生命科學與技術學院,四川 成都 610041)
頂空固相微萃取分析金黃色葡萄球菌揮發性代謝產物的條件優化
史 輝,唐俊妮,陳 娟*,王 瓊
(西南民族大學生命科學與技術學院,四川 成都 610041)
采用65 μm聚二甲基硅氧烷/二乙基苯(polydimethylsiloxane/divinylbenzene,PDMS/DVB)、75 μm碳分子篩/聚二甲基硅氧烷(carboxen/polydimethylsiloxane,CAR/PDMS)萃取頭和50/30 μm二乙基苯/碳分子篩/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取頭,20、30 min和40 min 3 種萃取時間,50、65 ℃和80 ℃ 3 種萃取溫度,分別對金黃色葡萄球菌胰蛋白胨大豆肉湯(tryptone soy broth,TSB)培養物的揮發性代謝產物進行萃取,經氣相色譜-質譜檢測,以建立適宜于金黃色葡萄球菌揮發性代謝物的萃取分析方法。結果表明,50/30 μm DVB/CAR/PDMS萃取頭能更好地滿足各類化合物的萃取需要,獲得更加全面的化合物信息,并且在萃取溫度80 ℃條件下萃取30 min,得到的金黃色葡萄球菌揮發性代謝物的數量和響應強度較高。因此,萃取金黃色葡萄球菌揮發性代謝產物的最適條件為:50/30 μm DVB/CAR/PDMS萃取頭、萃取溫度80 ℃、萃取時間30 min。在該萃取條件下,檢測出金黃色葡萄球菌在TSB中產生的主要揮發性物質為乙醇、1-癸醇、3-羥基-2-丁酮、丙酮、乙酸、苯甲醇、3-甲基-1-丁醇、吲哚、1-辛醇和正辛酸等。該萃取方法的建立可為細菌揮發性代謝產物的分析提供參考。
金黃色葡萄球菌;揮發性代謝產物;萃取條件;優化;頂空固相微萃取-氣相色譜-質譜聯用
細菌揮發性代謝產物是細菌代謝產物的重要組成部分,與細菌生命活動和細菌生長數量密切關聯,是細菌與周圍各種生物進行交流的重要信息素[1]。大多數細菌釋放的揮發性代謝物都具有微生物種屬特異性,意味著在某些情況下,揮發性特征或某些典型化合物能夠作為檢測和鑒別細菌的生物標志[2-3]。在臨床醫學上,細菌揮發性代謝產物作為一種新的檢測靶標,成為了診斷細菌感染的有效方法[4-5]。近年來,基于揮發性化合物分析的氣味指紋技術在食品中的應用越來越活躍。食品營養豐富,是微生物生長的良好培養基,容易受微生物污染,其次級代謝產物會產生特定的揮發性氣味物質,基于這點可利用氣味指紋技術來檢測食品中的微生物[6]。金偉平等[7]運用頂空固相微萃取-氣相色譜-質譜(headspace solid phase micro-extraction gas chromatography-mass spectroscopy,HS-SPME-GC-MS)聯用技術對單增李斯特菌污染的冷藏牛肉所產生的揮發性物質進行分析,尋找到單增李斯特菌污染牛肉的特征性氣味物質包括苯甲醛、二叔丁基對甲酚和十六烷。Holm等[8]也采用HSSPME-GC-MS技術對污染了熱殺索絲菌、淺黃金色單胞菌和肉桿菌的干臘腸的揮發性物質進行了分析,發現二乙酰、3-羥基-2-丁酮、2-(或3-)甲基丁醇、2-(或3-)甲基丁醛和2-甲基丙醇等物質與干臘腸的腐敗性感官指標緊密相關。Tait等[9]通過β-葡萄糖苷酶和馬尿酸酶水解底物產生2-硝基苯酚和3-氟苯胺的方式,經HS-SPMEGC-MS檢測牛奶是否受到單核增生李斯特菌的污染,方法的檢測限達到1×102~1.5×102CFU/mL牛奶(過夜培養之前)。這些報道都是應用氣味指紋技術檢測食品中污染微生物的探索性研究。由于食品中微生物種類復雜,并且食品基質不同于簡單的肉湯培養基,因此,擬通過氣味特征檢測食品中污染的微生物需要做大量的研究工作,包括全面分析食品中目標菌和背景菌各自的揮發性物質,目標菌和背景菌相互作用的揮發性物質,以及細菌生長情況與揮發性物質產生情況的相關性等。
金黃色葡萄球菌(Staphylococcus aureus)是一種重要的機會致病菌,可引起人和動物的多種疾病,如心內膜炎、骨髓炎、關節炎和奶牛乳房炎等,它是社區和醫院感染疾病中發病率和死亡率最高的病原菌[10]。對于食品安全而言,金黃色葡萄球菌引起的食源性疾病據估計在美國每年可暴發241 000 例[11]。我國由細菌引起的食物中毒事件中,由金黃色葡萄球菌污染的食物比例可占到32.5%[12]。目前,檢測金黃色葡萄球菌的方法主要為傳統培養法和基于分子生物學的聚合酶鏈式反應方法。有關金黃色葡萄球菌揮發性代謝產物的研究不多,已有文獻[13-14]報道了金黃色葡萄球菌在肉湯培養基中生長所產生的揮發性物質,以及耐受型和敏感型甲氧西林金黃色葡萄球菌肉湯培養物揮發性代謝產物之間的差異[15]等,但由于采用的菌株、培養基質和分析條件等方面的差異,目前關于應用氣味指紋技術檢測金黃色葡萄球菌的方法還有待詳細探索。
SPME是近年來應用較為廣泛的一種樣品前處理技術,具有萃取、濃縮和進樣于一體、操作簡便、靈活和靈敏度高等特點[16]。SPME與GC-MS聯用結合形成HSSPME-GC-MS分析技術,該技術是分析細菌揮發性代謝產物的主要方法之一[17]。萃取頭的選擇與萃取條件的優化是影響揮發性代謝物分析的關鍵。然而,目前僅見少量文獻[15,18]報道了萃取方式對細菌揮發性代謝產物萃取效果的影響。本研究采用不同的萃取頭、萃取溫度和萃取時間對金黃色葡萄球菌在胰蛋白胨大豆肉湯(tryptone soy broth,TSB)培養物的揮發性代謝物進行萃取,經GC-MS方法檢測。通過比較不同萃取條件對金黃色葡萄球菌揮發性代謝產物的萃取差異,確定最適宜的萃取條件,使得GC-MS分析檢測獲得的信息更全面,化合物在質譜中的響應強度更高。本實驗對金黃色葡萄球菌揮發性代謝產物分析方法的研究將為氣味指紋技術在食品微生物檢測技術中的應用提供參考數據。
1 材料與方法
1.1 材料與試劑
金黃色葡萄球菌菌株S. aureus ATCC 6538由西南民族大學生命科學與技術學院實驗室保存;TSB 杭州微生物試劑有限公司。
1.2 儀器與設備
Trace DSQ型GC-MS聯用儀(配Triplus自動進樣器) 美國Thermo公司;65 μm聚二甲基硅氧烷/二乙基苯(polydimethylsiloxane/divinylbenzene,PDMS/ DVB)萃取頭、50/30 μm二乙基苯/碳分子篩/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取頭和75 μm碳分子篩/聚二甲基硅氧烷(carboxen/polydimethylsiloxane,CAR/PDMS)萃取頭 美國Supelco公司;MOF-4086S低溫冰箱、MLS-3020高壓蒸汽滅菌鍋 日本三洋公司;SW-CJ-1F超凈工作臺 蘇州安泰空氣技術有限公司;HZQ-F160振蕩培養箱 太倉市實驗設備廠。
1.3 方法
1.3.1 細菌培養物的制備
吸取金黃色葡萄球菌貯藏菌液50 μL接種入6 mL TSB培養基中,于37 ℃,150 r/min條件下培養16 h。再吸取金黃色葡萄球菌的新鮮培養物接入150 mL TSB中,使初始接種量為100~200 CFU/mL,于37 ℃,150 r/min條件下培養12~14 h,進入對數生長后期。吸取該培養物5 mL轉入20 mL頂空瓶內,同時加入2 g氯化鈉,加蓋密封,作為測試樣品。
1.3.2 萃取實驗
在萃取溫度80 ℃、萃取時間30 min條件下,分別采用65 μm PDMS/DVB萃取頭、75 μm CAR/PDMS萃取頭和50/30 μm DVB/CAR/PDMS萃取頭進行萃取。重復3 次。
采用50/30 μm DVB/CAR/PDMS萃取頭,在萃取時間30 min條件下,分別采用50、65 ℃和80 ℃ 3 種萃取溫度進行萃取。重復3 次。
采用50/30 μm DVB/CAR/PDMS萃取頭,在萃取溫度80 ℃條件下,分別采用20、30 min和40 min 3 種萃取時間進行萃取。重復3 次。
在優化得到的最適萃取條件下,測定未接種金黃色葡萄球菌的TSB培養基,作為空白對照。
1.3.3 分析條件
GC條件:HP-5MS色譜柱(30 m×0.25 mm,0.25 μm);不分流模式,不分流1 min之后分流比為50∶1;流速1 mL/min;升溫程序:40 ℃保持3 min,以10 ℃/min升溫至280 ℃并保持3 min;載氣為99.999%氦氣;進樣口溫度230 ℃;解吸時間2 min。
MS條件:電子電離源;電子能量70 eV;離子源溫度250 ℃;傳輸線溫度280 ℃;全掃描模式;質量掃描范圍40~500 u。
1.3.4 定性與定量
MS結果經計算機自動檢索(NIST 08)進行定性分析,同時由Xcalibur軟件系統完成手動對照檢索,要求正反向匹配因子均大于850,可能性大于60%。利用面積歸一法計算已鑒定揮發性物質相對含量,采用提取離子流方式報告代表性揮發性物質的峰面積。揮發性物質相對含量的計算按下式進行:

2 結果與分析
2.1 萃取頭的選擇
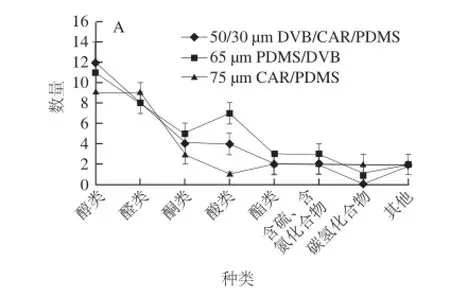
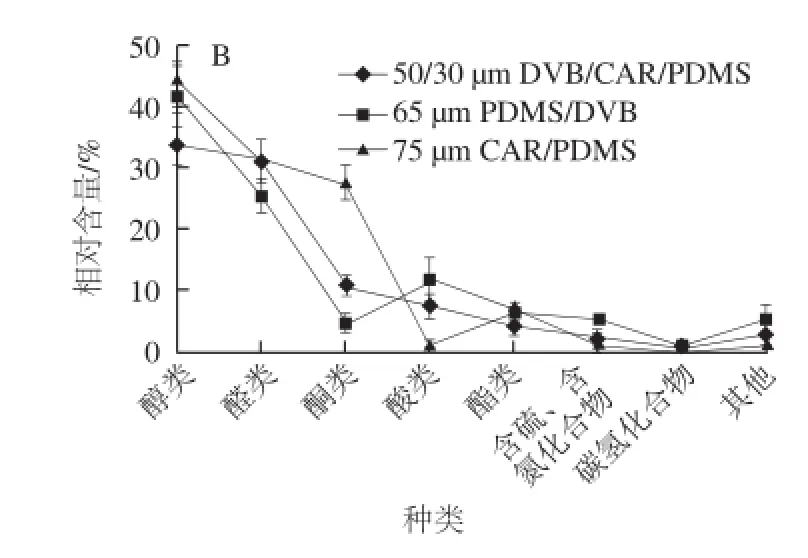
圖1 3 種萃取頭條件下金黃色葡萄球菌揮發性代謝物萃取數量(A)、相對含量(B)的比較Fig.1 Comparison of the composition of volatile metabolites fromS. aureusby using three fibers
由圖1可知,采用50/30 μm DVB/CAR/PDMS萃取頭對金黃色葡萄球菌揮發性代謝產物進行萃取,共鑒定出34 個化合物,其中醇類12 個、醛類8 個、酮類4 個、酸類4 個、酯類2 個、含硫和含氮化合物2 個、碳氫化合物0 個和其他2 個,分別占已檢出揮發性成分總含量的43.08%、30.66%、10.86%、7.13%、3.69%、2.01%、0%和2.56%。在采用65 μm PDMS/DVB萃取頭對金黃色葡萄球菌揮發性代謝產物進行萃取,共鑒定出40 個化合物,其中醇類11 個、醛類8 個、酮類5 個、酸類7 個、酯類3 個、含硫和含氮化合物3 個、碳氫化合物1 個和其他2 個,分別占已檢出揮發性成分總含量的41.85%、25.16%、4.34%、11.61%、6.16%、4.83%、0.60%和5.45%。采用75 μm CAR /PDMS萃取頭對金黃色葡萄球菌揮發性代謝產物進行萃取,共鑒定出30 個化合物,其中醇類9 個、醛類9 個、酮類3 個、酸類1 個、酯類2 個、含硫和含氮化合物2 個、碳氫化合物2 個和其他2 個,分別占已檢出揮發性成分總含量的33.41%、30.84%、27.40%、0.76%、6.85%、0.34%、0.18%和0.22%。對于醇類和醛類化合物,3 種萃取頭萃取的物質數量和相對含量都較高,對這2 類化合物有較好的萃取效果。對于酮類化合物,3 種萃取頭萃取的物質數量相當,在相對含量上,75 μm CAR/PDMS萃取頭>50/30 μm DVB/CAR/ PDMS萃取頭>65 μm PDMS/DVB萃取頭;對于酸類化合物,在數量和相對含量上,65 μm PDMS/DVB萃取頭>50/30 μm DVB/CAR/PDMS萃取頭>75 μm CAR/PDMS萃取頭。結果表明,50/30 μm DVB/CAR/PDMS萃取頭對于酮類和酸類化合物的萃取能力介于其他2 種萃取頭之間。對于酯類、含硫、含氮化合物和碳氫化合物,3 種萃取頭萃取的物質數量和相對含量都較低,且萃取效果差異較小。為滿足各類化合物的萃取需要,以獲得較全面的物質信息,選用50/30 μm DVB/CAR/PDMS萃取頭進行萃取較為適宜。
2.2 萃取溫度的選擇
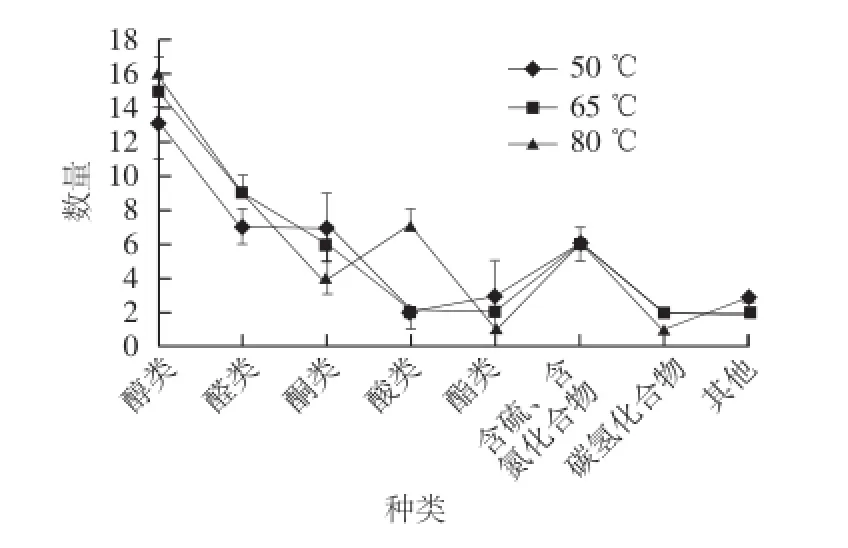
圖2 3 種萃取溫度條件下金黃色葡萄球菌揮發性代謝產物數量比較Fig.2 Comparison of the numbers of volatile metabolites fromS. aureusat three extraction temperatures
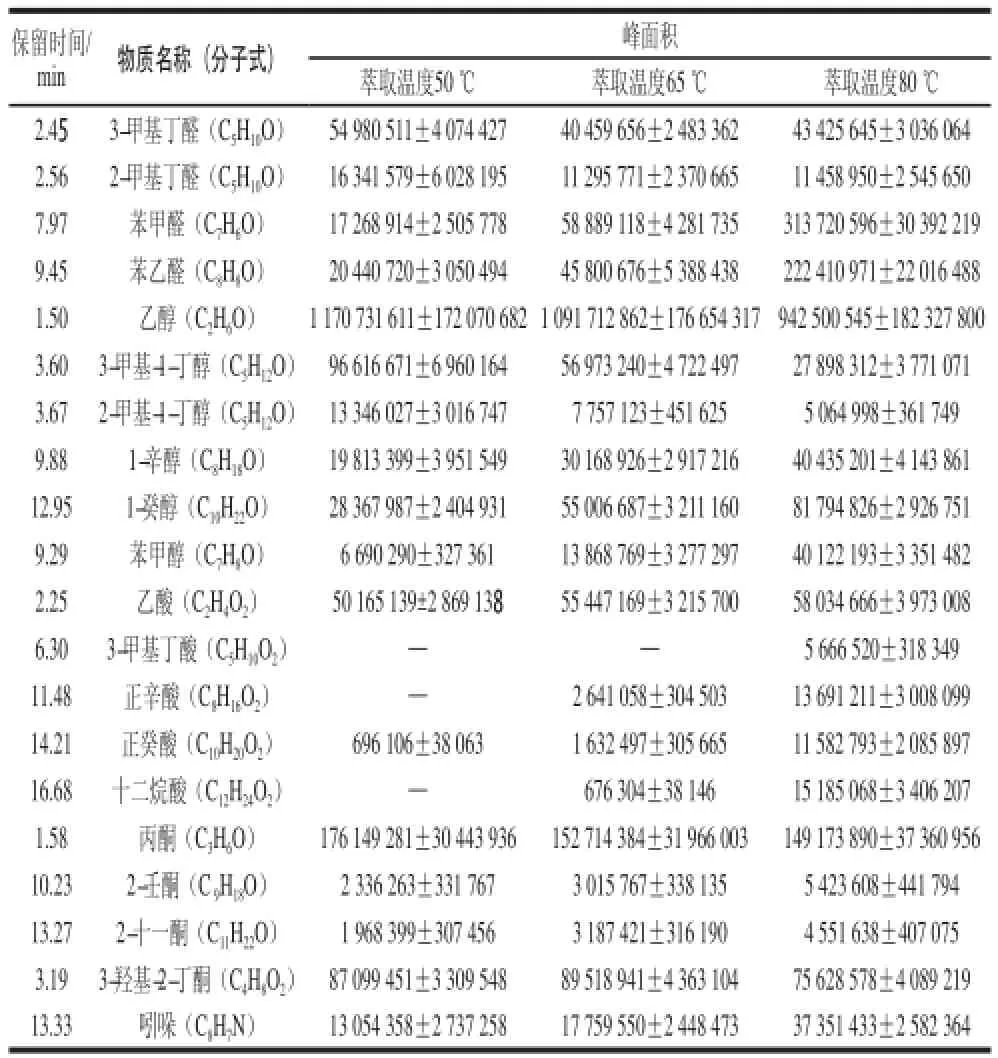
表1 3 種萃取溫度條件下金黃色葡萄球菌揮發性代謝物的峰面積比較Table 1 Comparison of volatile metabolites peak areas of S. aureus at three extraction temperatures
從圖2可以看出,萃取溫度為50 ℃時,共萃取出42 個物質,其中醇類13 個、醛類7 個、酮類7個、酸類2 個、酯類3 個、含硫和含氮化合物6 個、碳氫化合物2 個、其他2 個;萃取溫度為65 ℃時,共萃取出44 個物質,其中醇類15 個、醛類9 個、酮類6 個、酸類2 個、酯類2 個、含硫和含氮化合物6 個、碳氫化合物2 個、其他2 個;萃取溫度為80 ℃時,共萃取出47 個物質,其中醇類16 個、醛類9 個、酮類4 個、酸類7 個、酯類1 個、含硫和含氮化合物6 個、碳氫化合物1 個、其他3 個。在50、65 ℃和80 ℃ 3 種萃取溫度條件下,金黃色葡萄球菌各類揮發性代謝物的數量差異較小,但從萃取物質總量來看,80 ℃萃取物質數量最高,這說明隨著萃取溫度的升高,萃取得到的物質數量增加。其次,從眾多揮發性代謝物中篩選出20 種代表性化合物,采用提取離子流方式獲得峰面積,從化合物響應強度上比較3 種萃取溫度差異。由表1可知,隨著萃取溫度的升高,大多數揮發性代謝物峰面積都不斷上升,3-甲基丁醛、2-甲基丁醛、乙醇、乙酸、3-羥基-2-丁酮和丙酮的峰面積變化不明顯,僅3-甲基-1-丁醇和2-甲基-1-丁醇的峰面積不斷下降。因此,在萃取溫度80 ℃條件下,萃取得到的金黃色葡萄球菌揮發性代謝物的數量和響應強度都較高。
2.3 萃取時間的選擇
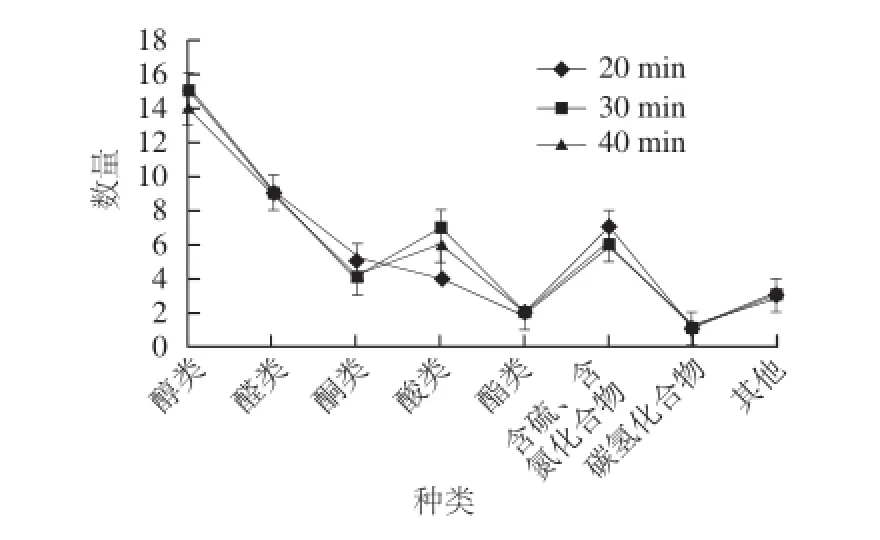
圖3 3 種萃取時間條件下金黃色葡萄球菌揮發性代謝產物數量比較Fig.3 Comparison in the numbers of volatile metabolites ofS. aureusby using three extraction times
從圖3可以看出,萃取時間為20 min時,共萃取出46 個物質,其中醇類15 個、醛類9 個、酮類5個、酸類4 個、酯類2 個、含硫和含氮化合物7 個、碳氫化合物1 個、其他3 個;萃取時間為30 min時,共萃取出47 個物質,其中醇類15 個、醛類9 個、酮類4 個、酸類7 個、酯類2 個、含硫和含氮化合物6 個、碳氫化合物1個、其他3 個;萃取時間為40 min時,共萃取出45 個物質,其中醇類14 個、醛類9個、酮類4 個、酸類6 個、酯類2 個、含硫和含氮化合物6 個、碳氫化合物1 個、其他3 個。在20、30 min和40 min 3 種萃取時間條件下,金黃色葡萄球菌各類揮發性代謝物的數量差異較小,且揮發性代謝物的總數量相近。從表2可以得出,隨著萃取時間的延長,2-甲基丁醛、3-甲基-1-丁醇、乙酸和吲哚的峰面積呈下降趨勢,但下降程度不大。萃取時間在20~30 min之間,苯甲醛、苯乙醛、苯甲醇、1-辛醇、1-癸醇、3-甲基丁酸、正辛酸、正癸酸、十二烷酸、2-壬酮和2-十一酮的峰面積呈上升趨勢,且上升程度明顯;萃取時間在30~40 min之間,這些物質的峰面積變化較小。因此,綜合考慮檢測到的揮發性代謝物的數量和響應強度,選擇萃取時間30 min較好。
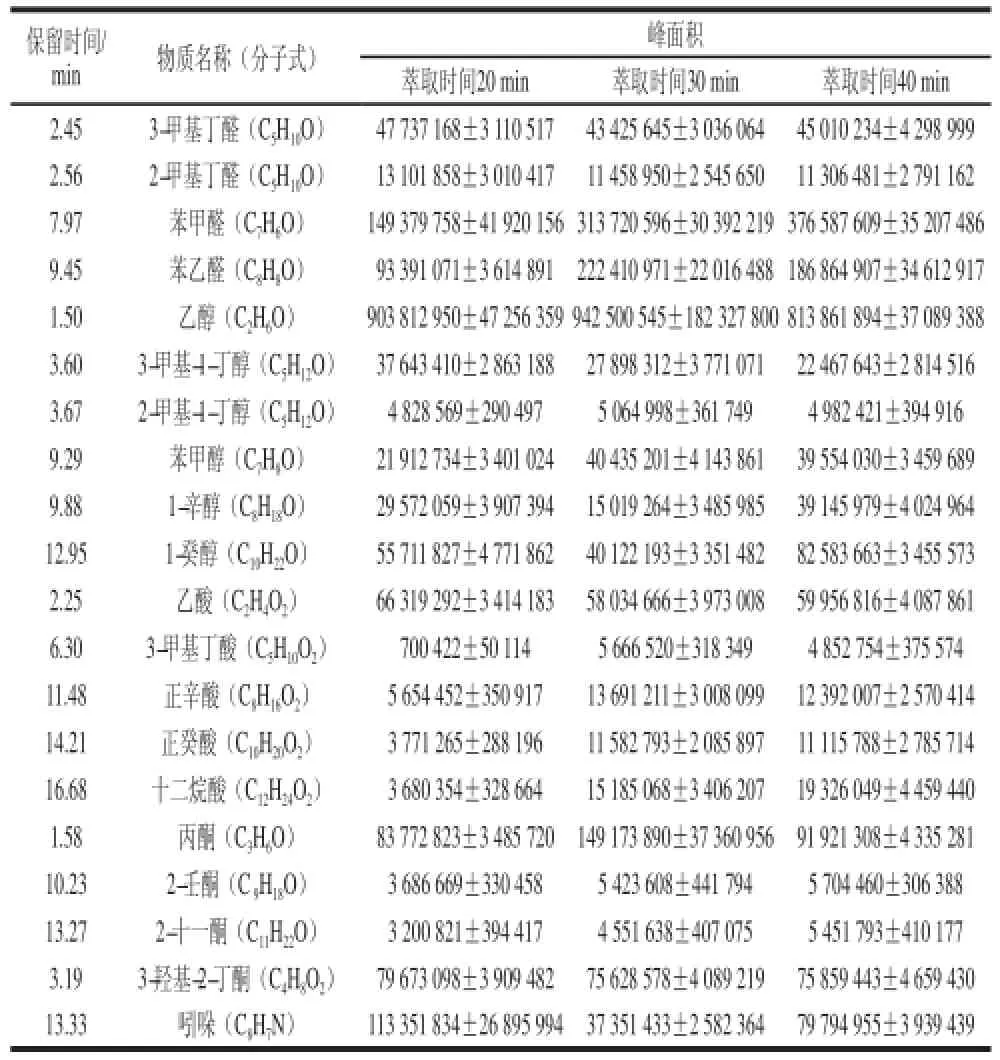
表2 3 種萃取時間條件下金黃色葡萄球菌揮發性代謝物的峰面積比較Table 2 Comparison of volatile metabolites peak areas of S. aureus at three extraction times
2.4 最適萃取條件下金黃色葡萄球菌產生的主要揮發性物質
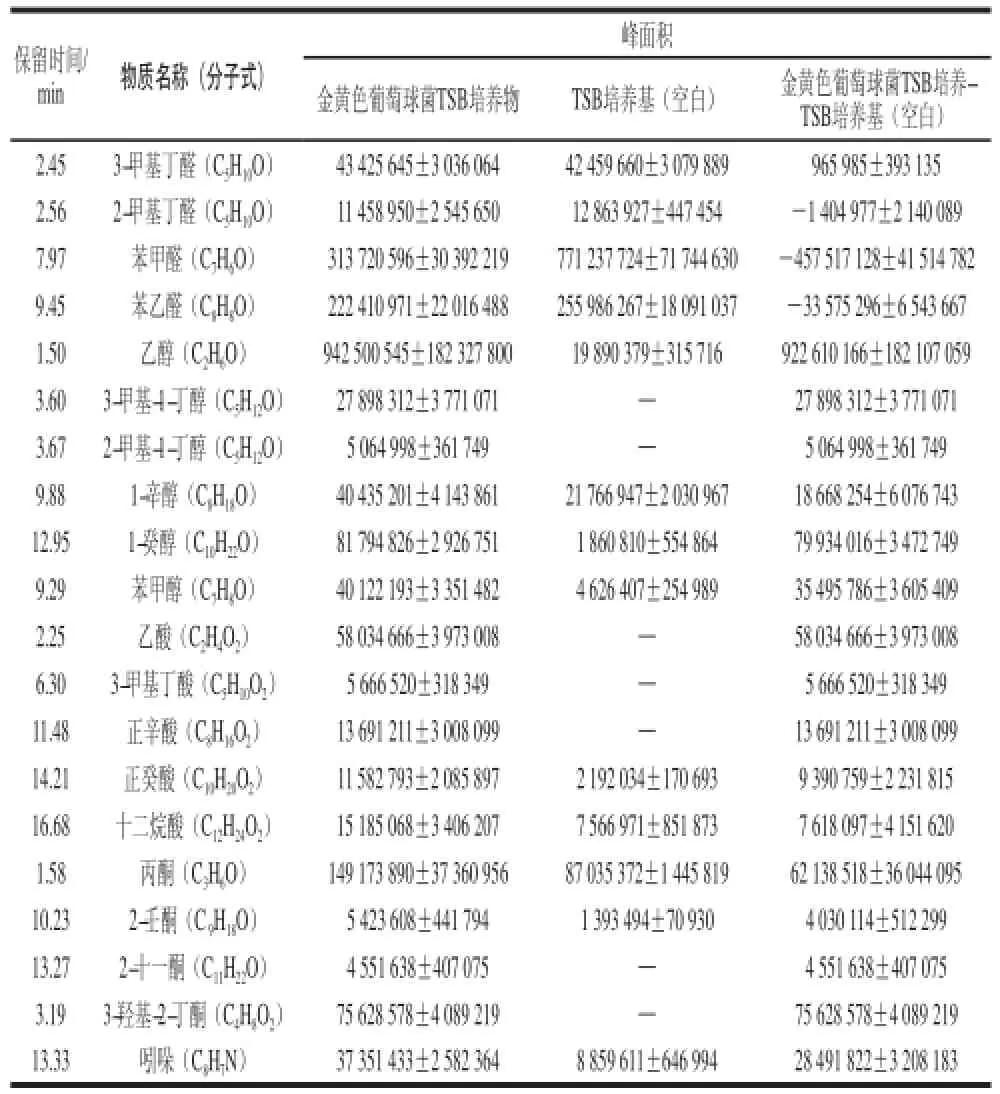
表3 最適萃取條件下金黃色葡萄球菌產生的揮發性物質Table 3 Volatile compounds produced byS. aureus under the optimal extraction conditions
從TSB空白培養基中檢測出大量醛類物質如3-甲基丁醛、2-甲基丁醛、苯甲醛和苯乙醛,發現它們的響應強度接近或大于在金黃色葡萄球菌TSB培養物中的響應強度,因此,確定檢測出的醛類物質不是由金黃色葡萄球菌生長代謝活動所產生。從表3可以看出,在TSB空白培養基中沒有檢測出3-甲基-1-丁醇、2-甲基-1-丁醇、乙酸、3-甲基丁酸、正辛酸、2-十一酮和3-羥基-2-丁酮,說明這些物質是由于金黃色葡萄球菌在TSB中生長代謝所產生;其他物質雖然在TSB空白培養基中被檢測出,同樣由于金黃色葡萄球菌的生長代謝活動,使得這些物質在金黃色葡萄球菌TSB培養物中的響應強度有所增加。在金黃色葡萄球菌產生的揮發性物質中,乙醇的響應強度最高,達到9×109;其次為1-癸醇、3-羥基-2-丁酮、丙酮、乙酸、苯甲醇、3-甲基-1-丁醇、吲哚、1-辛醇和正辛酸的響應強度為108,其余物質的響應強度為107。因此,在本實驗建立的萃取條件下,金黃色葡萄球菌在TSB中產生的主要揮發性物質包括乙醇、1-癸醇、3-羥基-2-丁酮、丙酮、乙酸、苯甲醇、3-甲基-1-丁醇、吲哚、1-辛醇和正辛酸等。
3 討 論
HS-SPME法萃取揮發性物質受到不同萃取頭的差異、樣品的萃取時間和萃取溫度等因素的影響。同時在萃取頭進樣時,由于GC進樣口熱解吸的時間、溫度和分流或不分流的進樣模式等均會影響到分析的靈敏度、準確度和分析物的色譜保留時間、峰形[19]。本實驗以萃取頭類型、萃取時間和萃取溫度進行單因素優化。采用纖維萃取頭的固定相或吸附劑包括非極性的PDMS,弱極性的DVB和弱極性的CAR。65 μm PDMS/DVB萃取頭是由聚二甲基硅氧烷和二乙烯苯復合材料涂布石英纖維而成,75 μm CAR/PDMS萃取頭是由碳分子篩和聚二甲基硅氧烷復合材料涂布石英纖維而成,50/30 μm DVB/ CAR/PDMS萃取頭則是由二乙烯苯、碳分子篩和聚二甲基硅氧烷復合材料涂布石英纖維而成。因此,可以看出,50/30 μm DVB/CAR/PDMS萃取頭的固定相材料包含了其他2 種萃取頭的固定相材料,50/30 μm DVB/CAR/ PDMS萃取頭對化合物極性的萃取要求具有更低的選擇性,萃取適應性更為廣泛。此外,75 μm CAR/PDMS萃取頭適宜小分子質量化合物的萃取,而50/30 μm DVB/ CAR/PDMS萃取頭和65 μm PDMS/DVB萃取頭萃取的物質分子質量范圍比較寬,能萃取到較大分子質量化合物。例如,正十四酸(相對分子質量228)和正十六酸(相對分子質量256)在選用65 μm PDMS/DVB萃取頭得到的萃取物中被檢出,而在選用75 μm CAR/PDMS萃取頭得到的萃取物中未被檢出。異雪松醇(相對分子質量222)和7,9-二叔丁基-1-氧雜螺(4,5)癸烯二酮(相對分子質量276)在選用50/30 μm DVB/CAR/PDMS萃取頭得到的萃取物中被檢出,而選用75 μm CAR/PDMS萃取頭得到的萃取物中未被檢出。Jia等[15]采用75 μm CAR/ PDMS萃取頭萃取,檢測耐甲氧西林金黃色葡萄球菌和敏感型金黃色葡萄球菌MH肉湯培養物的揮發性代謝產物,發現敏感型金黃色葡萄球菌產生乙醇、1-丙醇、3-甲基-1-丁醇、乙醛、丙醛、乙酸、丙酸和3-甲基丁酸等。在實驗中,用該萃取頭對金黃色葡萄球菌TSB培養物的揮發性代謝產物進行萃取,也檢出了許多小分子質量的醇、醛和酸等化合物,而對大分子物質的萃取效果較差,與Jia等[15]報道的結果吻合。
研究結果得出,金黃色葡萄球菌在TSB中產生的主要揮發性物質包括乙醇、1-癸醇、3-羥基-2-丁酮、丙酮、乙酸、苯甲醇、3-甲基-1-丁醇、吲哚、1-辛醇和正辛酸等。Filipiak等[14]在檢測金黃色葡萄球菌TSB培養物時,沒有檢測出長鏈脂肪醇和甲基酮類,但檢測出含量較高的物質有乙醇、3-甲基-1-丁醇、羥基丙酮、羥基丁酮、2,3-二丁酮、乙酸、異戊酸、乙醛、3-甲基-丁醛和2-甲基-丙醛。Elgaali等[20]在金黃色葡萄球菌TSB培養物中同樣也未檢出長鏈脂肪醇,酮類物質僅檢測出C13烯酮。Bos等[21]綜述前人研究報道,提出異戊酸和2-甲基-丁醛可以作為金黃色葡萄球菌的代表性物質。研究發現,醛類物質不是由金黃色葡萄球菌生長所產生的特異性物質,而是TSB培養基的揮發性物質;異戊酸是金黃色葡萄球菌產生的物質,但其響應強度較低。本研究結果與報道的結果有相似之處但也有差異,原因可能在于測試的菌株不同。另一方面,TSB培養基作為空白產生的揮發性物質在已報道的研究中沒有被扣除。此外,萃取條件也存在差異。Elgaali等[20]采用的萃取條件是100 μm PDMS萃取頭,在32 ℃條件下萃取15 min。Filipiak等[14]采用的萃取條件是75 μm CAR/PDMS萃取頭,37 ℃條件下萃取10 min。通過單因素試驗,階段性選擇最優條件后,得到適宜于金黃色葡萄球菌揮發性代謝物萃取的條件為采用50/30 μm DVB/CAR/PDMS萃取頭、萃取溫度80 ℃、萃取時間30 min。本研究建立的HSSPME-GC-MS分析方法可以獲得較全面的金黃色葡萄球菌揮發性代謝產物組成信息。
[1] KAI M, HAUSTEIN M, MOLINA F, et al. Bacterial volatiles and their action potential[J]. Applied Microbiology and Biotechnology, 2009, 81(6): 1001-1012.
[2] HENIS Y, GOULD J R, ALEXANDER M. Detection and identification of bacteria by gas chromatography[J]. Applied Microbiology, 1966, 14(4): 513-524.
[3] KAI M, EFFMERT U, BERG G, et al. Volatiles of bacterialantagonists inhibit mycelial growth of the plant pathogenRhizoctonia solani[J]. Archives of Microbiology, 2006, 187(5): 351-360.
[4] SOHRABI M, ZHANG Li, ZHANG Kai, et al. Volatile organic compounds as novel markers for the detection of bacterial infections[J]. Clinical Microbiology, 2014, 3(3): 151-157.
[5] ZHU Jiangjiang, BEAN H D, WARGO M J, et al. Detecting bacterial lung infections:in vivoevaluation ofin vitrovolatile fingerprints[J]. Journal of Breath Research, 2013, 7(1): 016003.
[6] 侯巧娟, 王錫昌, 劉源, 等. 氣味指紋技術在肉品品質及安全檢測中的應用[J]. 食品科學, 2011, 32(7): 327-331.
[7] 金偉平, 黃志強, 劉群群, 等. 頂空固相微萃取-氣質聯用法分析單增李斯特菌污染冷藏牛肉的揮發性物質[J]. 食品科學, 2012, 33(2): 243-247.
[8] HOLM E S, SCH?FER A, KOCH A G, et al. Investigation of spoilage in saveloy samples inoculated with four potential spoilage bacteria[J]. Meat Science, 2013, 93(3): 687-695.
[9] TAIT E, PERRY D, STANFORTH S P, et al. Bacteria detection based on the evolution of enzyme-generated volatile organic compounds: determination of Listeria monocytogenes in milk samples[J]. Analytica Chimica Acta, 2014, 848: 80-87.
[10] 王瓊, 唐俊妮, 湯承, 等. 針對不同來源金黃色葡萄球菌分離菌株的agrⅠ-Ⅳ分型初探[J]. 西南民族大學學報: 自然科學版, 2014, 40(3): 354-357.
[11] KADARIYA J, SMITH T C, THAPALIYA D. Staphylococcus aureus and staphylococcal food-borne disease: an ongoing challenge in public health[J]. Biomed Research International, 2014, 4(6): 660-667.
[12] TANG Junni, ZHANG Rong, CHEN Juan, et al. Incidence and characterization of Staphylococcus aureus strains isolated from food markets[J]. Annals of Microbiology, 2015, 65(1): 279-286.
[13] BOOTS A W, SMOLINSKA A, van BERKEL J J, et al. Identifi cation of microorganisms based on headspace analysis of volatile organic compounds by gas chromatography-mass spectrometry[J]. Journal of Breath Research, 2014, 8(2): 027106.
[14] FILIPIAK W, SPONRING A, BAUR M M, et al. Molecular analysis of volatile metabolites released specifically by Staphylococcus aureus and Pseudomonas aeruginosa[J]. BMC Microbiology, 2012, 12: 113-129.
[15] JIA B, SOHNLEIN B, MORTELMANS K, et al. Distinguishing between methicillin resistant and sensitive Staphylococcus aureus using volatile headspace metabolites[J]. IEEE Sensors Journal, 2010, 10(1): 71-75.
[16] VAS G, VEKEY K. Solid-phase micro-extraction: a powerful sample preparation tool prior to mass spectrometric analysis[J]. Journal of Mass Spectrometry, 2004, 39(3): 233-254.
[17] ZHANG Zhuomin, LI Gongke. A review of advances and new developments in the analysis of biological volatile organic compounds[J]. Microchemical Journal, 2010, 95(2): 127-139.
[18] TAIT E, PERRY J D, STANFORTH S P, et al. Identifi cation of volatile organic compounds produced by bacteria using HS-SPME-GC-MS[J]. Journal of Chromatographic Science, 2014, 52(4): 363-373.
[19] 張明霞, 趙旭娜, 楊天佑, 等. 頂空固相微萃取分析白酒香氣物質的條件優化[J]. 食品科學, 2011, 32(12): 49-53.
[20] ELGAALI H, HAMILTON-KEMP T R, NEWMAN M C, et al. Comparison of long-chain alcohols and other volatile compounds emitted from food-borne and related gram positive and gram negative bacteria[J]. Journal of Basic Microbiology, 2002, 42(6): 373-380.
[21] BOS L D, STERK P J, SCHULTZ M J. Volatile metabolites of pathogens: a systematic review[J]. Plos Pathogens, 2013, 9(5): 210-216.
Optimization of Headspace Solid Phase Micro-Extraction Conditions for GC-MS Analysis of Volatile Metabolites from Staphylococcus aureus
SHI Hui, TANG Junni, CHEN Juan*, WANG Qiong
(College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China)
Volatile metabolites from Staphylococcus aureus cultured with tryptone soy broth (TSB) were extracted under different conditions namely three types of fi ber (65 μm PDMS/DVB fi ber, 75 μm CAR/PDMS fi ber and 50/30 μm DVB/ CAR/PDMS fiber), three extraction times (20, 30 and 40 min) and three extraction temperatures (50, 65 and 80 ℃), respectively. The extracts were detected by gas chromatography-mass spectroscopy (GC-MS). The optimal extraction conditions were determined. The results indicated that 50/30 μm DVB/CAR/PDMS fi ber was suitable for the extraction of various components and more comprehensive information was obtained using this fi ber. Abundant amounts and response intensities of bacterial volatile metabolites were extracted at 80 ℃ for 30 min. Accordingly the optimal extraction conditions for volatile metabolites from S. aureus were obtained. Using the established extraction method, the main volatile compounds produced by S. aureus cultured in TSB were detected to be alcohol, 1-decanol, 3-hydroxy-2-butanone, acetone, acetic acid, benzyl alcohol, 3-methyl-1-butanol, indole, 1-octanol and octanoic acid. This extraction method can provide a valuable tool for the analysis of bacterial volatile metabolites.
Staphylococcus aureus; volatile metabolites; extraction condition; optimization; headspace solid phase micro-extraction gas chromatography-mass spectroscopy (HS-SPME-GC-MS)
TS201.6
A
1002-6630(2015)12-0185-06
10.7506/spkx1002-6630-201512034
2014-10-28
國家自然科學基金面上項目(31371781);教育部“新世紀優秀人才支持計劃”項目(NCET-11-0847);
西南民族大學研究生創新項目(CX2014SP263)
史輝(1990—),男,碩士研究生,研究方向為食品質量與安全。E-mail:823371756@qq.com
*通信作者:陳娟(1980—),女,副研究員,博士,研究方向為食品微生物與食品安全。E-mail:chenj1221@126.com

