動態高壓微射流對牛血清白蛋白糖基化反應的影響
涂宗財,余 莉,黃小琴
動態高壓微射流對牛血清白蛋白糖基化反應的影響
涂宗財,余 莉,黃小琴
(江西師范大學生命科學學院,江西 南昌 330022)
以牛血清白蛋白(bovine serum albumin,BSA)-葡萄糖為研究對象,通過比色法、差示掃描量熱儀、紅外光譜及圓二色譜研究動態高壓微射流(dynamic high pressure microfluidization,DHPM)不同處理壓力(40、80、120、160 MPa)對BSA-葡萄糖干熱糖基化反應產物性質和結構的影響。結果表明:BSA-葡萄糖經DHPM處理后,其糖基化產物游離氨基含量明顯減少,且隨著壓力的增加先減少后增加;經差示掃描量熱儀分析得出其熱穩定性隨處理壓力增大先升高后降低;紅外光譜和圓二色譜分析表明,BSA-葡萄糖經DHPM預處理后,糖基化產物二級結構發生變化。這些結果說明DHPM促進了BSA-葡萄糖體系的糖基化反應。
牛血清白蛋白;動態高壓微射流;糖基化;結構
蛋白質的糖基化反應是指親水性的糖類物質以共價鍵接入食品蛋白質分子中,使糖基化產物既具有蛋白質的大分子特性,又具有糖類物質的親水特性。影響蛋白質糖基化反應的因素很多,包括內在反應條件,如溫度、反應時間、水分活度和反應物的性質等[1];超高壓、超聲波、微波和脈沖電場等外場輔助法也都有助于促進糖基化反應的進行。Schwarzenbolz等[2]研究發現600 MPa的高靜壓可以影響酪蛋白或氨基酸與糖的糖基化反應,減少某些副產物的產生;Guan Junjun等[3]采用微波加熱大豆蛋白-糖溶液體系,發現微波加熱明顯加快大豆蛋白-糖共聚物的形成;Shi Wenhui等[4]發現牛血清白蛋白(bovine serum albumin,BSA)與葡萄糖溶液體系的美拉德反應程度隨著超聲強度的增大而提高,從而改變蛋白質的高級結構,并提高其抗氧化活性;Guan Yongguang等[5]研究發現脈沖電場可以促進BSA-葡聚糖溶液體系的糖基化反應。
動態高壓微射流技術(dynamic high pressure microfluidization,DHPM)是集輸送、混合、超微粉碎、加壓、膨化等多種單元操作于一體的一門全新技術[6]。DHPM可以有效改善蛋白質、淀粉、膳食纖維等的結構和功能性質,是一種前景很好的食品生物大分子改性技術[7]。目前關于DHPM對蛋白質糖基化反應的影響相關研究少見報道。BSA作為一種常用的模式蛋白,也是牛奶中乳清蛋白的一種組成成分[8],以其為原料研究美拉德反應產物的功能特性,可以作為動物來源的代表性蛋白,對其他動物蛋白的糖基化改性可提供理論參考[9]。本課題組前期采用DHPM與糖基化反應相結合改性蛋白質,研究 發現DHPM預處理誘導BSA的結構發生變化,從而促進BSA的糖基化反應,提高BSA的糖基化程度并增加其糖基化位點[10]。DHPM誘導的蛋白質去折疊進而促進蛋白質的糖基化反應,表明DHPM為食品加工過程中糖基化反應的促進提供了一種有效方法。因此,本實驗室在前期研究的基礎上,以BSA-葡萄糖體系為研究對象,研究DHPM對反應體系游離氨基、熱穩定性、二級結構和三級結構的影響,為DHPM在蛋白質-糖類反應體系中的應用提供一定的理論依據。
1 材料與方法
1.1材料與試劑
牛血清白蛋白(BSA)上海藍季科技發展有限公司。
鄰苯二甲醛(o-phthalic dicarboxaldehyde,OPA)國藥集團化學試劑有限公司;十二烷基硫酸鈉(sodium dodecyl sulfonate,SDS)、β-巰基乙醇美國Sigma公司;葡萄糖、磷酸鹽緩沖液、甲醇等均為分析純。
1.2儀器與設備
M-110EH微射流均質機美國Microfluidics公司;MOS-450/AF-CD圓二色譜儀法國Bio-Logic SAS公司;UV-3200型紫外-可 見分光光度計上海美譜達儀器有限公司;Nicolet 6700紅外光譜儀美國熱電尼高利儀器有限公司;DSC 200 F3差示掃描量熱儀德國耐馳儀器制造有限公司。
1.3方法
1.3.1樣品制備
將BSA溶于蒸餾水中配成10 mg/mL的溶液,BSA溶液與葡萄糖按質量比1∶1混合后,采用DHPM均質機在0、40、80、120、160 MPa條件下分別處理3次,冷凍干燥,然后根據Ledesma[11]和Li Zheng[12]等的方法稍作修改,樣品在55℃條件下干熱反應20 h,4℃儲存備用,所得樣品分別表示為BSA、BSAG(BSA-葡萄糖)、BSAG40(BSA-葡萄糖經DHPM 40 MPa處理)、BSAG80(BSA-葡萄糖經DHPM 80 MPa處理)、BSAG120(BSA-葡萄糖經DHPM 120 MPa處理)、BSAG160(BSA-葡萄糖經DHPM 160 MPa處理)。
1.3.2游離氨基含量的測定
準確稱取80 mg的OPA溶解于2 mL甲醇中,再加入20 g/100 mL SDS 5 mL,0.1 mol/L的硼砂50 mL及200μLβ-巰基乙醇,最后用蒸餾水定容到100 mL。測定時,配制0.5 mg/mL的樣品溶液,取4.0 mL OPA試劑于試管中,加入200μL樣品,混合均勻,放入35℃水浴中反應2 min后在340 nm波長處測定吸光度(A340nm),另取4.0 mL OPA試劑于試管中,加入200μL水作為空白對照。用相同的方法,以賴氨酸代替樣品做出標準曲線,根據曲線計算樣品中游離氨基的含量[13]。
1.3.3熱穩定性
采用差示掃描量熱儀的方法測定糖基化產物的變性溫度,用樣品鋁盒稱取6.0 mg左右的樣品(精確到0.1 mg)。掃描溫度范圍為30~120℃,掃描速率為10℃/min。空盤作參比,記錄峰值溫度[14]。
1.3.4紅外光譜測定
準確稱量2 mg的樣品,加入一定量的溴化鉀至200 mg,用研缽研磨成均勻粉末,壓制成薄片,再用紅外光譜儀做全波段掃描(4 000~400 cm-1),掃描次數32次[15]。
1.3.5圓二色譜分析
根據Choi等[16]的方法,將樣品采用10 mmol/L磷酸鹽緩沖溶液(pH 7.0)配制成質量濃度為0.15 mg/mL的溶液,用1 mm的比色皿裝樣,置于圓二色譜儀測定。檢測波長:190~250 nm,掃描速率:50 nm/min,寬度:1.0 nm,圓二色譜數據用平均橢圓率表示。采用圓二色譜分析網站計算不同二級結構含量。
1.4數據處理
樣品測定均重復3次,實驗數據采用Origin 8.0處理并用SPSS 20.0軟件進行顯著性差異分析(P<0.05)。
2 結果與分析
2.1游離氨基含量測定結果
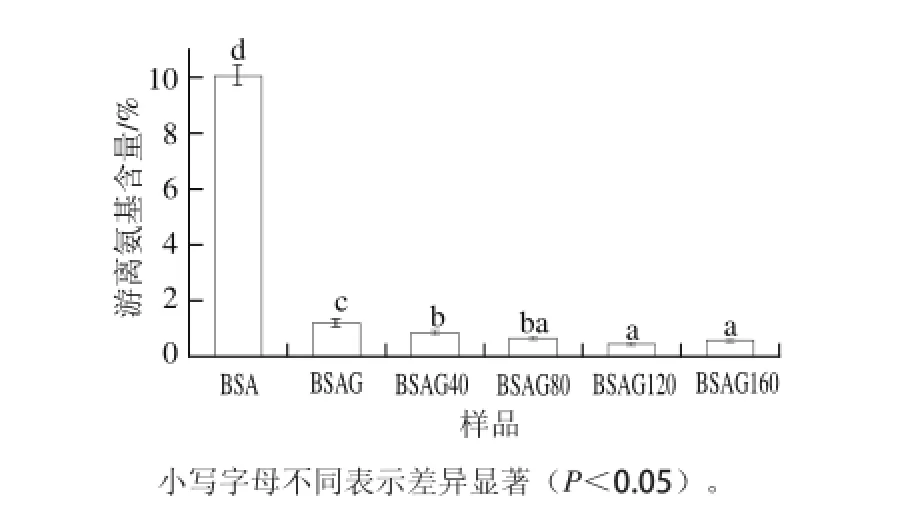
圖1 DHPM不同壓力對BSA-葡萄糖體系游離氨基含量的影響Fig.1 Effect of DHPM at various pressures on the free amino group content of BSA-glucose system
由圖1可知,BSA經葡萄糖糖基化后游離氨基含量明顯減少,與文獻[9]結果相同。經DHPM均質處理后,BSA糖基化產物游離氨基含量隨著壓力的增加先減少后增加,在120 MPa時游離氨基含量最低,說明DHPM促進了BSA糖基化反應,這可能是因為壓力誘導BSA構象發生變化,使其結構變得更為分散,糖基化反應位點增多,使得美拉德反應更加充分,游離氨基含量更少,當DHPM壓力低于某個值時,蛋白質趨于去折疊狀態,當壓力繼續升高,達到更大的值后,蛋白質將會聚集,使得糖基化產物的游離氨基含量又有所增加,這與Huang Xiaoqin等[10]研究結果相同。
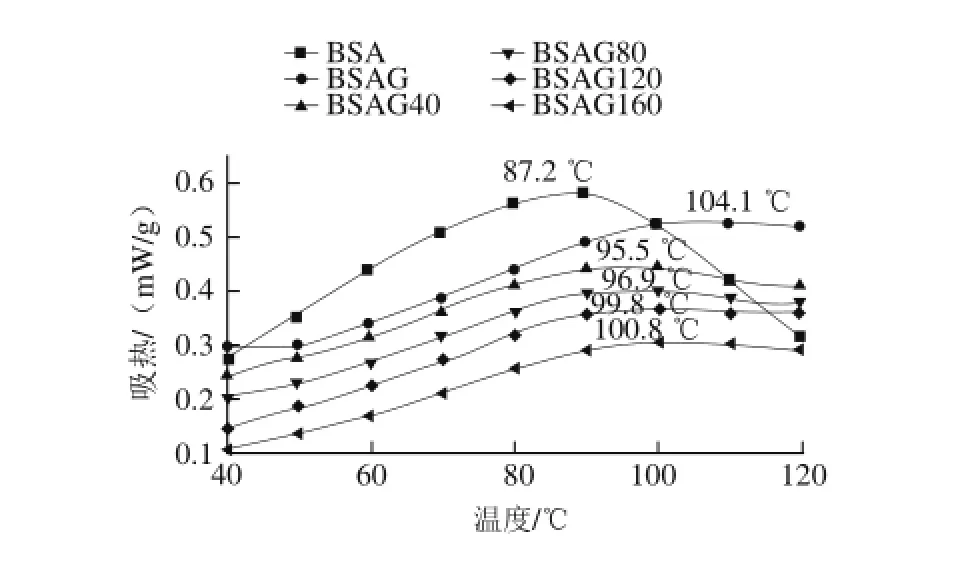
圖2 DHPM不同壓力對BSA-葡萄糖體系熱穩定性的影響Fig.2 Effect of DHPM at various pressures on the thermal stability of BSA-glucose system
2.2熱穩定性測定結果
由圖2可知,原樣BSA的熱變性溫度最低,經糖基化后明顯提高,變性溫度達到104.1℃,與文獻[17-18]
報道相同。經DHPM均質處理后,BSA糖基化產物的熱穩定性降低,隨著處理壓力的增大,熱穩定性呈升高趨勢,這是因為DHPM使BSA的構象發生變化,結構更為松散,部分相互作用力遭到破壞[19-20],說明DHPM降低了BSA的熱穩定性,但糖基化又使得BSA的熱穩定性明顯提高,糖基化增強BSA熱穩定性比DHPM降低BSA
熱穩定性要顯著,所以BSA糖基化產物的熱穩定性隨著DHPM壓力的增大而增大,且都高于原樣,低于未經DHPM處理的糖基化產物。
2.3紅外光譜分析
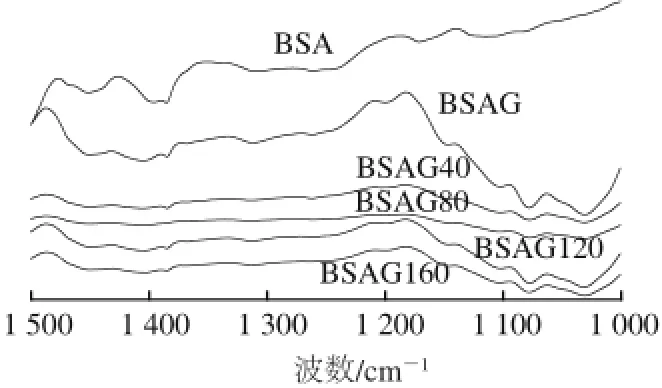
圖3 DHPM不同壓力下BSA-葡萄糖體系的紅外光譜Fig.3 Infrared spectra of BSA-glucose system after DHPM at various pressures
當蛋白質和糖共價結合后,在紅外圖譜上的典型特征是在1 360~1 250 cm-1范圍內和在1 260~1 000 cm-1范圍內出現吸收,這分別是C—N和C—O的伸縮振動引起的[21]。由圖3可知,BSA經糖基化后紅外圖譜在1 360~1 250 cm-1范圍內相對吸收增強,表明產物分子中新形成了C—N共價鍵[22],在1 260~1 000 cm-1范圍內峰的吸收強度明顯大于原蛋白,是因為葡萄糖的接入,引入了更多的C—O,使得對應吸收峰相對強度增大。1 500~1 350 cm-1波段的吸收峰強度增加,這說明接枝反應能引起C—H的彎曲振動及C—OH彎曲振動的增加。經DHPM處理的BSA糖基化產物的吸收峰隨壓力不同而發生不同程度的變化,有略微的紅移或藍移,峰位和峰面積有所變化,與文獻[20]報道相同。
2.4圓二色譜分析
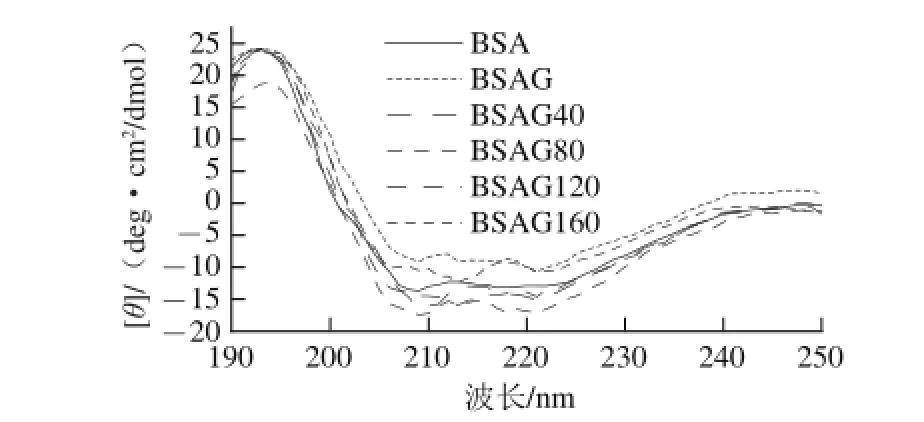
圖4 DHPM不同壓力下BSA-葡萄糖體系的圓二色譜圖Fig.4 CD of BSA-glucose system after DHPM at various pressures
由圖4可知,糖基化后BSA的二級結構遭到破壞,192、208 nm和222 nm的吸收較原蛋白明顯減弱,表明產物中α-螺旋結構顯著減少[23],說明蛋白質二級結構發生顯著變化。由表1可知,BSA的二級結構主要為α-螺旋,沒有β-折疊,與文獻[24]報道相同,經糖基化后,α-螺旋顯著減少,而β-折疊、β-轉角和無規卷曲含量增加,這是由于蛋白質肽鏈中引入葡萄糖,其空間位阻效應引起無規卷曲含量增加[9];另一方面,游離氨基參與反應,分子間氫鍵遭到破壞,減弱了蛋白質分子間的相互作用力,導致蛋白質分子充分伸展。經不同壓力DHPM處理后BSA糖基化產物的α-螺旋向β-折疊和無規卷曲轉變,這是因為BSA經高壓處理后結構更為松散,與Zhang Min等[25]報道相同。
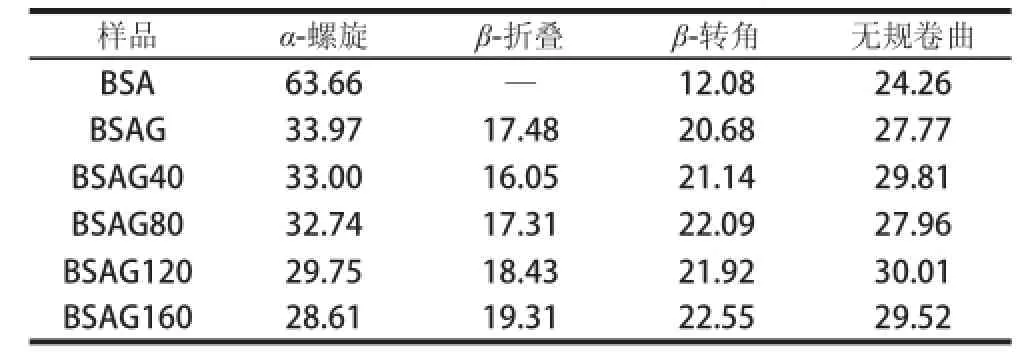
表1 DHPM不同壓力下BSA-葡萄糖體系的二級結構含量Table 1 Secondary structure contents of BSA-glucose system after DHPM at various pressureess%
3 結 論
BSA-葡萄糖經DHPM處理后糖基化產物的游離氨基、熱穩定性和結構發生了一定變化。BSA糖基化后游離氨基明顯減少,隨著壓力的增大游離氨基含量先減少后增加;糖基化后BSA的熱穩定性顯著提高,變性溫度由原來87.2℃升高到104.1℃,經DHPM不同壓力處理后,其熱變性溫度隨壓力增大逐漸升高;利用紅外光譜和圓二色譜分析表明二級結構發生變化。這些變化說明BSA與葡萄糖發生共價交聯時改變了蛋白質結構,導致游離氨基含量明顯減少,DHPM不同壓力處理,造成BSA聚集狀態不同程度的破壞,同時使蛋白質構象發生變化,使得游離氨基隨著壓力增加有略微下降趨勢,以上結果說 明DHPM預處理促進了BSA-葡萄糖體系的糖基化反應。
[1] LIU Jianhua, RU Qiaomei, DING Yuting. Glycation a promising method for food protein modification: physicochemical properties and structure, a review[J]. Food Research International, 2012, 49(1): 170-183.
[2] SCHWARZENBOLZ U, KLOSTERMEYER H, HENLE T. Maillard reaction under high hydrostatic pressure: studies on the formation of protein-bound amino acid derivatives[J]. International Congress Series, 2002, 1245: 223-227.
[3] GUAN Junjun, QIU Aiyong, LIU Xiaoya, et al. Microwave improvement of soy protein isolate-saccharide graft reactions[J]. Food Chemistry, 2006, 97(4): 577-585.
[4] SHI Wenhui, SUN Weiwei, YU Shujuan, et al. Study on the characteristic of bovine serum albumin-glucose model system, treated by ultrasonic[J]. Food Research International, 2010, 43(8): 2115-2118.
[5] GUAN Yongguang, LIN Hua, HAN Zhong, et al. Effects of pulsed electric field treatment on a bovine serum albumin-dextran model system, a means of promoting the Maillard reaction[J]. Food Chemistry, 2010, 123(2): 275-280.
[6] LIU Wei, LIU Jianhua, LIU Chengmei, et al. Activation and conformational changes of mushroom polyphenoloxidase by high pressure microfluidization treatment[J]. Innovative Food Science & Emerging Technologies, 2009, 10(2): 142-147.
[7] LIU Wei, ZHANG Zhaoqin, LIU Chengmei, et al. The effect of dynamic high-pressure microfluidization on the activity, stability and conformation of trypsin[J]. Food Chemistry, 2010, 123(3): 616-621.
[8] CONSIDINE T, PATEL H, ANEMA S, et al. Interactions of milk proteins during heat and high hydrostatic pressure treatments: a review[J]. Innovative Food Science & Emerging Technologies, 2007, 8(1): 1-23.
[9]林花.牛血清白蛋白-葡聚糖接枝改性及機理研究[D].廣州:華南理工大學, 2010: 8; 19; 32.
[10] HUANG Xiaoqin, TU Zongcai, WANG Hui, et al. Glycation promotedby dynamic high pressure microfluidisation pretreatment revealed by high resolution mass spectrometry[J]. Food Chemistry, 2013, 141(3): 3250-3259.
[11] LEDESMA O, ANA I, RAMOS C, et al. Characterization of bovine serum albumin glycated with glucose, galactose and lactose[J]. Acta Biochimica Polonica, 2008, 55(3): 491-497.
[12] LI Zheng, LUO Yongkang, FENG Ligeng. Effects of Maillard reaction conditions on the antigenicity ofα-lactalbumin andβ-lactoglobulin in whey protein conjugated with maltose[J]. European Food Research and Technology, 2011, 233(3): 387-394.
[13] SERPEN A, GOKMEN V. Evaluation of the Maillard reaction in potato crisps by acrylamide, antioxidant capacity and color[J]. Journal of Food Composition and Analysis, 2009, 22(6): 589-595.
[14] WANG Qian, ISMAIL B. Effect of Maillard-induced glycosylation on the nutritional quality, solubility, thermal stability and molecular configuration of whey proteinv[J]. International Dairy Journal, 2012, 25(2): 112-122.
[15] GARCIA B, ANA B, CARDELLE C, et al. Effect of drying methods on the reactivity of chitosan towards Maillard reaction[J]. Food Hydrocolloids, 2012, 29(1): 27-34.
[16] CHOI S J, MOON T W. Influence of sodium chloride and glucose on the aggregation behavior of heat-denatured ovalbumin investigated with a multiangle laser light scattering technique[J]. Journal of Food Science, 2008, 73(2): C41-C49.
[17] BROERSEN K, VORAGEN A G, HAMER R J, et al. Glycoforms ofβ-lactoglobulin with improved thermostability and preserved structural packing[J]. Biotechnology and Bioengineering, 2004, 86(1): 78-87.
[18] JAFARI-AGHDAM J, KHAJEH K, RANJBAR B, et al. Deglycosylation of glucoamylase fromAspergillus niger: effects on structure, activity and stability[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2005, 1750(1): 61-68.
[19]鐘俊楨.動態高壓微射流技術對乳清蛋白性質和結構的影響[D].南昌:南昌大學, 2009: 50-52.
[20]黎鵬.動態超高壓微射流技術對花生球蛋白功能性質的影響及其機理研究[D].南昌:南昌大學, 2007: 46-50; 61-65.
[21]孫煒煒.乳清分離蛋白-葡聚糖接枝改性及功能性質研究[D].廣州:華南理工大學, 2012: 25.
[22]杜廷發,劉靜宇,胡慎信.漢英對照有機波譜分析綱要[M].長沙:國防科技大學出版社, 2001: 5.
[23] PELTON J T, MCLEAN L R. Spectroscopic methods for analysis of protein secondary structure[J]. Analytical Biochemistry, 2000, 277(2): 167-176.
[24] BOUHEKKA A, BURGI T. Photodegradation of adsorbed bovine serum albumin on TiO2anatase investigated byin-situATR-IR spectroscopy[J]. Acta Chimica Slovenica, 2012, 59(4): 841-847.
[25] ZHANG Min, DANG Yongqiang, LIU Tianying, et al. Pressure-induced fluorescence enhancement of the BSA-protected gold nanoclusters and the corresponding conformational changes of protein[J]. The Journal of Physical Chemistry C, 2012, 117(1): 639-647.
Effect of Dynamic High Pressure Microfluidization on Glycation of Bovine Serum Albumin
TU Zongcai, YU Li, HUANG Xiaoqin
(College of Life Science, Jiangxi Normal University, Nanchang 330022, China)
The effect of dynamic high pressure microfluidization (DHPM) with different pressure (40, 80, 120, and 160 MPa) on the properties and structure of bovine serum albumin (BSA)-glucose dry glycosylation reaction products was investigated by colorimetry, differential scanning calorimetry, infrared spectroscopy, and circular dichroism spectrum. After DHPM treatment, the content of free amino group in BSA-glucose glycosylation products was significantly reduced, which first decreased and then increased with increasing pressure. Differential scanning calorimetry analysis showed that the thermal stability of glycosylation products first increased and then decreased as the pressure increased. Infrared spectroscopy and circular dichroism spectrum analysis showed changed secondary structure. These results indicate that DHPM can promote the glycosylation of BSA-glucose system.
bovine serum albumin; dynamic high pressure microflu idization; glycosylation; structure
TS201.2
1002-6630(2015)11-0017-04
10.7506/spkx1002-6630-201511004
2014-06-30
國家自然科學基金地區科學基金項目(2007DA105064)
涂宗財(1965—),男,教授,博士,主要從事極端條件下食品蛋白質營養與安全研究。E-mail:tuzc_mail@aliyun.com

