過量表達棉花GDSL脂肪酶提高甘藍型油菜油脂含量的研究
郝曉云 蔡永智 袁哈利 李 榕 王 斐 李鴻彬,2
(石河子大學生命科學學院1,石河子 832003)(石河子大學農業生物技術重點實驗室2,石河子 832003)
過量表達棉花GDSL脂肪酶提高甘藍型油菜油脂含量的研究
郝曉云1蔡永智1袁哈利1李 榕1王 斐1李鴻彬1,2
(石河子大學生命科學學院1,石河子 832003)(石河子大學農業生物技術重點實驗室2,石河子 832003)
GDSL脂肪酶作為一種脂質水解酶具有廣泛的底物特異性,在植物的油脂代謝、生長發育等眾多生理過程中發揮著重要作用。利用RT-PCR技術從發育的陸地棉種子中克隆得到棉花的GDSL脂肪酶基因的cDNA,該基因開放讀碼框為1 068 bp,編碼含有356個氨基酸的蛋白質。對棉花種子發育不同時期進行半定量PCR分析的結果表明,在種子發育15~20 d時,GhGLIP基因的表達量較高。將該基因構建到真核表達載體pCAMBIA2300中,轉入農桿菌GV3101后轉化甘藍型油菜野油19,通過篩選和鑒定獲得轉基因陽性油菜株系。轉基因油菜的GDSL脂肪酶活力獲得了顯著提高,轉基因油菜種子的油脂含量比野生型油菜提高了8.68%,提高比率為24.3%。
棉花種子 GDSL脂肪酶 油脂含量 甘藍型油菜
油菜是我國重要的油料作物,油菜籽不僅可以用于榨油供人們食用,還可以作為生物柴油的原料,對其含油量的研究一直是研究的熱點。油菜籽含油量的高低因品種類型不同而有很大差異。與加拿大等國相比,我國多數油菜品種的含油量偏低,尤其是長江流域冬油菜產區的菜籽含油量僅為40%左右,比加拿大的油菜品種低2%~3%,油脂加工效益較低[1-2]。因此,國內外許多學者在育種、栽培、基因工程技術等領域開展了大量研究,以期達到提高油菜種子含油量的目的[3]。在與種子含油量密切相關的生理生化方面,如蛋白質、可溶性糖、淀粉等與種子含油量相關的報道較多。劉后利[2]認為油菜種子成熟期即脫水期油脂含量與脂肪酶的參與有很大的關聯。
GDSL脂肪酶(GDSL lipase,GLIP)是一種脂質水解酶,許多研究表明GDSL脂肪酶在植物的油脂代謝及生長發育過程中發揮著重要作用。Eastmond[4]從擬南芥中獲得一個脂肪酶基因SDP1,該基因的缺失會導致擬南芥種子萌發受阻,在培養基中添加蔗糖后植物能夠繼續萌發生長。該基因編碼的蛋白定位于油體表面,主要在種子發育過程中表達。Ling等[5]從甘藍型油菜中克隆了2個GDSL脂肪酶基因BnLIP1 和BnLIP2,發現它們很可能與油菜種子的萌發、花和角果的形成及發育有關。Padham等[6]克隆了質體相關的脂肪酶基因At2g31690,認為該基因可能通過油體內的三酰甘油來維持葉綠體的完整性。植物脂肪酶不只在種子中表達,在擬南芥的根、莖、葉、花中都有表達,尤其在衰老的葉片中有高量表達[7]。
目前,對棉花GDSL脂肪酶的克隆和功能研究鮮有報道。在前期建立的甘藍型油菜野油19的再生體系基礎上[8],本研究從陸地棉徐-142發育的種子中克隆得到一個棉花GDSL脂肪酶基因GhGLIP,將該基因轉入甘藍型油菜野油19,顯著提高了油菜種子油脂含量。本研究為闡明棉花GDSL脂肪酶基因在棉花種子發育過程中及在油菜種子含油量調控中的重要作用提供了參考,并為進一步培育高含油量油菜品種提供了基礎。
1 材料與儀器
1.1 植物材料
陸地棉徐-142、甘藍型型油菜野油19由本實驗室培養,種子材料經液氮速凍后,于-80 ℃冰箱保存。
1.2 菌株和表達載體
大腸桿菌DH 5α、農桿菌GV 3101和表達載體pCAMBIA 2300由本實驗室保存。
1.3 試劑和酶
瓊脂糖凝膠回收試劑盒、質粒小提試劑盒、2×PCR Master Mix:天根生化科技(北京)有限公司;限制性內切酶BamHⅠ、XhoⅠ、KpnⅠ、XbaⅠ、T4 DNA Ligase、RNA反轉錄試劑、pMD-19T Vector:大連寶生物公司;對硝基苯酚棕櫚酸酯:上海銘睿生物科技有限公司;其他試劑為國產分析純。
1.4 儀器
Eppendorf PCR儀、Eppendorf 5424R型離心機:Eppendorf North America;HVE-50型高壓蒸汽滅菌鍋:上海申安醫療器械廠;Tannon Epson100型核酸電泳儀:上海天能設備有限公司;微波爐:佛山市順德區美的微波爐電器制造有限公司;BHC-1300A/B3型超凈工作臺:蘇州市蘇信凈化設備廠;ZF-158型凝膠成像分析系統:上海金鵬分析儀器有限公司;ZF-90型多功能暗箱式紫外透射儀:鄭州南北儀器設備有限公司(南北設備集團);ZSD-A1270A恒溫培養箱、ZHWY-100B恒溫搖床:上海智誠分析儀器有限公司;JY200C型蛋白質電泳儀:北京君意華鑫科技有限公司。
2 試驗方法
2.1 基因克隆
2.1.1 RNA的提取
RNA所用的EP管、槍頭盒、槍頭、試劑瓶等經DEPC水處理24 h,高壓滅菌處理后使用,研缽和藥勺經180 ℃烘烤6 h后備用[9]。參考李晶等[10]的方法提取棉花種子總RNA。
2.1.2 RNA反轉錄合成cDNA
用反轉錄試劑以提取的RNA為模板反轉錄成cDNA。反轉錄過程如下:在200 μL EP管中加入以下試劑:Total RNA 7 μL,Oligo(dT)2 μL,DEPC處理水1 μL;70 ℃水浴5 min;冰浴5 min;在上述EP管中再加入以下試劑:5×AMV RT synthesis buffer 4 μL;AMV Reverse Transcriptase(200 U/μL)1 μL;10 mmol/L dNTP Mixture 2 μL;RNase Inhibitor(40 U/μL)1 μL;EDPC 處理水2 μL;37 ℃水浴60 min;70 ℃水浴10 min;冰浴5 min后,于-20 ℃保存備用。
2.1.3 GhGLIP基因全長開放讀碼框的獲得
根據從GenBank EST數據庫所獲得的棉花片段序列信息,利用軟件設計上下游引物,并添加酶切位點和保護堿基,劃線部分為酶切位點,前面是保護堿基,上下游酶切位點分別為KpnⅠ和XbaⅠ,引物序列如下:
GhGLIP上游:5′-CGGGGTACC ATGGATGGTTATTGTAGCAGAAGG-3′
GhGLIP下游:5′-TGCTCTAGA AATGAGGGC AATGCCCTGAA-3′
PCR反應體系(20 μL):2×PCR Master Mix 10 μL;模板DNA 2 μL;上、下游特異性引物(25 μM)各0.2 μL; ddH2O 7.6 μL。將反應物加入0.2 mL EP管中,瞬時離心混勻,進行PCR反應。
反應程序:95 ℃預變性4 min,95 ℃變性30 s,60 ℃退火45 s,72 ℃延伸1 min 15 s,30次循環,72 ℃延伸7 min。
PCR反應結束后,用1.0% 的瓊脂糖凝膠電泳,檢測目的條帶。
2.2 半定量RT-PCR分析
以棉花開花后0、5、10、15、20、30、40、50、60 d的種子和發育15~20 d的棉花幼苗為材料,提取總RNA,反轉錄成cDNA,以cDNA為模板,對GhGLIP基因的表達量進行分析。選擇UBQ7為內參基因,引物序列為:
上游:5′-AGAGGTCGAGTCTTCGGACA-3′
下游:5′-GCTTGATCTTGGGCTTG-3′
PCR反應程序為:95 ℃預變性5 min,95 ℃變性45 s,55 ℃退火45 s,72 ℃延伸30 s,28個循環,72 ℃延伸10 min,4 ℃保存,PCR產物為200 bp。
以調節好濃度的cDNA為模板,用GhGLIP基因的RT-PCR引物,進行PCR反應,對基因表達量進行檢測,PCR產物為425 bp。GhGLIPRT-PCR引物序列如下:
上游引物:5′-CCTTGGCCCAGAAGCATCAG-3′
下游引物:5′-TCTCGTGGTAACCGAACAAT-3′
RT-PCR反應條件:95 ℃預變性4 min,94 ℃變性30 s,56 ℃退火45 s,72 ℃延伸45 s,25次循環,72 ℃延伸10 min。
2.3 GLIP蛋白酶活力分析
取約0.1 g材料,加入預冷的2 mL 50 mmol/L 的磷酸緩沖液(pH 7.0),研磨成勻漿,轉入2 mL 離心管中,4 ℃,13 000 r/min離心15 min,收集的上清液為蛋白酶提取液,用于后續的酶活力測定。酶活力測定反應混合物含有50 mmol/L磷酸鈉緩沖液(pH 7.0),1 mmol/L對硝基苯酚月桂酸酯,5%異丙醇,加入含50 μg蛋白酶提取液,37 ℃反應15 min, 100 ℃放置1~2 min,冷卻至室溫后在405 nm處的紫外分光光度計下測定吸光度值。以每分鐘對硝基苯酚月桂酸酯生成1 mmol/L對硝基苯酚所需的酶量為一個酶活力單位。
2.4 植物表達載體的構建
植物表達載體為pCAMBIA2300,酶切位點設計、PCR、電泳等其余步驟同2.1.3。
2.5 油菜的遺傳轉化
2.5.1 轉化受體的獲得
油菜無菌苗的獲得和外植體的選擇參考文獻[8]方法。將培養5 d的無菌油菜苗的下胚軸切成0.5~1 cm的小段,MS+1.5 mg/L 2,4-D預培養4 d,準備進行農桿菌介導的遺傳轉化。
2.5.2 農桿菌介導法轉化油菜
將pCAMBIA2300-GhGLIP質粒轉入農桿菌GV3101后并轉化野油19[8,12],獲得的再生芽長到2~3 cm時,剪下并移栽到生根培養基中(1/2 MS+0.5 mg/L IBA+15 mg/L Kan+400 mg/L Cef)。15~20 d待根系發育好后,打開培養基瓶口,煉苗2 d,洗去無菌苗上的培養基,移栽到草炭土∶珍珠巖=3∶1的土中[13],在培養室培養。
2.6 轉基因油菜的篩選與鑒定
收取T0轉基因油菜種子后,將其種在MS+100 mg/L Kan培養基中進行篩選和培養10 d。將含有抗性的苗移至草炭土∶珍珠巖=3∶1的土壤中進行培養,當油菜苗長出真葉后,對含有抗性的油菜苗,提取總DNA,進行PCR鑒定。PCR鑒定出來的苗為轉基因油菜。
2.7 油菜油脂含量的測定
用酸水解法測定總脂含量[14-15]。稱取成熟的且已烘干的油菜種子約0.25 g,將種子在研缽中研碎,置于10 mL帶蓋離心管中,加入1 mL滅菌蒸餾水, 混勻后加入1.5 mL 鹽酸,將離心管置于75 ℃水浴中20 min,取出離心管,加入1.5 mL 95%的乙醇,混勻。冷卻后加入2.5 mL 乙醚,加蓋振搖1 min,小心開蓋,不斷放出管內的氣體。4 000 r/min離心2 min,吸取上清液于已恒重的錐形瓶中,再加1 mL乙醚于離心管中,加蓋振搖1 min,4 000 r/min離心2 min,吸取上清液于原錐形瓶中。將錐形瓶置于水浴鍋上蒸干,再置于95 ℃ 烘箱中干燥2 h,取出冷卻后稱重。
式中:m0為稱量的油菜種子的質量/g;m1為錐形瓶的質量/g;m2為錐形瓶和脂肪的總質量/g。
3 結果與討論
3.1 GhGLIP基因的克隆
用CTAB法提取棉花胚珠的總RNA,結果顯示RNA呈現成明顯的2條帶,提取的RNA質量較好,可進行反轉錄合成cDNA進行后續試驗(圖1a )。以cDNA為模板,通過PCR擴增獲得目的片段,連接T載體后,測序獲得GhGLIP基因的全長序列,片段大小為1 068 bp,與預期的結果相符(圖1 b)。
注:1、2為RNA的電泳檢測結果,M為DNA MakerⅢ; 3、4為PCR擴增條帶。
圖1GhGLIP基因克隆
3.2 GhGLIP蛋白的序列比對與進化樹構建
將獲得的GhGLIP氨基酸序列與大豆GmGLIP、苜蓿 MtGLIP、油菜 BnGLIP1、油菜BnGLIP2等植物的氨基酸序列進行對比。結果顯示這幾種植物的氨基酸序列在N-端含有信號肽,都具有典型的保守域blockⅠ、Ⅱ、Ⅲ和Ⅴ。GDSL-motif位于blockⅠ中,Ser作為blockⅠ的親核體,把質子供體傳給氧離子孔;blockⅡ中的Gly和blockⅢ中的Asn為氧離子孔提供兩個其它的質子供體;blockⅤ中的His殘基能使blockⅠ中的Ser通過去質子化而更加親核(圖2)。將棉花的GhGLIP氨基酸序列與其他幾種植物GLIP的氨基酸序列構建系統進化樹,棉花 GhGLIP和高粱及油菜的進化關系較近(圖3)。

注:橫線表示信號肽; ▼表示活性位點; ●表示氧離子孔的位置; 方框表示保守域。植物GLIP的Genbank 登錄號為:GmGLIP:NM_001255437.2; MtGLIP:XP_003629880.1; BnGLIP1:AAX59709.1; BnGLIP2:AAX58135.1。
圖2 棉花GhGLIP的氨基酸序列比對

注:植物GLIP的Genbank 登錄號為:GmGLIP:NM_001255437.2; MtGLIP:XP_003629880.1; CaGLIP1:DQ119290.1; AtGLIP:NP_174259; MbGLIP:ABF70089.1; BdGLIP:XP_003569805.1; PtGLIP:XP_002304022.1; SbGLIP:ADQ08655.1; BnGLIP2:AAX58135.1; BnGLIP1:AAX59709.1; ZmGLIP:AFW63334.1; VvGLIP:CAN82331.1; OsGLIP:BAD73018.1。
圖3 棉花GhGLIP的進化樹構建
3.3 GhGLIP基因在棉花種子不同發育時期的表達分析
對棉花0~60 d不同發育時期的胚珠和棉花幼苗進行表達分析。在棉花開花后10~20 d的胚珠中GhGLIP基因的表達量較高,在15 d表達量達到最高,30 d后幾乎檢測不到表達量。GhGLIP基因在棉花幼苗的莖和葉中有一定表達,在根中幾乎檢測不到(圖4)。
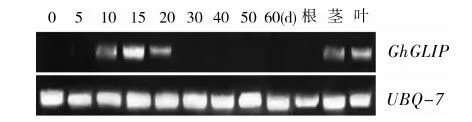
圖4 棉花GhGLIP基因的表達分析
3.4 植物過量表達載體的構建與轉基因油菜的篩選鑒定
按照圖5所示構建植物過量表達載體。對測序正確的質粒和pCAMBIA2300質粒同時用KpnⅠ和XbaⅠ進行雙酶切,回收目的片段和載體大片段,連接后,轉化大腸桿菌DH5α感受態細胞,挑取單菌落進行PCR鑒定(圖6a),并進一步對質粒進行雙酶切鑒定(圖6b),成功構建了植物過量表達載體pCAMBIA2300-GhGLIP。
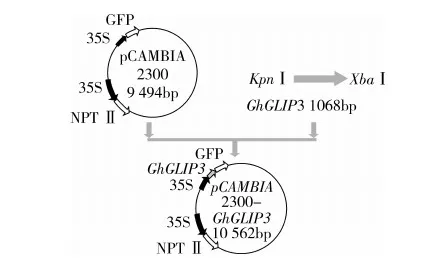
圖5 pCAMBIA2300-GhGLIP表達載體構建示意圖
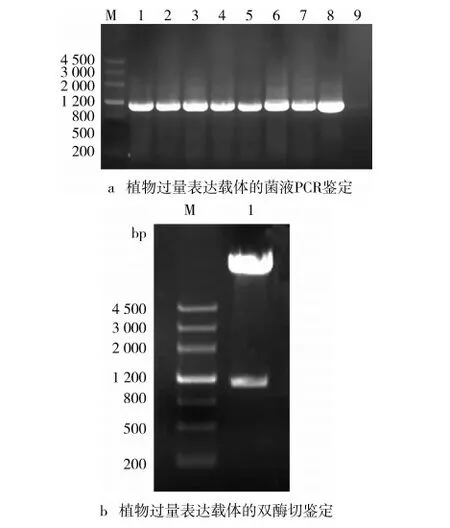
注:圖a中M,MakerⅢ; 1-7,菌液PCR產物; 8,陽性對照; 9,陰性對照; M,MakerⅢ;圖b中1,雙酶切產物。
圖6 植物過量表達載體的鑒定
以油菜幼苗的下胚軸為受體,利用農桿菌介導法轉化油菜。將轉化成功的幼苗移入土壤中進行培養,直至成熟。收獲種子后,通過抗生素卡那霉素初篩獲得含有Kan抗性的油菜植株。對含有抗性的油菜植株進一步提取DNA進行PCR鑒定(圖7),獲得轉基因油菜株系。
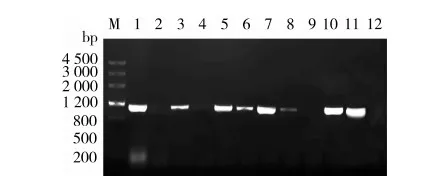
注:M,Marker Ⅲ; 1~10為不同轉基因株系的GhGLIP基因的PCR條帶; 11為陽性對照; 12為陰性對照。
圖7 轉基因油菜的鑒定
3.5 油菜酶活力和油脂含量分析
對獲得的轉GhGLIP基因油菜測定其GDSL脂肪酶活力,野生型油菜的酶活力為 18.6,轉基因油菜的酶活力為 88.3,轉基因油菜的GDSL酶活力獲得了顯著的提高;用酸水解法測定野生型油菜和轉基因油菜種子的油脂含量,野生型油菜的油脂質量分數為35.67%,轉基因油菜的油脂質量分數為44.35%,轉GhGLIP基因的油菜種子油脂含量提高了8.68%,提高比率為24.3 %(圖8)。
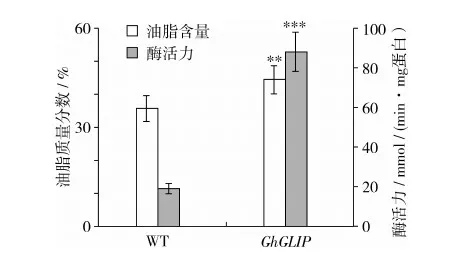
注:WT為野生型油菜;GhGLIP為轉基因油菜。**表示P<0.01,***表示P<0.001。
圖8 油菜酶活力和油脂含量分析
4 討論與結論
GDSL脂肪酶通過水解脂質進一步參與植物油脂代謝和生長發育等生理過程。目前,許多GDSL脂肪酶基因已經獲得了克隆,具有表達的組織特異性并參與種子萌發、油體形成等過程[5-7],本研究從棉花胚珠中克隆得到一個GDSL脂肪酶基因GhGLIP,這也是首次對棉花該基因的研究,GhGLIP具有典型的GDSL結構域和保守的功能域。GhGLIP基因表達具有一定的特異性,在10~20 d發育的胚珠中表達量較高,在莖和葉中也有部分表達。
油菜的遺傳轉化是近年來的一個研究熱點,農桿菌介導的轉化法是常用的轉化方法,但是農桿菌介導的轉化法轉化效率較低,并且受很多因素如外植體再生體系、基因型差異等的影響。在甘藍型油菜轉化體系中,研究者已經用下胚軸、花序莖、小孢子、莖節間以及子葉等進行轉化得到了一些轉化體,但轉化率均不太高,其中在外植體選擇上用下胚軸和子葉的較多[12-13,16-18]。本研究以甘藍型油菜野油19號的下胚軸為外植體,轉化率約為7.4%,建立了野油19的再生體系。構建了植物過量表達載體并轉化油菜,通過篩選和鑒定,獲得了轉GhGLIP基因油菜株系。
脂肪酸合成是種子胚胎發育過程中油脂積累的關鍵因素。研究表明很多基因都能調控種子的含油量,如擬南芥ACC合成酶、酵母中與三酰甘油酯合成相關的溶血磷脂酰基轉移酶、擬南芥二酰甘油酰基轉移酶等,這些基因的過量表達使種子含油量提高了5%~25%[19-22],本研究將棉花GDSL脂肪酶基因GhGLIP轉化甘藍型油菜,轉基因油菜GDSL酶活力表達獲得了顯著的提高,種子含油量提高了8.68%,提高率約為24.3%,說明GDSL脂肪酶活力的提高與種子油脂含量之間的密切聯系。
脂肪酸是生物體中重要的組成成分,參與細胞發育過程中一些重要的信號轉導過程,因此,細胞中脂肪酸的組成、含量及存在形式對細胞的生存和正常生長是至關重要的。GDSL脂肪酶能水解多種酯類物質而產生不同形式的脂肪酸,可能通過調節脂肪酸的合成,以及參與激素乙烯介導的信號途徑而進一步調控植物種子的油脂含量[23-24]。
[1]劉唐興.油菜品質育種的目標和方法[J].現代農業科技,2007(8):95-97
[2]劉后利.油菜的遺傳與育種[M].上海:上海科學技術出版社,1985:88-126
[3]龍艷,牛應澤.我國油菜品質育種研究的進展與展望[J].四川農業大學學報,2002,20(4):372-376
[4]Eastmond P J.SUGAR-DEPENDENT1 encodes a patatin domain triacylglycerol lipase that initiates storage oil breakdown in germinatingArabidopsisseeds[J].The Plant Cell,2006,18:665-675
[5]Ling H,Zhao J Y,Zuo K J,et al.Isolation and expression analysis of a GDSL-like lipase gene fromBrassicanapusL.[J].Journal of Biochemistry and Molecular Biology,2006,39(3):297-303
[6]Padham A K,Hopkins M T,Wang T W,et al.Characterization of a plastid triacylglycerol lipase from Arabidopsis[J].Plant Physiology,2007,143:1372-1384
[7]Kaup M T,Froese C D,Thompson J E.A role for diacylglycerol acyltransferase during leaf senescence[J].Plant Physiology,2002,129:1616-1626
[8]郝曉云,沈海濤,李鴻彬.甘藍型油菜下胚軸和帶柄子葉再生體系的研究[J].生物技術通報,2013(4):69-74
[9]田大鵬,葛娟,石峰,等.棉花GhDHAR2基因克隆、功能序列分析及原核表達[J].生物技術通報,2012(7):65-69
[10]李晶,王亦學,鄭德剛,等.一種簡單高效提取棉花不同組織總RNA的方法[J].山西農業科學,2009,37(5):17-19
[11]江洪,李平,王世全,等.農桿菌介導的幾個甘藍型油菜下胚軸轉化體系研究[J].西南農業學報,2006,19(5):800-805
[12]李紅.油菜離體再生體系的建立及遺傳轉化的研究[D].武漢:華中科技大學,2008
[13]唐桂香.油菜高效再生體系的創建及農桿菌介導法基因轉化研究[D].杭州:浙江大學,2004
[14]李秀花.酸水解法測定食品中脂肪含量與索氏抽提法的比較[J].山西醫科大學學報,1999,30(4):383-384
[15]何海情.酸水解法測豆奶粉脂肪的探討[J].汕頭大學學報:自然科學版,2009,24(1):50-55
[16]Khan RM,Rashid H,Ansar M,et al.High frequency shoot regeneration andAg-robacterium-mediated DNA transfer in Canola(Brassicanapus)[J].Plant Cell Tiss Organ Cult,2003,75:223-231
[17]何業華,熊興華,官春云,等.根癌農桿菌介導TA29-Barnase基因轉化甘藍型油菜的研究[J].作物學報,2003,29(4):615-620
[18]孔凡明.一個新的油菜轉化體系的優化和血紅蛋白基因SLR2097向甘藍型油菜中的轉化[D].鎮江:江蘇大學,2008
[19]Thelen J J,Ohlrogge J B.Both antisonse and sense expression of biotin carboxyl carrier protein isoform2 inactivates the plastid acetylcoenzyme A carboxylase inArabidopsisthaliana[J].Plant J,2002,32(4):419-431
[20]Zou J,Katavic V,Giblin EM.Modification of seed oil content and aeyl composition in the brassicaceae by expression of a yeast sn-2 aeyltransferase gene[J].Plant Cell,1997,9:909-923
[21]Jako C,Kumar A,Wei Y.Seed-specific over-expression of an Arabidopsis cDNA encoding a diacylglycerol aeyltransferase enhances seed oil content and seed weight[J].Plant Physiol,2001,126:861-874
[22]陳錦清,郎春秀,胡張華,等.反義PEP基因調控油菜籽粒蛋白質/油脂含量比率的研究[J].農業生物技術學報,1999,7(4):1-6
[23]Reina R J,Guerrero C,Heredia A.Isolation,characterization,and localization of AgaSGNH cDNA:a new SGNH-motif plant hydrolase specific Agave americana L.leaf epidermis[J].Journal of Experimental Botany,2007,58(11):2717-2731
[24]Kwon S J,Jin H C,Lee S,et al.,GDSL lipase-like 1 regulates systemic resistance associated with ethylene signaling in Arabidopsis[J].The Plant Journal,2009,58:235-245.
Overexpression of a Cotton GDSL Lipase Increases the Oil Content ofBrassicanapusL.
Hao Xiaoyun1Cai Yongzhi1Yuan Hali1Li Rong1Wang Fei1Li Hongbin1,2
(College of Life Science of Shihezi Universtiy1, Shihezi 832003)(Key Laboratory of Agrobiotechnology of Shihezi University2, Shihezi 832003)
GDSL lipase (GLIP), a lipid hydrolase with broad substrate specificity, exists in plant tissues, playing important roles in plants' lipid metabolism, growth and development and many other physiological processes. In the study, a cotton GDSL lipase named GhGLIP has been isolated from cotton ovules by RT-PCR method. The full open reading frame was 1 068 bp, containing a protein of 356 amino acids. Semi-quantitative PCR analysis of different cotton ovule development periods showed thatGhGLIPgene expressed higher values in 15~20 d ovules. The plant over expression vector pCAMBIA2300-GhGLIP was obtained then transformed intoBrassicanapusL. (wild-
oil 19) by agrobacterium mediated method. Transgenic oilseed rape plants were obtained after screening and identification with a significant promotion of GDSL lipase enzyme activity; the oil content of transgenic Brassica napus seeds was significantly enhanced by 8.68% higher and a increase ratio of 24.3% than wide-type.
cotton seed, GDSL lipase, oil content, L.
TS213.2
A
1003-0174(2014)06-0063-07
國家自然科學基金(31260339),兵團種質資源創新專項(2012BB050),石河子大學杰出青年項目(2012ZR KXJQ03)
2013-06-20

