花生濃縮蛋白超聲改性的工藝條件*
趙雪淞,藺雅菲,劉民
1(遼寧工程技術大學 礦業學院,遼寧 阜新,123000)2(遼寧工程技術大學理學院,遼寧阜新,123000)
花生濃縮蛋白是從脫脂花生粕中除去可溶性糖、灰分等,制得蛋白含量65%(N×6.25,干基)以上的花生蛋白產品,可作為食品添加劑及糧食強化劑廣泛應用于食品及飼料工業[1]。制取花生濃縮蛋白的方法主要有乙醇浸提法和堿溶酸沉法[2,3]。堿溶酸沉法能制得氮溶解指數(NSI)較高的產品,但其風味和色澤不如醇洗法制備的產品好,且有大量廢水排放。乙醇浸提法是較好的濃縮蛋白制備方法,但該方法的缺點是溶解性偏低,持水性、乳化穩定性及凝膠性較差,限制了其在食品工業中的應用[2-4]。為了充分利用花生濃縮蛋白,提高其附加值,必須改善其功能性質。花生蛋白改性方法主要有物理改性、化學改性和酶法改性[5]。其中物理改性方法由于具有無毒、可接受性高的特點,更利于在食品工業中應用。本文以自制的醇洗花生濃縮蛋白為原料,考察了超聲波處理功率和處理時間對花生濃縮蛋白各項功能性質(溶解性、乳化活性及乳化穩定性、起泡性及泡沫穩定性、吸水性、持油性和凝膠性質)的影響,并優化了改性條件。
1 材料與方法
1.1 材料與儀器
脫脂花生蛋白粉,阜新黑土地油脂有限公司提供。
Scientz-12型冷凍干燥機,寧波新芝生物科技股份有限公司;BM251C型粉碎機,廣東美的精品電器制造有限公司;HH-8型數顯恒溫水浴鍋,國華電器有限公司;KDC-160HR型高速離心機,科大創新股份有限公司中佳分公司;2DP-150型震蕩培養箱,上海精宏實驗設備有限公司;S10型高速分散器,寧波新芝生物科技股份有限公司;752型分光光度計,上海欣茂儀器有限公司;78-1型磁力攪拌器,寧波新芝生物科技股份有限公司;SCIENTZ-ⅡD型超聲波細胞粉碎儀,寧波新芝生物科技股份有限公司;2300型自動定氮儀、Soxtec Avanti 2050型自動索氏總脂肪分析系統,瑞典Foss公司。
1.2 實驗方法
1.2.1 原料和產品主要成分的測定
蛋白質含量測定:凱氏定氮法,參照 GB/T 5009.5-2010;脂肪含量的測定:索氏提取法,參照GB/T 5009.6-2003;水分含量的測定:直接干燥法,參照GB/T 5009.3-2010;灰分含量的測定,參照GB 5009.4-2010;總糖含量的測定:苯酚硫酸法。
1.2.2 花生濃縮蛋白的制備方法
將脫脂花生蛋白粉過20目標準篩,然后準確稱取2 g裝入三頸瓶中。將配置成體積分數75%濃度的乙醇溶液置于水浴鍋中加熱,當達到50℃時按料液比(g∶mL)1∶6加入三頸瓶中,保持溫度 30 min,然后離心分離,所得沉淀再次浸洗,浸洗物離心分離(3 000 r/min,20 min),浸洗3次,最后將蛋白沉淀冷凍干燥,即得到濃縮蛋白產品[6]。
1.2.3 超聲波處理方法
按1.2.2比例放大制備花生濃縮蛋白。稱取花生濃縮蛋白50 g,加入45℃的熱水溶解于燒杯中,配置成8%的蛋白溶液,旋渦振蕩均勻后,調節該蛋白溶液的pH值為7.2,再放置于超聲波發生器內,將超聲波細胞粉碎機的探頭深入液面下2 cm,在一定功率下超聲振蕩一定時間,最后冷凍干燥得改性產品,測定功能特性。
1.2.4 蛋白溶解性測定
半微量凱氏定氮法,參照GB5511-1985。

1.2.5 蛋白吸水性測定
10%的蛋白液10 mL移入15 mL離心管中,旋渦震蕩2 min確保蛋白全部均勻分散,室溫下靜置30 min,離心3 000 r/min,20 min。棄上清液,稱重。試驗做3次重復。吸水性為每克蛋白結合水的克數。
1.2.6 蛋白持油性測定
稱取1g蛋白(m0),加入10mL(V1)大豆油,并用旋渦震蕩儀使溶液混合均勻,室溫下靜置30 min,離心3 000 r/min,20 min,迅速將上層物小心移入干燥的10 mL量筒中,記錄體積(V2)。試驗做3次重復。持油性/
1.2.7 蛋白乳化性及乳化穩定性測定
采用濁度法測定,具體操作如下:取0.5 g/L濃度的蛋白溶液40mL,加入40 mL大豆油;用高速分散器(12 000 r/min)攪拌2 min;用注射器從底部取50 μL乳狀液,與10 mL 0.1%的SDS緩沖溶液混合均勻,在500 nm波長下比色,記錄吸光度(E0);10 min后再從底部取50 μL乳狀液,同樣稀釋比色,記錄吸光度(Et)。蛋白質的乳化性以E0表示,乳化穩定性=Et/E0,試驗做3 次重復[7]。
1.2.8 起泡性及泡沫穩定性測定
1%的蛋白質溶液(pH 7.4)取100 mL,用高速分散器(12 000 r/min)攪拌3 min;轉入量筒,盡快記錄泡沫體積(V0),靜置15 min、30 min后各再次記錄泡沫體積(Vt)。
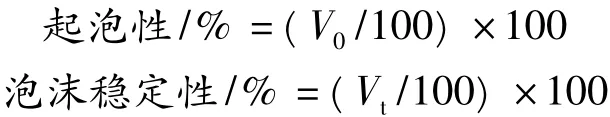
1.2.9 蛋白最低凝膠點的測定
取蛋白樣品溶于10 mL 0.1 mol/L的NaCI溶液中,制成 20、60、100、140、180 g/L 的溶液,調 pH 值到7.0,在90℃水浴中加熱60 min,冷至室溫,置于4℃條件下12 h以上,觀察凝膠情況:凝膠不流動的樣品為“+”,可形成凝膠;反之為“-’,不能形成[7]。
1.2.10 游離及總巰基含量測定
樣品60 mg于10 mL含有8 mol/L尿素的的緩沖液(Tris-Gly,pH 8.0)中攪拌溶解1 h,離心(12 000 r/min)10 min。游離巰基(SHF)測定:2 mL上清液,加入 80 μL Ellman’s試劑,4 mg/mL DTNB(5,5’-二硫代-雙-(2-硝基苯甲酸),立刻混勻,5 min后測412 nm吸光度。總巰基(SHT)測定:取2 mL上清液,加入0.2%巰基乙醇處理樣品2 h后,加入12%三氯乙酸(TCA)4 mL,靜置1 h,離心(12 000 r/min)10 min,12%TCA洗滌沉淀4次,沉淀溶于3 mL Tris-Gly緩沖液中,取2mL液體測巰基含量。以Ellman’s試劑-SH的摩爾吸光系數1.36×104計算蛋白質的—SH含量。
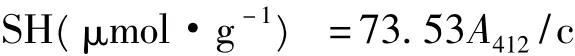
式中:A412:412 nm吸光度,c:樣品濃度(mg/mL),73.53:106/(1.36 ×104)。二硫鍵(—S—S—)=(SHT- SHF)/2[7]。
2 結果與分析
2.1 花生粕和花生濃縮蛋白的組分含量
本研究以冷榨花生粕為原料,采用乙醇浸提法自制花生濃縮蛋白。由表1可知,花生粕中蛋白質含量為37.23%,而制備成濃縮蛋白之后蛋白質含量有明顯的增加,達到71.05%,同時水分、灰分、脂肪等含量明顯下降,各項組分指標符合花生濃縮蛋白的質量要求。

表1 花生粕和花生濃縮蛋白各組分的含量%Table 1 The content of various components of the peanut meal and peanut protein concentrate%
2.2 超聲處理強度對蛋白質功能性質的影響
2.2.1 吸水性
蛋白質組分吸附和持留水分的能力對食品組成結構和品質有重要作用。由圖1可知,不同超聲強度處理后的花生濃縮蛋白吸水性呈先上升后下降的趨勢,超聲功率為700 W時吸水性達到最大值2.550 g/g,繼續加大超聲功率吸水性開始下降。因此,700 W確定為吸水性的最優超聲功率。

圖1 超聲處理強度對蛋白吸水性的影響Fig.1 Effect of ultrasonic irradiation power on water holding capacities of protein
2.2.2 持油性
蛋白質與脂質的相互作用受諸多因素的影響。非共價鍵是蛋白與油脂間的主要作用力,其次是氫鍵和疏水相互作用力。蛋白質的持油性在肉制品、焙烤食品、油炸食品等加工中起著非常重要的作用。由圖2可知,超聲功率在100~500 W時,持油性變化不明顯,500 W后,持油性升高,700 W時持油性達到最大值,繼續加大功率,持油性快速下降。因此,700 W為持油性的最優超聲功率。

圖2 超聲處理強度對蛋白持油性的影響Fig.2 Effect of ultrasonic irradiation power on oil binding capacities of protein
2.2.3 溶解性
蛋白產品的溶解性好是其作為食品蛋白質原料的首要條件,因為蛋白質的溶解性影響著許多其他功能特性,尤其是增稠、乳化、起泡和凝膠性質,也會對其在食品中的穩定性和風味等有直接影響[8]。其溶解性衡量指標是氮的可溶性指數(NSI)。由圖3可知,隨著超聲強度的升高,花生濃縮蛋白的溶解性呈一直上升的趨勢。而本實驗中所用的最大功率即900 W已達到實驗室儀器的最大功率值。因此,以實驗室現實條件為準,900 W為溶解性的最優超聲功率。
2.2.4 乳化性及其乳化穩定性
乳化能力是衡量蛋白質促進油-水型乳狀液形成能力的指標。乳化穩定性是指維持乳狀液穩定存在的能力。蛋白質是一種表面活性劑,它能降低水和油的表面張力,使之易于乳化。另一方面,蛋白質分散在非連續相和連續相之間的界面上,能夠阻止非連續相的聚集,起到穩定乳狀液的作用。由圖4可知,不同超聲強度處理后的花生濃縮蛋白乳化性呈先上升后下降再趨于平緩的趨勢,功率從100 W上升到300 W時,乳化性迅速上升,功率為500 W時乳化性下降,繼續加大功率到700 W以上時,乳化性上升并逐漸趨于平穩。不同超聲強度處理后,花生濃縮蛋白的乳化穩定性同樣在700 W后呈現趨于平緩的趨勢。因此,700 W確定為乳化性及乳化穩定性的最優超聲功率。

圖3 超聲處理強度對蛋白溶解性的影響Fig.3 Effect of ultrasonic irradiation power on protein solubility

圖4 超聲處理強度對蛋白乳化性及其乳化穩定性的影響Fig.4 Effect of ultrasonic irradiation power on emulsifying capacity and emulsifying stability of protein
2.2.5 起泡性及其泡沫穩定性
泡沫的形成類似于乳化液的形成。泡沫形成于水分子對空氣的包裹,空氣是非極性介質,而蛋白是兩性分子,因此它可以作為空氣-水表面的介質促成泡沫形成[9]。由圖5可知,在功率達到700 W以后,起泡性及其泡沫穩定性達到最大,繼續加大功率,變化不大。因此,700 W為起泡性及其泡沫穩定性的最優超聲功率。

圖5 超聲處理強度對蛋白起泡性及其泡沫穩定性的影響Fig.5 Effect of ultrasonic irradiation power on foaming capacity and foaming stability of protein
2.2.6 蛋白最低凝膠點
凝膠性是蛋白的重要功能性質之一,它賦予食品良好的凝膠組織結構,使食品對水分、脂質、糖類和其他成分具有良好的束縛作用,同時增加食品咀嚼感,為肉制品保持水分、脂肪提供基礎[10]。蛋白凝膠特性表現在擁有高的黏附力,塑性和彈性。這一性質在香腸制品中非常重要,同時也是豆腐形成的基礎。由表2可以看出,超聲功率為100 W時,蛋白濃度為18%時才能形成凝膠,而超升功率為700 W時,在蛋白濃度為10%時形成了良好的自持凝膠,因此,700 W為蛋白形成凝膠的最優功率,10%濃度為蛋白最低凝膠點。

表2 超聲處理強度對蛋白凝膠性的影響Table 2 Effect of ultrasonic irradiation power on gelatin of protein
2.2.7 游離巰基及二硫鍵含量的測定
超聲波可促使蛋白質分子間和分子內部的非共價鍵、—S—S—等斷裂,增加蛋白中的—SH含量,提高蛋白的表面親水性,以此增加蛋白的溶解性,同時保存蛋白中的—SH含量并使其在速凝階段發揮作用[7]。由圖6可知,超聲處理對蛋白質的速凝性質影響明顯。隨超聲功率的增加,蛋白的游離巰基含量緩慢增加,900 W時上升到10.91 μmol/g。雖然游離巰基含量在一直上升,但二硫鍵含量在700 W后已經不再下降。因此,700 W為提高蛋白凝膠性的最優功率。
綜上所述,超聲功率對花生濃縮蛋白各項功能性質有顯著影響。綜合分析上述結果,確定700 W為最佳超聲改性功率。為了進一步優化超聲改性條件,在固定功率70 0W條件下,繼續研究超聲時間對花生濃縮蛋白功能性質的影響。
2.3 超聲處理時間對蛋白質功能性質的影響
2.3.1 吸水性
由圖7可知,隨著超聲時間延長,花生濃縮蛋白的吸水性呈上升的趨勢,6 min后變化趨于平緩,6 min確定為蛋白吸水性的最優超聲時間。
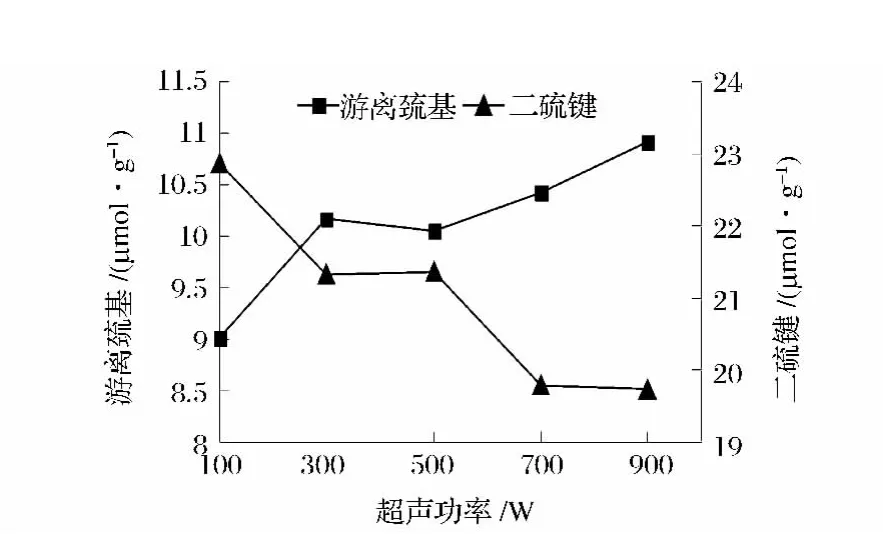
圖6 超聲處理強度對蛋白—SH/—S—S—含量的影響Fig.6 Effect of ultrasonic irradiation power on protein —SH/—S—S—
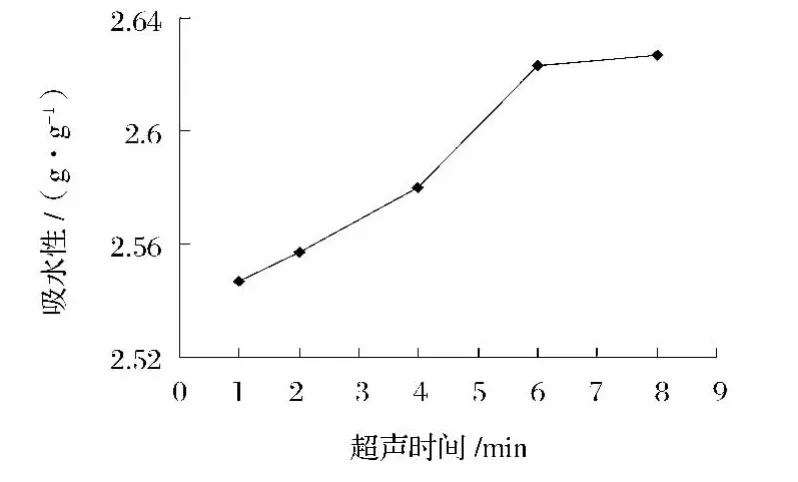
圖7 超聲處理時間對蛋白吸水性的影響Fig.7 Effect of ultrasonic irradiation time on water holding capacities of protein
2.3.2 持油性
由圖8可知,不同超聲時間處理后,花生濃縮蛋白的持油性呈先上升后緩慢下降的趨勢,6min時達到最大值。因此,6min為蛋白持油性的最優超聲處理時間。
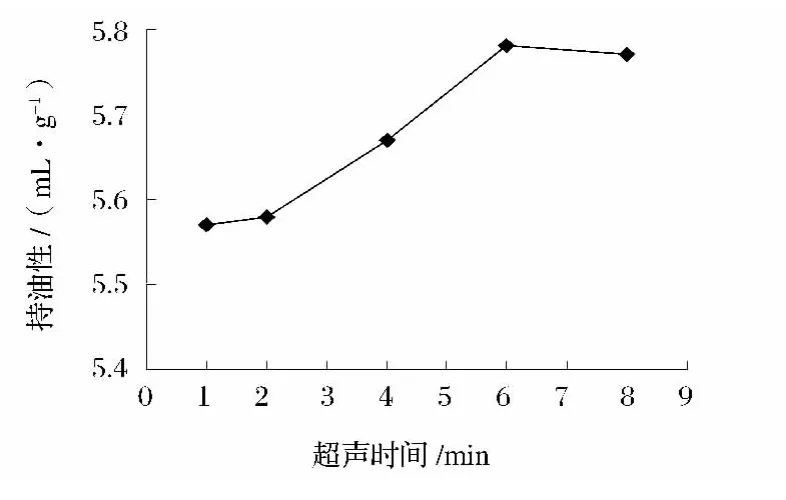
圖8 超聲處理時間對蛋白持油性的影響Fig.8 Effect of ultrasonic irradiation time on oil binding capacities of protein
2.3.3 溶解性
由圖9可知,不同超聲時間處理后,花生濃縮蛋白的溶解性呈持續上升的趨勢。原因可能是超聲時間越長,蛋白分解越多,導致蛋白質溶解性上升。
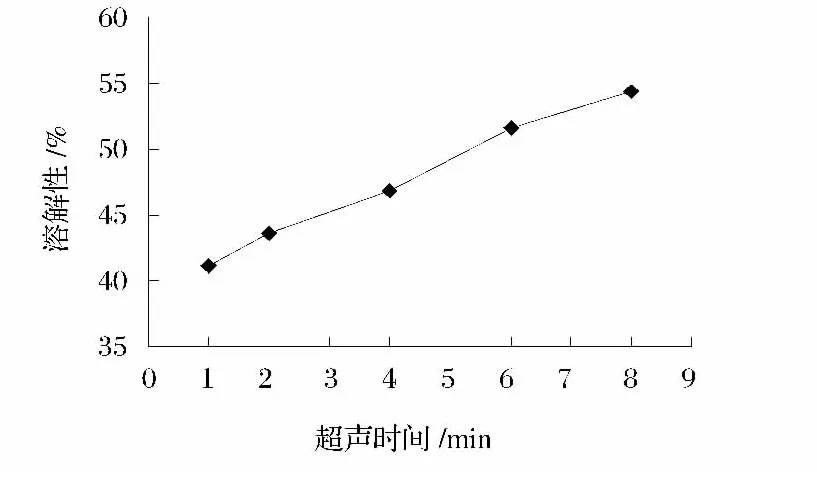
圖9 超聲處時間度對蛋白溶解性的影響Fig.9 Effect of ultrasonic irradiation time on protein solubility
2.3.4 乳化性及其乳化穩定性
由圖10可知,隨著超聲時間延長,花生濃縮蛋白的乳化性呈逐漸上升的趨勢,而乳化穩定性呈先上升后下降的趨勢,6 min時乳化穩定性達到最大值。雖然乳化性呈一直上升的趨勢,但乳化穩定性超過6 min則呈現下降的趨勢。因此,6 min確定為蛋白乳化及乳化穩定性的最優超聲處理時間。
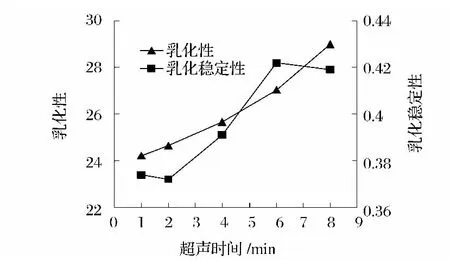
圖10 超聲處理時間對蛋白乳化性及其乳化穩定性的影響Fig.10 Effect of ultrasonic irradiation time on emulsifying capacity and emulsifying stability of protein
2.3.5 起泡性及其泡沫穩定性
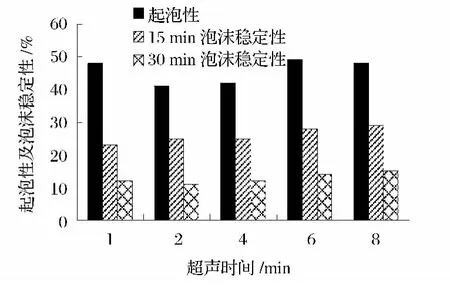
圖11 超聲處理時間對蛋白起泡性及其泡沫穩定性的影響Fig.11 Effect of ultrasonic irradiation time on foaming capacity and foaming stability of protein
由圖11可知,不同超聲時間處理后的花生濃縮蛋白起泡性及其泡沫穩定性均在6 min時達到最高,之后趨于平穩。因此,6 min為起泡性及其泡沫穩定性的最優超聲時間。
2.3.6 蛋白最低凝膠點

表3 超聲處理時間對蛋白凝膠性的影響Table 3 Effect of ultrasonic irradiation time on gelation of protein
由表3可知,超聲處理1~2 min時,花生濃縮蛋白的最低凝膠點是14%蛋白濃度,超聲處理4 min時,花生濃縮蛋白的最低凝膠點為10%蛋白濃度,繼續增加處理時間,最低凝膠點一直處于10%蛋白濃度。因此,4 min為最優超聲時間。
2.3.7 游離巰基及二硫鍵含量
花生濃縮蛋白的速凝特性主要是表現為蛋白質分子鏈的展開、斷裂過程,即蛋白經改性后,球狀的蛋白質分子開始伸展開來,原來包埋在卷曲的分子鏈內部的功能基團如二硫基,疏水基團暴露出來,使得蛋白分子間和分子內部的二硫鍵、氫鍵、疏水作用、靜電引力以及范德華力有不同程度的改變,從而使蛋白具有形成強凝膠的潛在性質[11]。由圖12可知,超聲時間的長短能有效地影響蛋白的速凝性質。超聲時間為6 min時,游離巰基含量達到最高值,二硫鍵含量達到最低值,作用時間延長至8 min,蛋白的游離巰基含量和二硫鍵含量與6 min時相比,沒有顯著的變化。因此,6 min為最優的超聲時間。
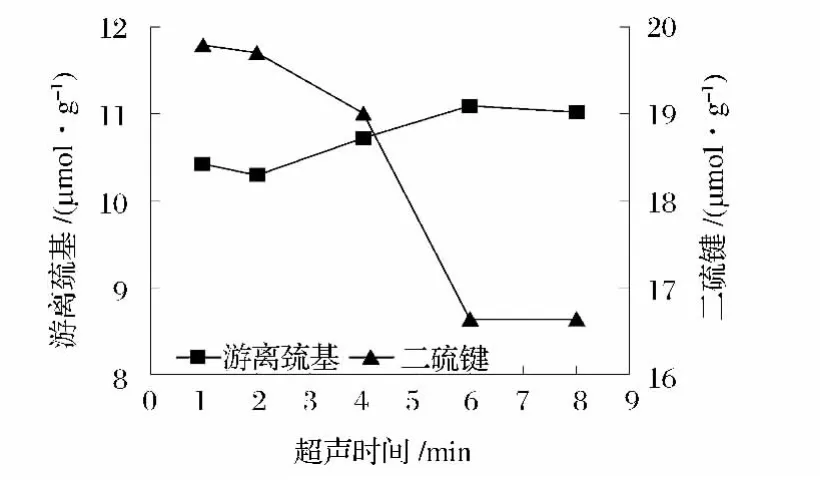
圖12 超聲處理時間對蛋白—SH/—S—S—含量的影響Fig.12 Effect of ultrasonic irradiation time on protein —SH/—S—S—
2.4 結果驗證
綜合以上結果分析,超聲處理改善花生濃縮蛋白功能性質的最佳條件為:超聲波功率700 W,超聲時間6 min。在上述最優改性工藝條件下進行驗證實驗,得到數據如表4所示。實驗結果表明,在上述條件下超聲處理花生濃縮蛋白,其各項功能指標顯著提高,驗證實驗取得的數據與之前的實驗結果基本相似,證明本研究結果具有可行性和可重復性。
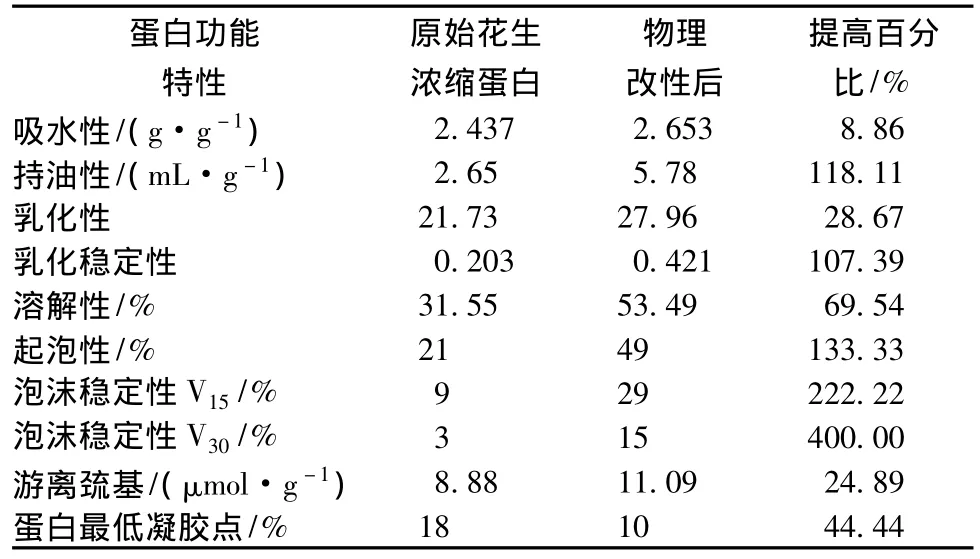
表4 最優工藝下花生濃縮蛋白改性結果Table 4 Data of modification of peanut protein concentrate at optimal condition
3 結論
本研究以自制的花生濃縮蛋白為原料,采用超聲波處理方法改善花生濃縮蛋白的功能性質。結果表明,超聲改性的最優工藝條件為:超聲功率700 W,超聲處理時間6 min。在此條件下得到的花生濃縮蛋白產品各項功能指標顯著提高:吸水性提高了8.86%,持油性提高了118.11%,乳化性提高了28.67%,乳化穩定性提高了107.39%,溶解性提高了69.54%,起泡性提高了133.33%,泡沫穩定性 V15提高了222.22%,泡沫穩定性V30提高了400.00%,游離巰基含量增加了24.89%,二硫鍵含量減少了28.61%,蛋白最低凝膠點由18%蛋白濃度下降到10%蛋白濃度。超聲波處理能夠顯著改善花生濃縮蛋白的功能性質,是一種簡便、有效的蛋白改性方法,適宜工業應用。
[1] 徐維艷,王衛東,秦衛東.花生蛋白的制備、功能性質及應用[J]. 食品科學,2010,31(17):476-479.
[2] Singh B,Singh U.Peanut as a source of protein for human foods[J].Plant Food for Human Nutrition,1991,41:165-177.
[3] Yu J,Ahmedna M,Goktepe I.Peanut protein concentrate:Production and functional properties as affected by processing[J].Food Chemistry,2007,103:121 -129.
[4] 劉大川,張 亮,劉 曄等.醇法花生濃縮蛋白改性工藝研究[J]. 中國油脂,2009,34(10):24-26.
[5] 董新紅,趙謀明,蔣躍明.花生蛋白改性的研究進展[J]. 中國糧油學報,2011,26(12):109 -117.
[6] 劉大川,張亮,劉紅丹.花生濃縮蛋白的制備工藝研究[J]. 中國油脂,2009,34(9):23 -25.
[7] 吳海文.花生濃縮蛋白的制備、凝膠形成機理及其應用研究[D].北京:中國農業科學院,2009:44-45.
[8] 董貝森,朱海濤,于躍芹.花生蛋白粉溶液流變學特性及功能性的研究[J].農業工程學報,1999,15(1):251-252.
[9] 李迎秋,陳正行.高壓脈沖電場對大豆分離蛋白功能性質的影響[J].農業工程學報,2006,22(8):194-198.
[10] Shand P J,Ya H,Pietrasik Z,et al.Physicochemical and textural properties of heat induced peaprotein isolate gels[J].Food Chemistry,2007,102(4):1 119 -1 130.
[11] Fuhrmeister,Meuser H,Fuhrmeister F M.Impact of processing on functional properties of protein products from wrinkled peas[J].Journal Food Engineering,2003,56(4):119-129.

