4種模式美拉德反應條件及其產物抗氧化作用
周向軍,周健,馮進兵,黃凱
(天水師范學院生命科學與化學學院,甘肅 天水,741001)
美拉德反應為非酶促褐變,是指食品加工和貯藏過程中還原糖羰基與胺、蛋白質或氨基酸等含氮化合物發生復雜化學反應的總稱,其產物(Maillard reaction products,MRPs)結構復雜、種類繁多,主要含有類黑精、還原酮及含N、S的雜環化合物[1]。美拉德反應分為3個階段:初級階段起始于羰基與氨基的縮合、Amadori/Heyns化合物的生成;高級階段主要是Amadori/Heyns的降解、烯醇化和醇醛縮合等生成風味小分子物質;終極階段是指小分子物質自身或相互聚合成大分子褐色物質[2]。研究表明,影響美拉德反應的因素除糖和氨基化合物的種類、濃度外,還受溫度、pH、時間、水分活度等因素的影響[3]。殼聚糖是廣泛存在于甲殼類動物硬殼及菌類細胞壁中的堿性高分子多糖,具有提高免疫能力、降低膽固醇等活性,其含有游離的羰基和氨基,分別加入阿拉伯糖和果糖時,殼聚糖的氨基能與后者的羰基發生美拉德反應。與其他化學和酶法改性相比,殼聚糖/還原糖體系的MRPs具有一定的抗氧化性、抑菌性、乳化性和水溶性等,因而在食品添加劑行業具有廣闊的應用前景。研究表明,BHA、BHT等可能有致癌作用,TBHQ的應用也受到嚴格的限制,而MRPs可為天然抗氧化劑的開發提供新的思路。MRPs的研究主要集中在其成分鑒定、機理探討及抗氧化活性測定等方面[4-6],但由于美拉德反應極其復雜,不易控制,其產物的分離制備極為困難[7],因此,目前大多只能采用模式美拉德反應來進行研究,從而獲得少量特定氨基供體與羰基供體發生美拉德反應的信息。同時,MRPs的形成機制、組成結構、性質及抗氧化機理仍未明確[8],不同體系產生的 MRPs,其抗氧化活性難以找到共同規律,要闡明食品體系MRPs的抗氧化作用機理及相關因子,目前的技術手段尚不能對其進行定性定量分析,具體哪種物質對MRPs抗氧化起主要作用還有待進一步研究。本試驗分別以精氨酸和賴氨酸為氨基供體,麥芽糖為羰基供體;殼聚糖為氨基供體,阿拉伯糖和果糖分別為羰基供體,研究各體系紫外可見光譜和熒光光譜隨加熱時間的變化,氨基與羰基物質的量比、初始pH值、溫度對產物褐變的影響及反應過程的pH變化,MRPs對DPPH·、HO·、H2O2的清除作用和總還原力。
1 材料與方法
1.1 材料與試劑
果糖、賴氨酸、精氨酸、麥芽糖、L-阿拉伯糖、殼聚糖、鄰二氮菲、FeSO4、K3Fe(CN)6、三氯乙酸、FeCl3及H2O2等,均為國產分析純;DPPH為Sigma產品。
1.2 儀器
AL204型電子天平,梅特勒-托利多儀器有限公司;TGL-20M型高速臺式冷凍離心機,湖南湘儀離心機儀器有限公司;PHS-3D雷磁pH計,上海精密科學有限公司;UV-9600型紫外分光光度計,北京瑞利分析儀器公司;UV-1800型分光光度計,日本島津;RF-5301型熒光分光光度計,日本島津。
1.3 實驗方法
1.3.1 MRPs制備
稱取0.1 g精氨酸、0.1 g賴氨酸于燒瓶中,加入蒸餾水使之完全溶解,加入麥芽糖,使氨基與羰基物質的量比為1∶3,混勻,pH=11,110℃下油浴回流,反應結束后快速冷卻,稀釋10倍用于抗氧化試驗,殼聚糖-果糖/阿拉伯糖同法操作。MRPs褐變在420nm測定[9]。
1.3.2 紫外可見光譜及熒光光譜掃描
4種體系的MRPs各稀釋一定倍數,進行紫外可見光譜和熒光光譜掃描。
1.3.3 單因素試驗
在90 ℃、各初始 pH、精氨酸2.2 g、賴氨酸0.25 g,殼聚糖1.053 g,探討氨基與羰基物質的量比分別為3∶1、2∶1、1∶1、1∶2、1∶3時,MRPs褐變程度;在 90℃、各初始 pH、精氨酸 2.2 g、賴氨酸 0.25 g,殼聚糖1.053 g,氨基與羰基物質的量比分別為 3∶1、2∶1、1∶1、1∶2、1∶3,探討反應過程 pH 值的變化;在 90 ℃、精氨酸0.03 g、賴氨酸0.025 g,氨基與羰基物質的量比為1∶3、探討初始 pH 值為 8、9、10、11、12 時,其對MRPs褐變的影響,殼聚糖0.561 3 g,氨基與羰基物質的量比為1∶3,不同醋酸濃度對褐變的影響;在pH=11、精氨酸 0.03 g、賴氨酸 0.1 g,殼聚糖 1.053 g,氨基與羰基物質的量比為 1∶3,探討 80、90、100、110、120℃時,其對MRPs褐變的影響。
1.4 抗氧化作用
1.4.1 DPPH·的清除作用[10]
分別加入一定體積的MRPs,蒸餾水補至2 mL,加入2 mL 0.04 g/L DPPH無水乙醇溶液,混勻,室溫暗處反應20 min,取上清液在517 nm測吸光度,為Ai。無水乙醇代替DPPH無水乙醇溶液,吸光度為Aj;以DPPH無水乙醇溶液+無水乙醇作為參比,吸光度為A0。
DPPH·清除率K=[1-(Ai-Aj)/A0]×100%
1.4.2 HO·的清除作用[11]
1 mL 1.25 mmol/L鄰二氮菲乙醇溶液于試管中,加入 0.05、0.1、0.15、0.2、0.25 mL 蒸餾水,pH 7.4 0.2 mol/L磷酸緩沖溶液補至2 mL,混勻,加入1 mL 1.25 mmol/L 硫酸亞鐵,1 mL 0.025%H2O2,37℃水浴60 min,536 nm測吸光度,為A損。以蒸餾水代替H2O2,為A未,以MRPs代替損傷管樣品溶劑,為A樣。
HO·清除率/%=[(A樣-A損)/(A未-A損)]×100
1.4.3 總還原力[12]
分別加入一定體積的 MRPs,0.2 mol/L pH 6.6磷酸緩沖液補至1 mL,1%K3Fe(CN)61 mL,混勻,50℃水浴20 min,加入1 mL 10%三氯乙酸,振蕩混勻,5 000 r/min離心10 min。取上清液2 mL,加入0.1%FeCl30.5 mL,混勻,靜置 10 min,700 nm 測定吸光度,為 A樣,以蒸餾水代替 MRPs,同法操作,為A空白。

1.4.4 對 H2O2的清除作用[13]
4 mL 10 mmol/L H2O2于100 mL容量瓶中,分別加入一定體積的MRPs,混勻,定至100 mL,248 nm測吸光度,為 A1,不加 MRPs的 H2O2,為 A0,不加 H2O2的 MRPs,為 A2。
清除率/%={[A0-(A1-A2)]/A0}×100
2 結果與分析
2.1 光譜分析
2.1.1 紫外可見光譜變化
由圖1-a和圖b可知,MRPs在260~270 nm處均出現吸收峰,強度隨加熱時間的延長而增加,表明有新物質生成且不斷積累。與報道的294 nm有所不同[14],Brands[15]認為,該吸收是美拉德反應高級階段通過Strecker裂解產生的酮、醛等類無色小分子中間物,為褐色素的形成的前體,其主要為呋喃、吡喃、糠醛及吡啶等及其衍生物。由圖1-b可知,330 nm處出現肩峰,可能是糖降解產生的各種小分子發色團通過賴氨酸活性側鏈共價結合,此時產物的最大吸收峰是各種發色團最大吸收波長的綜合表現,即沒有特征性吸收峰。由圖1-c和圖1-d可知,280 nm處均出現吸收峰,且強度隨加熱時間的延長而增加,Morales[16]認為是酸性條件下發生了糖的異構化和脫水反應,分別產生羥甲基糠醛和糠醛類美拉德反應標志物。隨加熱時間的延長,圖1-d中在220 nm處出現吸收峰,美拉德反應中220 nm的特征性吸收峰很少有報道,一般認為是小分子有機酸如甲酸、乙酸或Amadori降解生成具有共軛雙鍵且含有C O發色團的鄰酮糖類物質等的吸收。4種體系MRPs主要吸收范圍在200~400 nm,說明產物主要為中、小分子物質[17],其在可見光區幾乎沒有吸收。當反應120 min后,各峰強度均接近穩定狀態,表明已生成的無色小分子物質之間發生聚合反應,進入終級階段生成褪色的類黑精類物質,小分子具有一定的消除速率。當消除速率與生成速率接近時,峰強度不變,甚至有所下降,與孫麗平[18]、Hofmann[19]認為的無特征性吸收峰、隨波長增加吸光度降低是類黑精的典型表現和Cark[20]提出的“尾巴模式”觀點一致,即波長越短,吸光度越大。
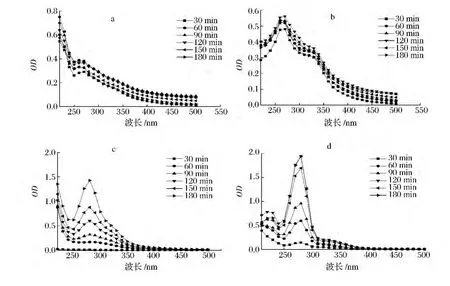
圖1 不同加熱時間下MRPs的紫外可見光譜變化(a)精氨酸-麥芽糖(b)賴氨酸-麥芽糖(c)殼聚糖-果糖(d)殼聚糖-阿拉伯糖Fig.1 The change of ultraviolet-visible spectrum with different heating time(a)arginine-maltose(b)lysine-maltose(c)chitosan-fructose(d)chitosan-arabinose
2.1.2 熒光光譜變化
精氨酸/賴氨酸-麥芽糖體系的激發波長分別為330和335 nm,發射波長為417和420 nm,殼聚糖-果糖/阿拉伯糖的激發波長分別為330和319 nm,發射波長為423和385 nm。385 nm處的發射波長與MRPs的熒光特征有所不同[21]。熒光物質是美拉德反應高級階段的小分子物質,可靈敏地反映其早期過程,其強度代表高級階段熒光物質的生成情況。如圖2-a和圖2-b所示,當反應進行一定時間后,熒光物質開始積累,達到最大值后開始降低,表明美拉德反應開始進入終極階段,Jing認為[22],此時熒光物質聚合形成類黑精類物質的速率大于其自身生成速率,熒光物質的積累越來越少,因而熒光強度的增長較為緩慢,但這是以產生風味為目的美拉德反應所不期望的。賴氨酸-麥芽糖體系的熒光強度強于精氨酸-麥芽糖體系,可能是賴氨酸的空間位阻相對小于精氨酸[23],反應易向高級階段進行,美拉德反應程度也越高。由圖2-c和圖2-d可知,精氨酸/賴氨酸-麥芽糖體系的最大發射波長未隨時間的延長而變化,但殼聚糖-果糖/阿拉伯糖體系的最大發射波長隨加熱時間的延長發生變化,這表明長時間加熱使該體系的一些熒光中間物聚合成化學結構更為復雜的熒光物質,或者是具有新化學結構的熒光物質生成,原來熒光物質被消耗而不再占優勢,與張嚴[24]研究一致。Lertittikul[25]研究表明,美拉德反應體系中熒光光譜與紫外光譜表現為不同的動力學行為,因此熒光小分子物質不同于2.1.1中260~270 nm紫外吸收的小分子物質,但它們均為美拉德反應的中間產物。
2.3 單因素試驗結果
2.2.1 氨基與羰基物質的量比對褐變的影響
由圖3-a和圖3-b可知,隨加熱時間的不斷延長,精氨酸/賴氨酸-麥芽糖體系褐變程度均逐漸增加,氨基與羰基物質的量比越低,褐變程度越高,這說明糖濃度的相對增加能促進美拉德反應,同時氨基的增多易使分子內氨基和羧基失水形成內酰胺而降低了參與美拉德反應的氨基的物質的量,使褐變速率降低[26],此時,只有增大羰基的相對物質的量,才有可能使羰氨反應占據優勢,分子內成酰胺作用降至最低,故當氨基與羰基物質的量比從 3∶1、2∶1、1∶1、1∶2降至1∶3時,褐變程度逐漸達到最強。由圖3-c和圖3-d可知,殼聚糖-果糖/阿拉伯糖體系的褐變均存在較長時間的延滯期,原因可能是殼聚糖含有大量氨基,從而溶于酸性溶液中,因此體系的酸度較大,不利于美拉德反應的進行。一般而言,對于不同的糖類,五碳糖褐變速率高于六碳糖,醛糖比酮糖易于發生反應,碳鏈較短或空間位阻效應小者,反應活性相對大一些[27]。另外,Kim[28]認為果糖與其它還原糖不同,其參與的氨基酸-還原糖模式反應所產生的褐變,部分原因是由焦糖反應引起的。

圖2 不同加熱時間下MRPs的熒光光譜變化Fig.2 The change of fluorescence spectrum with different heating time

圖3 氨基與羰基物質的量比對褐變的影響Fig.3 The effects of amount of substance ratio of amino to carbonyl group on browning
2.2.2 反應過程pH值變化MRPs的pH值變化趨勢與氨基酸和還原糖的種類有關。由圖4-a和圖4-b可知,反應初始時溶液為堿性,隨加熱時間的延長,pH值逐漸下降,原因是反應初始時,體系pH分別取決于精氨酸和賴氨酸,其均為堿性氨基酸,隨后發生羰氨反應,使氨基被封閉[29],Rufian-Henares 及 Liu[30-31]認為,還原糖在高pH值條件下加熱,易降解生成甲酸和乙酸等酸性化合物,從而pH值下降,這與 Lertittikul[25]等研究基本一致。由于羰氨縮合反應為可逆過程,當反應進行至420 min后,存在兩種情況:當氨基與羰基物質的量比>1時,2種體系pH或維持在堿性環境而趨于平穩或緩慢下降;當氨基與羰基物質的量比<1時,pH值降至酸性范圍,說明此時羰氨縮合的可逆反應并不占據優勢。由圖4-c和圖4-d可知,殼聚糖-果糖/阿拉伯糖體系的吸光值變化不大,且無一定規律,與王惠英等研究一致[32],這說明美拉德反應產物及其中間產物比較復雜,可能是中間產物發生重排所致,同時酸性條件不利于美拉德反應,從而使吸光值發生漂移。這種pH的相對穩定性對開發食品抗氧化劑是相當有利的[33]。

圖4 反應過程pH變化Fig.4 pH change of reaction process
2.2.3 初始pH值及醋酸濃度對褐變的影響
一般認為,pH≤7,糖易發生異構化和脫水反應,美拉德反應主要產物為糠醛(戊糖參與反應)或羥甲基糠醛(己糖參與反應)。pH>7時,Amadori重排產生還原酮和丙酮醇、丙酮醛和雙乙酰等。由圖5-a和圖5-b可知,初始pH值越高,反應速率越快,褐變程度越深,原因是堿性條件下,1,2-烯醇化較為困難,2,3-烯醇化較易進行,同時,反醇醛、烯醇化和脫水反應等均為堿催化作用的結果[34]。由圖5-c和圖5-d可知,在0~60 min范圍內,吸光值較低,這是因為在醋酸溶液中,殼聚糖氨基被質子化,由于正電荷的吸引,電子發生離域,1,2-烯醇化較易生成,而糖胺不能形成。同時,羰氨縮合反應為可逆反應,酸性條件下易水解,不利于美拉德反應而被抑制。但隨加熱時間的延長,2種體系褐變程度均明顯加深。
2.2.4 溫度對褐變的影響
溫度是影響美拉德反應的一個重要因素。隨溫度的升高,氨基和羰基的反應活性增加,美拉德反應速率加快,在不同加熱時間下褐變程度均逐漸增加,這是因為高溫條件下開鏈式還原糖及非質子化氨基含量增加,有利于美拉德反應的發生[35]。由圖6-a和圖6-b可知,當溫度增至110℃時,達到最大褐變,繼續增加溫度,褐變程度下降,說明過高溫度不利于MRPs的穩定。由圖6-c可知,隨溫度升高,殼聚糖-果糖體系的褐變程度逐漸增加,當溫度增至100℃后,褐變程度下降。由圖6-d可知,殼聚糖-阿拉伯糖體系的褐變逐漸增加并趨于平穩。Lan[36]研究表明,在80~120℃范圍內,褐變速率隨溫度的升高而加快,超過120℃后,褐變速率趨于平緩。

圖5 初始pH及醋酸濃度對褐變的影響Fig.5 The effects of initial pHand acetic acid concentration on browning

圖6 溫度對褐變程度的影響Fig.6 The effects of temperature on browning
2.3 抗氧化試驗結果
在反應體系總體積不變的條件下,隨MRPs體積的增大,可認為其濃度也相應增大。DPPH·是一種相對穩定的自由基,可與MRPs提供的氫原子結合形成穩定的DPPH-H順磁分子,從而達到清除自由基的目的。由圖7-a和圖7-b可知,隨MRPs濃度的增加,精氨酸/賴氨酸-麥芽糖體系對DPPH自由基的清除作用降低,這可能是早期生成的具有抗氧化作用的MRPs 被熱分解造成的[37],與 Morales[38]認 為 的,MRPs抗氧化能力并不完全依賴于其褐變程度的研究結論一致。殼聚糖-果糖/阿拉伯糖體系對DPPH·的清除作用與其濃度呈正相關,且清除作用均較強,原因可能是美拉德反應過程中產生大量獨特結構的雜環化合物,如噻吩、噻唑、吡咯等,其具有芳香性,電子非定域分布在環上,使碳原子上電子過剩,有利于自由基的親電加成,從而清除自由基。另外,MRPs的部分屬性如疏水性,也可能是影響DPPH·清除能力的因素[39]。

圖7 MRPs對DPPH·(a、b)、HO·(c、d)和H2O2(e、f)的清除作用和總還原力(g、h)Fig.7 The scavenging action of MRPs on DPPH(a),hydroxyl free radical(b),total reducing power(c)and H2O2(d)
由圖7-a、圖7-d可知,精氨酸/賴氨酸-麥芽糖體系對羥自由基清除作用幾乎均不隨濃度的增加而變化,且前者強于后者,可能是隨反應的進行,MRPs將部分Fe3+還原為Fe2+后,又被Fe2+螯合,使Fenton反應自身受到抑制,從而清除·OH能力保持不變[40-41]。殼聚糖-果糖/阿拉伯糖體系則隨其濃度的增加,對羥自由基清除作用增強,這可能是殼聚糖衍生物通過吡喃環上的-OH或-NH2進行氫原子轉移來達到清除羥自由基[42],另外,Silvan[43-44]認為生成的類黑精和還原酮提供的羥基也可以通過鏈的斷裂來表現抗氧化作用。
MRPs的大分子物質和中間產物如吡咯酮、還原酮類、脫氧果糖嗪等具有供氫能力,可提供電子作為還原性物質,將Fe3+還原成Fe2+,Fe2+進一步發生普魯士藍反應[39]。由圖7-a和圖7-f可知,隨MRPs濃度的增大,精氨酸/賴氨酸-麥芽糖體系的總還原力逐漸增強,可能是MRPs中的大分子結構上具有羥基或具有還原能力的發色團所致,但殼聚糖-果糖/阿拉伯糖體系的總還原力先增大后減小,可能是還原性物質首先形成于反應初期Amadori產物的熱解,Charurin[45-46]認為隨反應時間的延長和加熱,美拉德反應或焦糖化過程中所產生的雜環化合物開始分解,分子發生重排,從而使還原能力趨于平緩、甚至降低。
由圖7-g和圖7-h可知,4種體系均表現出較好的H2O2清除作用,且均隨MRPs濃度的增加而增強。
3 結論
本試驗對精氨酸/賴氨酸-果糖、殼聚糖-果糖/阿拉伯糖模式體系的美拉德反應進行了研究。結果表明隨加熱時間的延長,前者褐變程度和酸度均逐漸增加,后者的褐變均增加,但酸度變化無規律。各體系氨基與羰基物質的量比為1∶2~1∶3、pH 11~12和110~120℃時,褐變程度分別接近最大程度。隨各體系MRPs濃度的增加,前者對DPPH自由基清除率逐漸降低,后者則逐漸增強,說明其抗氧化能力并不完全依賴于MRPs的褐變程度;對羥自由基清除作用,前者幾乎保持不變,后者則逐漸增強;前者總還原力及對H2O2的清除作用均逐漸增強,后者則總還原力先增加后降低,對H2O2的清除作用逐漸增強。這說明不同的反應體系和反應條件產生的MRPs具有不同的抗氧化性能[47]。由于MRPs并非單一物質,體系十分復雜,既有低分子質量化合物,也有類黑精類高分子物質,故單一波長難以真正反映其真實顏色,最好用色差計測定體系顏色變化,同時輔助熒光光度法才能全面準確地反映MRPs不同階段產物的色澤[48]。因此,MRPs作為抗氧化劑的商業應用還有待于進一步研究。
[1]孫濤,朱云,謝晶,等.低聚殼聚糖與α-丙氨酸/天冬酰胺的美拉德反應及其衍生物的抗氧化性能研究[J].天然產物研究與開發,2012,24(4):450-453.
[2]LI B,CHEN F,WANG X,et al.Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J].Food Chemistry,2007,102(4),1 135-1 143.
[3]龔巧玲,張建友,劉書來,等.食品中的美拉德反應及其影響[J].食品工業科技,2009,30(2):330-334.
[4]孫濤,朱云,王燕萍,等.低聚殼聚糖的美拉德反應及其衍生物的抗氧化性能研究[J].海洋科學,2012,36(5):65-70.
[5]趙喜榮.殼聚糖與葡萄糖發生美拉德反應的條件及產物的抗氧化性能[J].食品科學,2004,25(6):61-63.
[6]Wagner K H,Derkits S,Herr M,et al.Antioxidative potential of melanoidins isolated from a roasted glucose-glycine model[J].Food Chemistry,2002,78:375-382.
[7]鄭文華,許旭.美拉德反應的研究進展[J].化學進展,2005,17(1):122-129.
[8]邵瀾媛,周建偉,劉東紅.食品中美拉德反應機理及動力學模型的研究進展[J].中國食品學報,2012,12(12):103-112.
[9]Morales F J,Jiménez-Pérez S.Free radical scavenging capacity of maillard reaction products as related to colour and fluorescence[J].Food Chemistry,2001,72(1):119-125.
[10]賈俊強,馬海樂,曲文娟,等.超聲預處理大米蛋白制備抗氧化肽[J].農業工程學報,2008,24(8):288-293.
[11]牛慧慧,馬美湖,楊昆.蛋清肽的抗氧化穩定性與功能特性[J].食品科學,2011,32(15):139-143.
[12]李菁,劉騫,孔保華,等.L-賴氨酸與3種還原糖美拉德反應產物的理化特性及抗氧化活性[J].食品科學,2013,34(3):80-85.
[13]郭麗萍,王鳳舞,劉翠翠.木糖與甘氨酸美拉德反應產物抗氧化性能的研究[J].食品工業科技,2012,33(7):79-81.
[14]孫麗平.美拉德反應體系的光譜特性、抗氧化活性及評價方法[D].青島:中國海洋大學,2009.
[15]Brands C M,Alink G M,Van boekel M A,et al.Mutagenicity of heated sugar-casein systems:effect of the maillard reaction[J].Journal of Agricultural and Food Chemistry,2000,48(6):2 271-2 275.
[16]Morales F J,Romero C,Jiménez-Pérez S.Chromatographic determination of bound Hydroxymethylfurfural as an index of milk protein glycosylation[J].Journal of Agricultural and Food Chemistry,1997,45(5):1 570-1 573.
[17]張曉溪,曾艷,張澤生,等.果糖與氨基酸美拉德反應產物的抗氧化性研究[J].食品工業科技,2011,32(6):175-178.
[18]孫麗平,莊永亮,張莉,等.酶解小麥蛋白產物-還原糖美拉德反應的光譜研究[J].分析化學,2009,37(9):1 359-1 362.
[19]Hofmann T.Studies on the relationship between molecular weight and the color potency of fractions obtained by ther-mal treatment of glucose/amino acid and glucose/protein solutions by using ultracentrifugation and color dilution techniques[J].Journal of Agricultural and Food Chemistry,1998,46(10):3 891-3 895.
[20]Clark A V,Tannenbaum S R.Isolation and characterization of pigments from rotein-carbonyl browning systems.Models for two insulin-glucose pigments[J].Journal of Agricultural and Food Chemistry,1974,22(6):1 089-1 093.
[21]劉平.美拉德肽的形成機理及功能特性研究[D].無錫:江南大學,2012:42-43.
[22]Jing H.,Kitts D.D.Antioxidant activity of sugar-lysine Maillard reaction products in cell free and cell culture systems[J].Archives of Biochemistry and Biophysics,2004,429(2):154-163.
[23]孫煒煒,于淑娟,楊曉泉,等.乳清分離蛋白-葡聚糖接枝物性質的熒光光譜法分析[J].光譜學與光譜分析,2011,31(12):3 307-3 310.
[24]張嚴,汪何雅,錢和.美拉德反應產物的褐變、熒光吸收及抗氧化性的研究[J].食品工業科技,2012,33(6):193-196.
[25]Lertittikul W.,Benjakul S.,Tanaka M.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J].Food Chemistry,2007,100(2):669-677.
[26]趙晶,張宏坤,馬丹雅,等.葡萄糖與賴氨酸美拉德反應產物的抗氧化性研究[J].食品工業科技,2013,34(11):92-95.
[27]吳惠玲,王志強,韓春,等.影響美拉德反應的幾種因素研究[J].現代食品科技,2010,26(5):441-444.
[28]Kim J.S.,Lee Y.S.Effects of reaction pH on enolization and racemization reactions of glucose and fructose on heating with amino acid enantiomers and formation of melanoidins as result of the Maillard reaction[J].Food Chemistry,2008,108(2):582-592.
[29]王惠英,孫濤,周冬香,等.L-賴氨酸與葡萄糖美拉德反應及其產物的抗氧化性能研究[J].食品與發酵工業,2007,33(9):54-56.
[30]Rufian-Henares J A,Delgado-Andrade C,Morales F.J.Occurrence of acetic acid and formic acid in breakfast cereals[J].Journal of the Science of Food and Agriculture,2009,86(9):1 321-1 327.
[31]LIU S C,YANG D J,JIN S Y,et al.Kinetics of color development,pH decreasing,and anti-oxidative activity reduction of Maillard reaction in galactose/glycine model systems[J].Food Chemistry,2008,108(2):533-541.
[32]王惠英,孫濤,周冬香,等.殼聚糖的美拉德反應及其產物的抗氧化性能研究[J].食品工業科技,2007,28(10):91-93.
[33]童彥,雒莎莎,應鐵進.魚蛋白水解液美拉德反應條件優化及反應前后氨基酸組成變化[J].中國食品學報,2011,11(8):101-106.
[34]Shibamoto T,Bernhard R A.Investigation of pyrazine formation pathways in sugar-ammonia model systems[J].Agricultural and Food Chemistry,25(3):609.
[35]李伶俐.美拉德反應體系中影響烤肉風味形成的因素研究[D].無錫:江南大學,2011:17.
[36]LAN X H,LIU P,XIA S Q,et al.Temperature effect on the non-volatile compounds of Maillard reaction products derived from xylose-soybean peptide system:Further insights into thermal degradation and cross-linking[J].Food Chemsistry,2010,120(4):967-972.
[37]鄒利,趙妍嫣,朱坦,等.豬骨粉酶解液的美拉德反應產物清除DPPH·的研究[J].食品工業科技,2013,34(13):79-82.
[38]Morales F J,Jiménez-Pérez S.Free radical scavenging capacity of Maillard reaction products as related to color and fluorescence[J].Food Chemistry,2001,72(1):119-125.
[39]黃梅桂.大豆肽美拉德反應體系中色澤抑制及其機理研究[D].無錫:江南大學,2012:32-33.
[40]夏炳樂,劉永軍.生理溫度下苯丙氨酸-葡萄糖模式體系Maillard反應的影響因素研究[J].中國科學技術大學學報,2011,41(5):422-427.
[41]徐紅萍,余翔,張迎陽,等.美拉德反應改性殼聚糖產物體外抗氧化能力的研究[J].食品工業科技,2013,34(16):150-153.
[42]XIE W M,XU P X,LIU Q.Antioxidant activity of watersoluble chitosan derivatives[J].Bioorganic & Medicinal Chemistry Letters,2001,11(13):1 699-1 701.
[43]Silvan J M,Van de lagemaat J,Olano A,et al.Analysis and biological properties of amino acid derivates formed by Maillard reaction in foods[J].Journal of Pharmaceutical and Biomedical Analysis,2006,41(5):1 543-1 551.
[44]王瑩瑩,許朵霞,焦瓊,等.天然防腐劑美拉德反應改性研究進展[J].食品科學,2013,34(7):296-301.
[45]Charurin P,Ames J M,Castillo M D.Antioxidant activity of coffee model systems[J].Journal of Agricultural and Food Chemistry,2002,50(13):3 751-3 756.
[46]趙晶,馬丹雅,張筠,等.酪蛋白與還原糖美拉德反應產物抗氧化性的研究[J].食品工業科技,2011,32(12):187-189.
[47]張凌燕,李倩,尹姿.3種氨基酸和葡萄糖美拉德產物的物理化學特性及抗氧化活性的研究[J].中國食品學報,2008,8(3):12-22.
[48]沈軍衛,樊金玲,朱文學,等.模式美拉德反應物的抗氧化性與反應進程的關系研究[J].食品科技,2010,35(3):253-257.

